Способ получения биологического материала для создания аутологичных противоопухолевых вакцин
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и может быть использовано для выделения опухолевых антигенов для иммунотерапии опухолей. Для этого измельчают 1 грамм опухоли на охлаждаемой поверхности, добавляют 9 мл буфера (рН 7,0), состоящего из 10 мМ NaHCO3, 10 мМ ЭДТА, 2 мМ PMSF, и гомогенизируют. Затем центрифугируют сначала при 20000 g при 4°С в течение 30 минут, а затем при 100000 g при 4°С в течение 90 минут. Надосадочную жидкость подвергают ультра-/диафильтрации, используя мембрану с пределом отсечения 50 кДа, при этом используют формулирующий буфер (рН 7,0), состоящий из 10 мМ NaHCO3 и 150 мМ хлорида натрия. Использование данного способа позволяет получить фракцию, состоящую из комплексов, представленных различными классами белков теплового шока, что определяет широкий спектр связанных с ними опухолевых пептидов. 1 пр., 2 табл., 2 ил.
Реферат
Область техники
Изобретение относится к медицине и биотехнологии, фармакологии, онкологии, а именно к выделению и очистке биологического иммуногенного материала из опухолевой ткани, который может быть использован в качестве основы для получения противоопухолевых аутологичных вакцин. Способ позволяет получить биологический материал, обогащенный опухолевыми антигенами, способными вызвать специфический иммунный ответ против того вида опухоли, из которой он был получен. Изобретение характеризуется наиболее высоким выходом антигенов в комплексе с белками теплового шока (БТШ), широким спектром антигенов и относительно небольшим количеством технологических стадий, что способствует получению экономических и биологических преимуществ.
Уровень техники
Из уровня техники известен способ получения биологического материала, состоящего из БТШ70 и пептидов (Peng et al., 1997). Осадок клеток или ткань гомогенизируют (1:4) в гипотоническом буфере, центрифугируют при 100000 g, супернатант для замены буфера направляют на гель-фильтрацию. Далее раствор белков наносят на колонну с аффинным носителем (ADP-агароза) и после промывки инкубируют и смывают в буфере, содержащем ADP. Недостатком данного изобретения является низкий выход комплексов БТШ70 и пептидов, использование дорогих хроматографических методов, а также получение ограниченного спектра антигенов, ассоциированных только с БТШ70.
Известен способ получения биологического материала, состоящего из БТШ96 и пептидов (Zabrecky & Sawlivich, 2004). Осадок клеток гомогенизируют, осветляют центрифугированием при 18000 g и супернатант подвергают процедуре высаливания сульфатом аммония, после чего белковую смесь пропускают через колонну Con-A-сефарозой, проскок после смены буфера наносят на анионообменник (DEAE-), с которого целевой белок снимают в градиенте соли. Недостатком данного изобретения является низкий выход комплексов БТШ96 и пептидов, использование дорогих хроматографических методов, а также получение ограниченного спектра антигенов, ассоциированных только с БТШ96.
Известен способ получения биологического материала, состоящего из БТШ96 и пептидов (Meng et al, 2002). Осадок клеток гомогенизируют, центрифугируют при 100000 g и супернатант подвергают процедуре высаливания сульфатом аммония, после чего белковую смесь пропускают через колонну Con-A-сефарозой, проскок после смены буфера наносят на анионообменник (POROS 20QE-), с которого целевой белок снимают в градиенте соли. Недостатком данного изобретения является низкий выход комплексов БТШ96 и пептидов, использование дорогих хроматографических методов, а также получение ограниченного спектра антигенов, ассоциированных только с БТШ96.
Известен способ получения биологического материала, состоящего комплексного выделения кальретикулина, БТШ70, БТШ90, gp96 (Graner et al, 2000a). Ткань гомогенизируют, центрифугируют при 100000 g, для удаления альбумина супернатант пропускают через колонну с цибакроновым красителем (Cibacron Blue 36А-), далее проскок наносят на колонну с Con-А-сефарозой, связавшийся материал элюируют и наносят на колонну с другим аффинным носителем (heparin-сефароза), с которого элюируют gp96. Несвязавшийся с Con-А-сефарозой материал подвергают высаливанию сульфатом аммония, после чего наносят на анионообменник (DEAE-). Снимают тремя ступенями концентрации соли. Первый элюат, с самой низкой концентрацией соли, направляют на аффинную хроматографию с ADP-агарозой для получения БТШ70. Второй элюат, снятый средней концентрацией соли - передают вначале на колонну с гидроксилаппатитом, затем на анионообменную хроматографию (Q-) для получения БТШ90. И, наконец, элюат, полученный с самой большой концентрацией соли, осаждают солью цинка и передают на анионообменник для получения кальретикулина. Недостатком данного изобретения является особенность самой технологии, которая предполагает индивидуальную очистку каждого из БТШ, что осуществляется большим количеством технологических шагов и использованием дорогих хроматографических методов.
Известен способ получения биологического материала, состоящего из кальретикулина (Basu et al 1999). Осадок клеток гомогенизируют, центрифугируют при 100000 g, полученный супернатант подвергают ступенчатому высаливанию, полученный в результате осадок ресуспендируют и пропускают через колонну с ConA-сефарозой. В полученном проскоке меняют буфер с помощью гель-фильтрации и пропускают через колонну с катионообменником (СМ-). Проскок наносят на колонну с анионообменником (DEAE-). Кальретикулин снимают в градиенте хлорида натрия. Недостатком данного изобретения является низкий выход комплексов кальретикулина и пептидов, использование дорогих хроматографических методов, а также получение ограниченного спектра антигенов, ассоциированных только с кальретикулином.
Известен способ получения биологического материала, состоящего из БТШ70 (Udono et al 1993). Клетки гомогенизируют, центрифугируют при 100000 g, супернатант пропускают через колонну с ConA-сефарозой, проскок наносят на колонну с анионообменником (Q-) и целевой белок снимают в градиенте хлорида натрия, после чего концентрируют сульфатом аммония. Недостатком данного изобретения является низкий выход комплексов БТШ70 и пептидов, использование дорогих хроматографических методов, а также получение ограниченного спектра антигенов, ассоциированных только с БТШ70.
Известен способ получения биологического материала, состоящего из БТШ70 (Murshid et al 2013). Клетки гомогенизируют, центрифугируют при 15000 g, супернатант подвергают гель-фильтрации для смены буфера и наносят на колонну с анионообменником (DE52-), целевой белок элюируют в градиенте хлорида натрия. Фракции, содержащие БТШ70, наносят на колонну с ADP-агарозой. Целевой белок элюируют буфером, содержащим ADP. Полученную фракцию переводят в формулирующий буфер. Недостатком данного изобретения является низкий выход комплексов БТШ70 и пептидов, использование дорогих хроматографических методов, а также получение ограниченного спектра антигенов, ассоциированных только с БТШ70.
Известен способ получения биологического материала, состоящего из БТШ70, БТШ 90, gp96 (Северин и др., 2005). Ткань гомогенизируют, центрифугируют при 35000 g, супернатант подвергают ступенчатому высаливанию, обессоливают с помощью гель-фильтрации и наносят на колонну с heparin-сефарозой, снимают градиентом хлорида натрия, фракции, содержащие БТШ 70, 90 и gp96, объединяют. Недостатком данного изобретения является низкий выход комплексов, а также использование дорогих хроматографических методов.
Известен способ получения биологического материала, состоящего из БТШ70, БТШ 90, gp96 (Menoret et al 2000). Клетки гомогенизируют, центрифугируют при 100000 g, супернатант пропускают через колонну для смены буфера и наносят на колонну с heparin-сефарозой, снимают градиентом хлорида натрия, фракции, содержащие БТШ90, объединяют и пропускают через колонну для смены буфера, после чего наносят на колонну с анионообменником (HQ-POROS), целевой белок элюируют в градиенте хлорида натрия; фракции, содержащие gp 96, подвергают ступенчатому высаливанию. Полученный осадок ресуспендируют и пропускают через колонну с ConA-сефарозой. Проскок после смены буфера методом гель-фильтрации наносят на колонну с анионообменником (DEAE-), целевой белок снимали в градиенте соли. Фракции, содержащие БТШ70, объединяют, пропускают через колонну для смены буфера и затем наносят на колонну с ADP-агарозой, элюируют целевой белок и пропускают через колонну для смены буфера. Затем наносят на колонну с анионообменником (DEAE-) и элюируют в градиенте хлорида натрия. Недостатком данного изобретения является особенность самой технологии, которая предполагала индивидуальную очистку каждого из БТШ по отдельности, что предполагает введение большого количества технологических шагов. И хотя данный подход и позволяет получить 4 типа пептидов, ассоциированных с 4 видами БТШ, а также получение ограниченного спектра антигенов, использование дорогих хроматографических методов.
Известен способ получения биологического материала, состоящего из БТШ110 (Wang et al 2001). Клетки гомогенизируют в гипотоническом буфере, центрифугируют последовательно при 4000g и 100000g, супернатант пропускают через колонну с ConA-сефарозой, диализуют и сажают на колонну со слабым анионообменником (DEAE-), снимают в градиенте хлорида натрия, фракции, содержащие БТШ 110, объединяют и после диализа сажают на колонну с сильным анионообменником (Q-), элюцию проводят в градиенте хлорида натрия, фракции, содержащие БТШ 110, объединяют и пропускают через Superose 12. Недостатком данного изобретения является низкий выход комплексов БТШ110 и пептидов, использование дорогих хроматографических методов, а также получение ограниченного спектра антигенов, ассоциированных только с БТШ110.
Наиболее близким к заявляемому является способ получения биологического материала, состоящего из кальретикулина, БТШ70, БТШ90, gp96 (прототип) (Graner et al 2000b). Осадок клеток гомогенизируют, осветляют центрифугированием при 10000 g, затем центрифугируют при 10000 g, супернатант используют как сырье для препаративной изоэлектрической фокусировки. Получают смесь белков, состоящую из кальретикулина, БТШ70, БТШ90 и gp96. Было показано, что для исследованных опухолей такой белковый коктейль более эффективен в качестве исходного материала для вакцины, чем один БТШ70, полученный из той же опухоли. Недостатками данного подхода является тот факт, что в процессе получения CRCL используются детергенты, что может приводить к потере пептидов из их комплекса с БТШ. Кроме того, использование этого метода приводит к захвату некоторых соединений, обладающих иммуносупрессорной активностью. Согласно оценке самих авторов, повышение дозы CRCL выше 20 мкг приводит к резкому падению эффективности данной вакцины. Наконец, основной технологический прием - препаративная изоэлектрическая фокусировка - представляется довольно трудоемкой и сложной в воспроизведении процедурой.
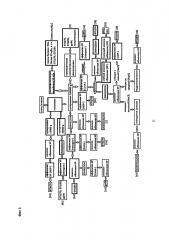
Общий недостаток большинства вышеперечисленных способов выделение в подавляющем числе случаев только одного представителя БТШ, что обедняет спектр получаемых антигенов, либо использование дорогих хроматографических стадий, что ведет к технологическим потерям целевых белков. Сравнение описываемых способов по отношению к заявляемому приведено на Фиг. 1.
Таким образом, технических решений, совпадающих с совокупностью существенных признаков заявляемого изобретения, из уровня техники не выявлено, что позволяет сделать вывод о соответствии заявляемого изобретения такому условию патентоспособности как «новизна».
Термины и определения
- Под термином «Caperon-Rich Cell Lysate» (CRCL) подразумевается смесь белков, включающих БТШ70, БТШ90, калретикулин и gp96, полученная с помощью метода препаративной изофокусировки.
- Под термином «БТШ + пептид (белок)» подразумевается комплекс того или иного белка теплового шока с пептидом или белком.
Краткое описание чертежей
Фиг. 1. Сравнение наиболее часто используемых и заявляемых способов выделения и очистки комплексов «БТШ + пептид». Условные обозначения: ХР - хроматография; БТШ - белок теплового шока.
Фиг. 2. Содержание БТШ 70 и БТШ 90 во фракциях белков с молекулярной массой более 50 кДа. Условные обозначения: на оси абсцисс - объем элюата (в мл), на оси ординат - количество БТШ; Vо - значение свободного объема колонны; 669 кДа, 158 кДа и 43 кДа - объемы выхода калибровочных белков с разной молекулярной массой (тироглобулин, альдолаза и овальбумин, соответственно).
Раскрытие изобретения
Предложен способ выделения и очистки биологического иммуногенного материала для получения аутологичных противоопухолевых вакцин.
Использование противоопухолевых вакцин - одно из ведущих направлений иммунотерапии опухолей (Srivastava 2002; Никитин, Барышников 2007; Никитин 2008; Calderwood et al 2005; Wang et al 2006). Одним из перспективных направлений их создания является применение белков теплового шока (БТШ). Эти белки участвуют в формировании и поддержании трехмерной и четвертичной структуры белков, важных для выживания и поддержания метаболизма любой клетки, в том числе и опухолевой; уровень этих белков повышается в момент клеточного стресса. В отношении опухоли это может быть результат химиотерапии, радиотерапии, иммунотерапии, иных классических видов противоопухолевого лечения. Все эти виды стресса, несомненно, включают в опухолевой ткани защитные механизмы, что на биологическом уровне выражается в повышении экспрессии анти-апоптотических БТШ, защищающих пространственные структуры опухолевых белков от разрушения. Не являются исключением и такие белки, которые образовались в опухоли в результате неконтролируемых мутаций и которые присутствуют только в данной опухоли. Структура таких белков также защищается белками теплового шока; биологическая защита опосредуется через образование комплекса «БТШ + белок (пептид)», и количество таких комплексов в различных компартментах клетки тем выше, чем выше опухолевый стресс. Стоит отметить, что даже в отсутствие вышеуказанных видов внешнего стресса уровень БТШ в опухолевой клетке сам по себе на порядок выше, чем в нормальной, поскольку в самой опухоли имеет место и внутренний стресс, такой как, например, гипоксия, потребность в усилении энергетического обмена, множество других механизмов, неизбежно возникающих в условиях быстрого роста опухолевой ткани.
В этой связи БТШ, с точки зрения биотехнологических подходов, реализуемых для получения противоопухолевых вакцин, рассматриваются как наиболее привлекательные объекты, на основе которых проводится выделение и очистка комплексов, БТШ-связанных антигенов, в которых БТШ используются как целевые белки. Первооткрывателем данного феномена, использующего указанные свойства, стал P. Srivastava (Udono&Srivastava, 1993; Srivastava 1998).
Каковы природные механизмы, благодаря которым стало возможным применение комплексов «БТШ-пептид» в качестве иммунотерапевтического фактора? Во-первых, БТШ в опухолях никогда не мутируют, в отличие от связанных с ними белков (пептидов). Следовательно, введение таких комплексов в качестве вакцин пациенту не вызывет у него иммунного ответа против БТШ, что и подтверждается в ряде публикаций (Udono & Srivastava, 1993; Srivastava et al., 1998, 2001, 2002, 2010, 2016). С другой стороны, иммуногенными являются пептиды (белки), связанные с БТШ. Это и дает строго специфичный иммунный ответ против данного вида опухоли.
Во-вторых, концентрация БТШ в клетке может быть заметно увеличена после приложения любых вышеуказанных стрессовых условий. Это дает больше исходного материала для изготовления аутологичных вакцин.
В-третьих, многие антиген-представляющие клетки (АПК) имеют на своей поверхности рецепторы к БТШ (CD91, TLR2, TLR4 и др.) (Srivastava 2002; Noessner et al., 2002). Это позволяет не только захватить комплекс БТШ-пептид и затем представить пептид с помощью комплекса гистосовместимости на поверхности АПК, но и запустить синтез цитокинов и костимулирующих молекул. Все это, в конечном итоге, способствует активации клеточного и гуморального ответа против опухолевых антигенов (Srivastava 2002; Noessner et al 2002; Zuo et al 2016).
Таким образом, комплексы «БТШ + пептид (белок)» являются идеальным биологическим материалом для создания специфического противоопухолевого иммунного ответа.
Учитывая все вышесказанное, предлагается следующий способ получения материала для создания противоопухолевой вакцины: на первом этапе опухолевая ткань измельчается и гомогенизируется; на втором этапе из полученного гомогената выделяют цитозольную фракцию путем центрифугирования при 100000 g в течение 90 минут; на третьем этапе полученную цитозольную фракцию подвергают ультра-/диафильтрации, используя мембрану с пределом отсечения 50 кДа. Цель этапа - оставить БТШ и их комплексы; отбросить компоненты цитозоля с молекулярной массой ниже 50 кДа и заменить буфер на формулирующий.
В диапазоне молекулярных масс до 50 кДа находятся все факторы роста, в том числе и те, которые способствуют иммуносупрессии (Gross et al 2008; Бабышкина и др 2010; Khong et al 2002), протеазы, компоненты протеосом и белок-синтезирующего аппарата, которые гиперэкспрессируются в опухолях (Deng S.-S. et al 2006).
Высокомолекулярная часть (с молекулярной массой выше 50 кДа), которая остается для создания противоопухолевой вакцины, содержит все БТШ, участвующие в комплексообразовании с опухолевыми пептидами (белками), их олигомерные комплексы (Bernaroudj et al 1996; Poller et al 2008; Lee et al 2011), ингибиторы протеаз (Deng S.-S. et al 2006).
Технический результат, проявляющийся при использовании предложенного способа выделения и очистки комплексов «БТШ + пептид», заключается в том, что в результате выделения и очистки получают фракцию, состоящую из комплексов, представленных различными классами БТШ, что определяет широкий спектр связанных с ними опухолевых пептидов, что, в свою очередь, способствует индукции противоопухолевого специфического иммунитета на основе большого количества разнообразных антигенов. При этом предложенная технология позволяет получить наиболее высокий выход антигенов, по сравнению с аналогичными технологиями (Таблица 1).
Другим техническим результатом заявляемого способа выделения и очистки комплексов «БТШ + пептид» является расширение арсенала средств указанного назначения.
Заявляемые признаки, предопределяющие получение вышеуказанного технического результата, явно не следуют из уровня техники, что позволяет сделать вывод о соответствии заявляемого изобретения такому условию патентоспособности как «изобретательский уровень».
Условие патентоспособности «промышленная применимость» подтверждено на примерах конкретного применения, которыми заявляемое изобретение проиллюстрировано, но не исчерпано.
Примеры осуществления изобретения
Пример 1. Выделение и очистка комплексов «БТШ + пептид» на примере опухоли молочной железы
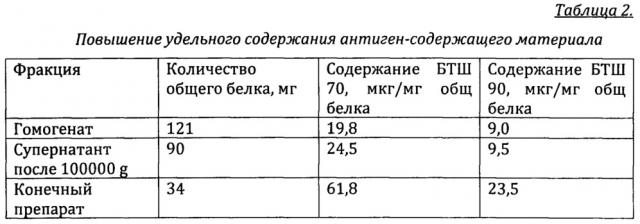
1 г опухолевой ткани молочной железы мелко измельчают на охлаждаемой поверхности, добавляют 9 мл буфера (10 мМ NaHCO3, рН 7,0, 10 мМ ЭДТА, 2 мМ PMSF /фенилметилсульфонилфлюорид/) и гомогенизируют. Полученный гомогенат подвергают центрифугированию сначала при 20000 g при 4°С в течение 30 минут, затем при 100000 g при 4°С в течение 90 минут. Надосадочную жидкость подвергают ультра-/диафильтрации, используя ячейку мембрану с пределом отсечения 50 кДа. В качестве формулирующего буфера используют 10 мМ NaHCO3, рН 7,0, содержащего 150 мМ хлорида натрия. В результате получают 34 мг белка в 84 мл формулирующего буфера. Белковый раствор стерильно разливают по 1 мл и замораживают при -20°С.
С помощью иммуноферментного анализа показано наличие в нем 25 мкг БТШ70 и 9,5 мкг БТШ90. В таблице 2 проиллюстрировано получение иммунобиологического материала из 1 г ткани опухоли молочной железы.
На Фиг. 2 приведен результат хроматографического разделения смеси белков с молекулярной массой выше 50 кДа.
На колонну 1×120 см (Econo-column, Bio-Rad), упакованную Sephacryl S-300HR (GE Healthcare) и уравновешенную 10 мМ NaHCO3, рН 7,0 буфером, была нанесена смесь белков в объеме 100 мкл (концентрация белка 10 мг/мл). Процесс проводился со скоростью 0,5 мл/мин при комнатной температуре. Элюат собирали по 1 мл. Приготовление образца: супернатант (надосадочную жидкость) получали, как описано в Примере 1. После этого проводили ультра-/диафильтрацию, используя мембрану с пределом отсечения 50 кДа. Диафильтрацию проводили против 8 объемов уравновешивающего буфера. Конечный объем белкового раствора составлял 3,5 мл. Из него и отбирали 100 мкл для нанесения на колонну. Измерения проводили, начиная с 33 по 61 мл. Количественную оценку проводили с использованием наборов для иммуноферментного анализа (EnzoLifeScience). Видно, что и БТШ70, и БТШ90 присутствуют в виде олигомерных комплексов в широком диапазоне молекулярных масс, заметно превосходящих 70 кДа и 90 кДа.
Список используемой литературы
1. Basu B.S., Srivastava P.K. Calreticulin, peptide-binding chaperone of the endoplasmic reticulum, elicits tumor- and peptide-specific immunity. J. Exp. Med. 1999, 189, 797-802.
2. Bernaroudj N., Triniolles F., Ladjimi M. Effect of nucleotides, peptides, and unfolded proteins on the self-association of the molecular chaperone HSC70. J Biol Chem 1996, 271, 18471-18476.
3. Calderwood S.K., Theriault J.R., Gong J. Message in a bottle: role of the 70-kDa heat shock protein family in anti-tumor immunity. Eur. J. Immunol. 2005, 35, 2518-2527.
4. Callahan M.K., Garg M., Srivastava P. Heat-shock protein 90 associates with N-terminal extended peptides and is required for direct and indirect antigen presentation. Proc Nat Acad Sci USA 2008, 105, 1662-1667.
5. Deng S.-S., Xing T.-Y., Zhou H.-Y., Xiong R.-H., Lu Y.-G., Wen В., Liu S.-Q., Yang H.-J. Comparative proteome analysis of breast cancer and adjacent normal breast tissues in human. Geno. Prot. Bioinfo. 2006, 4, 165-172.
6. Denis M. Two-step purification and N-terminal amino acid sequence analysis of the rat Mr 90,000 heat shock protein. Anal Biochem. 1988, 173, 405.
7. Feng H., Zeng Y., Graner M.W., Likhacheva A., Katsanis E. Exogenous stress proteins enhance the immunogenicity of apoptotic tumor cells and stimulate antitumor immunity. Blood 2003, 101, 245-252.
8. Fu Q., Wu Y., Yan F., Wang N., Wang W., Cao X., Wang Y., Wan N. Cell. Mol. Immunol. 2011, 8, 424-432.
9. Graner M., Raymond A., Akporiaye E., Katsanis E. Tumor-derived multiple chaperone enrichment by free-solution isoelectric focusing yields potent antitumor vaccines. Cancer Immunol. Immunother. 2000b, 49, 476-484.
10. Graner M., Raymond A., Romney D., He L., Whitesell L., Katsanis E. Immunoprotective activites of multiple chaperone proteins isolated from murine B-cell leukemia/lymphoma. Clin. Cancer Res. 2000a, 6, 909-915.
11. Gross S., Walden P. Immunosupressive mechanisms in human tumors: why we still cannot cure cancer. Immunol. Lett. 2008, 116, 7-14.
12. Khong H.T., Restifo N. Natural selection of tumor variants in the generation of "tumor escape" phenotypes. Nat. Immunol. 2002, 3, 999-1005.
13. Lee C.-C., Lin T.-W., Ко T.-P., Wang A.H.-J. The hexameric structures of human heat shock protein 90. PlosOne 2011, 6, 1-14.
14. Li G., Andreansky S., Helguera G., Sepassi M., Janikashvili N., Canterll J., LaCasse C.L., Larmonier N., Penchet M.L., Katsanis E. A chaperon protein-enriched tumor cell lysate vaccine generates protective humoral immunity in a mouse breast cancer model. Mol. Cancer Ther. 2008, 7, 721-729.
15. Meng S-D., Song J., Rao Z., Tien P., Gao G.F. Three-step purification of gp96 from human liver tumor tissues suitable for isolation of gp-bound peptides. J. Immunol. Methods 2002, 264, 29-35.
16. Menoret A, Bell G. Purification of multiple heat shock proteins from a single tumor sample. J Immun Methods 2000, 237, 119-130.
17. Morol Y., Mayhew M., Trcka J., Hoe M.H., Takechi Y., Hartl F.U., Rothman J.E., Houghton A.N. Induction of cellular immunity by immunization with novel hybrid peptides complexed to heat shock protein 70. Proc. Nat. Acad. Sci. USA 2000, 97, 3485-3490.
18. Murshid A., Gong J., Calderwood S.K. Purification, preparation, and use of chaperon-peptide complex for tumor immunotherapy. Methods Mol. Biol. 2013, 960, 209-217.
19. Noesssner E., Gastpar R., Milani V., Brandl A., Hutzler P.J.S., Kuppner M.C., Roos M., Kremmer E., Asea A, Calderwood S.K., Issels R.D. Tumor-derived heat shock protein 70 peptide complexes are cross-presented by human dendritic cells. J Immunol 2002, 169, 5424-5432.
20. Peng P., Menoret A., Srivastava P.R. Purification of immunogenic heat shock protein 70-peptide complexes by ADP-affinity chromatography. J. Immunol. Methods 1997, 204, 13-21.
21. Poller S., Dragovic Z., Hartl F.U., Bracher A. structural basis for cooperation of hsp70 and hsp110 chaperones in protein folding. Cell 2008, 133, 1068-1079.
22. Srivastava P. Compositions and methods for eliciting an immune response using heat shock/stress protein-peptide complexes in combination with adoptive immunotherapy. USP 6322790, 2001.
23. Srivastava P. Immunotherapeutic stress protein-peptide complexes against cancer. USP 5750119, 1998.
24. Srivastava P. Interaction of heat shock proteins and peptides and antigen presenting cells; chaperoning of the innate and adaptive immune responses. Annu Rev Immunol 2002, 20, 395-425.
25. Srivastava P. Method for preparing compositions comprising heat shock proteins useful for the treatment of cancer and infectious disease. USP 7666581, 2010.
26. Srivastava P. Using heat shock proteins to improve the therapeutic benefit of a non-vaccine treatment modality. USP 9352019, 2016.
27. Srivastava PK. Composition and methods using complexes of heat shock proteins and antigenic molecules for the treatment and prevention of neoplastic diseases. USP 5837251, 1998.
28. Srivastava PK. Endo-β-D-glucuronidase (heparanase) activity of the heat shock protein/tumor rejection antigen gp 96. Biochem. J. 1994, 301, 919
29. Udono B.H., Srivastava P.K. Heat shock protein 70 - associated peptides elicit specific cancer immunity. J. Exp. Med. 1993, 178, 1391-1396.
30. Udono H., Saito Т., Ogawa M., Yui Y. Hsp-antigen fusion and their use for immunization. Methods 2004, 32, 21-24.
31. Wang H.-H., Mao Y., Teng L.S., Cao J. Recent advances in heat shock protein-based chaperon vaccines. Hepatobiliary Pancreatic Dis Int. 2006, 5, 22-27.
32. Wang X.Y., Chen X., Manjili M.H., Repasky E., Henderson R., Subjeck J.R. Targeted immunotherapy using reconstituted chaperone complexes of heat shock protein 110 and melanoma-associated antigen gp100. Cancer res. 2003, 63, 2553-2560.
33. Wang X.Y., Kazim L., Repasky E.A., Subjeck J.R. Characterization of heat shock protein 110 and glucose-regulated protein 170 as cancer vaccines and the effect of fever range hyperthermia on vaccine activity. J. Immunol. 2001, 166, 490-497.
34. Wang X.Y., Sun X., Chen X., Facciponte J., Repasky E., Kane J., Subjeck J. Superior antitumor response induced by large stress protein chaperoned protein antigen compared protein antigen compared with peptide antigen. J Immunol. 2010, 184, 6309-6319.
35. Zabrecky J., Sawlivich W. Purification of the heat shock protein, gp96, from natural sources. Methods 2004, 32, 3-6.
36. Zeng Y., Feng H., Graner M.W., Katsanis E. Tumor-derived, chaperon-rich cell lysate activates dendritic cell and elicits potent antitumor immunity. Blood 2003, 101, 4485-4491.
37. Zuo D., Subjeck J., Wang X.Y. Unfolding the role of large heat shock proteins: new insights and therapeutic implications. Frontiers in immunologe 2016, 7, 1-15.
38. Бабышкина H.H., Малиновская Е.Ф., Стахеева M.H., Волкоморов В.В., Уфандеев А.А., Слонимская Е.М. Роль трансформирующего ростового фактора TGF-B1 в патогенезе рака молочной железы. Сибирский онкологический журнал 2010, 6, 63-70.
39. Никитин К.Д. Белки теплового шока: биологические функции и перспективы применения. Клиническая онкогематология 2008, 1, 125-130.
40. Никитин К.Д., Барышников А.Ю. Противоопухолевые вакцины на основе белков теплового шока. Российский биотерапевтический журнал 2007, 6, 3-12.
41. Северин С.Е., Ляшенко А.А., Коваленко Н.А., Обухова В.В., Кешелава В.В. Способ получения препарата, содержащего комплекс белков теплового шока 70, 90, 96, ассоциированных с антигенными пептидами. Патент RU №2287339, 2005.
Способ выделения опухолевых антигенов для иммунотерапии опухолей, характеризующийся тем, что измельчают 1 грамм опухоли на охлаждаемой поверхности, добавляют 9 мл буфера (рН 7,0), состоящего из 10 мМ NaHCO3, 10 мМ ЭДТА, 2 мМ PMSF, гомогенизируют, затем центрифугируют сначала при 20000 g при 4°С в течение 30 минут, а затем при 100000 g при 4°С в течение 90 минут, надосадочную жидкость подвергают ультра-/диафильтрации, используя мембрану с пределом отсечения 50 кДа, при этом используют формулирующий буфер (рН 7,0), состоящий из 10 мМ NaHCO3 и 150 мМ хлорида натрия.