Жидкий состав
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой перорально биодоступный неводный жидкий состав для лечения болезни сердца и/или гипертонии, содержащий по меньшей мере 7 мас.% пропиленгликоля от общей массы состава, кардиотоническое средство, или ингибитор ангиотензинпревращающего фермента, или комбинацию кардиотонического средства и ингибитора ангиотензинпревращающего фермента. Изобретение раскрывает способ получения состава, описанного выше, смешиванием по меньшей мере 7 мас.% пропиленгликоля от общей массы состава с кардиотоническим средством, или ингибитором ангиотензинпревращающего фермента, или комбинацией кардиотонического средства с ингибитором ангиотензинпревращающего фермента. 3 н. и 31 з.п. ф-лы, 11 ил., 17 табл., 2 пр.
Реферат
Область техники
Настоящее изобретение относится к жидкому составу, в частности жидкому составу, содержащему кардиотоническое средство, предпочтительно пимобендан, и/или ингибитор ангиотензинпревращающего фермента, предпочтительно эналаприл или беназеприл, для применения для лечения болезни сердца и/или гипертонии у млекопитающих, в частности собак или кошек.
Уровень техники
Болезнь сердца и/или гипертония становятся все более распространенными проблемами у животных, особенно у животных-компаньонов и животных в зоопарке. Например, по оценкам, приблизительно 10% домашних собак страдают заболеваниями сердца. Распространенные болезни сердца у собак включают первичные или вторичные болезни сердца, такие как застойная сердечная недостаточность (ЗСН), острая ЗСН, хроническая ЗСН, декомпенсированный эндокардиоз (DCE), дилатационная кардиомиопатия (ДКМП), бессимптомная (скрытая) ЗСН, бессимптомная ДКМП, хронический порок клапана сердца. Дисфункция сердца может быть связана с шоком, расширением желудка, заворотом кишок и ишемией миокарда. Из данных состояний хронический порок клапана сердца (ХПКС) (также известный как миксоматозная дегенерация клапана) является одним из наиболее распространенных.
ХПКС более распространен у самок собак, чем у самцов и обычно поражает левый атриовентрикулярный или митральный клапан, хотя правый атриовентрикулярный или трехстворчатый клапан поражается примерно в 30% случаев. Распространенность ХПКС гораздо выше у маленьких собак, например, собак, масса тела которых меньше 20 кг, хотя более крупные собаки также могут быть поражены. Причина ХПКС неизвестна.
Американский колледж ветеринарной терапевтической медицины (ACVIM) опубликовал согласованное заключение относительно ХПКС в 2009 году, которое определяет четыре стадии для функциональной классификации сердечной недостаточности, а именно:
- I класс описывает пациентов с бессимптомной болезнью сердца;
- II класс описывает пациентов с болезнью сердца, демонстрирующей клинические признаки только во время интенсивной физической нагрузки;
- III класс описывает пациентов с болезнью сердца, демонстрирующей клинические признаки при обычной повседневной деятельности или легкой физической нагрузке; и
- IV класс описывает пациентов с болезнью сердца, демонстрирующей тяжелые клинические признаки даже в состоянии покоя.
Согласованные рекомендации ACVIM для лечения ХПКС включают введение кардиотонического средства. ACVIM рекомендовал вводить пимобендан, кардиотоническое средство, два раза в сутки для острого лечения в больнице и длительного лечения на дому ХПКС III класса.
Согласованные рекомендации ACVIM также включают лечение хронического ХПКС III класса фуросемидом, мочегонным средством, в дополнение к лечению пимобенданом. Указанное мочегонное средство рекомендуется как для острого, так и для длительного лечения. Для острого лечения ХПКС предпочтительной является комбинация фуросемида и пимобендана.
Согласованные рекомендации ACVIM включают длительное лечение ХПКС ингибитором ангиотензинпревращающего фермента (АПФ) (иАПФ), таким как эналаприл. Доказательства, подтверждающие эффективность и безопасность иАПФ, менее ясны для острого лечения ХПКС III класса, чем для длительного лечения ХПКС. Кроме того, иАПФ подходят для лечения гипертонии.
Предпочтительное согласованное мнение ACVIM для длительного лечения ХПКС III класса заключается во введении одного или более из: пимобендана, фуросемида и иАПФ.
Принимая во внимание значительную проблему, связанную с болезнью сердца и/или гипертонией, по-прежнему существует потребность в разработке улучшенных составов активных агентов, подходящих для лечения таких состояний.
Краткое описание изобретения
В соответствии с первым аспектом предложен жидкий состав, содержащий пропиленгликоль и эффективное количество кардиотонического средства, ингибитора ангиотензинпревращающего фермента или комбинации кардиотонического средства и ингибитора ангиотензинпревращающего фермента.
В соответствии со вторым аспектом предложен жидкий состав, содержащий эффективное количество кардиотонического средства и пропиленгликоль.
В соответствии с третьим аспектом предложен жидкий состав, содержащий эффективное количество ингибитора ангиотензинпревращающего фермента и пропиленгликоль.
В соответствии с четвертым аспектом предложен жидкий состав, содержащий пропиленгликоль и эффективное количество комбинации кардиотонического средства и ингибитора ангиотензинпревращающего фермента.
Указанный состав может содержать один или более дополнительных активных агентов, таких как мочегонное средство или блокатор кальциевых каналов.
В соответствии с пятым аспектом предложен способ лечения болезни сердца и/или гипертонии, включающий введение состава, определенного выше, нуждающемуся в этом субъекту.
Также предложено применение пропиленгликоля и эффективного количества кардиотонического средства, ингибитора ангиотензинпревращающего фермента или комбинации кардиотонического средства и ингибитора ангиотензинпревращающего фермента для получения жидкого состава для лечения болезни сердца и/или гипертонии.
Также предложен состав, определенный выше, для применения для лечения болезни сердца и/или гипертонии.
Также предложено применение состава, определенного выше, для лечения болезни сердца и/или гипертонии.
Болезнь сердца включает первичную и вторичную болезнь сердца. Первичная болезнь сердца может быть выбрана из группы, состоящей из застойной сердечной недостаточности (ЗСН), острой ЗСН, хронической ЗСН, декомпенсированного эндокардиоза (DCE), дилатационной кардиомиопатии (ДКМП), бессимптомной (скрытой) ЗСН, бессимптомной ДКМП и хронического порока клапана сердца или их комбинации. Вторичная болезнь сердца может быть выбрана из группы, состоящей из дисфункции сердечно-сосудистой системы и нарушенной почечной перфузии во время анестезии, шока, расширения желудка, заворота кишок, ишемии миокарда и ишемии почек или их комбинации.
Гипертония обычно связана с активацией ренин-ангиотензин-альдостероновой системы (РААС). Нарушения, связанные с гипертонией, включают гиперадренокортицизм, гипертиреоз, феохромоцитому, первичный гиперальдостеронизм, сахарный диабет и болезнь почек или их комбинацию.
В соответствии с шестым аспектом предложен способ получения состава, определенного выше, который включает смешивание эффективного количества кардиотонического средства и/или ингибитора ангиотензинпревращающего фермента с пропиленгликолем.
В соответствии с седьмым аспектом предложен набор, содержащий первый состав, содержащий эффективное количество кардиотонического средства, и второй состав, содержащий эффективное количество ингибитора ангиотензинпревращающего фермента, при этом указанный первый и второй составы находятся отдельно, и по меньшей мере один из первого и второго составов содержит пропиленгликоль.
В соответствии с восьмым аспектом предложен набор, содержащий первый состав, содержащий эффективное количество кардиотонического средства или ингибитора ангиотензинпревращающего фермента, и второй состав, содержащий дополнительный активный агент, при этом указанный первый и второй составы находятся отдельно, и по меньшей мере один из первого и второго составов содержит пропиленгликоль.
Краткое описание фигур
Фиг. 1 представляет собой график, показывающий сравнение концентраций пимобендана в плазме у собак после перорального введения исследуемого ветеринарного продукта IVP и эталонного ветеринарного продукта RVP.
Фиг. 2 представляет собой график, показывающий схожее сравнение, как на фиг. 1, в случае другого IVP по сравнению с коммерческим ветеринарным продуктом (CVP), содержащим пимобендан, из отдельного исследования in vivo.
Фиг. 3 представляет собой график, показывающий сравнение концентраций пимобендана в плазме у собак после перорального введения жидкого состава, содержащего пимобендан и пропиленгликоль, и жидкого состава, содержащего пимобендан без пропиленгликоля.
Фиг. 4 представляет собой график, показывающий сравнение концентраций пимобендана в плазме у собак после перорального введения двух исследуемых ветеринарных продуктов, содержащих комбинацию пимобендана и иАПФ, и коммерческого ветеринарного продукта CVP, содержащего пимобендан в качестве активного ингредиента.
Фиг. 5 представляет собой график, показывающий сравнение концентраций эналаприла в плазме у собак после перорального введения исследуемого ветеринарного продукта (IVP), содержащего пимобендан и эналаприл, и коммерческого ветеринарного продукта (CVP), содержащего эналаприл без пимобендана.
Фиг. 6 представляет собой график, показывающий сравнение концентраций эналаприлата в плазме у собак после перорального введения IVP и CVP из фиг. 5.
Фиг. 7 представляет собой график, показывающий концентрации эналаприла и эналаприлата в плазме после перорального введения IVP из фиг. 5 и 6, что демонстрирует превращение про лекарства эналаприла в активный эналаприлат in vivo.
Фиг. 8 представляет собой график, показывающий сравнение концентраций беназеприла в плазме в случае IVP4, содержащего комбинацию пимобендана и беназеприла, IVP3, содержащего беназеприл без пимобендана, и коммерческого ветеринарного продукта (CVP2), содержащего беназеприл без пимобендана.
Фиг. 9 представляет собой график, показывающий сравнение концентраций беназеприлата в плазме в случае IVP4, IVP3 и CVP2, описанных для фиг. 8.
Фиг. 10 представляет собой график, показывающий концентрации беназеприла и беназеприлата в плазме после перорального введения IVP3, что демонстрирует превращение пролекарства беназеприла в активный беназеприлат in vivo.
Фиг. 11 представляет собой график, показывающий концентрации беназеприла и беназеприлата в плазме после перорального введения IVP4, что демонстрирует превращение пролекарства беназеприла в активный беназеприлат in vivo.
Подробное описание - жидкий состав
В соответствии с одним из аспектов предложен жидкий состав, содержащий пропиленгликоль и эффективное количество кардиотонического средства, ингибитора ангиотензинпревращающего фермента или комбинации кардиотонического средства и ингибитора ангиотензинпревращающего фермента.
Указанный состав подходит для перорального или парентерального введения нуждающемуся в этом субъекту, такому как собака или кошка, и его можно применять для острого или длительного лечения болезни сердца и/или гипертонии. Пероральное введение, как правило, является предпочтительным для длительной терапии, тогда как парентеральное введение может быть предпочтительным для острого лечения. Таким образом, жидкий состав может находиться в форме фармацевтического состава для применения в ветеринарии или у людей.
В соответствии с одним из аспектов предложен жидкий состав, содержащий эффективное количество кардиотонического средства и пропиленгликоль.
Примером кардиотонического средства является пимобендан. До настоящего изобретения пимобендан был доступен в виде твердого состава для перорального введения или водного состава для инъекций. Данные составы часто трудно вводить. Это особенно проблематично для лечения хронических состояний, таких как ХПКС, поскольку лекарственную терапию часто необходимо осуществлять на протяжении оставшейся части жизни животного.
Например, введение таблеток собаке или кошке часто является сложным из-за нежелания субъекта проглотить таблетку. Кроме того, осуществление лекарственной терапии путем инъекции, например, внутривенный, внутримышечный или подкожный пути инъекции, является трудным для владельцев животных, которые могут не иметь никакой медицинской подготовки, и может приводить к ряду возможных осложнений. Более того, субъекты, которым трудно вводить дозы, могут испытывать стресс при лечении и, следовательно, управление болезнью сердца, проявляющейся клинически, будет меньше оптимального. Кроме того, если животному трудно вводить дозы, владельцы или люди, осуществляющие уход, будут неохотно осуществлять лечение и соблюдение режима и схемы лечения будет низким, что также приводит к управлению болезнью сердца меньше оптимального.
Неожиданно было обнаружено, что жидкие составы, содержащие кардиотоническое средство и пропиленгликоль, обладают неожиданно предпочтительными свойствами. В этом отношении было обнаружено, что жидкий состав, содержащий пимобендан и пропиленгликоль, представляет собой стабильный и биодоступный при пероральном введении состав.
Пимобендан представляет собой (RS)-6-[2-(4-метоксифенил)-1H-бензимидазол-5-ил]-5-метил-4,5-дигидропиридазин-3(2H)-он и имеет следующую структуру:
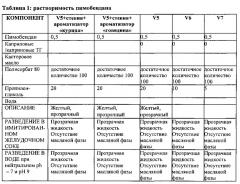
Пимобендан представляет собой содержащий заместители бензимидазол, который крайне нерастворим в воде. Например, 1 г пимобендана растворяется в 10000 мл воды. Известно, что данная растворимость зависит от рН, при этом растворимость при рН 7 составляет 0,1 мг на 100 мл (или 1 г на 1000000 мл). Данная растворимость является слишком низкой для получения раствора с эффективным количеством лекарственного средства. Кроме того, тогда как рН желудка субъекта, в целом, низкий, например, рН примерно от 1 до 2 для собак, рН желудка отдельного субъекта может варьироваться, например, рН желудка у собак может варьироваться от примерно рН 1 до примерно рН 8, на который могут влиять такие факторы, как то, производили ли измерение рН натощак или после еды. Таким образом, до настоящего изобретения было известно, что растворимость пимобендана в желудке повышается при добавлении лимонной кислоты в вводимый состав. Соответственно, для обеспечения биодоступной формы пимобендана получали твердые составы пимобендана, содержащие лимонную кислоту.
В качестве альтернативы было показано, что добавление возрастающих концентраций гидроксипропил-бета-циклодекстрина (HPβCD) в водные растворы пимобендана может повышать растворимость пимобендана до концентраций от 0,5 до 1,5 мг/мл в водном составе при рН больше 5. Однако при рН от 3 до 5 добавление HPβCD не повышает эффективно растворимость пимобендана в воде. Такие водные составы подходят для внутривенного (в/в) и/или подкожного (п/к) введения пимобендана.
Следовательно, до настоящего изобретения полагали, что для успешного получения стабильных и биодоступных составов пимобендана были необходимы добавки, такие как лимонная кислота или гидроксипропил-бета-циклодекстрин, из-за низкой и зависящей от рН растворимости пимобендана в воде.
Как описано в настоящем документе, было обнаружено, что могут быть получены жидкие составы пимобендана, которые стабильны и являются источником легко и быстро системно абсорбируемого или биодоступного пимобендана, тогда как они не требует добавления лимонной кислоты или гидроксипропил-бета-циклодекстрина.
Жидкие составы обладают преимуществами над твердыми составами при введении лекарственных средств животным. Например, в большинстве случаев легче вводить активный агент животному в жидкой форме путем быстрой доставки дозы из, например, шприца или другого дозирующего устройства в рот животного без необходимости жевания или в некоторых случаях проглатывания животным. Кроме того, по сравнению с таблетками и капсулами, которые содержат фиксированную дозу, количество пимобендана для введения можно легко регулировать в соответствии с массой тела субъекта путем выбора соответствующего объема жидкого состава для введения.
Авторы настоящего изобретения неожиданно обнаружили, что стабильный раствор кардиотонического средства, такого как пимобендан, может быть получен с использованием пропиленгликоля без лимонной кислоты или циклодекстрина. Такой жидкий состав неожиданно обеспечивает хорошую растворимость пимобендана в водных растворах во всем диапазоне рН в соответствии с уровнями рН in vivo. Авторы настоящего изобретения также обнаружили, что такие жидкие составы обеспечивают биодоступное при пероральном введении кардиотоническое средство.
Лимонная кислота дает вкус, который неприятен для животных, таких как собаки. Следовательно, таблетки, содержащие лимонную кислоту, имеют неприятный вкус для собак, который часто не удовлетворительно маскируют путем использования веществ, улучшающих вкус. Соответственно, преимуществом обнаружения того, что стабильный состав пимобендана может быть получен с использованием пропиленгликоля без лимонной кислоты, является получение составов, которые обладают более привлекательным вкусом для животных, таких как собаки или кошки. Это значительно повышает удобство введения состава пимобендана животным, а также может способствовать длительному поддержанию лечения.
Растворимость пимобендана в составе, содержащем HPβCD, в воде при рН от 3 до 5 является низкой. Такой состав может не подходить для перорального введения, поскольку растворимость пимобендана в воде не сохраняется в широком диапазоне рН.
Соответственно, преимуществом обнаружения авторами настоящего изобретения того, что стабильный состав пимобендана может быть получен с использованием пропиленгликоля без HPβCD, является получение составов, которые биодоступны при пероральном введении и которые также могут подходить для парентерального введения. Это может помогать вводить состав пимобендана субъектам, а также может способствовать длительному поддержанию лечения болезни сердца, например, например, ЗСН или ХПКС.
Жидкий состав может состоять из или содержать раствор или эмульсию. Раствор содержит один или более компонентов, растворенных в жидком носителе. Эмульсия содержит жидкость, суспендированную в другой жидкости, как правило, с помощью эмульгатора. Микроэмульсия представляет собой термодинамически стабильный раствор, который является прозрачным при визуальном осмотре. Для некоторых микроэмульсий один или более компонентов могут быть суспендированы в жидком носителе и иметь размер частиц, который слишком мал, чтобы их можно было видеть глазом.
Кардиотоническое средство может представлять собой любое соединение, которое способно оказывать положительный инотропный эффект и сосудорасширяющее действие при введении нуждающемуся в этом субъекту. Например, кардиотоническое средство может представлять собой пимобендан, левосимендан, амринон, эноксимон, милринон, олпринон (olprinone) или веснаринон. Как правило, кардиотоническое средство может представлять собой пимобендан. В настоящем описании термин «кардиотоническое средство» включает пимобендан, его фармацевтически и/или ветеринарно приемлемые соли, производные, метаболиты, стереоизомеры или пролекарства.
Субъект, упомянутый выше, может представлять собой человека или любое животное, в отношении которого лечение кардиотоническим средством может оказывать полезный эффект. Указанное животное может представлять собой млекопитающее, как правило, животное-компаньона, например, собаку, лошадь или кошку, а также может включать другие виды млекопитающих. В настоящем описании термин «животное» включает, но не ограничивается ими, животных-компаньонов, таких как собаки, кошки, морские свинки, хомяки, лошади, крупный рогатый скот, козы, овцы и т.п. Как правило, субъект представляет собой собаку, лошадь или кошку, чаще всего - собаку или кошку. Однако животные, нуждающиеся в таком лечении, также могут включать животных в зоопарке, таких как обезьяны, слоны, жирафы и другие копытные, медведи, мыши и другие мелкие млекопитающие.
В предпочтительном варианте жидкого состава кардиотоническое средство представляет собой пимобендан, его фармацевтически или ветеринарно приемлемые соли, производные или метаболиты.
В случае фармацевтически или ветеринарно приемлемых солей данные соли включают, например, неорганические соли, такие как хлоридные, сульфатные, фосфатные, дифосфатные, бромидные и/или нитратные соли. Кроме того, составы согласно настоящему изобретению также могут содержать органические соли, такие как, например, малатные, малеатные, фумаратные, тартратные, сукцинатные, этилсукцинатные, цитратные, ацетатные, лактатные, метансульфонатные, бензоатные, аскорбатные, пара-толуолсульфонатные, пальмоатные, салицилатные, стеаратные, эстолатные, глюцептатные или лактобионатные соли. В то же время соответствующие соли могут содержать фармацевтически приемлемые катионы, такие как, например, натрий, калий, кальций, алюминий, аммоний.
Кардиотоническое средство может присутствовать в количествах от примерно 0,01 масс. % до примерно 50 масс. %, от примерно 0,01 масс. % до примерно 45 масс. %, от примерно 0,01 масс. % до примерно 40 масс. %, от примерно 0,01 масс. % до примерно 35 масс. %, от примерно 0,01 масс. % до примерно 30 масс. %, от примерно 0,01 масс. % до примерно 25 масс. %, от примерно 0,05 масс. % до примерно 50 масс. %, от примерно 0,05 масс. % до примерно 35 масс. %, от примерно 0,05 масс. % до примерно 25 масс. %, от примерно 0,1 масс. % до примерно 50 масс. %, от примерно 0,1 масс. % до примерно 35 масс. %, от примерно 0,1 до примерно 25 масс. %, от примерно 1 масс. % до примерно 50 масс. %, от примерно 1 масс. % до примерно 35 масс. %, от примерно 1 масс. % до примерно 25 масс. %, от примерно 0,01 масс. %) до примерно 20 масс. %, от 0,1 масс. % до примерно 50 масс. %, от примерно 1 масс. % до примерно 20 масс. %, от примерно 5 масс. % до примерно 20 масс. %, от примерно 5 масс. % до примерно 50 масс. %, от примерно 3 масс. % до примерно 25 масс. %, от примерно 3 масс. % до примерно 50 масс. % или от примерно 0,1 масс. % до примерно 5 масс. % от общей массы состава.
В некоторых вариантах реализации кардиотоническое средство присутствует в количестве меньше или равном 50, 49, 48, 47, 46, 45, 44, 43, 42, 41, 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1, 0,5, 0,3, 0,1, 0,05 или 0,01 масс. % от общей массы состава.
Состав также содержит пропиленгликоль. Пропиленгликоль имеет молекулярную формулу С3Н6(ОН)2.
Авторы настоящего изобретения неожиданно обнаружили, что жидкий состав, содержащий кардиотоническое средство и пропиленгликоль, обладает сопоставимой, а в некоторых случаях большей биодоступностью по сравнению с биодоступностью коммерчески доступных твердых составов пимобендана у собак. В частности, как показано в исследованиях биодоступности, описанных в настоящем документе, в отличие от твердого коммерчески доступного состава пимобендана, для жидкого состава согласно настоящему изобретению не требуется лимонная кислота для проявления эффективной биодоступности при пероральном введении. Жидкий состав в исследованиях биодоступности, описанных в настоящем документе, также не содержит циклодекстрин, такой как гидроксипропил-бета-циклодекстрин.
Авторы настоящего изобретения также обнаружили, что жидкий состав, содержащий пимобендан и пропиленгликоль, более эффективно обеспечивает биодоступный пимобендан после перорального введения у собаки, чем жидкий состав, содержащий пимобендан в отсутствии пропиленгликоля, см., например, пример 3 и фиг. 3.
Пропиленгликоль может присутствовать в количестве от примерно 0,05 масс. % до примерно 99,99 масс. %, от примерно 0,05 масс. % до примерно 99,9 масс. %, от примерно 0,05 до примерно 99 масс. %, от примерно 0,05 масс. % до примерно 97 масс. %, от примерно 0,05 масс. % до примерно 55 масс. %, от примерно 0,05 масс. % до примерно 50 масс. %, от примерно 0,05 масс. % до примерно 65 масс. %, от примерно 5 масс. % до примерно 99,99 масс. %, от примерно 10 масс. % до примерно 99,99 масс. %, от примерно 20 масс. % до примерно 99,99 масс. %, от примерно 5 масс. % до примерно 60 масс. %, от примерно 5 масс. % до примерно 50 масс. %, от примерно 10 масс. % до примерно 50 масс. % или по меньшей мере 20 масс. % от общей массы состава. Например, пропиленгликоль может присутствовать в количестве, составляющем по меньшей мере 65, 60, 65, 50, 49, 48, 47, 46, 45, 44, 43, 42, 41, 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1, 0,75, 0,5, 0,2, 0,1 или 0,05 масс. % от общей массы состава. Любое количество пропиленгликоля, указанное в настоящем описании, может быть использовано с любым количеством кардиотонического средства, такого как пимобендан, указанным в настоящем описании, при условии, что используют достаточное количество пропиленгликоля для солюбилизации выбранного количества кардиотонического средства.
Обычная терапевтически эффективная целевая доза, в частности, для лечения острой ЗСН, например, пимобенданом, а также для любого другого терапевтического применения, описанного в настоящем документе, составляет от примерно 0,05 до 1,0 мг пимобендана на кг массы тела животного в сутки, как правило, от примерно 0,1 до 0,5 мг пимобендана на кг массы тела животного в сутки, чаще примерно 0,5 мг пимобендана на кг массы тела животного в сутки. Суточную дозу, как правило, делят и вводят в виде двух равных доз, а в тяжелых случаях трех доз с приблизительно равными временными интервалами. Целевая концентрация пимобендана в лекарственном средстве должна быть соответствующим образом задана на уровне 5,0 мг/мл, что позволяет вводить безопасные и равные объемы. Например, собака с массой тела 10 кг будет точно получать дозу 0,5 мл, содержащую 2,5 мг пимобендана. Специалист в данной области техники легко сможет скорректировать количество жидкого состава в зависимости от массы и породы животного, и других факторов, которые необходимо учитывать, например, уже имеющихся состояний, рациона животного, конкретного болезненного состояния и симптоматики, и т.д. Кроме того, специалист в данной области техники легко сможет определить необходимую дозу для других кардиотонических средств в зависимости от болезненного состояния животного и тяжести заболевания в соответствии с рекомендациями дозы и практикой.
Согласованные рекомендации ACVIM для длительного лечения ХПКС III класса у собак включают комбинированное лечение пимобенданом и иАПФ, например, эналаприлом, или другим подходящим иАПФ, таким как беназеприл.
Авторы настоящего изобретения обнаружили, что состав, содержащий иАПФ и пропиленгликоль, обеспечивал биодоступные количества иАПФ при пероральном введении у животного, в частности, у собаки после введения.
Соответственно, согласно одному из аспектов предложен жидкий состав, содержащий эффективное количество ингибитора ангиотензинпревращающего фермента и пропиленгликоль.
Ренин-ангиотензин-альдостероновая система (РААС) является сложной и при активации приводит к повышению кровяного давления. Ангиотензин II представляет собой мощный регулятор кровяного давления, вовлеченный в РААС, который вызывает сужение кровеносных сосудов. Таким образом, понижение уровней ангиотензина II способствует снижению кровяного давления путем дезактивации данного аспекта РААС. Ангиотензинпревращающий фермент (АПФ) катализирует превращение ангиотензина I в ангиотензин II. Следовательно, было показано, что ингибирование АПФ является эффективным гипотензивным средством для снижения кровяного давления одинаково у людей и животных. Более того, поскольку активация РААС является одной из основных причин гипертонии у животных, таких как собаки и кошки, иАПФ рекомендуется в качестве начальной терапии, когда у животного обнаруживается гипертония.
Кроме того, снижение кровяного давления часто является полезным для лечения состояний сердца, таких как ЗСН и ХПКС.
Эналаприл представляет собой активное при пероральном введении пролекарство эналаприлата - ингибитора АПФ. Эналаприл и эналаприлат имеют следующие соответствующие структуры:
Беназеприл представляет собой активное при пероральном введении пролекарство беназеприлата - другого ингибитора АПФ. Беназеприл и беназеприлат имеют следующие соответствующие структуры:
Очевидно, что в настоящем описании ссылка на ингибитор ангиотензинпревращающего фермента (иАПФ) является ссылкой либо на пролекарство иАПФ, либо на активную форму иАПФ, т.е. она включает эналаприл и эналаприлат, беназеприл и беназеприлат, их фармацевтически и ветеринарно приемлемые соли или их комбинацию. Другие подходящие иАПФ включают алацеприл, цилазаприл, делаприл, фозиноприл, имидаприл, моэксиприл, спираприл, темокаприл, трандолаприл, зофеноприл, каптоприл, рамиприл, хинаприл, периндоприл, лизиноприл и их фармацевтически и ветеринарно приемлемые соли, и их пролекарства или соответствующие активные формы, или их комбинацию.
Ингибитор ангиотензинпревращающего фермента может присутствовать в количествах от примерно 0,01 масс. % до примерно 50 масс. %, от примерно 0,01 масс. % до примерно 45 масс. %, от примерно 0,01 масс. % до примерно 40 масс. %, от примерно 0,01 масс. % до примерно 35 масс. %, от примерно 0,01 масс. % до примерно 30 масс. %, от примерно 0,01 масс. % до примерно 25 масс. %, от примерно 0,05 масс. % до примерно 50 масс. %, от примерно 0,05 масс. % до примерно 35 масс. %, от примерно 0,05 масс. % до примерно 25 масс. %, от примерно 0,1 масс. % до примерно 50 масс. %, от примерно 0,1 масс. % до примерно 35 масс. %, от примерно 0,1 до примерно 25 масс. %, от примерно 1 масс. % до примерно 50 масс. %, от примерно 1 масс. % до примерно 35 масс. %, от примерно 1 масс. % до примерно 25 масс. %, от примерно 0,01 масс. % до примерно 20 масс. %, от 0,1 масс. % до примерно 50 масс. %, от примерно 1 масс. % до примерно 20 масс. %, от примерно 5 масс. % до примерно 20 масс. %, от примерно 5 масс. % до примерно 50 масс. %, от примерно 3 масс. % до примерно 25 масс. %, от примерно 3 масс. % до примерно 50 масс. % или от примерно 0,1 масс. % до примерно 5 масс. % от общей массы состава.
В некоторых вариантах реализации ингибитор ангиотензинпревращающего фермента присутствует в количестве меньше или равном 50, 49, 48, 47, 46, 45, 44, 43, 42, 41, 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1, 0,5, 0,3, 0,1, 0,05 или 0,01 масс. % от общей массы состава.
Пропиленгликоль может присутствовать в количестве, схожем с описанным выше. Любое количество пропиленгликоля, описанное выше, может быть использовано с любым количеством иАПФ, описанным выше, при условии, что используют достаточное количество пропиленгликоля для солюбилизации выбранного количества иАПФ.
Обычная терапевтически эффективная целевая доза иАПФ, в частности, для длительного лечения ХПКС III класса, а также для любого другого терапевтического применения, описанного в настоящем документе, составляет от примерно 0,05 до 1,0 мг иАПФ на кг массы тела животного в сутки, как правило, от примерно 0,1 до 0,5 мг и АПФ на кг массы тела животного в сутки, чаще примерно 0,5 мг иАПФ на кг массы тела животного в сутки. Суточную дозу, как правило, вводят в виде однократной дозы после потребления воды, однако в тяжелых случаях ее можно вводить в виде двух или трех доз с приблизительно равными временными интервалами в течение одного дня. Целевая концентрация иАПФ в лекарственном средстве должна быть соответствующим образом задана на уровне от 5,0 до 10 мг/мл, что позволяет вводить безопасные и равные объемы в соответствии с выбранным иАПФ. Например, собака с массой тела 10 кг будет точно получать дозу 0,5 мл, содержащую 2,5 мг или 5,0 мг иАПФ. Специалист в данной области техники легко сможет скорректировать количество жидкого состава в зависимости от массы и породы животного, и других факторов, которые необходимо учитывать, например, уже имеющихся состояний, рациона животного, конкретного болезненного состояния и симптоматики, и т.д. Кроме того, специалист в данной области техники легко сможет определить необходимую дозу для введения эффективного количества конкретного вводимого иАПФ в зависимости от болезненного состояния животного и тяжести заболевания в соответствии с рекомендациями дозы и практикой.
Например, рекомендуемая доза для эналаприла для длительного лечения ХПКС III класса у собак составляет примерно 0,5 мг/кг, перорально каждые 12 часов. Рекомендуемый диапазон доз для эналаприла составляет от 0,25 до 0,5 мг/кг, перорально каждые 12 часов или каждые 24 часа. Подобным образом, рекомендуемый диапазон доз для беназеприла составляет от 0,25 до 0,5 мг/кг, перорально каждые 12 часов или каждые 24 часа.
Очевидно, что подобно жидкому составу кардиотонического средства, описанному в настоящем документе, введение иАПФ животному, не относящемуся к человеку, такому как собака или кошка, путем доставки жидкого состава часто является более легким, чем другие формы введения, например, посредством таблетки. Кроме того, до настоящего изобретения не существовало коммерчески доступных неводных доступных для перорального введения готовых к применению жидких составов иАПФ. Для поддержания хронических состояний у животных, таких как собаки или кошки, желательными являются готовые к применению доступные для перорального введения жидкие составы.
Как описано в настоящем документе, авторы настоящего изобретения обнаружили, что состав, содержащий кардиотоническое средство, иАПФ и пропиленгликоль, обеспечивает уровни активного кардиотонического средства и иАПФ в плазме в пределах опубликованного терапевтического диапазона.
Соответственно, согласно одному из аспектов предложен жидкий состав, содержащий пропиленгликоль и эффективное количество комбинации кардиотонического средства и ингибитора ангиотензинпревращающего фермента.
Получение готового к применению жидкого состава, содержащего комбинацию кардиотонического средства и ингибитора ангиотензинпревращающего фермента, является предпочтительным по причинам, описанным выше, в отношении легкости введения доз активного агента животному в жидком составе по сравнению с другими типами составов. Кроме того, поскольку кардиотонические средства и ингибиторы ангиотензинпревращающего фермента часто вводят в виде комбинации при лечении болезни сердца, данный состав может способствовать соблюдению режима и схемы лечения, и поддержанию лечения.
Комбинированный состав содержит пропиленгликоль, кардиотоническое средство и ингибитор ангиотензинпревращающего фермента в количествах, сходных с количествами, описанными выше. Специалист в данной области техники легко сможет определить количества кардиотонического средства и ингибитора ангиотензинпревращающего фермента для включения в комбинированный состав на основе рекомендуемой дозы для конкретного выбранного агента. Кроме того, количество комбинированного состава для введения будет легко определено на основе концентраций каждого активного вещества и может быть модулировано в зависимости от факторов, описанных выше, таких как масса тела животного, болезненное состояние и тяжесть заболевания, и т.д.
Составы, описанные в настоящем документе, могут дополнительно содержать один или более фармацевтически или ветеринарно приемлемых вспомогательных веществ. Вспомогательное вещество может представлять собой любые фармацевтически или ветеринарно приемлемые вспомогательные вещества для жидкой лекарственной формы. Вспомогательные вещества, которые могут присутствовать в составе, включают поверхностно-активное вещество, загуститель, усилитель вкуса, консервант, растворитель или их комбинацию.
Например, состав может содержать поверхностно-активное вещество. Поверхностно-активные вещества представляют собой соединения, которые содержат как гидрофильную, так и гидрофобную область в одной молекуле, что позволяет им уменьшать поверхностное натяжение между водной и неводной фазами так, что может происходить смешивание. Поверхностно-активное вещество может представлять собой анионное поверхностно-активное вещество, катионное поверхностно-активное вещество, амфолитное поверхностно-активное вещество или неионное поверхностно-активное вещество, или может быть использована комбинация таких поверхностно-активных веществ. Анионные поверхностно-активные вещества включают моностеарат алюминия, стеароиллактилат кальция, цетостеарилсульфат натрия, кокоилизетионат натрия, кокоилсаркозинат натрия, лаурилсульфат натрия, лауроилизетионат натрия или кокоилизетионат натрия, лауроилсаркозинат натрия, олеат натрия, стеарат натрия, стеароиллактилат натрия и сульфатированное касторовое масло. Катионные поверхностно-активные вещества включают бромид тонзония. Амфолитные поверхностно-активные вещества включают аминокарбоновые