Активация cd89 в терапии
Иллюстрации
Показать всеНастоящая группа изобретений относится к медицине, а именно к фармакологии, и касается активации CD89 в терапии. Для этого нейтрофилы, предварительно активированные посредством стимула воспаления, приводят в контакт с эффективной дозой молекул, активирующих CD89 и содержащих Fc-альфа. Активация CD89 увеличивает апоптоз в нейтрофилах, что обеспечивает ингибирование воспаления при аутоиммунных и воспалительных заболеваниях. 3 н. и 15 з.п. ф-лы, 13 ил., 8 пр.
Реферат
Изобретение относится к применению молекул, активирующих CD89, в частности молекул, содержащих Fc-альфа, и конкретнее IgA, для индукции апоптоза в нейтрофилах. Альтернативно могут быть использованы антитела против CD89. Активация CD89 благоприятна для лечения большого числа расстройств, ассоциированных с повышенным количеством нейтрофилов, таких как аутоиммунные расстройства, воспалительные реакции, NETоз или кистозный фиброз.
Нейтрофилы образуют существенную часть врожденной иммунной системы. В норме они находятся в кровотоке. Во время острой фазы воспаления, например в результате бактериальной инфекции, нейтрофилы мигрируют по направлению к участку воспаления за счет хемотаксиса, привлекаемые цитокинами/хемокинами, высвобождающимися активированным эндотелием, тучными клетками и макрофагами в участке инфицирования или воспаления. Нейтрофилы также экспрессируют и высвобождают цитокины, которые усиливают воспалительные реакции за счет других типов клеток. Нейтрофилы играют важную роль в защите против внедряющихся патогенов, используя фагоцитоз, дегрануляцию, благодаря чему высвобождая растворимые противомикробные агенты, и создание нейтрофильных внеклеточных ловушек (NET), которые содержат сеть волокон, состоящую из хроматина и белков гранул, таких как сериновые протеазы, которые улавливают и уничтожают микробы внеклеточно. NET также могут захватывать патогены и предотвращать их дальнейшее распространение. Нейтрофилы часто будут фагоцитировать себя сами с участием макрофагов.
Иммуноглобулин А (IgA) представляет собой основной класс антител на слизистых оболочках, где он является важным участником адаптационного иммунитета слизистой. Заболевания, ассоциированные с полным или частичным отсутствием IgA, такие как общая вариабельная иммунная недостаточность (CVID) или абсолютный дефицит IgA, ассоциируют с рецидивирующей синусно-пульмональной и желудочно-кишечной инфекцией, бронхоэктазом и аутоиммунными заболеваниями. Одной из наиболее частых находок в остром периоде этих иммунопатологических состояний является нейтрофильная инфильтрация, которая за счет высвобождения токсичных медиаторов и катаболических ферментов вызывает существенное побочное повреждение тканей. Поэтому, несмотря на то, что нейтрофилы обладают большим числом полезных функций, они также могут вызывать значительное повреждение при отсутствии эффективной элиминации после удаления исходного стимула.
Рецептор IgA CD89 (Fc-альфаR) представляет собой трансмембранный гликопротеин, присутствующий на поверхности клеток миелоидного ростка, таких как нейтрофилы, моноциты, макрофаги и эозинофилы, где он опосредует иммунологические ответы на патогены. Он взаимодействует с IgA-опсонизированными мишенями и запускает процессы иммунологической защиты, такие как фагоцитоз, антителозависимая клеточно-опосредованная цитотоксичность, высвобождение медиаторов воспаления и активация окислительного взрыва.
Авторы изобретения неожиданно обнаружили, что активация CD89, в частности с помощью молекул, содержащих Fc-альфа, таких как IgA, или антитела против CD89, может индуцировать апоптоз в нейтрофилах и что эта активность усиливается при предварительной активации нейтрофилов, например с помощью компонентов микробных клеток, таких как липополисахарид (LPS) или липотейхоевая кислота (LTA), или цитокинов, таких как GM-CSF или TNF-альфа. Это наблюдение имеет большое значение для лечения заболеваний, включающих хроническое нейтрофильное воспаление, например состояний, связанных с аутоиммунным воспалением, состояний, включающих избыточный NETоз, хронических инфекций с нагноением или состояний стерильного опосредованного нейтрофилами воспаления, которые могут персистировать или становиться хроническими после разрешения инфекции, что изначально приводит к накоплению нейтрофилов в участке воспаления. Поэтому по настоящему изобретению активация CD89 на самом деле приводит к ингибированию воспаления за счет активации в нейтрофилах пути апоптоза.
Один из аспектов изобретения поэтому представляет собой CD89-активирующую молекулу, такую как молекула, содержащая Fc-альфа, или антитело против CD89, для применения в индукции апоптоза в нейтрофилах, предпочтительно в ранее активированных нейтрофилах. Предпочтительно, чтобы молекула, содержащая Fc-альфа, представляла собой иммуноглобулин А (IgA). IgA может быть поликлональным, и он может быть получен из сыворотки или плазмы, предпочтительно из сыворотки или плазмы человека. IgA может представлять собой, например, димер или мономер или их смесь. Димерный IgA также может содержать J-цепь и он может дополнительно содержать секреторный компонент. Также рассматривается применение моноклонального IgA. IgA может представлять собой IgA1, или IgA2, или их смесь. Предпочтительно, чтобы IgA был человеческим, тем не менее также может быть использован IgA приматов. Димерный IgA из сыворотки или плазмы также может быть объединен с секреторным компонентом, предпочтительно рекомбинантным секреторным компонентом, даже более предпочтительно с рекомбинантным секреторным компонентом человека. Иногда также могут присутствовать тетрамерные формы IgA.
Молекула, содержащая Fc-альфа, также может представлять собой сам по себе фрагмент Fc-альфа или его функциональный вариант (например, форму с усеченным концом, с отсутствием нескольких С-концевых аминокислотных остатков, например 18 С-концевых аминокислотных остатков, см. статью Pleass, RJ et al. J. Biol. Chem. 274, 23508-23514, 1999), но предпочтительно она представляет собой слитый белок Fc-участка IgA или его функционального варианта с другим белком, например с альбумином, таким как сывороточный альбумин человека. Тем не менее, в качестве партнеров по слиянию также могут быть использованы другие растворимые белки. Кроме того, рассматриваются одноцепочечные участки Fc-альфа или одноцепочечные версии функционального варианта Fc-альфа, а также димеры или даже мультимеры таких одноцепочечных участков Fc-альфа. В настоящем документе термин «Fc-альфа» также охватывает функциональные варианты Fc-альфа, например усеченные формы и/или другие функциональные варианты, например молекулы Fc-альфа с одной или несколькими аминокислотными заменами, делециями или вставками, которые не приводят к потере CD89-активирующей активности.
Функциональный вариант представляет собой молекулу, которая сохраняет по меньшей мере 30% CD89-активирующей активности исходной молекулы, предпочтительно по меньшей мере 40%, 50% или 60%, более предпочтительно по меньшей мере 70%, 75%, 80%, 90%, 95%, даже более предпочтительно по меньшей мере 98%, самое предпочтительное всю активность. Также полагают, что функциональный вариант мог бы обладать усиленной CD89-активирующей активностью.
Антитело против CD89 может представлять собой антисыворотку, полученную при иммунизации с помощью CD89 или его фрагментов, очищенные антитела или их CD89-связывающие фрагменты из антисыворотки против CD89 или моноклональные антитела против CD89 или их CD89-связывающие фрагменты. Предпочтительно используют моноклональное антитело против CD89. После идентификации моноклонального антитела с желаемой активностью могут быть получены миметики, которые обладают тем же эффектом, что и моноклональное антитело.
Другой аспект изобретения представляет собой фармацевтическую композицию, содержащую CD89-активирующую молекулу, предпочтительно молекулу, содержащую Fc-альфа, или антитело против CD89, описанное выше, в которой по меньшей мере 50% белка в композиции представляет собой молекулу, содержащую Fc-альфа, или антитело против CD89. Предпочтительно, чтобы по меньшей мере 60% белка представляло собой молекулу, содержащую Fc-альфа, или антитело против CD89, более предпочтительно 70%, 75%, 80%, 85%, 90% или 95%, самое предпочтительное по меньшей мере 98%.
В другом аспекте изобретения нейтрофилы, которые обрабатывают с помощью CD89-активирующей молекулы, предпочтительно молекулы, содержащей Fc-альфа, или антитела против CD89, находятся у пациента, страдающего аутоиммунным расстройством или воспалительным заболеванием, в частности состояниями, связанными с хроническим нейтрофильным воспалением. Примерами аутоиммунного расстройства или воспалительного заболевания являются стерильное нейтрофильное воспаление, такое как эмпиема плевры или эмпиема в других полостях, таких как матка (пиометра), инфекционное воспаление, например менингит с нагноением, кистозный фиброз, бронхоэктаз, воспаление, индуцированное нейтрофилами, NETоз, артрит, в частности ревматоидный артрит, спондилоартрит, анкилозирующий спондилит/болезнь Бехтерева или реактивный артрит (например, болезнь Рейтера). К дополнительным примерам относятся другие воспалительные заболевания, которые опосредованы главным образом нейтрофилами, такие как воспаление кишечника (IBD).
В другом аспекте изобретения CD89-активирующую молекулу, предпочтительно молекулу, содержащую Fc-альфа, или антитело против CD89 вводят местно в участок увеличенного количества нейтрофилов, например в больной сустав пациента, страдающего артритом, в частности в больной сустав пациента, страдающего ревматоидным артритом, или в участок стерильного или инфекционного воспаления или в участок хронического нейтрофильного воспаления.
Нейтрофилы также могут находиться в легком пациента, страдающего кистозным фиброзом, причем NETоз, т.е. избыточное образование NET (нейтрофильных внеклеточных ловушек), коррелировал с нарушенной функцией легкого с обструкцией. В этом случае предпочтительно вводить CD89-активирующую молекулу, предпочтительно молекулу, содержащую Fc-альфа, путем ингаляции. Предпочтительно ее вводят в сочетании с ДНКазой.
Кроме того, NETоз может быть ассоциирован с патогенезом других аутовоспалительных состояний, таких как преэклампсия, септический шок и аутоиммунный васкулит. Другой аспект изобретения поэтому представляет собой молекулу, содержащую Fc-альфа, в частности IgA, или антитело против CD89 для применения в лечении этих состояний, предпочтительно для применения в индукции апоптоза в нейтрофилах, предпочтительно в активированных нейтрофилах, находящихся у пациентов, страдающих этими состояниями.
Другой аспект изобретения представляет собой способ индукции апоптоза у нейтрофилов, содержащий приведение нейтрофилов в контакт с эффективной дозой CD89-активирующей молекулы, такой как молекула, содержащая Fc-альфа, или антитело против CD89. Предпочтительно, нейтрофилы были подвергнуты или подвергаются действию провоспалительных цитокинов или микробных продуктов или других стимулов перед или во время контакта с CD89-активирующей молекулой.
Эффективная доза молекулы, содержащей Fc-альфа, может быть выше концентрации IgA в плазме, предпочтительно в около трех раз выше концентрации IgA в плазме, более предпочтительно в около 10 раз, 15 раз или 20 раз выше концентрации IgA в плазме или даже выше.
CD89-активирующая молекула, предпочтительно молекула, содержащая Fc-альфа, или антитело против CD89, предпочтительно содержится в фармацевтической композиции, содержащей один или несколько фармацевтически приемлемых эксципиентов. Композиция дополнительно может содержать стабилизатор.
Способ введения может представлять собой внутривенный, подкожный, ингаляторный, интраназальный, местный (т.е. через поверхность кожи или слизистой, к которым относятся кишечник или глаз, в виде глазных капель), пероральный способ, но предпочтительно введение осуществляют местно, т.е. в участок избыточной инфильтрации или активности нейтрофилов, например в сустав, пораженный артритом, путем ингаляции при кистозном фиброзе, путем инъекции в участок стерильной инфекции и т.д. Лекарственная форма может представлять собой таблетку, капсулу, крем, свечу, но предпочтительно она представляет собой стерильный раствор. Продукт может быть предоставлен в лиофилизированной форме и восстановлен в жидкую форму перед применением или он может быть предложен в виде стабильной жидкой препаративной формы.
Другой аспект изобретения представляет собой CD89-активирующую молекулу, такую как молекула, содержащая Fc-альфа, или антитело против CD89, использованные в сочетании с другими терапевтическими агентами, такими как противовоспалительные соединения, например NSAID, антитела, которые могут модулировать иммунный ответ, такие как антитела против CD20 (например, ритуксан), против TNFальфа (например, ремикад, хумира), антибиотики, противовирусные соединения, такие как ганцикловир, противогрибковые соединения, такие как вориконазол, или антипротозойные соединения.
Молекула, содержащая Fc-альфа, может представлять собой поликлональный IgA, например, выделенный из сыворотки или плазмы, предпочтительно из сыворотки или плазмы человека. Более предпочтительно его очищают из пула плазмы человека. Еще более предпочтительно его очищают как побочный продукт фракционирования плазмы человека и/или последующей очистки белков плазмы, самое предпочтительное из побочной фракции, которую получают в процессе производства препаратов IgG (например, IVIg или SCIg) из пулированной плазмы человека и/или из преципитата, полученного в процессе производства препаратов IgG из плазмы.
Предпочтительно из пулированной плазмы человека выделяют (или обогащают) димеры IgA. Более предпочтительно эти димеры дополнительно объединяют с секреторным компонентом, например секреторным компонентом, полученным рекомбинантным путем. Полагают, что полученный секреторный IgA должен быть более устойчив в среде с высоким уровнем протеаз, например синовиальной жидкости сустава, пораженного артритом, или воспаленном легком или кишечнике. Поскольку большинство белков нейтрофильных гранул представляют собой протеазы, это может быть особенно предпочтительным способом осуществления настоящего изобретения.
Альтернативно, IgA может быть моноклональным. Моноклональный IgA может быть получен посредством гибридомных клеточных линий или путем создания клеточных линий, содержащих кДНК легкой цепи и тяжелой цепи в экспрессирующей плазмиде с подходящим промотором и необязательно дополнительными регуляторными элементами. Специалист в данной области хорошо осведомлен о способах получения гибридом, например, путем слияния клеток или иммортализации В-лимфоцитов, продуцирующих IgA. Способы выделения кДНК, кодирующих тяжелую цепь и легкую цепь антитела, и клонирования этих кДНК в подходящих экспрессирующих векторах также хорошо известны в данной области. Экспрессирующие векторы затем могут быть трансфицированы в линии клеток, например линии клеток млекопитающих, такие как клетки СНО или клетки НЕК293, и линии клеток могут быть выбраны так, чтобы устойчиво экспрессировать желаемое антитело. Подходящие техники можно найти, например, в руководстве Current Protocols in Molecular Biology, Ausubel FM et al. (eds.) John Wiley & Sons, Inc.; http://www.currentprotocols.com/WileyCDA/. В настоящем документе при использовании термина «IgA» также охватываются функциональные варианты IgA, например IgA с одной или несколькими аминокислотными заменами, делециями или вставками, которые не приводят к потере CD89-активирующей активности.
Молекула, содержащая Fc-альфа, также может представлять собой созданный слитый белок. Например, кДНК, кодирующую участок Fc-альфа тяжелой цепи IgA, сливают в рамке считывания с кДНК, кодирующей другой белок, предпочтительно растворимый белок, например, сывороточный альбумин человека. Примеры подходящих последовательностей кДНК Fc-альфа представлены в SEQ ID NO:1 и 2.
Молекула, содержащая Fc-альфа, также может представлять собой одноцепочечный белок Fc-альфа, в котором две кДНК Fc-альфа связывают посредством нуклеиновой кислоты, кодирующей линкерный пептид, аналогично созданию одноцепочечных фрагментов Fv. (Wörn A, Plückthun A. J. Mol. Biol, 2001; 305:989-1010). Два или несколько таких одноцепочечных белков Fc-альфа также могут быть соединены с образованием димера или мультимера, составленного из единиц Fc-альфа. Такие молекулы могут быть получены принятыми техниками, например, описанными в руководстве Current Protocols in Molecular Biology, Ausubel FM et al. (eds.) John Wiley & Sons, Inc.; http://www.currentprotocols.com/WileyCDA/. Например, участок Fc-альфа тяжелой цепи IgA может быть амплифицирован с клетки, продуцирующей IgA, посредством RT-PCR, используя праймеры, созданные так, чтобы содержать подходящие сайты рестрикции. Полученная кДНК затем может быть расщеплена с помощью соответствующей(их) рестриктазы(з) и клонирована в подходящим образом полученный экспрессирующий вектор. Синтетические олигонуклеотиды, кодирующие линкерные пептиды, могут быть вставлены в соответствующие позиции, например, путем расщепления кДНК с помощью соответствующих рестриктаз и лигирования олигонуклеотидов с помощью подходящим образом созданных концов в вектор. Полная экспрессирующая плазмида затем может быть получена в больших количествах, например в E. coli, используя стандартные техники. После очистки она может быть трансфицирована в клетки млекопитающих, и могут быть получены линии клеток, стабильно экспрессирующие желаемые белки. Белки затем могут быть очищены. Для осуществления этих процедур доступны стандартные техники.
Также рассматриваются химерные участки Fc-альфа, содержащие, например, один константный домен тяжелой цепи IgA1 и один константный домен тяжелой цепи IgA2; специалисту в данной области хорошо известны иммуноглобулиновые домены, и он может определить границы доменов и объединить иммуноглобулиновые домены по желанию. Также охватываются комбинации участков Fc-альфа с J-цепью; дополнительно полученная молекула также может быть объединена с секреторным компонентом. Как указано выше, также могут быть использованы функциональные фрагменты Fc-альфа и функциональные варианты; также охватываются слитые белки, димеры, мультимеры, комбинации таких функциональных вариантов с J-цепью или с J-цепью и секреторным компонентом.
Предпочтительный секреторный компонент содержит по меньшей мере сегмент аминокислотных остатков с 1 до около 606 остатка аминокислотной последовательности полимерного иммуноглобулинового рецептора человека (pIgR) или ее вариантов, например аналогичные участки различных видов млекопитающих. Тем не менее, предпочтительна последовательность человека. Белковую последовательность pIgR человека можно найти под номером доступа РО1833 в базе данных SwissProt (см. также статью Krajci et al., 1989, Biochem. Biophys. Res. Comm 158, 783-789).
Альтернативно, CD89-активирующий белок может представлять собой антитело против CD89. Специалисту в данной области будут хорошо известны способы получения антитела против CD89. Для продукции специфической антисыворотки в качестве антигена могут быть использованы CD89 или его фрагменты. Антитела могут быть выделены из такой антисыворотки. Также могут быть получены моноклональные антитела, и способы получения таких моноклональных антител хорошо известны специалистам в данной области. Предпочтительно моноклональное антитело против CD89 представляет собой антитело человека, например, полученное из иммортализированных В-лимфоцитов человека или в животном, у которого собственные гены иммуноглобулинов животного по меньшей мере частично были заменены соответствующими генами человека. Техники, использованные для продукции антител, хорошо известны и подробно описаны в большом числе лабораторных руководств, например Ed Harlow & David Lane: Antibodies, A Laboratory Manual, или Sambrook et al. Molecular Cloning, A Laboratory Manual (оба из лаборатории CSHL).
Изобретение поясняется на следующих примерах. Примеры предлагаются в качестве иллюстрации пути осуществления изобретения и не предназначены ограничивать изобретение.
ПРИМЕРЫ: Индукция апоптоза в нейтрофилах
Материалы и способы
Антитела: Антитела против CD89 (клон А59) (как немеченые, так и конъюгированные с фикоэритрином [PE]) и контрольный иммуноглобулин изотипа G1 (IgG1), конъюгированный с РЕ, получали у фирмы BD Biosciences (Basel, Switzerland). Антитела козы против IgG мыши (GaM) и немеченые контрольные IgG1 получали у фирмы Jackson ImmunoResearch Laboratories (рассылались Milan Analytica, La Roche, Switzerland). Антагонистические mAb против Fas (СН11) получали у фирмы LabForce AG (Nunningen, Switzerland). IgA из пулированной сыворотки получали у фирмы CSL Behring AG (Wankdorf, Bern) и готовили согласно следующему: IgA очищали из плазмы человека и побочной фракции процесса производства IVIg/SCIg путем аффинной хроматографии, используя смолу с IgA человека CaptureSelect, продукция фирмы ВАС (Naarden, Netherlands). Вкратце, крио-обедненную пулированную плазму человека или побочную фракцию загружали на колонку CaptureSelect, уравновешенную IgA человека, при условиях, близких к физиологическим (рН, проводимость), не превышая способности колонки связывать IgA. После загрузки колонку отмывали фосфатно-забуференным солевым раствором и IgA элюировали с помощью глицинового буфера при величине рН 3. Элюаты корректировали по величине рН и концентрировали до содержания белка 50 мг/мл. Мономерный IgA может быть очищен из IgA плазмы, полученного, как описано выше, посредством препаративной эксклюзионной хроматографии, например, используя смолу гель Superdex 200. Клетки: Нейтрофилы крови выделяли от здоровых индивидуумов, а также пациентов, страдающих ревматоидным артритом (RA), ассоциированным с острым воспалением сустава. Вкратце, мононуклеарные клетки периферической крови (PBMC) отделяли путем центрифугирования на смеси Ficoll-Hypaque (продукция фирмы Seromed-Fakola AG, Basel, Switzerland). Низшую фазу, главным образом, гранулоциты и эритроциты, обрабатывали раствором для лизиса эритроцитов (155 мМ NH4Cl, 10 мМ КНСО3 и 0,1 мМ EDTA [этилендиаминтетрауксусная кислота], pH 7,3). Полученные популяции клеток содержали, главным образом, нейтрофилы. Нейтрофилы суставной жидкости пациентов, страдающих RA, выделяли, используя тот же протокол. Степень очистки клеток оценивали путем окрашивания красителем Diff-Quik (продукция фирмы Baxter, Düdingen, Switzerland) и анализа световой микроскопии. Степень очистки полученных популяций в отношении нейтрофилов составляла по меньшей мере 95%.
Иммунофлуоресценция: Экспрессию на поверхности CD89 анализировали посредством проточной цитометрии после инкубации клеток с насыщающими концентрациями РЕ-конъюгированных антител против CD89 и РЕ-конъюгированных контрольных mAb соответствующего изотипа.
Культуры клеток: Нейтрофилы культивировали в количестве 1×106/мл при наличии или в отсутствие цитокинов или LPS и/или антител в течение указанных интервалов времени, используя полную культуральную среду (RPMI 1640, содержащую 10% фетальную сыворотку теленка [FCS] и пенициллин в количестве 200 МЕ/мл/стрептомицин в количестве 100 мкг/мл, продукция фирмы Life Technologies, Basel, Switzerland). Если не указано другое, клетки стимулировали с помощью mAb против CD89 в концентрации 17,5 мкг/мл или IgA плазмы в концентрации 10 мг/мл. GM-CSF (продукция фирмы Novartis Pharma GmbH, Nürnberg, Germany) использовали в количестве 25 нг/мл, mAb против Fas (CH11) в количестве 1 мкг/мл. LPS (продукция фирмы Sigma Aldrich, Buchs, Switzerland) использовали в концентрации 100 нг/мл. Антитела козы против мыши использовали в концентрации 30 мкг/мл, G-CSF (продукция фирмы Aventis Pharma, Zurich, Switzerland) в концентрации 25 нг/мл, IFN-γ (продукция фирмы R&D Systems, Wiesbaden-Nordenstadt, Germany) в концентрации 85 нг/мл, IFN-α (продукция фирмы PBL Biomedical Laboratories, распространяемая Alexis) в концентрации 500 Ед/мл, TNF-α (продукция фирмы R&D Systems, Wiesbaden-Nordenstadt, Germany) в концентрации 25 нг/мл и LTA (продукция T. Hartung University, Констанц) в концентрации 10 мкг/мл. Ингибитор каспаз qVD-OPh (хинолин-Val-Asp-дифторфеноксиметилкетон) использовали в концентрации 20 мкМ.
Идентификация гибели клеток и апоптоза: Гибель клеток оценивали по поглощению 1 мкМ этидиумбромида и анализу проточной цитометрии (FACSCalibur, Becton Dickinson). Для определения формы гибели клеток осуществляли морфологический анализ и анализ с помощью аннексина V. Для морфологического анализа клетки культивировали в течение 15 часов и окрашивали по Гимзе-Маю-Грюнвальду (краситель Diff-Quik). Использовали микроскоп Axiovert 35, оснащенный линзой объектива 630/1,4 oil (продукция фирмы Carl Zeiss, Heidelberg, Germany). Изображения обрабатывали с помощью программного обеспечения Adobe Photoshop 5.0 (продукция фирмы Adobe, San Jose, CA). Для определения, погибла ли клетка путем апоптоза, на мембране нейтрофилов измеряли перераспределение фосфатидилсерина (PS) посредством окрашивания аннексином V и проточной цитометрии (FACSCalibur, Becton Dickinson), используя коммерчески доступный набор для детекции апоптоза согласно протоколу производителя (BD Biosciences) при наличии пропидиум йодида (PI) (von Gunten S et al., Blood 2005; 106:1423-1431). Для идентификации фрагментации ДНК, характерного маркера апоптоза, клетки пермеабилизовали посредством гипотоничного раствора флуорохрома (50 мкг/мл пропидиум йодид, 0,1% цитрат натрия, 0,1% тритон Х-100), что приводит к просачиванию мультимеров ДНК (182 нп) из клетки. Оставшееся уменьшенное количество ДНК затем окрашивали с помощью агента, встраивающегося в ДНК, пропидиум йодида и анализировали посредством проточной цитометрии (Nicoletti I et al., J Immunol. Methods 1991; 139:271-279).
Статистический анализ: Статистический анализ осуществляли, используя t-критерий Стьюдента. При наличии средних уровней в каждом случае указывают стандартную ошибку среднего (SEM) и число (n) независимых экспериментов. Величину вероятности меньше чем 0,05 считали статистически значимой.
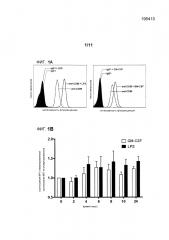
Пример 1: Экспрессия CD89 на нейтрофилах при стимуляции с помощью LPS или GM-CSF
Нейтрофилы выделяли из крови здоровых добровольцев, как описано выше. Клетки инкубировали при наличии или в отсутствие стимула, вызывающего воспаление, (LPS в количестве 100 нг/мл или GM-CSF в количестве 10 нг/мл) в течение 8 часов. Клетки затем инкубировали с антителом против CD89, меченным фикоэритрином (РЕ), или контрольным антителом соответствующего изотипа, меченным фикоэритрином (РЕ). Экспрессию CD89 затем оценивали посредством проточной цитометрии.
Нейтрофилы экспрессировали CD89 в отсутствие стимула, вызывающего воспаление (фиг.1А), и экспрессия CD89 увеличивалась при инкубации клеток в присутствии стимула воспаления, такого как LPS (Фиг.1А, левая панель) или GM-CSF (Фиг.1А, правая панель). Также представлены профили клеток, окрашенных контрольным антителом. На фиг. 1В показана динамика активации CD89 с помощью LPS и GM-CSF. Существенная активация экспрессии наблюдалась после 4 часов.
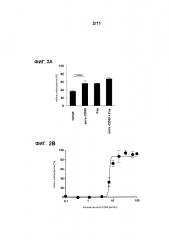
Пример 2: Лигирование CD89 стимулирует гибель клеток нейтрофилов
Нейтрофилы выделяли, как описано выше. Клетки затем инкубировали с моноклональным антителом против CD89, антителом против Fas, анти-Fas + анти-CD89, с каждым антителом инкубировали при наличии и в отсутствие антитела козы против мыши (GaM). Гибель клеток оценивали по поглощению этидиумбромида и с помощью анализа проточной цитометрии. Лигирование CD89 с помощью моноклонального антитела против CD89 (mAb) привело к существенно увеличенной гибели клеток нейтрофилов (Фиг. 2А), аналогично антитело против Fas также индуцировало клеточную смерть. CD89-опосредованная гибель дополнительно существенно усиливалась за счет перекрестного связывания. Представлены результаты 22-часовых культур (n=5). (B) График зависимости эффекта от концентрации mAb против CD89 в 22-часовых культурах нейтрофилов указал на максимальный эффект гибели при концентрации 17,5 мкг/мл (n=5) (Фиг. 2В).
У IgA, выделенных из плазмы, или моноклональных IgA и других молекул, содержащих Fc-альфа, будет наблюдаться подобное же влияние, особенно при перекрестном связывании CD89.
Пример 3: IgA сыворотки и CD89 индуцируют гибель клеток нейтрофилов
Нейтрофилы крови выделяли от здоровых добровольцев, как описано выше. Клетки инкубировали в среде при наличии или в отсутствие IgA плазмы в концентрации 10 мг/мл (Фиг. 3А) или mAb против CD89 в концентрации 17,5 мкг/мл (Фиг. 3В) при наличии большого числа стимулов воспаления. IgA отчетливо повысил гибель клеток в активированных нейтрофилах (Фиг. 3А). Подобные же результаты получали с участием моноклонального антитела против CD89, как показано на Фиг. 3В. Суммарные IgA плазмы (содержащие мономеры и димеры) и мономерная подфракция IgA плазмы оказались в равной степени эффективны в индукции гибели клеток нейтрофилов (Фиг. 3С).
Пример 4: Нейтрофилы пациентов, страдающих анкилозирующим спондилоартритом, экспрессируют повышенные уровни CD89
Нейтрофилы выделяли из крови здорового добровольца и пациента, страдающего анкилозирующим спондилоартритом. Затем их инкубировали с mAb против CD89, меченным РЕ, или контрольным антителом, меченным РЕ, и экспрессию CD89 анализировали посредством проточной цитометрии. У нейтрофилов пациента, страдающего анкилозирующим спондилоартритом, наблюдалась существенно повышенная поверхностная экспрессия CD89 (Фиг. 4, сплошная линия) по сравнению со здоровым донором (Фиг. 4, пунктирная линия). Также представлено окрашивание тех же образцов контрольным mAb соответствующего изотипа.
Пример 5: Нейтрофилы, выделенные от пациентов, более чувствительны к гибели клеток, опосредованной антителами против CD89 и IgA
Нейтрофилы выделяли из крови здоровых добровольцев с целью контроля и из суставной/синовиальной жидкости пациентов, страдающих артритом (пациентов, страдающих ревматоидным артритом, анкилозирующим спондилоартритом, псориатическим артритом и артритом неизвестной этиологии), и культивировали в течение 24 часов при наличии или в отсутствие антитела против CD89 или среды; после чего гибель клеток нейтрофилов анализировали, как описано выше. Антитела против CD89 привели к значительному проценту погибших нейтрофилов в синовиальной жидкости пациентов, страдающих артритом. Процент погибших нейтрофилов оказался существенно выше, чем в крови здоровых добровольцев, как показано на фиг. 5А. Тот же эффект наблюдался с IgA плазмы в концентрации 10 мг/мл (Фиг. 5В).
Пример 6: Панкаспазный ингибитор qVD-OPh ингибирует IgA-опосредованную гибель клеток нейтрофилов
Нейтрофилы выделяли из крови здоровых добровольцев, как описано выше. Клетки затем культивировали в течение 24 часов при наличии или в отсутствие стимула, вызывающего воспаление (LPS, GM-CSF), и оценивали гибель клеток в отсутствие или при наличии IgA и/или панкаспазного ингибитора qVD-OPh (20 мкМ). Результаты представлены на фиг. 6. Панкаспазный ингибитор qVD-OPh блокировал гибель клеток нейтрофилов, опосредованную IgA плазмы, как при наличии, так и в отсутствие LPS и GM-CSF. В качестве контроля представлена индукция апоптоза с помощью mAb против Fas и его ингибирование с помощью qVD-OPh. Эти находки указывают на то, что гибель клеток нейтрофилов, опосредованная IgA, представляет собой каспаззависимую программируемую гибель клеток, т.е. апоптоз.
Пример 7: Перераспределение фосфатидилсерина при связывании IgA пулированной сыворотки с нейтрофилами, как показано путем окрашивания аннексином V
Нейтрофилы выделяли из крови здоровых добровольцев, как описано выше, и инкубировали в среде, среде c GM-CSF или LPS, при наличии или в отсутствие IgA плазмы или mAb против CD89. С целью контроля нейтрофилы инкубировали с mAb против Fas, индуцирующим апоптоз. Через 6 часов распределение фосфатидилсерина оценивали посредством окрашивания аннексином V и проточной цитометрии. Через 10 часов оценивали фрагментацию ДНК посредством окрашивания пропидиум йодидом и проточной цитометрии.
Лигирование IgA пулированной сыворотки при наличии GM-CSF или LPS привело к значительному перераспределению фосфатидилсерина (Фиг. 7А) и фрагментации ДНК (Фиг. 7В), и то и другое указывает на индукцию апоптоза у нейтрофилов. Сопоставимые результаты получали, используя mAb против CD89 вместо IgA плазмы (Фиг. 7А, 7В). Эти диаграммы рассеяния представляют один репрезентативный эксперимент из 5. Проценты клеток указаны в каждом квадранте. На фиг. 7В в каждой гистограмме указано относительное число апоптотических клеток (процент).
Пример 8: Морфология гибели нейтрофилов, опосредованной CD89
Нейтрофилы выделяли из крови здоровых добровольцев, как описано выше. Их культивировали в течение 15 часов при наличии среды самостоятельно, GM-CSF или LPS при наличии и в отсутствии анти-CD89. Их окрашивали по Гимзе-Маю-Грюнвальду (краситель Diff-Quik) и оценивали путем микроскопии. У CD89-опосредованной гибели нейтрофилов наблюдались типичные морфологические признаки классического апоптоза (уменьшенный объем клетки, фрагментированные ядра). Полагают, что у IgA-опосредованной гибели нейтрофилов будет та же морфология.
1. Применение молекулы, активирующей CD89, содержащей Fc-альфа или его функциональный эквивалент для индуцирования апоптоза в нейтрофилах, где нейтрофилы предварительно активируют посредством стимула воспаления, такого как липополисахарид (LPS), липотейхоевая кислота (LTA), GM-CSF или TNF-альфа.
2. Применение по п.1, где молекула, содержащая Fc-альфа, представляет собой иммуноглобулин А (IgA).
3. Применение по п.2, где IgA получают из сыворотки или плазмы.
4. Применение по п.2 или 3, где IgA представляет собой димер.
5. Применение по п.2 или 3, где IgA представляет собой мономер.
6. Применение по п.4, где димер IgA содержит J-цепь.
7. Применение по п.6, где димер IgA содержит секреторный компонент.
8. Применение по п.2 или 3, где IgA содержит мономерный и димерный IgA.
9. Применение IgA по пп. 2, 3, 6 или 7, где IgA является поликлональным.
10. Применение по любому из пп. 2, 6 или 7, где IgA является моноклональным.
11. Применение по любому из пп. 2, 3, 6 или 7, где IgA представляет собой IgA1, или IgA2, или их смесь.
12. Фармацевтическая композиция для индуцирования апоптоза нейтрофилов, содержащая молекулу, активирующую CD89, охарактеризованную в любом из пп. 1-11, где по меньшей мере 50% белка в композиции представляет собой молекулу, активирующую CD89, и где нейтрофилы предварительно активируют посредством стимула воспаления, такого как LPS, LTA, GM-CSF или TNF-альфа.
13. Применение по любому из пп. 1, 2, 3, 6 или 7, где нейтрофилы содержатся у пациента, страдающего аутоиммунным расстройством или состоянием воспаления.
14. Применение по п.13, где аутоиммунное расстройство или состояние воспаления выбирают из стерильного нейтрофильного воспаления, инфекционного воспаления, воспаления, индуцированного нейтрофилами, воспалительного заболевания кишечника и NETоза.
15. Применение по п.13, где аутоиммунное расстройство представляет собой артрит, в частности ревматоидный артрит, спондилоартрит, анкилозирующий спондилит/болезнь Бехтерева или реактивный артрит.
16. Применение по любому из пп. 1, 2, 3, 6 или 7, где молекулу, активирующую CD89, вводят местно.
17. Применение по любому из пп. 1, 2, 3, 6 или 7, где нейтрофилы находятся у пациента, страдающего кистозным фиброзом.
18. Способ индукции апоптоза нейтрофилов, включающий приведение нейтрофилов в контакт с эффективной дозой молекулы, активирующей CD89, по любому из пп. 1-11, в котором нейтрофилы предварительно активируют посредством стимула воспаления, такого как LPS, LTA, GM-CSF или TNF-альфа.