Сшиваемые in situ полимерные композиции и способы для них
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к композиции гелеобразного матрикса для обработки кровоточащих ран, состоящей из а) 0,1-5% масс. альгината натрия; b) 2-25% масс. хитозана; c) воды – остальное. Изобретение обеспечивает более быстрое заживление ткани, на которую наносится предлагаемая композиция, которая в том числе является легко наносимой и легко удаляемой с места нанесения. 11 з.п. ф-лы, 12 ил.
Реферат
По данной заявке испрашивают приоритет предварительной патентной заявки с серийным №61/559110, поданной 13 ноября 2011 года, полное описание которой включено в настоящий документ посредством ссылки.
Область изобретения
Настоящее изобретение в основном относится к композиции, в которой используют биологически совместимый полимерный состав, и, в частности, к гемофильной полимерной матрице для использования в заживлении ран, свертывании крови и для косметического использования.
Предпосылки изобретения
Заживление ран представляет собой сложный организованный процесс, в который вовлечены взаимодействия различных клеток и компонентов матрикса для того, чтобы сначала создавать временную ткань, а затем ремоделировать ее, при этом формируя зрелую замену. Изначально, кровоостанавливающая тромбоцитарная пробка воссоздает сдерживающий инфекцию и ограничивающий высыхание барьер и вытягивает первую волну клеточных инфильтратов. Она преимущественно состоит из лейкоцитов, которые обеспечивают как врожденный, так и приобретенный иммунитет. Эти клетки продуцируют ферменты и биоцидные молекулы для того, чтобы устранять микробную контаминацию; однако эти же защитные механизмы повреждают кератиноциты, фибробласты и клетки эндотелия, необходимые для регенерации утраченной ткани. Таким образом, по мере заживления события и процессы воспалительной фазы должны сходить на нет.
Конкретная проблема возникает в случае восстановления кожной раны, которая происходит на контаминированной поверхности. Если рана инфицируется, нормальное заживление нарушается, поскольку воспалительная фаза становится хронической, подавляя регенеративную фазу. Кроме того, ферменты, высвобождаемые как микробами, так и лейкоцитами, разрушают ткань раны, а также окружающую кожу. Таким образом, важно обеспечить правильное заживление для того, чтобы предотвратить развитие инфекции за счет нормальных контаминантов кожной раны.
Заживление ран обычно разделяют на три фазы: воспалительная фаза, пролиферативная фаза и фаза ремоделирования. Сообщалось, что фибронектин вовлечен в каждый этап процесса заживления ран, в частности, посредством создания каркаса, к которому прилипают проникающие клетки. Изначально происходит высвобождение множества медиаторов в место раны, таких как фибронектин и фибриноген. Фибронектин способствует миграции воспалительных клеток в рану и фагоцитозу дебриса моноцитами. После этого происходят ангиогенез и реэпителизация. На этом этапе фибронектин проявляет хемотаксическую активность для клеток эндотелия и способствует миграции эпителиальных клеток и фибробластов к базальной мембране. Фибронектин также, по-видимому, важен для фазы ремоделирования, где он играет основную роль в организации фибрилл коллагена. Фибриллярный коллаген в конечном итоге образует пучки волокон, которые увеличивают прочность ткани при растяжении, что ведет к закрытию раны.
Гидрогели типично используют в качестве топических составов для ускорения процесса заживления ран. Гелевые композиции выбирали по их свойствам - степени набухания, биосовместимости, проницаемости и кинетике набухания. Примеры таких соединений включают виниловые полимеры (например, полиакриловая кислота), целлюлозу и производные целлюлозы. Полимер полиакриловой кислоты, также обозначаемый как карбомер, использовали по причине его превосходства в доставке фибронектина в раны кожи.
Встречающиеся в природе биополимеры имеют применения в технологии культивирования тканей, регенеративной медицине, доставке лекарственных средств, медицинских имплантах, пластической хирургии и др. Такие продукты имеют компоненты, содержащие гиалуроновую кислоту (ГК), хитозан, гепарин, хондроитинсульфат, альгинат и другие глюкозамины и глюкозаминогликаны, другие полисахариды и их производные.
В комбинации сосредоточения фибронектина (и схожих белков) использовали с альгинатной солью для лечения хронических язв. Повязочную систему отверждали, превращая гель в нити, посредством процесса лиофилизации. Эта процедура создает губчатую структуру с гидрофильными свойствами. В присутствии текучих веществ повязки могут возвращаться в гелеобразное состояние, поглощая вплоть до 20 раз больше их массы в раневом экссудате. Повязку легко удалять после лечения раны по причине ее губчатой структуры и влагоудержания. Однако после гидратации физиологическим раствором фибронектин-целлюлозная повязка не предоставляет желаемой волокнистой защитной пленки на поверхности деэпителизированной кожи человека. Затем осуществляют санацию раневой полости после удаления повязки для того, чтобы удалять любое некротизированное вещество.
Таким образом, в лечении острых и хронических ран существуют проблемы, включая медленное заживление, сниженную грануляцию и эпителизацию и постоянное воспаление раны. Нарушенное заживление ран может вести к другим осложнениям и проблемам, таким как инфекция, боль и развитие хронических (незаживающих) ран.
В настоящее время существует потребность в лечении хронических ран, которое будет помогать заживлению, снижению воспаления, уменьшению боли и предотвращать формирование шрама в случае как острых, так и хронических ран. Такие острые раны, которые можно лечить, включают ожоги, истирания, сухую кожу, послеоперационные хирургические разрезы, порезы, колотые раны, буллезные поражения, укусы насекомых и другие тяжелые повреждения ткани. Лечение хронических ран может охватывать медленно заживающие раны, включая сдавленные язвы, венозные язвы, язвы при диабетической стопе, пролежни и незаживающие повреждения тканей.
В общем, желательна композиция, которую будет легко наносить, которая формирует матрикс, способствующий заживлению ткани, и которая имеет противомикробные свойства. Композиция может быть биологически совместимой или быстро реагирующей, чтобы избегать возможной цитотоксичности. Кроме того, композиция должна стимулировать и максимально увеличивать заживление ран, при этом предоставляя контролируемый способ обеспечения, по желанию, тонких и толстых слоев отвержденной раневой повязки.
Непрямые эффекты могут включать сниженную потребность в медицинских процедурах, таких как санация раневой полости, уменьшенное время госпитализации, уменьшенное время послеоперационного восстановления, укороченный интервал возвращения к повседневным функциям и труду и уменьшенная общая стоимость лечения. По желанию, эти улучшения в отношении заживления ран, включая нанесение и способ использования, будут полезны при лечении и восстановлении различных тканей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Следующее изобретение представляет собой биологически совместимую полимерную композицию, которая представляет собой гелеобразный заживляющий раны и кровоостанавливающий матрикс, который можно формировать и отверждать как внутренне, так и внешне.
В одном из вариантов осуществления изобретения биологически совместимая полимерная композиция содержит 1) один или больше чем один полианионный полимер и 2) один или больше чем один поликатионный полимер. В одном из вариантов осуществления изобретения один или больше чем один полианионный полимер включает по меньшей мере один сшиваемый полианионный полимер. В другом варианте осуществления изобретения один или больше чем один полианионный полимер включает по меньшей мере один сшиваемый полианионный полимер и по меньшей мере один несшиваемый полианионный полимер.
В одном из вариантов осуществления изобретения биологически совместимая полимерная композиция содержит смесь из 1) одного или больше чем одного полианионного полимера, который можно формировать на поверхности раны и 2) один или больше чем один поликатионный полимер, который способствует процессу отверждения, а также ускоряет свертывание крови. В другом варианте осуществления изобретения биологически совместимая полимерная композиция содержит смесь из 1) одного или больше чем одного полианионного полимера, который можно формировать на поверхности раны; 2) одного или больше чем одного поликатионного полимера, который способствует процессу отверждения, а также ускоряет свертывание крови; и 3) сшивающий аэрозоль, который сшивает гель в ране, при этом дезинфицируя окружающую область.
В одном из вариантов осуществления изобретения один или больше чем один полианионный полимер содержит альгинаты или гиалуронаты. В одном из вариантов осуществления изобретения один или больше чем один поликатионный полимер содержит хитозан. В одном из вариантов осуществления изобретения сшивающий аэрозоль может представлять собой водный хлорид кальция.
Также раскрыты один или несколько способов использования медицинского геля по изобретению, включающих быстрое достижение гемостаза без необходимости прикладывать давление и предоставление биологически совместимого матрикса для заживления ран.
Различные варианты осуществления изобретения позволяют корректировать и реализовать состав для того, чтобы варьировать желаемую вязкость и предварительно определяемые характерные функции. В одном из аспектов отношение поликатионного полимера к полианионному полимеру можно усовершенствовать, получая различные степени эффективности заживления ран. В другом аспекте можно добавлять терапевтические средства, чтобы интегрировать лекарственные составы в целях возможности доставки лекарственных средств. Кроме того, другие признаки могут охватывать управление температурой(ами) и/или давлением(ями) во время получения медицинского геля, во время нанесения геля и реализацию управления эластичностью или жесткостью отвержденного матрикса. Состав матрикса, как жидких, так и отвержденных структур, также может зависть от анатомических и физиологических измерений и условий.
Различные варианты осуществления изобретения позволяют корректировать и реализовать композицию в первом месте ткани или втором месте ткани, и такие модификации полагают очевидными и их можно встраивать и объединять в различных количествах, чтобы предоставить структурный матрикс любого размера, геометрической формы и конфигурации.
Описание чертежей
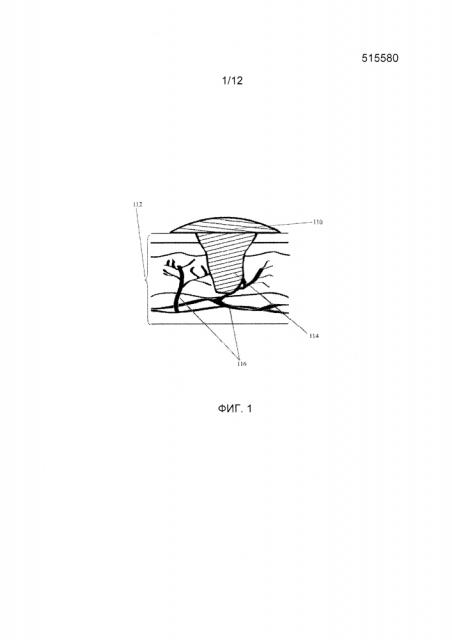
На фиг. 1 представлен вид сбоку варианта осуществления настоящего изобретения.
На фиг. 2 представлено микроскопическое изображение того, как настоящее изобретение взаимодействует с кровью и с самим собой.
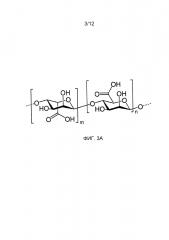
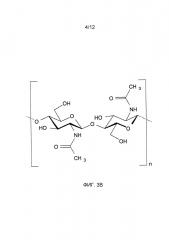
На фиг. 3A-3I представлены различные полимерные звенья, которые можно использовать для получения поликатионных или полианионных полимеров.
На фиг. 4 представлена польза от настоящего изобретения по сравнению с существующей технологией.
Подробное описание изобретения
В следующем подробном описании в целях объяснения, а не ограничения образцовые варианты осуществления, раскрывающие конкретные подробности, изложены для того, чтобы обеспечить полное понимание настоящего изобретения. Однако среднему специалисту в данной области будет очевидно, что настоящее изобретение можно осуществлять на практике в других вариантах осуществления, которые отступают от конкретных подробностей, описанных в настоящем документе. В других случаях подробные описания общеизвестных композиций и способов можно опустить с тем, чтобы не мешать описанию настоящего изобретения.
Биологически совместимые полимерные композиции по настоящему изобретению можно использовать для того, чтобы лечить внешние раны, а также внутренние раны. В одном из вариантов осуществления изобретения биологически совместимую полимерную композицию можно наносить на различные раны. Неограничивающие примеры ран включают, но не ограничиваясь этим: внешний разрыв, истирание, ожог, разрыв глазного яблока, повреждение паренхиматозных органов, внутренний разрыв, разрыв в желудочно-кишечном тракте, поверхностные порезы и царапины, внутреннее кровотечение, артериальное кровотечение, венозное кровотечение, кровотечения или порезы в зубах или ротовой полости. Субъекты, которые могут получить пользу от такого лечения ран, включают различных животных, включая человека, млекопитающих, таких как лошади, овцы, крупный рогатый скот, свиньи, собаки, кошки и морские животные, такие как киты, дельфины, тюлени, выдры, рыбы и рептилии, такие как черепахи.
Иллюстрация структурного матрикса в соответствии с одним из вариантов осуществления изобретения представлена на фиг. 1. Как изображено, поврежденная секция ткани, рана (112), имеет сосудистое русло (116), выступающее на всем протяжении. Биологически совместимую полимерную композицию (114) нанесли на рану (112), которая покрыта защитным покрытием (110).
На фиг. 2 представлен увеличенный вид одного из вариантов осуществления биологически совместимой полимерной композиции (114), которая содержит структурный полимер (226) и гемофильный полимер (224). Структурный полимер (226) содержит приблизительно от 0,1% до 95% масс. сшиваемого полианионного полимера от общей массы композиции и от 0% до 95% масс. несшиваемого полианионного полимера от общей массы композиции. Гемофильный полимер (224) содержит приблизительно от 1% до 90% масс. поликатионного полимера от общей массы композиции. Красные клетки крови (210) показаны в связи с катионными функциональными группами (212) через связывающуюся с красными клетками крови катионную группу (216).
На фиг. 3A-3I представлены различные полимеры, которые можно выбирать в качестве структурного полимера (226) или гемофильного полимера (224). Полимеры можно модифицировать посредством добавления карбоксиметильных (СМ) групп, чтобы получать анионные функциональные группы (218). На фиг.3E представлена карбоксиметилцеллюлоза. Альгинат (3A), гиалуронат натрия (3F), κ-каррагенан (3G), ι-каррагенан (3H) и полиакрилат натрия (3I) представляют собой примеры полимеров, которые будут выполнять функцию структурного полимера (226). Аналогичным образом, хитин (3В) и хитозан (3С) представляют собой примеры полимеров, которые будут выполнять функцию гемофильного полимера (224). На фиг. 3D показано, как какой-либо полимер (340) можно модифицировать с использованием диэтиламиноэтиловой (ДЭАЭ) группы, чтобы получать катионные функциональные группы (212).
Биологически совместимая полимерная композиция (114) содержит приблизительно от 0,1% до 99,8% масс. растворителя от общей массы композиции. В одном из вариантов осуществления изобретения растворитель представляет собой этанол. Предпочтительно растворитель представляет собой 5% водный раствор этанола в воде. Неограничивающие примеры растворителей включают воду, этанол, амилацетат, ацетон, метилэтилкетон, изопропанол и тетрагидрофуран. В растворе структурный полимер (226) и гемофильный полимер (224) испытывают межмолекулярные взаимодействия, которые связывают их вместе. Катионные функциональные группы (212) на гемофильном полимере (224) притягивают анионные функциональные группы (218) к структурному полимеру (226) и ведут к ионной сшивке (214). Дополнительно, гемофильный полимер (224) и структурный полимер (226) можно сшивать ковалентно (228), подобно шиффовому основанию или азометиновой связи.
Защитное покрытие (110) содержит от 0,1% до 30% масс. двухвалентного катиона или катиона (220) более высокой валентности, от 0% до 90% масс. гидрофобного полимера и от 5% до 99,9% масс. растворителя. Защитное покрытие (110) сшивает композицию (114) посредством диффузии двувалентного катиона (220) внутрь, результатом чего является двувалентная катионная сшивка (222) структурного полимера (226). Это увеличивает жесткость композиции (114) и делает возможной улучшенную стабильность. Защитное покрытие (110) также может содержать гидрофобные полимеры, которые ограничивают потерю воды из композиции (114) и повышают долговечность. Гидрофобный полимер может представлять собой полиуретан, нитроцеллюлозу, цианоакрилат, стирол, политетрафторэтан и силикон, а также их сочетания. Растворитель может представлять собой воду, амилацетат, ацетон, метилэтилкетон, изопропанол и тетрагидрофуран, а также их сочетания. Двухвалентный катион или катион более высокой валентности может представлять собой Са2+, Fe2+, Fe3+, Ag2+, Ag3+, Au2+, Au3+, Mg2+, Cu2+, Cu3+ и Zn2+. В одном из вариантов осуществления изобретения катион представляет собой Са2+.
В одном из вариантов осуществления изобретения структурный полимер (226) содержит от 0,1% до 5% масс. альгината натрия и от 1% до 5% масс. гиалуроната натрия, гемофильный полимер (224) содержит от 2% до 25% масс. хлорида хитозана, а растворитель содержит от 65% до 96,9% масс. 5% водного раствора этанола в воде. В этом варианте осуществления композиция выполняет функцию матрикса для заживления ран для того, чтобы содействовать более быстрой регенерации тканей.
В другом варианте осуществления структурный полимер (226) содержит от 2% до 5% масс. альгината натрия и от 0% до 2% масс. гиалуроната натрия, гемофильный полимер (224) содержит от 5% до 20% масс. хлорида хитозана и растворитель содержит от 73% до 93% масс. 5% водного раствора этанола в воде. В этом варианте осуществления композиция выполняет функции толстого геля для быстрого достижения гемостаза без необходимости прикладывать давление. Композицию можно доставлять топически в поврежденный кровеносный сосуд.
В другом варианте осуществления изобретения структурный полимер (226) содержит от 0,1% до 4% масс. альгината натрия и от 1% до 5% масс. богатого лизином полипептида, гемофильный полимер (224) содержит от 5% до 25% масс. диэтиламиноэтилдекстрана (ДЭАЭ-декстрана), а растворитель содержит от 65% до 93% масс. 5% водного раствора этанола в воде. Затем биологически совместимую полимерную композицию (114) сшивают in situ посредством нанесения аэрозоля, содержащего от 0,1% до 1% масс. хлорида кальция, от 1% до 5% масс. нитроцеллюлозы и 94% до 98,9% масс. амилацетата. В этом варианте осуществления композиция выполняет функцию защитного покрытия для порезов и царапин, которая является долговременной и ограничивает потерю воды из раны.
В одном из вариантов осуществления изобретения биологически совместимая полимерная композиция содержит приблизительно 3,6% масс. альгината натрия, приблизительно 7% масс. хлорида хитозана и приблизительно 89,4% масс. 5% водного раствора этанола в воде. Этот вариант осуществления может выполнять функцию композиции для того, чтобы лечить артериальное кровотечение.
В одном из вариантов осуществления изобретения защитное покрытие содержит раствор, содержащий приблизительно от 0,1% приблизительно до 30% масс. двухвалентного катиона или катиона более высокой валентности; от 0% приблизительно до 90% масс. гидрофобного полимера; и приблизительно от 5% приблизительно до 99,9% масс. растворителя. В одном из вариантов осуществления изобретения защитное покрытие содержит раствор, который содержит приблизительно от 0,1% приблизительно до 1% масс. двухвалентного катиона; приблизительно от 1 приблизительно до 5% масс. гидрофобного полимера и приблизительно от 94% приблизительно до 98,9% масс. растворителя.
В одном из вариантов осуществления изобретения композицию (114) используют в качестве носителя для терапевтического средства, такого как лекарственное средство или биологическая молекула. Использование композиции (114) в качестве системы доставки лекарственного средства повышает эффективность геля для заживления ран. В одном из аспектов получают защитное покрытие (110) с солью серебра, что увеличивает противомикробные свойства геля. В одном из вариантов осуществления терапевтическое средство выбирают из группы, состоящей из: противомикробных средств, антибиотиков, гормонов, белков (таких как кальретикулин, тромбин, протромбин, фактор VIII и йод, а также их сочетания). В одном из вариантов осуществления изобретения терапевтическое средство предпочтительно представляет собой йод. В другом варианте осуществления изобретения терапевтическое средство представляет собой белок.
В одном из вариантов осуществления изобретения сшиваемый полианионный полимер может представлять собой полистиролсульфонат (например, полистиролсульфонат натрия), полиакрилат (например, полиакрилат натрия), полиметакрилат (например, натрия полиметакрилат), поливинилсульфат (например, поливинилсульфат натрия), полифосфат (например, полифосфат натрия), ι-каррагенан, κ-каррагенан, геллановую камедь, карбоксиметилцеллюлозу, карбоксиметилагарозу, карбоксиметилдекстран, карбоксиметилхитин, карбоксиметилхитозан, полимер, модифицированный карбоксиметильной группой, альгинат (такой как альгинат натрия), полимер, содержащий множество карбоксилатных групп, ксантановую камедь и их сочетания. Предпочтительно сшиваемый полианионный полимер представляет собой альгинат, более предпочтительно альгинат натрия.
Предпочтительно сшиваемый полианионный полимер содержит приблизительно от 1% приблизительно до 95% масс. биологически совместимой полимерной композиции; предпочтительно сшиваемый полианионный полимер содержит приблизительно от 5% приблизительно до 40% масс. биологически совместимой полимерной композиции; предпочтительно сшиваемый полианионный полимер содержит приблизительно от 10% приблизительно до 30% масс. биологически совместимой полимерной композиции.
В одном из вариантов осуществления изобретения несшиваемый полианионный полимер может представлять собой гиалуронат (например, гиалуронат натрия), полинуклеотид (например, РНК), полипептидную цепь, которая имеет среднюю изоэлектрическую точку остатков ниже 7, глюкозаминогликан и протеогликан, а также их сочетания. Предпочтительно несшиваемый полианионный полимер представляет собой гиалуронат, более предпочтительно гиалуронат натрия.
Предпочтительно несшиваемый полианионный полимер содержит приблизительно от 0 приблизительно до 95% масс. биологически совместимой полимерной композиции; предпочтительно несшиваемый полианионный полимер содержит приблизительно от 5 приблизительно до 25% масс. биологически совместимой полимерной композиции; предпочтительно несшиваемый полианионный полимер содержит приблизительно от 0 приблизительно до 5% масс. биологически совместимой полимерной композиции; предпочтительно несшиваемый полианионный полимер содержит приблизительно от 0 приблизительно до 2% масс. биологически совместимой полимерной композиции; предпочтительно несшиваемый полианионный полимер содержит приблизительно от 1 приблизительно до 5% масс. биологически совместимой полимерной композиции.
В одном из вариантов осуществления изобретения поликатионный полимер может представлять собой хитозан (например, хлорид хитозана), хитин, диэтиламиноэтилдекстран, диэтиламиноэтилцеллюлозу, диэтиламиноэтилагарозу, диэтиламиноэтилальгинат, полимер, модифицированный диэтиламиноэтильной группой, полимер, содержащий множество протонированных аминогрупп, и полипептид, который имеет среднюю изоэлектрическую точку остатков ниже 7, а также их сочетания. Предпочтительно поликатионный полимер представляет собой хитозан, более предпочтительно хлорид хитозана. Предпочтительно поликатионный полимер представляет собой диэтиламиноэтилдекстран (ДЭАЭ-декстран).
Предпочтительно поликатионный полимер содержит приблизительно от 1% приблизительно до 90% масс. биологически совместимой полимерной композиции; предпочтительно поликатионный полимер содержит приблизительно от 2% приблизительно до 80% масс. биологически совместимой полимерной композиции; предпочтительно поликатионный полимер содержит приблизительно от 2% приблизительно до 25% масс. биологически совместимой полимерной композиции.
Индивидуальные компоненты биологически совместимой полимерной композиции можно хранить в различных контейнерах для различных применений, включая, например, пакеты, пакеты-саше, пробирки, емкости, насосы, шприцы, бутылки, мешки и аэрозольные пульверизаторы. Компоненты можно хранить в контейнерах, выполненных из различных материалов, включая, например, пластмассу, металл или стекло. Компоненты можно предоставлять для пользователя в функционально связанных конфигурациях или в виде отдельных компонентов, которые подготавливают перед использованием.
Композиции и системы, описанные в настоящем документе, могут быть включены в набор или промышленное изделие для формирования биологически совместимой полимерной композиции, содержащей одно или несколько из: раствора, содержащего полианионный полимер; раствора, содержащего поликатионный полимер; растворителя и раствора, содержащего двухвалентный катион или катион более высокой валентности, гидрофобный полимер и растворитель. Набор или промышленное изделие дополнительно может содержать марлю, повязки, ленту, кисти, шпатели и губки.
Описано определенное число реализаций. Тем не менее, понятно, что различные модификации можно создавать, не отступая от сущности и объема этого документа. В частности, например, описаны различные композиции растворов, но замену на схожие компоненты и элементы можно встраивать или использовать взамен, чтобы достигать тех же или схожих эффектов. Кроме того, изменение матрикса можно использовать для адаптации к ранам в различных местоположениях, расположенных внутри или снаружи по отношению к дермальным слоям кожи, включая трансплантацию органов, пересадку тканей и/или различные хирургические разрезы и повреждения в каком-либо месте или местоположении, расположенном снаружи и/или внутри организма. Соответственно другие реализации входят в объем следующей формулы изобретения.
Кроме того, в описанных исследованиях можно использовать один из вариантов осуществления композиции для того, чтобы формировать жесткий матрикс, тогда как можно разрабатывать другую композицию с повышенной эластичностью, отдельно или в комбинации. Кроме того, способы смешивания и формулирования композиции можно осуществлять в любом порядке и комбинации с тем, чтобы достигать тех же или схожих эффектов встроенного отвержденного матрикса, матрикса, интегрирующего формирование естественным образом перестраивающейся ткани. В одном из вариантов осуществления один или больше чем один полианионный полимер сначала наносят на рану, и затем один или больше чем один поликатионный полимер наносят на указанный один или больше чем один полимерный полимер в месте раны. В одном из вариантов осуществления один или больше чем один полианионный полимер смешивают с одним или больше чем одним поликатионным полимером и затем смесь наносят на рану. В одном из вариантов осуществления один или больше чем один полианионный полимер наносят на рану одновременно или приблизительно в то же время, когда один или больше чем один поликатионный полимер наносят на рану.
В одном из вариантов осуществления способ лечения раны включает нанесение одного или больше чем одного полианионного полимера на рану и затем нанесение одного или больше чем одного поликатионного полимера на указанный один или больше чем один полимерный полимер в месте раны. В одном из вариантов осуществления способ лечения раны включает смешивание одного или больше чем одного полианионного полимера с одним или больше чем одним поликатионным полимером и затем нанесение смеси на рану. В одном из вариантов осуществления способ лечения раны включает нанесение одного или больше чем одного полианионного полимера на рану одновременно или приблизительно в то же время, что и один или больше чем один поликатионный полимер наносят на рану.
1. Композиция гелеобразного матрикса для обработки кровоточащих ран, состоящая из
a. от 0,1% до 5% масс. альгината натрия;
b. от 2% до 25% масс. хитозана;
c. воды - остальное.
2. Композиция по п. 1, в которой содержание альгината натрия составляет от 2% до 5% масс.
3. Композиция по п. 1, в которой содержание воды составляет от 73 до 93% масс.
4. Композиция по п. 1, где кровоточащей раной является артериальное кровотечение, венозное кровотечение, кровотечение в зубах или кровотечение в ротовой полости.
5. Композиция по п. 1, где кровоточащей раной является артериальное кровотечение.
6. Композиция по п. 1, где кровоточащей раной является венозное кровотечение.
7. Композиция по п. 1, кровоточащую рану обрабатывают без необходимости прикладывания давления.
8. Композиция по п. 1, где композиция образует кровоостанавливающий матрикс в области кровотечения.
9. Композиция по п. 1, где композиция отверждается в области кровотечения.
10. Композиция по п. 1, где кровоточащую рану обрабатывают в животном.
11. Композиция по п. 1, где кровоточащую рану обрабатывают в человеке.
12. Композиция по п. 1, выполненная с возможность хранения в пакете, пакете-саше, емкости, шприце, бутылке или мешке.