Применение пептида thr-lys-pro-arg-pro-gly-pro (селанк) для профилактики и лечения токсического гепатита
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к токсикологии, и может быть использована для гепатопротективного воздействия при токсическом гепатите. Предложено применение пептида формулы Thr-Lys-Pro-Arg-Pro-Gly-Pro (селанк) в качестве гепатопротекторного средства. Способ по изобретению включает введение лекарственного препарата на основе гептапептида общей формулы Thr-Lys-Pro-Arg-Pro-Gly-Pro (селанк) путем нанесения его на слизистую оболочку. Использование изобретений позволяет достоверно снизить летальность, уровень цитолиза, обменных нарушений, обеспечивает повышение активности процесса дезинтоксикации, предупреждает развитие существенных изменений в морфологии и цитоархитектонике печени. 2 н. п. ф-лы, 9 табл., 2 пр.
Реферат
Изобретение относится к медицине, а именно к гепатологии, физиологии, патофизиологии, и может быть использовано для гепатопротекторного воздействия при токсическом поражении печени химическими агентами.
Многие авторы указывают, что печень является одним из главных органов мишеней при токсическом действии многих химических соединений, включая и лекарственные средства [Ковтун А.В и др. Лекарственно-индуцированные поражения печени. Диагностика и лечение // Лечащий врач. Гастроэнтерология. - 2011. - №2. - С. 2-7]. В связи с высокими темпами развития химической и фармацевтической промышленности, широким внедрением их продукции во все сферы жизни человека, злоупотреблением алкоголем и его суррогатами в настоящее время все большую актуальность приобретает проблема токсических гепатитов. Согласно статистическим данным, только от побочных эффектов применения медикаментозных средств в мире ежегодно страдают 1 млн человек, причем в 180 тыс. случаев именно негативное побочное действие лекарств является непосредственной причиной летального исхода [Бабак О.Я. Медикаментозные токсические поражения печени: пути фармакологической коррекции // Здоровье Украины. - 2009. - №19/1. - С. 26; Assis D.N., Navarro V.J. Human drug hepatotoxicity: a contemporary clinical perspective // Expert Opinion on Drug Metabolism & Toxicology 2009, vol. 5, n 5, p. 463-473]. Повреждения печени химическими веществами в дальнейшем могут привести к развитию токсического гепатита, а учитывая важнейшую роль печени в поддержании гомеостаза, это будет отрицательно сказываться на функциональном состоянии организма вплоть до летального исхода.
В структуре острых и хронических заболеваний печени лекарственно-индуцируемые поражения печени (ЛИПП) составляют от 0,7% до 20%, причем каждый седьмой больной погибает [Топчий Н.В., Топорков А.С. Гепатотоксичность - наиболее вероятные причины и возможности оптимальной коррекции Гептралом // РМЖ, 2013, №5, 249-254; Chalasani N., Fontana R.J., Bonkovsky H.L. et al. For the DILIN Study Group. Causes, clinical features, and outcomes from a prospective study of drug-induced liver injury in the United + States // Gastroenterology. 2008. Vol. 135. P. 1924-1934]. Лекарственная гепатотоксичность является лидирующей причиной развития печеночной недостаточности, требующей пересадки печени [Ковтун А.В и др. Лекарственно-индуцированные поражения печени. Диагностика и лечение // Лечащий врач. Гастроэнтерология. - 2011. - №2. - С. 2-7; Russo M.W., Galanko J.A., Shrestha R. et al. Liver transplantation for acute liver failure from drug-induced liver injury in the United States // Liver Transplantation. 2004. Vol. 10. P. 1018-1233].
В странах Европы и в США побочные эффекты лекарственных средств выступают в роли причинного фактора желтухи у 2-5% госпитализированных больных; 40% острых гепатитов у пациентов старше 40 лет и 13-25% случаев фульминантной печеночной недостаточности - это токсическое действие лекарств на печень [Бурков С.Г., Егорова Н.В., Аронова О.В., Годунова С.А., Кикта С.В., Леонова В.И., Чугунникова Л.И. Применение препарата Прогепар® в клинической практике // РМЖ, 2011, №31, с. 1969-1975].
Повреждение печени описано у нескольких тысяч химических веществ, из которых можно выделить не менее 1000 лекарственных препаратов. С препаратами, провоцирующими ЛИПП, сталкивается врач практически любого профиля. Это противоинфекционные средства, препараты, воздействующие на ЦНС, опорно-двигательный аппарат (в частности, нестероидные противовоспалительные средства), желудочно-кишечный тракт и другие [Полунина Т.Е., Маев И.В. Клиника, диагностика и коррекция острого лекарственного гепатита // Лечащий врач; Суханов Д.С, Иванов А.К., Романцов М.Г., Коваленко А.Л. Лечение гепатотоксических осложнений противотуберкулезной терапии сукцинатсодержащими препаратами // РМЖ, 2009, №6, с. 1-4; Chalasani N., Fontana R.J., Bonkovsky H.L. et al. For the DILIN Study Group. Causes, clinical features, and outcomes from a prospective study of drug-induced liver injury in the United States // Gastroenterology. 2008; 135: 1924-1934].
Развитие и течение токсического гепатита связано с формированием многозвеньевого патогенеза. Независимо от причин заболевания обязательными этапами патологического процесса являются активация свободнорадикального пути окисления субстратов, нарушение функций клеточных и митохондриальных мембран, дезорганизация обменных процессов и гибель гепатоцитов. На фоне патологии процессы нормальной регенерации заторможены (или вообще невозможны), что провоцирует развитие в печени соединительнотканных элементов с последующим формированием фиброза и цирроза. И все это происходит на фоне выраженного медиаторно-гормонального дисбаланса, усугубляющего поражение органа [Радченко В.Г., Шабров А.В., Зиновьева Е.Н. Основы клинической гепатологии. - СПб., 2005, 234 с.; Махов В.М. Алкогольная болезнь печени и неалкогольная жировая болезнь печени - общность и различия // Лечащий доктор, 2012, №7, с. 34-37; Чиркин А.А. Молекулярные механизмы повреждения печени // Иммунология, аллергология, инфектология. - 2000. - №3. - С. 12-16].
Метаболические процессы в печени регулируются многочисленными физиологически активными веществами, ведущая роль из которых принадлежит моноаминам, в частности катехоламинам и их метаболитам [Крыжановский Г.Н. Дисрегуляционная патология // Патологическая физиология и экспериментальная терапия. - 2002. - №3. - С. 2-19]. Так, катехоламины вызывают изменение тонуса гладкой мускулатуры сосудов, стимулируют окислительные процессы (особенно адреналин), влияют на жировой и белковый обмены, гликогенолиз и глюконеогенез. При ряде заболеваний, в том числе и токсического (лекарственного) генеза, происходит нарушение числа или соотношения адренорецепторов, сопряжения рецепторов с внутриклеточными структурами, что оказывает неблагоприятное влияние на функциональные возможности печени и приводит, в итоге, к структурным нарушениям органа [Ситников И.Г. Биохимические маркеры хронизации парентеральных гепатитов // «Инфекционные болезни». - 2005. - №3 (т. 3). - С. 23-27; Ситников И.Г., Федоров В.Н., Шошин А.А. Препараты гепатопротективного действия. Ярославль, 2004, 58 с.]. При длительном повышении содержания вазоспастических катехоламинов возможно развитие так называемых «катехоламиновых» повреждения тканей. Высвобождающиеся катехоламины накапливаются во внеклеточном пространстве, нарушая коллатеральную циркуляцию, способствуя возникновению отека и прогрессированию гипоксии и ишемии ткани, что приводит к энергетическому дефициту, оксидативному стрессу и провоцирует печеночный апоптоз [Ситников И.Г. Биохимические маркеры хронизации парентеральных гепатитов // «Инфекционные болезни». - 2005. - №3 (т. 3). - с. 23-27].
Исходя из вышеизложенного, можно предположить, что фармакологические вещества, препятствующие цитолизу (гибели гепатоцитов) и предупреждающие нарушение печеночных функций, могут оказывать гепатопротекторный эффект.
Гепатопротекторы - группа лекарственных средств, предотвращающих повреждение гепатоцита и восстанавливающих нарушения структуры и функции печени. Их действие направлено на восстановление гомеостаза в печени, повышение устойчивости органа к действию патогенных факторов, нормализацию функциональной активности и стимуляцию репаративно-регенерационных процессов [Рациональная фармакотерапия в гепатологии / ред. В.Т. Ивашкина. М.: Литтерра, 2009. - 296 с.; Абдурахманов Д.Т., Моисеев С.В. Лекарственные поражения печени // Фарматека. - 2011. - №17 - С. 67-73; Кучерявый Ю.А., Морозов С.В. Гепатопротекторы: рациональные аспекты применения. М., 2012; Вялов С.С. Поражение печени и сопутствующая патология: рациональная комбинация гепатопротекторов. // Российский медицинский журнал, 1621].
Многообразным защитным действием обладают соединения, созданные на основе регуляторных пептидов. Регуляторные пептиды (РП) - группа биологически активных веществ олигопептидной природы. Их основными признаками являются полифункциональность, каскадный механизм действия и способ образования из полипептида-предшественника. Регуляторные пептиды выполняют важные нейромедиаторные, модулирующие и интегративные задачи, формируют единый функциональный континуум и являются связующим звеном между основными информационными системами (нервная, эндокринная, иммунная). Их значимость возрастает при воздействии на организм негативных факторов (стрессы, повреждения и пр.) [Мясоедов Н.Ф. Инновационные лекарства: от фундаментальных исследований к производству // Вестник Российской академии наук, 2016, т. 86, №6, 488-494; Ашмарин И.П., Незавибатьков Н.Н., Мясоедов Н.Ф., Каменский А.А. и др. Ноотропный аналог адренокортикотропина 4-10 - Семакс (15-летний опыт разработки и изучения) // Журнал высшей нервной деятельности. - 1997. - Т. 47. - С. 419-425; Ашмарин И.П., Каменский А.А., Ляпина Л.А., Самонина Г.Е., Мясников Н.Ф. Глипролины как самостоятельные регуляторы и стабилизаторы других пептидов // Вопр. биологии, медицины и фармацевтической химии. 2002, №1, с. 24-27].
При различных заболеваниях регуляторные пептиды активируют процессы саморегуляции и самовосстановления нарушенных функций пораженных органов и систем. Важным моментом применения регуляторных олигопептидов является их способность к нормализации уровня тканевых трофических факторов (например, в мозговой ткани), которые, с одной стороны, угнетают различные механизмы патологического каскада, а с другой - стимулируют репаративные процессы [Алтунбаев Р.А. Нейропептиды (регуляторные пептиды головного мозга) в лечении цереброваскулярных заболеваний // Медицинский советник, 2013, 7, 63-64].
Thr-Lys-Pro-Arg-Pro-Gly-Pro (селанк) - гептапептид, являющийся комбинацией гликопролина и молекулы тафцина. Глипролин (Pro-Gly-Pro) - фрагмент коллагена, который при присоединении к другим олигопептидам с С-конца способен повышать устойчивость конечной молекулы к действию протеаз. Тафцин (Thr-Lys-Pro-Arg) - синтетический аналог короткого фрагмента тяжелой цепи иммуноглобулина G - является неспецифическим иммуномодулятором, обладающим защитным действием на ЦНС [Зозуля А.А., Незнамов Г.Г., Сюняков Т.С. и др. Эффективность и возможные механизмы действия нового пептидного анксиолитика Селанка при терапии генерализованного тревожного расстройства и неврастении // Журн. неврологии и психиатрии им. С.С. Корсакова. - 2008. - Т. 108, №4. - С. 38-49].
В медицинской практике Селанк используется как анксиолитик с антидепрессивной активностью, антиастеническим действием и положительным влиянием на мнестические функции. Селанк также обладает стресспротективной и вегетостабилизирующей активностью [Козловская М.М., Козловский И.И., Вальдман Е.А., Середенин С.Б. Селанк и короткие пептиды семейства тафтсина в регуляции адаптивного поведения при стрессе. Рос. физиол. Журн. 2002. 88 (6): 751-761; Козловская М.М. Влияние гептапептида селанка на депрессию поведения высоко- и низкотревожных мышей BALB/c и C25BL/6 и крыс с наследуемой депрессивностью поведения WAG/RIJ. / М.М. Козловская, К.Ю. Саркисова, И.И. Козловский // Психофармакология и биологическая наркология. - 2005. - Т. 5. - №3. - С. 989-996; Зозуля А.А., Незнамов Г.Г., Сюняков Т.С и др. Эффективность и возможные механизмы действия нового пептидного анксиолитика Селанка при терапии генерализованного тревожного расстройства и неврастении // Журн. неврологии и психиатрии им. С.С. Корсакова. - 2008. - Т. 108, №4. - С. 38-49].
Селанк обладает протекторными противоязвенными свойствами, проявляющимися повышением устойчивости слизистой оболочки желудка к действию различных ульцерогенных факторов. Помимо протекторного эффекта селанк обладает терапевтическим действием, ускоряя заживление ацетатных язв. Этот эффект обусловлен как непосредственным действием на слизистую оболочку желудка, так и на структуры нервной системы, участвующие в поддержании гомеостаза слизистой [Павлов Т.С. Селанк и его метаболиты поддерживают гомеостаз слизистой оболочки желудка / Т.С. Павлов, Т.Е. Самонина, З.В. Бакаева, Ю.А. Золотарев, А.А. Гусева // Бюллетень экспериментальной биологии и медицины. - 2007. - Т. 143. - №1. - С 57-59. Самонина Г.Е. Трипептид Pro-Gly-Pro и гомеостаз слизистой оболочки желудка / Г.Е. Самонина, Г.Н. Копылова, Б.А. Умарова // Нейрохимия. - 2008. - Т. 25. - №1. - С. 128-131].
Селанк обладает цитокинрегулирующими свойствами, реализуемыми путем подавления экспрессии гена ИЛ-6 лейкоцитов периферической крови, что позволяет рассматривать его в качестве иммуномодулятора для коррекции иммунодефицитных состояний, лечения и профилактики вирусных инфекций [Учакина О.Н. Иммуномодулирующие свойства Селанка у людей с тревожно-астеническими расстройствами / О.Н. Учакина, П.Н. Учакин, Н.Ф. Мясоедов и др. // Журн. неврологии и психиатрии им. С.С. Корсакова. - 2008. - №5. - С. 71-75. Мезенцева М.В. Нейротропный пептид, обладающий антивирусной активностью в отношении гриппа человека и птиц и герпесвирусной инфекции / М.В. Мезенцева, Л.А. Андреева, Р.Я. Подчерняева и др. // Инфекция и иммунитет. - 2011. - Т. 1. - №1. - С. 81-84].
В ЦНС и на периферии селанк нормализует кругооборот катехоламинов и серотонина, что обусловлено его влиянием на активность ключевых ферментов, контролирующих биосинтез моноаминов de novo (тирозин- и триптофангидроксилазу). Селанк также является ингибитором энкефалиназ, что препятствует ускоренному распаду энкефалинов [Козловская М.М., Незнамов Г.Г., Кошелев В.В., Телешова Е.С., Бочкарев В.К. Результаты клинико-фармакологического исследования пептидного препарата Селанк в качестве анксиолитического средства // Социальная и клиническая психиатрия, 2003. - N 4. - С. 28-36; Сюняков Т.С. Клинико-фармакологическая характеристика анксиолитического действия нового пептидного препарата селанк. Автореферат канд. диссертации, М., 2010, 24 с.; Клодт П.М., Кудрин B.C., Наркевич В.Б., Козловская М.М., Майский А.И., Раевский К.С. Содержание моноаминов и их метаболитов в структурах мозга крыс. Психофарм. биол. наркология. 2005. 5 (3): 1012-1015]. Повышая на периферии уровень лей- и метэнкефалинов, селанк влияет на симпатическую и парасимпатическую регуляцию внутренних органов и кровеносных сосудов (эндотелий-независимый сосудорасширяющий эффект), предотвращая гиперактивацию симпатической нервной системы, например, при хроническом стрессе [Кост Н.В. Опиоидергические механизмы тревожных расстройств и эффектов анксиолитических препаратов. Автореферат докт. диссертации. М., 2007, 49 с.].
Введение селанка способствует активизации пептидергической системы организма и синтезу широкого спектра регуляторных пептидов [Соловьев В.Б. Роль пептидергической системы в адаптационных процессах и регуляции метаболизма при физической работе / Автореф. докт. дисс. М., 2011, 39 с.; Соловьев В.Б., Генгин М.Т., Соллертинская Т.Н., Латынова И.В., Живаева Л.В. Влияние семакса на активность карбоксипептидазы Н в отделах мозга и надпочечниках крыс // Нейрохимия. - 2011. - Т. 28. - №2. - С. 169-172] и, в частности, соединений, обладающих трофическими свойствами. Сложное биологическое действие селанка на организм, по крайней мере частично, обусловлено его действием на экспрессию генома в различных органах [Т.А. Коломин, М.И. Шадрина, Я.В. Агниуллин, С.И. Шрам, П.А. Сломинский, С.А. Лимборская, академик РАН Н.Ф. Мясоедов. Транскриптомный ответ клеток гиппокампа и селезенки крысы на однократное и курсовое введение пептида селанка // ДАН, 2010, 1, 127-129].
Тем не менее, использование пептида Thr-Lys-Pro-Arg-Pro-Gly-Pro (селанк) для гепатопротекторного воздействия в условиях применения гепатотоксичных агентов не изучено.
Задача, решаемая при создании настоящего изобретения, состоит в расширении арсенала средств для гепатопротекторного воздействия при лечении и профилактике токсического гепатита. Техническим результатом, достигаемым при решении такой задачи, является повышение эффективности лечения и профилактики токсического гепатита.
Для достижения поставленного результата предлагается в качестве гепатопротекторного средства при лечении и профилактике токсического гепатита применять пептид общей формулы Thr-Lys-Pro-Arg-Pro-Gly-Pro (селанк).
Предметом изобретения может также являться способ профилактики или лечения токсического гепатита, заключающийся в ведении пациенту, нуждающемуся в этом, эффективного количества лекарственного препарата, содержащего пептид формулы Thr-Lys-Pro-Arg-Pro-Gly-Pro (селанк), наносимого на слизистую оболочку.
Химическая формула данного пептида Селанк известна. Был использован препарат, синтезированный в ЗАО «Инновационный научно-производственный центр «Пептоген». Растворенный в изотоническом растворе хлорида натрия пептид вводили экспериментальным животным (крысы) интраназально в дозе 200 мкг/кг.
Экспериментальные животные содержались в помещении при температуре воздуха 22-24°C, световом режиме: 12 часов - свет, 12 часов - темнота и получали стандартный гранулированный корм и воду в свободном доступе с соблюдением всех правил и Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997), в соответствии с действующими "Правилами лабораторной практики" [Приказ Минздравсоцразвития РФ от 23 августа 2010 г. №708н «Об утверждении Правил лабораторной практики»] и «Руководством по экспериментальному (доклиническому) изучению новых фармакологических веществ» [Москва, 2005]. На момент выполнения эксперимента все животные были здоровыми, изменений поведения, аппетита, режима сна и бодрствования не выявлено.
Пример конкретного выполнения №1
Для воспроизведения острого токсического гепатита применялась модель с введением четыреххлористого углерода (CCl4) [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. - М.: Ремедиум, 2000. - 598 с.]. Перед моделированием гепатита у белых крыс была определена острая токсичность CCl4 [Беленький, М.Л. Элементы количественной оценки фармакологического эффекта. - Л., 1963. - 153 с.] при внутрижелудочном введении. Дозы минимальной токсичности (ДМТ) 16%, 50%, 84% и 100% летальности (DL16, DL50, DL84 и DL100), которые, соответственно, были равны 5,8; 7,1; 9,6; 12,1 и 15,1 мл/кг. Подопытным крысам вводилась доза DL50 - 9,6 мл/кг.
Опыты были поставлены на 45 белых крысах-самцах, массой 240-260 г, разделенных на 3 группы. Над животными первой группы никаких манипуляций не производилось (интактная группа). Вторая (контрольная) группа животных однократно внутрижелудочно получила 9,6 мл/кг CCl4. Третья группа дополнительно к CCl4 получала селанк - пептид растворяли в изотоническом растворе хлорида натрия и вводили экспериментальным животным интраназально в дозе 200 мкг/кг ежедневно в течение 14 дней, пока шло наблюдение за животными. Контрольным животным вводили эквивалентные объемы физиологического раствора. На 15-й день животных выводили из эксперимента путем обескровливания под эфирным наркозом. Анализируемыми критериями являлись процент выживаемости, продолжительность жизни погибших животных, весовой коэффициент печени у выживших крыс.
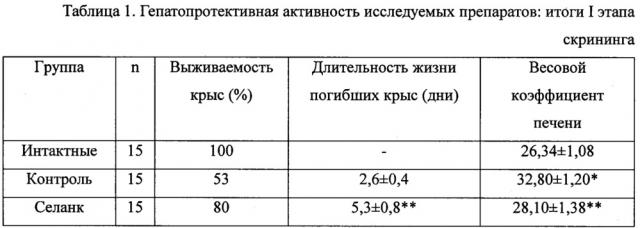
Исследование показало (табл. 1), что селанк обладает выраженной гепатопротекторной активностью: выживаемость животных повысилась с 53 до 80%, в два раза увеличилась продолжительность жизни погибших белых крыс, повышение весового коэффициента печени у выживших животных существенно снизилось.
*) достоверная разница с интактными животными
**) достоверная разница с контрольными животными
Пример конкретного выполнения №2. Для создания подострого токсического гепатита применялась модификация методики, предложенная в 1989 году Сливкой Ю.И., основанная на применении комбинации: изониазид + пиразинамид + рифампицин [патент RU 2197984 от 02.10. 2003, патент RU 2189817 от 27. 09. 2002]. Основными особенностями примененной модели являлось повышение дозировок изониазида (100 мг/кг, внутрижелудочно) и рифампицина (125 мг/кг, внутрижелудочно), удлинение срока воздействия с двух до трех недель, а также добавление в качестве потенцирующего фактора этанола в виде 25% раствора (3 г/кг, внутрибрюшинно).
Опыты были поставлены на 30 белых крысах-самцах, массой 230-250 г, разделенных на 3 группы. Над животными первой группы никаких манипуляций не производилось (интактная группа). Вторая (контрольная) группа животных ежедневно внутрижелудочно получала комбинацию изониазида (100 мг/кг) с рифамицином (125 мг/кг), а также ежедневные внутрибрюшинные инъекции 25% раствора этанола в дозировке 3 г/кг. Третья группа дополнительно к данным препаратам получала селанк - пептид растворяли в изотоническом растворе хлорида натрия и вводили экспериментальным животным интраназально в дозе 200 мкг/кг ежедневно в течение 21 дня, пока вводились гепатотоксические средства. Контрольным животным вводили эквивалентные объемы физиологического раствора. Наблюдение за животными проводилось в течение трех недель. На 22-й день эксперимента животных выводили из эксперимента путем обескровливания под эфирным наркозом.
Функциональное состояние печени оценивали по ряду стандартизированных биохимических показателей крови, которые объединялись по функцинальным группам: маркеры цитолиза гепатоцитов (активность аспартаттрансаминазы-АСТ, аланинтрансаминазы-АЛТ и лактатдегидрогеназы-ЛДГ), показатели синтетической активности и белкового обмена (общий белок, альбумины, глобулины), углеводного обмена (активность альфа-амилазы общей и панкреатической, содержание глюкозы), липидного обмена (активность липазы, содержание триглицеридов, общего холестерина, в также холестерина липопротеидов низкой плотности - ХС ЛПНП и холестерина липопротеидов высокой плотности - ХС ЛПВП), дезинтоксикационной функции печени (прямой билирубин). Уровень катехоламинов (КА) крови [адреналина (АД), норадреналина (НА), дофамина (ДА)] определяли дифференциально-флюориметрическим методом В.О. Осинской [Осинская В.О. Исследования обмена адреналина и норадреналина в тканях животного организма // Биохимия. - 1977. - №3. - С. 537-539; Камышников, B.C. Клинико-биохимическая лабораторная диагностика: Справочник: В 2 т. Т. 2 / B.C. Камышников - Минск: Интерпрессервис, 2003 - 463 с.]. Об активности перекисного окисления липидов и функции клеточных мембран судили по уровню осмотической резистентности эритроцитов (ОРЭ), которая изучалась стандартизированым методом [Владимиров Ю.А. Свободные радикалы и антиоксиданты // Вестник РАМН. - 1998. - №8. - С. 43-51]. Для гистоморфологического исследования печени использовали окраску препаратов гематоксилином и эозином, коллагеновые волокна выявляли, прибегая к окраске по Массону; эластические волокна окрашивали фукселином по Харту, а ретикулиновые - путем импрегнации серебром по Футу. Стереометрическое исследование печени проводили для определения соотношений различных тканевых компонентов. Статистическую обработку результатов производили с использованием t-критерия Стьюдента.
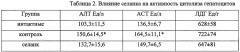
Анализ динамики активностей цитолитических ферментов в крови показал (табл. 2), что на фоне токсического гепатита имело место достоверное повышение активности у ACT и АЛТ на 46% и 21% и тенденция к повышению на 15% общей активности ЛДГ. Селанк препятствовал повышению активностей цитолитических ферментов в крови.
*) - достоверная разница с интактными животными (при p<0,05)
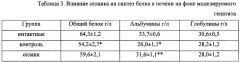
При поражениях печени нарушение белкового обмена типичное явление. У контрольных крыс 21-дневное введение гепатотоксических препаратов (табл. 3) вызывало в крови достоверное снижение уровня общего белка на 16% за счет падения концентрации альбуминов (-23%, p<0,05); концентрация глобулинов крови достоверно не изменялась. Селанк нормализовал все нарушенные показатели.
*) - достоверная разница с интактными животными (при p<0,05)
**) достоверная разница с контрольными животными (при p<0,05)
При моделировании гепатита имело место достоверное падение амилазной активности на 17% при нормальном содержании глюкозы в крови (табл. 4). Введение селанка вызвало нормализацию амилазной активности.
*) - достоверная разница с интактными животными (при p<0,05)
**) достоверная разница с контрольными животными (при p<0,05)
При моделировании токсического гепатита (табл. 5) у крыс имело место снижение липазной активности крови (-57% при p<0,05) на фоне достоверного повышения в ней концентрации триглицеридов (+43%) и тенденции к увеличению уровня общего холестерина (+20% при p>0,05). Селанк препятствовал развитию отрицательной динамики показателей липидного обмена.
*) - достоверная разница с интактными животными (при p<0,05)
**) достоверная разница с контрольными животными (при p<0,05)
На фоне формирования гепатита уровень прямого билирубина в крови достоверно возрастал на 27% (табл. 6), что является свидетельством нарушения пигментного обмена и развития холестаза. Введение селанка нивелирует эти нарушения.
*) - достоверная разница с интактными животными (при p<0,05)
Осмотическая резистентность эритроцитов (ОРЭ) является интегральным показателем устойчивости организма к ПОЛ [Крылов В.И., Жмуров В.А., Иванова Е.Е. и др. Метаболизм перекисных соединений липидов при заболеваниях почек у детей // Механизмы регуляции обмена веществ в норме и патологии. - Свердловск, 1982. - С. 14-18]. Нарастание свободно-радикальных процессов приводит к снижению резистентности клеточных мембран, показателем чего является падение осмотической резистентности эритроцитов. Поскольку имеет место тесная связь между изменением проницаемости эритроцитарных мембран и мембран клеток, пораженных патологическим процессом органов [Владимиров, Ю.А. Свободные радикалы и антиоксиданты [Текст] / Ю.А. Владимиров // Вестник РАМН. - 1998. - №8. - С. 43-51], исследовалась осмотическая резистентность эритроцитов при их инкубации в 0,5% растворе NaCl.
При моделировании токсического гепатита у животных имело место достоверное снижение ОРЭ на 30% (табл. 7). Селанк препятствовал повышению уровня гемолиза эритроцитов в гипоосмотических условиях, что можно связывать с его антирадикальной активностью.
*) - достоверная разница с интактными животными (при p<0,05)
**) достоверная разница с контрольными животными (при p<0,05)
Моделирование лекарственного гепатита выявило выраженные гистоморфологические изменения структуры печени. В органе развивалось резкое полнокровие артериальной и венозной сети, отмечалось расширение синусоидов и лимфатического русла. Одновременно происходила инфильтрация внедольковой стромы исследуемого органа мононуклеарами, нейтрофилами и эозинофилами, а также наблюдалось разрастание грубоволокнистой соединительной ткани, в том числе в сосудах (артерии и ветви воротной вены) и желчных протоках. Это указывало на наличие склероза портальных трактов, отмеченного увеличением их удельной площади, что продемонстрировано с помощью стереометрии. Гепатоциты подвергались гидропической белковой дистрофии, иногда переходящей в фокальные некрозы, что приводило к снижению удельной площади паренхимы. Нередко полиморфноклеточный инфильтрат из стромы выходил через пограничную пластинку в дольку, формируя характерные «ступенчатые» некрозы. Удельная площадь гепатоцитов, по сравнению с контрольной серией, уменьшалась в 1,3 (p<0,001) раза. И, наоборот, удельная площадь синусоидов увеличивалась в 1,3 (p<0,001) раза, а площадь стромы возрастала в 1,2 (p<0,05) раза. В целом, морфологическую картину можно охарактеризовать как хронический активный гепатит с фиброзом стромы, а воспроизводимый в эксперименте гепатит по своим структурным проявлениям вполне соответствовал таковому, наблюдаемому в клинической практике.
На фоне введения селанка у крыс с моделированным гепатитом резко уменьшалась воспалительная гиперемия сосудов притока и оттока крови от печени, а также синусоидов; хорошо подвергались снижению склеротические изменения стенок артерий, ветвей воротной вены, а тонус данных сосудов возвращался к норме. Кроме того, полностью сохранялась привычная дольковая архитектоника печени, а также отсутствовали признаки повреждения печеночных клеток в виде дистрофии и некроза. Также отмечалось усиление регенеративных процессов паренхимы печени, что выражалось в увеличении, гиперхроматозе ядер клеток и появлении двуядерных форм. Следовательно, на фоне лечения крыс селанком наблюдался не только явный регресс патологических изменений печеночной ткани, но и создавались условия для ее восстановления.
Стереометрическое исследование показало (табл. 8), что селанк препятствовал достоверному снижению удельной площади гепатоцитов (повышая ее по отношению к контролю на 22% при p<0,01) и замещению их соединительнотканными элементами, т.к. он препятствовал увеличению площади стромы (снижал на 14% по отношению к контролю при p<0,01).
*) - достоверная разница с интактными животными (при p<0,05)
**) - достоверная разница с контрольными животными (при p<0,05)
Летальность животных - наиболее важный интегральный показатель действия токсических агентов на организм. На фоне моделирования токсического гепатита имела место 20%-я летальность животных. Введение селанка ее предупреждало.
Развитие лекарственного гепатита приводило у животных к значимому дисбалансу симпатоадреналовой системы (табл. 9), который, прежде всего, характеризовался повышением в крови концентрации норадреналина на 88% и уменьшением содержания дофамина на 45%; уровень АД практически не менялся. Снижение значений коэффициента АД/НА в крови почти в 2 раза (p<0,05) свидетельствовало том, что при лекарственном гепатите происходит преимущественная активация нейрональной компоненты симпатоадреналовой системы, а не эндокринной. Падение значения «дофаминового» коэффициента [ДА/(АД+НА)] в 2,6 раза указывало о превалировании активности вазоконстрикторных катехоламинов над вазодилятирующими и, в итоге, о снижении кровотока в паренхиматозных органах.
Применение селанка положительно влияло на динамику уровня катехоламинов в крови больных животных. Он препятствовал нарастанию концентрации норадреналина и падению содержания дофамина крови, способствовал нормализации значений адреналинового и дофаминового коэффициентов.
* - достоверная разница (p<0,05) с интактной группой
** - достоверная разница (p<0,05) с группой острого гепатита
Таким образом, результаты выполненных исследований показали, что пептид Thr-Lys-Pro-Arg-Pro-Gly-Pro (селанк) оказывает выраженный гепатопротекторный эффект при токсическом гепатите.
1. Применение пептида формулы Thr-Lys-Pro-Arg-Pro-Gly-Pro (селанк) в качестве гепатопротекторного средства при профилактике и лечении токсического гепатита.
2. Способ лечения токсического гепатита, включающий введение лекарственного препарата на основе гептапептида общей формулы Thr-Lys-Pro-Arg-Pro-Gly-Pro (селанк) через слизистую оболочку, где способ включает нанесение указанного препарата на слизистую оболочку.