Промежуточные соединения и способы синтеза производных калихеамицина
Иллюстрации
Показать всеИзобретение относится к промежуточным соединениям формулы I
где R12 выбран из C1-С8алкила с прямой и разветвленной цепью; каждый R10 независимо выбран из водорода, R12 и -OR12; каждый из R8 и R9 независимо выбран из С1-С8алкила с прямой и разветвленной цепью; r означает 0; G представляет собой кислород; Z1 представляет собой С1-С5алкил с прямой или разветвленной цепью; Ar представляет собой 1,2-, 1,3- или 1,4-фенилен; W выбран из -О- и -S-; и Y представляет собой (С1-С6)алкиленовую группу с прямой или разветвленной цепью, а также к способам синтеза и очистки производных калихеамицина. 8 н. и 16 з.п. ф-лы, 8 пр.
Реферат
Область изобретения
Изобретение относится к синтезу производных калихеамицина. Изобретение также относится к промежуточным соединениям и линкерным молекулам, используемых для получения производных калихеамицина и для конъюгирования калихеамицина с биомакромолекулой, такой как моноклональное антитело.
Предшествующий уровень техники
MYLOTARG® (гемтузумаб озогамицин) состоит из моноклонального антитела к CD33, которое связано с калихеамицином посредством гидролизуемого кислотой линкера. Этот коммерческий продукт поступил на рынок как первый антитело-химиотерапевтический агент направленного воздействия и был одобрен для лечения острого миелоидного лейкоза (AML) у пожилых пациентов. Инотузумаб озогамицин представляет собой антитело к CD22, связанное с калихеамицином, и в настоящее время проходит клинические испытания для лечения некоторых типов рака.
Семейство сильнодействующих антибактериальных и
противоопухолевых агентов, известное в совокупности как калихеамицины, или комплекс LL-E33288, раскрыто в патенте США №4970198. В патенте США №5053394 также раскрыты метил-трисульфидные антибактериальные и противоопухолевые агенты. Эти соединения, раскрытые в патенте США №4970198 и в патенте США №5053394, содержат метилтрисульфидную группу, которая может взаимодействовать с подходящими тиолами с образованием дисульфидов с одновременным введением функциональной группы, такой как гидразид или подобный нуклеофил. Примеры этой реакции с калихеамицинами приведены в патенте США №5053394. Патент США №577070 относится к способу получения направленно доставляемых форм дисульфидных соединений комплекса LL-E33288. Линкер, 4-(4-ацетил-фенокси)бутановую кислоту, подвергают реакции конденсации с диметилгидразидом N-ацетил-гамма-калихеамицина с образованием карбоновая кислота-гидразона, который дополнительно обрабатывают N-гидроксисукцинимидом с получением сложного OSu эфира (N-сукцинимидилокси), который готов для конъюгирования с выбранной биомакромолекулой.
В патенте США №8273862 раскрыт синтетический способ создания линкерных промежуточных молекул (именуемых здесь "трилинкер-активированные сложные эфиры" или "трифункциональные линкерные промежуточные соединения"). Эти линкерные промежуточные соединения могут быть конъюгированы с калихеамицинами для получения производных калихеамицинов, которые затем могут быть дополнительно конъюгированы с биомакромолекулами, такими как моноклональные антитела. На стадиях, приводящих к получению линкерного промежуточного соединения, в способе синтеза, описанном в патенте США №8273862, в качестве промежуточного соединения используется меркаптосоединение ("соединение 2'' в указанном патенте), например гидразид 3-метил-3-меркаптобутановой кислоты.
В WO 2008/147765 раскрыт способ синтеза меркаптосодержащих промежуточных соединений, таких как гидразид 3-метил-3-меркаптобутановой кислоты, которые полезны в получении линкерных промежуточных соединений и производных калихеамицина, как описано в предыдущем абзаце. WO 2008/147765 альтернативно относится к гидразиду 3-метил-3-меркаптобутановой кислоты в качестве "DMH линкера". В WO 2008/147765 отмечено, что гидразид 3-метил-3-меркаптобутановой кислоты является предпочтительным меркаптосодержащим N-ацилгидразином в целях связывания калихеамицина с моноклональными антителами с получением, к примеру, гемтузумаба озогамицина или инотузумаба озогамицина.
В WO 2008/147765 гидразид 3-метил-3-меркаптобутановой кислоты получают путем удаления бензильной защитной группы с соединения гидразид пара-метоксибензилтиоэфира в кислотных условиях. Для того чтобы получить гидразид пара-метоксибензилтиоэфира, согласно WO 2008/137765 сначала подвергают взаимодействию пара-метоксибензилтиоэфирную кислоту с оксалилхлоридом в метиленхлориде с образованием хлорангидрида пара-метоксибензилтиоэфирной кислоты. Хлорангидрид пара-метоксибензилтиоэфирной кислоты затем добавляют в смесь безводного гидразина и метиленхлорида с получением гидразид пара-метоксибензилтиоэфира. Однако, как описано в WO 2008/147765, два реагента, пара-метилоксибензилтиоэфирная кислота и хлорангидрид пара-метоксибензилтиоэфирной кислоты, сами вместе образуют нежелательный побочный продукт, гидразид бис-метоксибензилтиоэфира, что приводит к снижению выхода и качества. Кроме того, как описано в WO 2008/147765, вследствие реакционной и нестабильной природы молекулы хлорангидрида пара-метоксибензилтиоэфирной кислоты необходимо использовать безводный гидразин и низкие температуры, например -70°С.
В другом аспекте получение производных калихеамицина включает в себя химическое связывание калихеамицина с линкерной молекулой. Для того чтобы конъюгировать калихеамицин с линкерным промежуточным соединением, в патенте США №8273862 проводят конечную реакцию между калихеамицином и "трилинкер-активированным сложным эфиром" (или "трифункциональным линкерным промежуточным соединением"). Структурно калихеамицины содержат трисульфидную группировку, как раскрыто выше, которую используют в их дериватизации, и химизм этой реакции между трисульфидной группировкой калихеамицина и трилинкер-активированным сложным эфиром важен для достижения хороших выходов и чистоты. Ранее используемые реакции обмена серы для производных калихеамицина давали сложные реакционные смеси, многочисленные побочные продукты и низкие выходы.
Наконец, производное калихеамицина должно быть очищено после его образования. Способ, описанный в патенте США №8273862, включает в себя очистку производного калихеамицина, включающую стадию нормально-фазной хроматографии. На стадии нормально-фазной хроматографии в процессе очистки, описанном в патенте США №8273862, используют метиленхлорид в качестве растворителя, и, как сказано выше, считается, что воздействие метил енхлорида свыше различных минимальных уровней наносит потенциальный вред здоровью. Поэтому при использовании нормально-фазной хроматографии с использованием метиленхлорида должны быть предприняты меры по ограничению воздействия метиленхлорида.
Краткое изложение сущности изобретения
Согласно настоящему изобретению предложены новые промежуточные соединения и способы синтеза и очистки линкерных промежуточных соединений, которые полезны для конъюгирования калихеамициновых противоопухолевых антибиотиков с биомакромолекулами, такими как моноклональные антитела. Согласно настоящему изобретению также предложены новые способы синтеза производного калихеамицина, которое содержит калихеамицин, ковалентно связанный с линкером. Производное калихеамицина, полученное таким способом, может быть конъюгировано с биомакромолекулой, такой как моноклональное антитело, с получением конъюгата антитело-лекарственное средство. Промежуточные соединения и способы синтеза по настоящему изобретению могут быть использованы, например, для получения производного калихеамицина для изготовления гемтузумаба озогамицина (MYLOTARG®) или инотузумаба озогамицина.
Согласно заявленному изобретению предложены усовершенствования способов синтеза и очистки производных калихеамицина предшествующего уровня техники, которые решают проблемы, ассоциированные с этими предшествующими способами.
Как указано выше, согласно WO 2008/137765 сначала промежуточное соединение пара-метоксибензилтиоэфирную кислоту подвергают взаимодействию с оксалилхлоридом в метиленхлориде с образованием промежуточного хлорангидрида пара-метоксибензилтиоэфирной кислоты, используемого для синтеза производного калихеамицина. В WO 2008/137765 промежуточный хлорангидрид пара-метоксибензилтиоэфирной кислоты затем добавляют в смесь безводного гидразина и метиленхлорида для получения промежуточного гидразида пара-метоксибензилтиоэфира. Однако, как описано в WO 2008/147765, эти два реагента, пара-метилоксибензилтиоэфирная кислота и хлорангидрид пара-метоксибензилтиоэфирной кислоты сами вместе образуют нежелательный побочный продукт, гидразид бис-метоксибензилтиоэфира, что приводит к снижению выхода и качества. Настоящее изобретение всецело решает эту проблему образования побочного продукта гидразида бис-метоксибензилтиоэфира за счет устранения полностью использования хлорангидрида пара-метоксибензилтиоэфирной кислоты в качестве промежуточного соединения. За счет устранения полностью использования хлорангидридного промежуточного хлорангидрида пара-метоксибензилтиоэфирной кислоты заявленное изобретение теперь дает возможность также использовать гидратированные формы гидразина, которые не требуют таких же специальных процедур обработки, каких требует безводный гидразин, и новый способ также исключает обременительное требование низкой температуры. Наконец, поскольку хлорангидрид пара-метоксибензилтиоэфирной кислоты обойден в настоящем изобретении, меры предосторожности в отношении метиленхлорида и безопасности, используемые в связи с этим, нет необходимости использовать.
Настоящее изобретение также повышает выход реакции между калихеамицином и линкерным промежуточным соединением по сравнению со способами предшествующего уровня техники, такими как способ, описанный в патенте США №8273862. Настоящее изобретение повышает выход получаемого производного калихеамицина за счет включения в реакцию карбодиимида.
Было также установлено, как описано в данном документе, что может быть осуществлен новый способ очистки производных калихеамицина, включающий использование обращенно-фазной высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ), несмотря на присутствие двух водолабильных групп (гидразона и эфира N-гидроксисукцинимида) на производном калихеамицина. Данное изобретение решает упомянутые выше проблемы, связанные с очисткой производных калихеамицина с использованием нормально-фазной хроматографии, например с использованием метиленхлорида, как описано в патенте США №8273862.
Согласно настоящему изобретению предложены соединения формулы I
,
где R12 выбран из С1-С8алкила с прямой и разветвленной цепью;
каждый R10 независимо выбран из водорода, R12 и -OR12;
каждый из R8 и R9 независимо выбран из водорода и С1-С8алкила с прямой и разветвленной цепью, где каждый алкил, указанный для R8 и R9, независимо возможно замещен -NH2, -NHR11, -NR11R13, -OR11, -ОН или -SR11, где каждый R11 и каждый R13 независимо выбран из С1-С5алкила с прямой и разветвленной цепью;
r означает целое число 0 или 1;
G представляет собой кислород или серу;
Z1 представляет собой Н или С1-С5алкил с прямой или разветвленной цепью;
Ar представляет собой 1,2-, 1,3- или 1,4-фенилен, возможно замещенный одной, двумя или тремя группами, независимо выбранными из С1-С6алкила с прямой или разветвленной цепью, -OR14, -SR14, галогена, нитро, -COOR14, -C(=O)NHR14, -O(CH2)nCOOR14, -S(CH2)nCOOR14, -O(CH2)nC(=O)NHR14 и -S(CH2)nC(=O)NHR14, или Ar представляет собой 1,2-, 1,3-, 1,4-, 1,5-, 1,6-, 1,7-, 1,8-, 2,3-, 2,6- или 2,7-нафтилиден, возможно замещенный одной, двумя, тремя или четырьмя группами, независимо выбранными из C1-C6алкила с прямой или разветвленной цепью, -OR14, -SR14, галогена, нитро, -COOR14, -C(=O)NHR14, -O(CH2)nCOOR14, -S(CH2)nCOOR14, -O(CH2)nC(=O)NHR14 и -S(CH2)nC(=O)NHR14;
где каждый R14 независимо выбран из (С1-С5)алкила, и каждый R14 независимо возможно замещен одной или двумя группами, выбранными из -ОН, -(С1-С4)алкила и группы -S(С1-С4)алкил;
каждый n означает целое число, независимо выбранное из 0, 1, 2, 3, 4 и 5;
W выбран из -О-, -S-, -C(=O)NH-, -NHC(=O)- и -NR15-, где R15 представляет собой (С1-С5)алкил, и R15 возможно замещен одной или двумя группами, выбранными из -ОН, -(С1-С4)алкила и группы -S(С1-С4)алкил; и
Y представляет собой (С1-С6)алкиленовую группу с прямой или разветвленной цепью или (С2-С6)алкениленовую группу с прямой или разветвленной цепью.
Соединения формулы I полезны в качестве промежуточных соединений для синтеза линкерных промежуточных соединений и производных калихеамицина, содержащих такие линкерные промежуточные соединения, и эти производные калихеамицина, в свою очередь, могут быть конъюгированы с биомакромолекулами, такими как моноклональные антитела.
В одном воплощении изобретения каждый R10 в соединении формулы I представляет собой водород. В еще одном воплощении каждый R10 в соединении формулы I представляет собой водород, и R12 представляет собой метил.
В другом воплощении изобретения соединение формулы I представляет собой соединение, имеющее структуру
.
В другом воплощении изобретения R8 и R9 в соединении формулы I оба представляют собой метил, r означает О, G представляет собой кислород, Z1 представляет собой метил, Ar представляет собой 1,4-фенилен, W представляет собой -О-, и Y представляет собой -(СН2)3-.
В другом воплощении изобретения R8 и R9 в соединении формулы I оба представляют собой метил.
В другом воплощении изобретения r в соединении формулы I означает 0. В другом воплощении изобретения, r в соединении формулы I означает 0, и G представляет собой кислород. В другом воплощении изобретения r в соединении формулы I означает 0, и G представляет собой серу.
Согласно настоящему изобретению предложен также способ синтеза вышеупомянутых соединений формулы I, которые, как указано, полезны в качестве промежуточных соединений для синтеза линкерных промежуточных соединений и производных калихеамицина, содержащих указанные группы линкерных промежуточных соединений. В одном воплощении настоящего изобретения предложен способ синтеза соединения формулы I
,
где R12 выбран из C1-С8алкила с прямой и разветвленной цепью;
каждый R10 независимо выбран из водорода, R12 и -OR12;
каждый из R8 и R9 независимо выбран из водорода и С1-С8алкила с прямой и разветвленной цепью, где каждый алкил, указанный для R8 и R9, независимо возможно замещен -NH2, -NHR11, -NR11R13, -OR11, -ОН или -SR11, где каждый R11 и каждый R13 независимо выбран из С1-С5алкила с прямой и разветвленной цепью;
r означает целое число 0 или 1;
G представляет собой кислород или серу;
Z1 представляет собой Н или С1-С5алкил с прямой или разветвленной цепью;
Ar представляет собой 1,2-, 1,3- или 1,4-фенилен, возможно замещенный одной, двумя или тремя группами, независимо выбранными из С1-С6алкила с прямой или разветвленной цепью, -OR14, -SR14, галогена, нитро, -COOR14, -C(=O)NHR14, -O(CH2)nCOOR14, -S(CH2)nCOOR14, -O(CH2)nC(=O)NHR14 и -S(CH2)nC(=O)NHR14, или Ar представляет собой 1,2-, 1,3-, 1,4-, 1,5-, 1,6-, 1,7-, 1,8-, 2,3-, 2,6- или 2,7-нафтилиден, возможно замещенный одной, двумя, тремя или четырьмя группами, независимо выбранными из C1-С6алкила с прямой или разветвленной цепью, -OR14, -SR14, галогена, нитро, -COOR14, -C(=O)NHR14, -O(CH2)nCOOR14, -S(CH2)nCOOR14, -O(CH2)nC(=O)NHR14 и -S(CH2)nC(=O)NHR14;
где каждый R14 независимо выбран из (С1-С6алкила, и каждый R14 независимо возможно замещен одной или двумя группами, выбранными из -ОН, -(C1-С4)алкила и группы -S(С1-С4)алкил;
каждый n означает целое число, независимо выбранное из 0, 1, 2, 3, 4 и 5;
W выбран из -О-, -S-, -C(=O)NH-, -NHC(=O)- и -NR15-, где R15 представляет собой (С1-С5)алкил, и R15 возможно замещен одной или двумя группами, выбранными из -ОН, -(С1-С4)алкила и группы -S(C1-С4)алкил; и Y представляет собой (С1-С6)алкиленовую группу с прямой или разветвленной цепью или (С2-С6)алкениленовую группу с прямой или разветвленной цепью; включающий взаимодействие соединения формулы II
,
где R10, R12, R8, R9, r и G такие, как определено выше, с соединением формулы III
,
где Z1, Ar, W и Y такие, как определено выше. В одном воплощении способа синтеза соединения формулы I r означает 0, G представляет собой кислород, Z1 представляет собой метил, Ar представляет собой 1,4-фенилен, W представляет собой -О-, и Y представляет собой -(СН2)3-. В еще одном воплощении способа синтеза соединения формулы I R8 и R9 представляют собой метил. В еще одном воплощении способа синтеза соединения формулы I каждый R10 представляет собой водород. В еще одном воплощении способа синтеза соединения формулы I каждый R10 представляет собой водород, и R12 представляет собой метил.
В другом воплощении изобретения для синтеза соединения формулы I R8 и R9 в соединении формулы II оба представляют собой метил.
В другом воплощении изобретения для синтеза соединения формулы I r в соединении формулы II означает 0. В другом воплощении изобретения для синтеза соединения формулы I r в соединении формулы II означает 0, и G представляет собой кислород. В другом воплощении изобретения для синтеза соединения формулы I r в соединении формулы II означает 0, и G представляет собой серу.
Согласно настоящему изобретению предложен также способ синтеза соединения формулы II
,
где R12 выбран из C1-С8алкила с прямой и разветвленной цепью;
каждый R10 независимо выбран из водорода, R12 и -OR12;
каждый из R8 и R9 независимо выбран из водорода и C1-С8алкила с прямой и разветвленной цепью, где каждый алкил, указанный для R8 и R9, независимо возможно замещен -NH2, -NHR11, -NR11R13, -OR11, -ОН или -SR11, где каждый R11 и каждый R13 независимо выбраны из С1-С5алкила с прямой и разветвленной цепью;
r означает целое число, выбранное из 0 и 1; и
G представляет собой кислород или серу; включающий обработку соединения формулы VII
,
где R16 представляет собой -С(=O)ОН или -C(=V)SH, где V представляет собой кислород или серу, или R16 представляет собой -NH2;
азольным активирующим агентом формулы IX
,
где V' представляет собой кислород или серу; и
где Е представляет собой
; ; ;
; . или ;
где m означает целое число 0,1,2 или 3; q означает целое число 0, 1 или 2; и p означает целое число 0, 1, 2, 3 или 4; и где каждый R17, присоединенный к Е, независимо выбран из (С1-С6)алкильных групп с прямой и разветвленной цепью;
в органическом растворителе с образованием соединения формулы VIII
,
где когда R16 представляет собой -С(=O)ОН, тогда r означает 0, и G представляет собой кислород; когда R16 представляет собой -C(=V)SH, тогда r означает 0, и G представляет собой V; и когда R16 представляет собой -NH2, тогда r означает 1, и G представляет собой V';
с последующим объединением соединения формулы VIII с гидразином с получением в результате соединения формулы II. Соединения формулы II полезны в качестве промежуточных соединений для синтеза линкерных промежуточных соединений и производных калихеамицина, содержащих указанные группы линкерных промежуточных соединений, и эти производные калихеамицина, в свою очередь, могут быть конъюгированы с биомакромолекулой, такой как моноклональное антитело.
Азольный активирующий агент представляет собой любое азол-содержащее соединение данной формулы IX, которое при взаимодействии с соединением формулы VII обеспечивает образование соединения формулы VIII, где Е такой, как описано выше. Примеры азольных активирующих агентов, которые могут быть использованы в заявленном изобретении, включают карбонилдиимидазол, тиокарбонилдиимидазол, карбонил-бис-пиразол, где каждый пиразол возможно замещен одной-тремя (С1-С6)алкильными группами, карбонил-бис-1,2,3-триазол, карбонил-бис-бензотриазол и карбонил-бис-1,2,4-триазол. Предпочтительно, азольный активирующий агент представляет собой карбонилдиимидазол.
Соединение формулы VIII возможно выделяют перед объединением с гидразином. В одном воплощении соединение формулы VIII не выделяют перед объединением с гидразином. В еще одном воплощении соединение формулы VIII выделяют перед объединением с гидразином.
Предпочтительно, R16 представляет собой -С(=O)ОН, и азольный активирующий агент представляет собой карбонилдиимидазол.
В одном воплощении настоящего способа получения соединения формулы II r означает 0, и G представляет собой кислород в соединении формулы II. В еще одном воплощении настоящего способа получения соединения формулы II r означает 0, и G представляет собой кислород в соединении формулы II, и R16 в соединении формулы VII представляет собой -С(=O)ОН. В дополнительном воплощении способа получения соединения формулы II r означает 0, и G представляет собой кислород в соединении формулы II, R16 в соединении формулы VII представляет собой -С(=O)ОН, и азольный активирующий агент представляет собой карбонилдиимидазол.
В еще одном воплощении настоящего способа получения соединения формулы II соединение формулы VIII имеет структуру:
.
В дополнительном воплощении способа получения соединения формулы II соединение формулы VIII имеет структуру:
,
и азольный активирующий агент представляет собой карбонилдиимидазол.
В другом воплощении изобретения для синтеза соединения формулы II R8 и R9 в соединении формулы VII оба представляют собой метил.
В другом воплощении изобретения для синтеза соединения формулы II соединение формулы VII содержит R16, представляющий собой -C(=V)SH, и V, представляющий собой кислород или серу. Следует иметь в виду, что когда соединение формулы VII содержит R16, представляющий собой -C(=V)SH, и V, представляющий собой кислород, тогда такое соединение формулы VII может существовать в таутомерной форме, которая представляет собой то же самое соединение формулы VII, но где R16 представляет собой -(C=S)OH. Когда соединение формулы VII содержит R16, представляющий собой -C(=O)SH, и его таутомер, где R16 представляет собой -C(=S)OH, тогда полученный продукт соединение формулы II содержит G, представляющий собой кислород.
В другом воплощении изобретения для синтеза соединения формулы II соединение формулы VII содержит R16, представляющий собой -NH2. Когда соединение формулы VII в способе синтеза соединения формулы II содержит R16, представляющий собой -NH2, тогда r в соединении формулы II, полученном этим способом, означает 1. В еще одном воплощении способа синтеза соединения формулы II способ включает использование соединения формулы VII, где R16 представляет собой -NH2, и соединения формулы IX, где V представляет собой кислород, и соединение формулы II, полученное указанным способом, содержит r, означающий 1, и G, представляющий собой V (т.е. кислород). В еще одном воплощении способа синтеза соединения формулы II способ включает использование соединения формулы VII, где R16 представляет собой -NH2, и соединения формулы IX, где V' представляет собой серу, и соединение формулы II, полученное указанным способом, содержит r, означающий 1, и G, представляющий собой V' (т.е. серу).
В еще одном воплощении способа синтеза соединения формулы II способ включает использованием азольного активирующего агента формулы IX, где V' представляет собой кислород. В еще одном воплощении способа синтеза соединения формулы II способ включает использование азольного активирующего агента формулы IX, где V' представляет собой серу.
В еще одном воплощении способа синтеза соединения формулы II гидразин представляет собой безводный гидразин. В еще одном воплощении способа синтеза соединения формулы II гидразин представляет собой моногидрат гидразина. В еще одном воплощении гидразин представляет собой водный раствор гидразина. В еще одном воплощении гидразин представляет собой тетрагидрофурановый раствор гидразина.
Как раскрыто выше, соединения формулы I полезны в качестве промежуточных соединений для синтеза линкерных промежуточных соединений и производных калихеамицина, содержащих указанные группы линкерных промежуточных соединений. Соответственно, согласно заявленному изобретению предложен способ синтеза соединений формулы IV, которые также полезны в качестве промежуточных соединений для синтеза линкерных промежуточных соединений и производных калихеамицина, содержащих указанные группы линкерных промежуточных соединений. В одном воплощении заявленного изобретения предложен способ синтеза соединения формулы IV
,
где каждый из R8 и R9 независимо выбран из водорода и С1-С8алкила с прямой и разветвленной цепью, где каждый алкил, указанный для R8 и R9, независимо возможно замещен -NH2, -NHR11, -NR11R13, -OR11, -ОН или -SR11, где каждый R11 и каждый R13 независимо выбран из С1-С5алкила с прямой и разветвленной цепью;
r означает целое число, выбранное из 0 и 1;
G представляет собой кислород или серу;
Z1 представляет собой Н или С1-С5алкил с прямой или разветвленной цепью;
Ar представляет собой 1,2-, 1,3- или 1,4-фенилен, возможно замещенный одной, двумя или тремя группами, независимо выбранными из С1-С6алкила с прямой или разветвленной цепью, -OR14, -SR14, галогена, нитро, -COOR14, -C(=O)NHR14, -O(CH2)nCOOR14, -S(CH2)nCOOR14, -O(CH2)nC(=O)NHR14 и -S(CH2)nC(=O)NHR14, или Ar представляет собой 1,2-, 1,3-, 1,4-, 1,5-, 1,6-, 1,7-, 1,8-, 2,3-, 2,6- или 2,7-нафтилиден, возможно замещенный одной, двумя, тремя или четырьмя группами, независимо выбранными из С1-С6алкила с прямой или разветвленной цепью, -OR14, -SR14, галогена, нитро, -COOR14, -C(=O)NHR14, -O(CH2)nCOOR14, -S(CH2)nCOOR14, -O(CH2)nC(=O)NHR14 и -S(CH2)nC(=O)NHR14;
где каждый R14 независимо выбран из (С1-С5)алкила, и каждый R14 независимо возможно замещен одной или двумя группами, выбранными из -ОН, -(С1-С4)алкила и группы -S(С1-С4)алкил;
каждый n означает целое число, независимо выбранное из 0, 1, 2, 3, 4 и 5;
W выбран из -О-, -S-, -C(=O)NH-, -NHC(=O)- и -NR15-, где R15 представляет собой (С1-С5)алкил, и R15 возможно замещен одной или двумя группами, выбранными из -ОН, -(С1-С4)алкила и группы -S(С1-С4)алкил; и Y представляет собой (С1-С6)алкиленовую группу с прямой или разветвленной цепью или (С2-С6)алкениленовую группу с прямой или разветвленной цепью, включающий обработку соединения формулы I
,
где R12 выбран из С1-С8алкила с прямой и разветвленной цепью;
каждый R10 независимо выбран из водорода, R12 и -OR12;
и R8, R9, r, G, Z1, Ar, W и Y такие, как определено; с сильной кислотой с образованием смеси, содержащей соединение формулы IV. Сильная кислота, используемая в способе синтеза соединения формулы IV, может быть определена специалистом в данной области техники, так как она является любой кислотой, которая будет удалять замещенный фенил-метиленовую группу с атома серы с получением в результате соединения формулы IV. В одном воплощении сильная кислота, используемая в способе по изобретению для синтеза соединения формулы IV, выбрана из трифторуксусной кислоты, серной кислоты, трифторметансульфоновой кислоты, HCl, HBr, HI. В одном воплощении способа синтеза соединения формулы IV R8 и R9 представляют собой метил, r означает 0, G представляет собой кислород, Z1 представляет собой метил, Аr представляет собой 1,4-фенилен, W представляет собой -О-, и Y представляет собой -(СН2)3-. В еще одном воплощении способа синтеза соединения формулы IV каждый R10 представляет собой водород. В еще одном воплощении способа синтеза соединения формулы IV каждый R10 представляет собой водород, и R12 представляет собой метил.
В другом воплощении изобретения для синтеза соединения формулы IV R8 и R9 в соединении формулы I оба представляют собой метил.
В другом воплощении изобретения для синтеза соединения формулы IV r в соединении формулы I означает 0. В другом воплощении изобретения для синтеза соединения формулы IV r в соединении формулы I означает 0, и G представляет собой кислород. В другом воплощении изобретения для синтеза соединения формулы IV r в соединении формулы I означает 0, и G представляет собой серу.
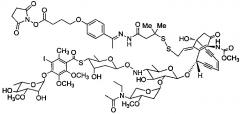
Согласно изобретению предложен также способ синтеза линкерного промежуточного соединения формулы V с использованием промежуточных соединений формулы I и промежуточных соединений формулы IV. В одном воплощении изобретения предложен способ синтеза линкерного промежуточного соединения формулы V
,
где каждый из R8 и R9 независимо выбран из водорода и C1-С8алкила с прямой и разветвленной цепью, где каждый алкил, указанный для R8 и R9, независимо возможно замещен -NH2, -NHR111, -NR11R13, -OR11, -ОН или -SR11, где каждый R11 и каждый R13 независимо выбран из С1-С5алкила с прямой и разветвленной цепью;
r означает целое число, выбранное из 0 и 1;
G представляет собой кислород или серу;
Z1 представляет собой Н или С1-C5алкил с прямой или разветвленной цепью;
Ar представляет собой 1,2-, 1,3- или 1,4-фенилен, возможно замещенный одной, двумя или тремя группами, независимо выбранными из C1-С6алкила с прямой или разветвленной цепью, -OR14, -SR14, галогена, нитро, -COOR14, -C(=O)NHR14, -O(CH2)nCOOR14, -S(CH2)nCOOR14, -O(CH2)nC(=O)NHR14 и -S(CH2)nC(=O)NHR14, или Ar представляет собой 1,2-, 1,3-, 1,4-, 1,5-, 1,6-, 1,7-, 1,8-, 2,3-, 2,6- или 2,7-нафтилиден, возможно замещенный одной, двумя, тремя или четырьмя группами, независимо выбранными из C1-C6алкила с прямой или разветвленной цепью, -OR14, -SR14, галогена, нитро, -COOR14, -C(=O)NHR14, -O(CH2)nCOOR14, -S(CH2)nCOOR14, -O(CH2)nC(=O)NHR14 и -S(CH2)nC(=O)NHR14;
где каждый R14 независимо выбран из (С1-С5)алкила, и каждый R14 независимо возможно замещен одной или двумя группами, выбранными из -ОН, -(C1-С4)алкила и группы -S(С1-С4)алкил;
каждый n означает целое число, независимо выбранное из 0, 1, 2, 3, 4 и 5;
W выбран из -О-, -S-, -C(=O)NH-, -NHC(=O)- и -NR15-, где R15 представляет собой (С1-С5)алкил, и R15 возможно замещен одной или двумя группами, выбранными из -ОН, -(С1-С4)алкила и группы -S(С1-С4)алкил;
Y представляет собой (С1-С6)алкиленовую группу с прямой или разветвленной цепью или (С2-С6)алкениленовую группу с прямой или разветвленной цепью; и
Z выбран из группы, состоящей из
, , , ,
и ;
включающий
а) обработку соединения формулы I
,
где R12 выбран из C1-С8алкила с прямой и разветвленной цепью, и каждый R10 независимо выбран из водорода, R12 и -OR12,
сильной кислотой с образованием смеси, содержащей соединение формулы IV
; и
б) взаимодействие соединения формулы IV с соединением ZH;
тем самым синтезируя линкерное промежуточное соединение формулы V. В одном воплощении способа синтеза линкерных промежуточных соединений формулы V сильная кислота представляет собой трифторуксусную кислоту или серную кислоту.
В другом воплощении изобретения для синтеза линкерного промежуточного соединения формулы V R8 и R9 в соединении формулы I оба представляют собой метил.
В другом воплощении изобретения для синтеза линкерного промежуточного соединения формулы V r в соединении формулы I означает 0. В другом воплощении изобретения для синтеза линкерного промежуточного соединения формулы V r в соединении формулы I означает 0, и G представляет собой кислород. В другом воплощении изобретения для синтеза линкерного промежуточного соединения формулы V r в соединении формулы I означает 0, и G представляет собой серу.
В еще одном воплощении способа синтеза линкерных промежуточных соединений формулы V ZH представляет собой
.
В еще одном воплощении способа синтеза линкерных промежуточных соединений формулы V линкерное промежуточное соединение представляет собой соединение, имеющее структуру
.
В еще одном воплощении способа синтеза линкерных промежуточных соединений формулы V соединение формулы I, используемое в способе, получают путем взаимодействия соединения формулы II
;
с соединением формулы III
.
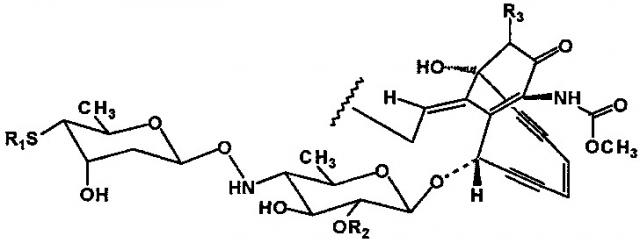
Как раскрыто, линкерные промежуточные соединения полезны для получения производных калихеамицина, содержащих указанные группы линкерных промежуточных соединений. Производные калихеамицина, в свою очередь, могут быть крнъюгированы с биомакромолекулами, такими как моноклональные антитела. Соответственно, соединения формулы I и способы синтеза, описанные в данном документе, полезны для получения таких производных калихеамицина. Таким образом, согласно настоящему изобретению предложен способ синтеза производного калихеамицина формулы VI
,
где J представляет собой
;
R1 представляет собой или СН3;
R2 представляет собой или Н;
R3 представляет собой или Н;
R4 представляет собой или Н;
R5 представляет собой -СН3, -С2Н5 или -СН(СН3)2;
X представляет собой атом йода или брома;
R5' представляет собой водород или группу RCO, где R представляет собой водород, разветвленный или неразветвленный алкил из 1-10 атомов углерода, алкилен из 2-10 атомов углерода, арил из 6-11 атомов углерода, группу (С6-С11)арил-алкил(С1-С5), или гетероарил или группу гетероарил-алкил(С1-С5), где гетероарил определен как 2- или 3-фурил, 2- или 3-тиенил, 2-или 3-(N-метилпирролил), 2-, 3- или 4-пиридинил, 2-, 4- или 5-(N-метилимидазолил), 2-, 4- или 5-оксазолил, 2-, 3-, 5- или 6-пиримидинил, 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолил или 1-, 3-, 4-, 5-, 6-, 7- или 8-изохинолил, и все арильные и гетероарильные группы возможно замещены одной или более группами ги