Способ введения генов патогенных стрептококков в хромосомную днк пробиотического штамма enterococcus faecium l3 для экспрессии в пилях
Иллюстрации
Показать всеИзобретение относится к области биохимии, генной инженерии и биотехнологии, в частности к способу создания живой вакцины на основе биологически активного штамма Еnterococcus faecium L3 за счет включения в структуру его пилей антигена клинически актуального патогенного микроорганизма. Настоящий способ предусматривает получение слитого гена entF-bac, состоящего из двух отдельных фрагментов гена пробиотика E. faecium L3 и фрагмента гена bac и имеющего нуклеотидную последовательность, представленную на фиг. 7а, его клонирование и выявление бактериальных клонов, экспрессирущих нужный белок в пилях. Изобретение также относится к рекомбинантной плазмидной ДНК pentF-bac. Настоящая ДНК pentF-bac предназначена для создания живой вакцины на основе биологически активного штамма Е. faecium L3. Указанная ДНК pentF-bac представляет собой суицидную плазмиду pT7ERMB, по сайтам BamHI и KpnI которой вставлена последовательность ДНК слитого гена entF-bac. Настоящее изобретение также относится к вакцинному препарату E. faecium L3 Вас+. Указанный вакцинный препарат получают путем электропорации E. faecium L3 плазмидной ДНК pentF-bac. Настоящее изобретение позволяет получать живую вакцину на основе биологически активного штамма Е. faecium L3. 3 н.п. ф-лы, 9 ил., 1 табл., 5 пр.
Реферат
Изобретение относится к области микробиологии и молекулярной генетики и может быть использовано в медицинской промышленности при производстве живых вакцин против стрептококков Streptococcus agalactiae (стрептококков группы В (СГВ)) и Streptococcus pyogenes (стрептококков группы А (СГА)).
Проблема вакцинной профилактики инфекций, вызываемых стрептококками, стафилококками и пневмококками, только в последнее время стала рассматриваться в качестве актуальной проблемы в медицинской науке.
Streptococcus agalactiae или стрептококк группы В (СГВ) является основной причиной смерти новорожденных от сепсиса, менингита или бактериальной пневмонии. Новорожденные приобретают бактерии через родовой канал их матери, являющейся носителем СГВ или антенатально в случае бессимптомного носительства СГВ у матери. Стрептококковая инфекция у детей старшего возраста часто выражена в виде артрита, остеомиелита и поражения кожных покровов. СГВ также способны вызывать выкидыши, внутриутробное повреждение плода, послеродовой сепсис и другие патологии у взрослых. СГВ все чаще рассматривается как возбудитель урогенитальных инфекций у взрослых, а также септических процессов у лиц пожилого возраста.
Streptococcus pyogenes (СГА) являются широко распространенным патогеном для человека и приматов, инфицируя, главным образом, назофарингеальную слизистую и кожу. Стрептококки, инфицирующие слизистую человека, вызывают острую ангину, скарлатину, хронический тонзиллит и фарингит, которые часто сопровождаются серьезными осложнениями, такими как отит, ревматизм и гломерулонефрит. К кожным заболеваниям, вызываемым СГА, относятся импетиго, васкулиты, гнойные посттравматические и постожоговые поражения тканей, рожистое воспаление. В ряде случаев инфекции, вызванные СГА, переходят в более генерализованные формы: некротический фасцит, стрептококковый сепсис и токсический шоковый синдром. Эти заболевания характеризуются высоким процентом летальных исходов вследствие быстрого развития шока на фоне общей недостаточности работы органов человеческого организма.
Несмотря на профилактические меры, широкий спектр тяжелых заболеваний, вызываемый СГВ и СГА, рассматривается как существенная медицинская и эпидемиологическая социально-экономическая проблема в большинстве стран, в том числе и в развитых.
Профилактику инфекционных заболеваний стрептококковой этиологии осуществляют с применением бензатин бензилпенициллина, эритромицина, ампициллина и сульбактама [Бурбелло А.Т. и др. Соврем. Лекар. Средства, СПб: Нева, 323-324, 332, 352 (2003)]. Для лечения больных с заболеваниями, вызванными СГВ, используют антибиотики [Страчунский Л.С., Козлов С.Н. Соврем. Антимикроб. Химиотер., М.: Боргес, 1-432 (2002), Поляк М.С. Основы антибиотикотерапии, СПб: НИЦФ, 1-53 (2003)]. Наибольшее распространение получили представители группы пенициллинов - бензилпенициллин и ампициллин, а также макролиды: эритромицин, ванкомицин, азитромицин, кларитромицин, рокситромицин [(Семина Н.А., Сидоренко С.В. и др. Клин. Микробиол. Антимикроб. Химиотер. 6(4): 306-359 (2004), Зуева Л.П., Поляк М.С. и др. Микробиологический мониторинг, СПб: Медицинский информационно-аналитический центр, 1-72 (2004)].
Сложность при лечении и профилактике посредством антибиотикотерапии возникает в связи с многообразием побочных эффектов, проявляющихся у пациентов: негативное действие на центральную нервную и сердечно-сосудистую, иммунную системы организма, нарушение микробиоценоза организма, а также аллергические реакции. Неэффективность терапии с применением антибиотиков в ряде случаев обусловлена появлением антибиотико-резистентных штаммов СГВ и СГА.
Отсутствие безопасных и эффективных мер по профилактике и лечению заболеваний, вызываемых СГВ или СГА делает актуальным направление по разработке антибактериальных вакцин.
Разработка вакцинных препаратов для профилактики данных заболеваний идет в направлении создания различных форм рекомбинантных полипептидных и конъюгированных полисахаридных вакцин.
Группе исследователей удалось сконструировать ряд эффективных конъюгированных поливалентных СГВ вакцин на основе полисахаридных антигенов, соответствующих основным серотипам бактерий [Baker CJ., Paoleti L.C., Wessels M.R. et al., J. Infect Dis., 179: 142-150 (1999)].
Недостатком полисахаридных вакцин является низкая эффективность вследствие недостаточной иммуногенности самой полисахаридной капсулы, Т-независимого характера иммунного ответа и узкой типовой специфичности антител, поскольку существует одиннадцать различных серотипов СГВ [Lindahl G. и др. Clin Microbiol Rev. 18(1): 102-127 (2005); Slotved H.C., Kong F., и др. J Clin Microbiol. 45(9): 2929-36 (2007)].
Расширение пределов специфичности полисахаридных вакцин достигается за счет включения в вакцинный препарат полисахаридов, принадлежащих всем наиболее распространенным серотипам СГВ, что существенно удорожает стоимость вакцины. Наиболее хорошо разработаны и доведены до этапа клинических испытаний конъюгированные вакцины, представляющие собой комплекс полисахаридов СГВ и бактериальных токсинов и токсоидов, используемых в качестве адъювантов. Препятствием на пути применения препаратов подобного типа у людей является наличие иммунитета к адъювантным компонентам вакцины, что ощутимо снижает иммунный ответ на специфический полисахарид [Burrage M., Robinson A. и др. Infect Immun. 70: 4948-54 (2002)].
Ранее было показано, что поверхностные белки СГВ могут служить компонентами вакцины, эффективной против СГВ-инфекции [Грабовская К.Б., Леонтьева Г.Ф., Мерингова Л.Ф. и др. Медицинская иммунология, 6: 133-138 (2006)]. Используя генно-инженерные подходы, были созданы рекомбинантные конструкции, соответствующие иммуногенным участкам ряда стрептококковых поверхностных белков. Профилактическая вакцинация рекомбинантными полипептидами обеcпечила возможность защиты лабораторных животных от инфекции, вызванной различными серотипами СГВ [Суворов А.Н., Грабовская К.Б., Леонтьева Г.Ф и др. Журнал микробиол., 2: 44-50 (2010)].
В состав разработок СГВ вакцин на основе рекомбинантных белков входят рекомбинантные полипептиды, полученные на основе хорошо изученных поверхностных белков стрептококка группы В: Bac, Sip, Rib, C5a пептидазы, LrrP [Yang H.H., Madoff L.C. Inf. Immun. 75: 3455-61 (2007); Martin D., Rioux S. и др. Infect Immin. 70(9): 4897-4901 (2002); Stålhammar-Carlemalm M. и др. J Exp Med. 177(6): 159301603; Cleary P.P., Matsuka Y.V. и др., Vaccine 22(31032): 4332-41 (2004); Seepersaud R., Hanniffy S.B. Infect Immun. 73(3): 1671-83 (2005)].
Недостатком рекомбинантных моновакцин против стрептококков группы В является дифференциальная экспрессия различных поверхностных белков бактерий в зависимости от фазы роста, а также существование антигенной вариабельности белков среди бактериальных штаммов одного вида.
Другим недостатком рекомбинантных моновакцин является отсутствие экспрессии поверхностного белка, на основе которого была создана моновакцина, некоторыми стрептококковыми штаммами. Следствием этого станет неэффективность такой моновакцины в отношении определенных стрептококковых штаммов. Примером может служить Вас белок, который не продуцируется СГА штаммами.
Среди разработок СГВ вакцин получен четырехкомпонентный комплекс рекомбинантных полипептидов, полученных на основе четырех консервативных белков СГВ [Maione D., Margarit I. и др. Science 309 (5731): 148-150 (2005)]. Три из этих белков входят в состав пилей СГВ, четвертый белок был идентифицирован как Sip.
К недостаткам этого комплекса можно отнести использование в ходе иммунизации лабораторных животных адъюванта Фрейнда, который, как было продемонстрировано еще в 1993 г., является токсически активным веществом [Gupta R.k., Relyveld E.H. и др. Vaccine 11: 293-306 (1993)].
К недостаткам этого комплекса также относится отсутствие данных о синергетическом эффекте комплекса по отношению к синтезу специфических антител, а также высокая вариабельность белков пилей у штаммов СГВ.
Также недостатком комплекса является продемонстрированная протективность специфических антител только по отношению к стрептококку группе В.
Наиболее востребованными вакцинами, специфичными в отношении СГА, являются вакцины на основе различных производных антифагоцитарного М белка. В литературе описаны вакцинные препараты на основе консервативного эпитопа пептида P 145, локализованного в области C повторов и расположенного проксимально по отношению к клеточной стенке бактерии; на основе полипептида, соответствующего полноразмерному участку С-повторов; а также рекомбинантного полипептида, составленного из N-терминальных последовательностей М белков, принадлежащих 26 различным М-серотипам СГА [Good M., Cleary P. и др. New generation vaccines, M.M. Levine (ed.), NY, 695-710 (2004); (Fischetti V.A. ASM News 62: 405-410 (1996); Hu M.C., M.A. Walls и др. Infect. Immun. 70: 2171-2177 (2002)].
Вакцины на основе М белка СГА являются средством борьбы с инфекциями, вызываемыми стрептококком группы А, и не эффективны для профилактики СГВ инфекций.
Вакцинные препараты на основе других поверхностных белков СГА, в том числе общих для стрептококков групп А и В, находятся на начальных стадиях разработки [Hae-Sun Park H.S., Cleary P.P. Infect. Immun. 73(12): 7878-7886 (2005); Schulze Kai, Eva Medina и др. Vaccine 21(17-18): 1958-1964 (2003)].
Эффективное применение и белковых и полисахаридных вакцинных препаратов предусматривает двух- или трехкратную иммунизацию путем подкожных или внутримышечных инъекций с адъювантом, что может быть сопряжено с осложнениями и требует серьезных организационных и финансовых затрат.
Альтернативой использованию химических адъювантов для вакцинации является применение так называемых живых бактериальных вакцин на основе пробиотиков. Живые вакцины применяют, как правило, однократно, вводят подкожно, накожно или внутримышечно, а некоторые вакцины перорально и ингаляционно. Главным преимуществом живых вакцин является то, что они активируют все компоненты иммунной системы, вызывая сбалансированный прочный иммунный ответ.
Пробиотики - препараты, оказывающие общее благотворное влияние на организм человека (чаще всего молочнокислые бактерии). Установлено, что некоторые пробиотики являются эффективными неспецифическими стимуляторами выработки специфических иммуноглобулинов против различных инфекций [Vintini E.O., Medina M.S., BMC Immunol., 12: 46 (2011), Bermudez-Hurnarun L.G., Kharrat P., Chatel J.M., Microb. Cell. Fact., 10: 17-24 (2011)]. Пробиотики стали использоваться в качестве векторов, в часть из которых успешно внесены плазмидные конструкции, обеспечивающие зкспрессию антигенов патогенных бактерий [ME Y., Luo Y., Huang X., Song F., Liu G. Microbiology, 158: 498-504 (2012), De Azevedo M., Karczzewski J., Lefeure F. Et al. BMC Microbiol. 12: 299 (2011)].
Разработана вакцина против Enterohemorrhagic Escherihia coli (EHEC), вызывающей уремический синдром [Ahmed, M. Loos, D. Vanrompay, E. Cox. Vaccine, 32: 3909-3916 (2014). Он является причиной острой почечной недостаточности у детей и пожилых людей. В своей вакцине авторы используют пробиотический штамм Lactococcus lactis, который является безопасной бактерией и может служить платформой для пероральной вакцинации. В работе создан рекомбинантный штамм, в котором Lactococcus lactis экспрессирует антиген EHEC, EspB, в цитоплазме. Эта вакцина может быть особенно полезна для детей и пожилых людей, находящихся в группе высокого риска заболеваемости.
Персистенция подобных вариантов пробиотиков в организме способна не только стимулировать выработку протективных иммуноглобулинов, специфичных в отношении целевых антигенов возбудителя, но и обеспечить благоприятный фон для борьбы с инфекцией за счет усиления защитных реакций врожденного иммунитета.
Описано создание живой вакцины на основе штамма пробиотика Еnterococcus faecium L3 для профилактики вагинальной инфекции, вызванной Streptococcus agalactiae. [Гупалова Т.В., Леонтьева Г.Ф., Ермоленко Е.И. и др. Медицинский академический журнал, 13: 64-70, (2013)]. На основе штамма пробиотика Еnterococcus faecium L3 сконструирована первая генно-инженерная живая вакцина со встроенным в хромосому участком гена белка патогенного Streptococcus agalactiae.
Эта живая вакцина принята в качестве прототипа заявляемого изобретения.
В представленном изобретении для создания живой вакцины против СГВ в настоящей заявке использовался подход, основанный на введении bac гена патогенных СГВ в хромосомную ДНК пробиотического штамма Enterococcus faecium L3 при экспрессии в пилях. Пили из энтерококков являются идеальными кандидатами для вакцин из-за их экспозиции на клеточной поверхности. Они выступают за пределы бактериальных клеток и способны проникать сквозь капсулу, которая экранирует большинство белков-антигенов. Пили состоят из мономеров, способных к агрегации, за счет чего увеличивается доза антигена, что способствует увеличению титров антител, специфичных к встраиваемому в структуру поверхностного белка энтерококка полипептидного фрагмента штамма патогенного СГВ. Поэтому способ введения гена патогенных стрептококков в пили пробиотического штамма Enterococcus faecium L3 выгодно отличается от прототипа заявляемого изобретения, в котором рекомбинантный белок экспрессировался не на поверхности, а в цитоплазме бактерии.
В патенте представлены данные по конструированию и проверке иммуногенных и протективных свойств новой живой вакцины против Streptococcus agalactiae.
Для профилактики инфекций, передающихся половым путем, требуются безопасные и эффективные вакцины, способные стимулировать иммунную защиту на слизистых оболочках генитального тракта. Пробиотические микроорганизмы рассматриваются в настоящее время как хорошая основа для получения рекомбинантных живых вакцин, экспрессирующих вакцинные антигены возбудителей актуальных инфекций [Vintini E.O., Medina M.S., BMC Immunol., 12: 46 (2011); Bermudez-Hurnarun L.G., Kharrat P., Chatel J.M., Microb. Cell. Fact., 10: 17-24 (2011); ME Y., Luo Y., Huang X., Song F., Liu G. Microbiology, 158: 498-504 (2012), De Azevedo M., Karczzewski J., Lefeure F. Et al. BMC Microbiol. 12: 299 (2011)].
Отличие данного исследования от других экспериментальных работ с живыми вакцинами на основе пробиотиков заключается в том, что обычно пробиотики используют в качестве природных адъювантов иммунного ответа, а антиген вводится отдельно. Другой подход заключается во введении гена целевого белка непосредственно в пробиотик в составе экспрессионной плазмиды. Настоящее исследование представляет собой способ интеграции участка ДНК, кодирующего антигенный фрагмент белка патогенного микроорганизма, в структуру хромосомной ДНК энтерококка. При этом задача генетической части работы состояла в осуществлении интеграции гетерологичного участка ДНК в структуру гена поверхностного белка пробиотика без нарушения открытой рамки считывания и повреждения участков кодирования компонентов, участвующих в процессинге поверхностного белка PilF. В данном исследовании в качестве бактерии-реципиента использовался хорошо изученный пробиотический штамм Enterococcus faecium L3, обладающий целым рядом уникальных биологических свойств.
Штамм Еnterococcus faecium L3 обладает выраженной антагонистической активностью в отношении грамположительных и грамотрицательных бактерий, способностью восстанавливать микробиоценоз кишечника на фоне дисбиотических состояний [Yermolenko E., Suvorov A., Chernush A., et al. International Congress Series, 1289: 363-366 (2006)], а также оказывать иммуномодулирующее действие на организм хозяина [Tarasova E., Yermolenko E., Donets V. et al. Beneficial Microbs, 1: 265-270, (2010)]. Осуществлено физическое картирование штамма Еnterococcus faecium L3 [Suvorov A., Simanenkov V., Gromova L. et al. Prebiotics and probiotics potencial for human health, 104-112, (2011)]. В экспериментах на здоровых самках мышей показано, что интравагинальное введение высоких доз штамма Еnterococcus faecium L3 не только не оказывает токсического действия на организм, но и не влияет на состояние слизистой оболочки влагалища [Суворов А., Алехина Г.Г., Пигаревский П.В. и др. Гастробюллетень, 4: 29-31, (2001)], способствует экспрессии IL-10 клетками слизистой оболочки влагалища крыс с экспериментальным вагинитом, вызванном S.agalactiae и Staphylococcus aureus [Tarasova E., Yermolenko E., Donets V. et al. Beneficial Microbs, 1: 265-270, (2010)]. В штамме Еnterococcus faecium L3, как и у других грамположительных бактерий, были найдены пили, которые представляют собой фимбрии длиной 0,3-3 μm и диаметром 2-10 nm [Telford JL, Barocchi MA, Margarit I et al. Nature Reviews Microbiology 4: 509-519, (2006)]. Это длинные белок подобные полимеры, тянущиеся на поверхности бактерий, представляют собой субъединицы белка пилина, соединенные ковалентной связью. Они играют большую роль в адгезиии колонизации хозяина. Пили являются высокоиммуногенными структурами, которые находятся под селективным давлением иммунных реакций хозяина [Camille Danne, Shaynoor Dramsi. Research in Microbiology, 163: 645-658, (2012)]. Пили из энтерококков являются идеальными кандидатами для вакцин из-за их экспозиции на клеточной поверхности.
В качестве существенного фактора вирулентности СГВ рассматривается уникальный поверхностный протеин - Вас белок, или β антиген (130 kDa), экспрессируемый многими штаммами СГВ серотипов Ia, Ib, II и V, не имеющий гомологов среди других бактериальных белков. Отличительной особенностью Bac белка является способность связывать Fc-часть IgA человека, основным иммуноглобулином, обеспечивающим защиту слизистых от проникновения микроорганизмов. [Jerlstrom p.G., Talay S.R. и др. Infect. Immun. 64: 2787-2793 (1991)]. Также Вас белок взаимодействует с фактором H (FH) человека - белком плазмы крови, связывание которого приводит к инактивации альтернативного пути комплемента и способствует адгезии микроорганизма к человеческим клеткам. Способность вступать во взаимодействие с двумя указанными компонентами иммунной системы человека позволяет СГВ уклоняться от иммунного ответа [Eur. J. Immunol. - 1985. - №15. - P. 893-899; Adv. in host defense mechanisms. - 1985. - V. 4. - P. 31-61]. Распространенность среди штаммов СГВ, важная роль в обеспечении вирулентности бактерий, консервативность структуры белка обусловили выбор Вас как основы для создания потенциальных компонентов вакцинных препаратов. Кроме того, ранее было показано, что рекомбинантный дериват белка Bac - полипептид Р6, обладает хорошими иммуногенными свойствами, а стимулированный его введением иммунитет обеспечивает защиту от летальной СГВ-инфекции [Грабовская К.Б., Леонтьева Г.Ф., Мерингова Л.Ф. и др. Медицинская иммунология, 6: 133-138, (2006)].
Задачей данного изобретения явилась разработка способа создания живой вакцины на основе биологически активного штамма Еnterococcus faecium L3 за счет включения в структуру его пилей антигена клинически актуального патогенного микроорганизма. Предложенный способ основан на введении участка ДНК, кодирующего антигенный фрагмент различных белков патогенных микроорганизмов, в структуру пилей пробиотика и создании вакцины против инфекций, вызываемых СГА, СГВ или пневмококками.
Задача решалась конкретно на примере введения bac гена патогенных СГB в хромосомную ДНК пробиотического штамма Еnterococcus faecium L3 для экспрессии в пилях:
а) получение слитого гена entF-bac и его клонирование;
б) выявление бактериальных клонов, экспрессирущих Bac белок в пилях;
в) иммунизация мышей живой пробиотической вакциной/
г) определение Bac-специфических антител в крови и вагинальных смывах.
Сущностью предлагаемого изобретения является создание уникальной живой вакцины, обладающей выраженным иммуногенным и протективным эффектами.
Авторами заявляемого изобретения на основе штамма пробиотика Еnterococcus faecium L3, содержащего пили на своей поверхности, сконструирована генно-инженерная живая вакцина со встроенным в хромосому участком гена Вас патогенного Streptococcus agalactiae. Интравагинальное введение вакцины Еnterococcus faecium L3- Вас+ стимулировало развитие системного иммунного ответа. На модели острой вагинальной инфекции у беспородных мышей аппликация живой пробиотической вакцины приводила к защите от летальной СГВ-инфекции. Конструирование живых вакцин на основе биологически активных пробиотических штаммов за счет включения в их структуру антигенов клинически актуальных патогенных микроорганизмов позволяет объединить в одном препарате эффективность полезных свойств пробиотика и специфического антигенного стимула. Подобные вакцинные препараты могут быть полезны для профилактики острых и лечения хронических инфекций, передаваемых половым путем.
Поставленная задача решалась получением слитого гена entF-bac и его клонированием. Для этого были сконструированы уникальные праймеры, представленные в таблице.
Таблица. Олигонуклеотидные праймеры
| Название | Ориентация | Нуклеотидная последовательность от 5' к 3' |
| А1 | прямой | GGGGTACCCCCGATGAGAGCAGCTGGTATTG |
| B1 | обратный | CAGAATCATTTGTTTCATCAAACAATGCGCCATCATAGTTT |
| C1 | прямой | TGGAGCAGGTTGAGAAGGAAGGTTCTGCGCGAGTGATAGAT |
| D1 | обратный | CAACAAGCTTCAAAGCATCGTTGG |
| E1 | прямой | TTGATGAAACAAATGATTCTGATG |
| F2 | обратный | TTCCTTCTCAACCTGCTCCA |
| D2 | обратный | CAACAGGATCCAAAGCATCGTTGG |
| B3 | прямой | TCAGCAACGTGTGTCTTGGT |
| B4 | обратный | CGAACCTTTACTTCGGCATC |
Подчеркнутые звенья нуклеотидной последовательности указывают на сайты рестрикции.
Фрагменты ДНК, соответствующие фрагментам гена Enterococcus faecium L3 и фрагменту гена bас, были амплифицированы в ПЦР с помощью Tag полимеразы («Ampli Tag», Perkin-Elmer, Cetus, USA) и амплификатора (BIO-RAD, USA). Проведена амплификация отдельных двух фрагментов гена Enterococcus faecium L3 с праймерами А1 и В1 и с праймерами С1 и D1 и фрагмента гена P6 с праймерами E1 и F1. Синтез слитого фрагмента осуществляли с праймерами A1 и D1. Одна пара праймеров представлена одновременно участком ДНК энтерококков, а другая участком гена bac. Дизайн праймеров предполагал образование слитого гена без стоп-кодонов в местах сшивок. В результате постановки двух последовательных этапов ПЦР сначала получены отдельные части конструкции, а затем и целый слитый фрагмент ДНК. Клонирование амплифицированного фрагмента ДНК осуществляли с использованием плазмиды pJET1.2, используя Clone JET™ PCR Cloning Kit (Fermentas). В результате клонирования была создана уникальная гибридная ДНК entF-bac с использованием плазмиды pJET1.2. Клон, содержащий гибридную ДНК entF-bac, обладал IgA связывающей способностью. Гибридная ДНК entF-bac из плазмиды pJET1.2 была переклонирована в суицидную плазмиду pT7ERMB с геном устойчивости к эритромицину. Для этого была проведена амплификация гибридной плазмиды с праймерами A1 и D2. В результате клонирования была получена плазмида pentF-bac с ожидаемой вставкой и геном устойчивости к эритромицину и обладала IgA-связывающей активностью.
В результате электропорации энтерококков созданной интегративной плазмидой получены трансформанты. Отобранный Bac+ клон проверяли в реакции ПЦР со специально сконструированными праймерами для секвенирования B3 и B4. ДНК-секвенирование подтвердило соответствие теоретически запланированной схемы экспериментально полученным участкам слияния гена entF с фрагментом гена bac (entF-bac). Этот клон энтерококков, экспрессирующий Bac белок, выбран в качестве вакцинного препарата для дальнейшего исследования.
Иммуногенные свойства вакцинного штамма Еnterococcus faecium L3- Bac+ и протективную эффективность вакцинации изучали на двух равных группах самок беспородных мышей. В этих целях опытной группе мышей вводили Еnterococcus faecium L3- Bac+, а контрольной группе мышей вводили исходный штамм Еnterococcus faecium L3 орально в составе питьевой воды на 1, 2, 3, 6, 7, 22, 23 и 24 в дозе 2×108 на мышь в день. С этой целью суспензию бактерий помещали в бутылку с водой и заменяли ее только после того, как содержимое было полностью выпито. Обе экспериментальные группы находились в течение всего эксперимента на одной и той же диете. Через 40 дней от начала эксперимента две группы мышей, получавшие Enterococcus faecium L3 и Еnterococcus faecium L3-Bac+ соответственно, были заражены внутрибрюшинно Streptococcus agalactiae Н36 (Ibc) в дозе 3×107/мышь в объеме 0,5 мл. В каждую группу входило 20 мышей. Через 5, 24 и 48 часов от начала инфекции определяли содержание бактерий в селезенках 5-6 мышей из группы. На 35 день от начала эксперимента у 10 мышей из каждой группы проводили забор крови из подчелюстной вены. Титр Р6-специфических антител определяли общепринятым методом ИФА.
Через 35 дней от начала эксперимента в крови мышей, получавших вместе с питьевой водой штамм Еnterococcus faecium L3-Bac+, содержащий в составе пилей полипептид Р6 СГВ, были обнаружены Р6- специфические антитела класса G (фиг. 8).
После внутрибрюшинного заражения Streptococcus agalactiae Н36 (Ibc) в дозе 3×107/мышь выявлены различия в динамике очищения мышей от инфекции. Если в группе мышей, получавших «вакцинный» вариант Еnterococcus faecium L3-Bac+, наблюдалось неуклонное снижение содержания бактерий в селезенке, то в группе мышей с исходным вариантом пробиотика отмечено постепенное накопление СГВ (фиг. 9).
Таким образом, мышам вместе с питьевой водой per os в три приема продолжительностью два-три дня вводили генетически модифицированный штамм пробиотика Еnterococcus faecium L3-Bac+, в структуру пилей которого был инкорпорирован полипептид Р6 СГВ.
Анализ сывороток крови исследуемых животных через 35 дней от начала эксперимента позволил обнаружить циркуляцию Р6-специфических IgG и заключить, что присутствие вакцинного варианта Еnterococcus faecium L3-Bac+ в желудочно-кишечном тракте стимулировало развитие Р6-специфического системного иммунного ответа. Мыши этой группы при сравнении с контролем оказались более устойчивыми к внутрибрюшинному заражению штаммом Н36 СГВ, несущим в своем составе белок Bac, антигенно аналогичный полипептиду Р6. Последнее позволяет заключить, что иммунный ответ, вызванный приемом модифицированного полипептидом Р6 пробиотика, имеет очевидную протективную эффективность в отношении генетически гомологичного возбудителя.
Таким образом, на основе штамма пробиотика Еnterococcus faecium L3 сконструирована генно-инженерная живая вакцина со встроенным в хромосому участком гена белка Bac патогенного Streptococcus agalactiae. Белок Bac был встроен в структуру пилей. Интравагинальное введение вакцины Еnterococcus faecium L3-Bac+ стимулировало развитие системного и местного иммунного ответа. На модели острой вагинальной инфекции у беспородных мышей аппликация живой пробиотической вакцины приводила к защите от летальной СГВ-инфекции.
Описан способ создания живой вакцины на основе биологически активного штамма за счет включения в его структуру антигена клинически актуального патогенного микроорганизма. Этот способ основан на введении слитого гена, состоящего из двух участков гена энтерококка и фрагмента гена, кодирующего нужный белок патогенных микроорганизмов в структуру пробиотиков.
Пример 1. Получение фрагментов гена Еnterococcus faecium L3 и фрагмента гена bac
Для работы были выбран пробиотический штамм Enterococcus faecium L3, хромосомную ДНК которого использовали в качестве матрицы в полимеразной цепной реакции (ПЦР). Для выделения хромосомной ДНК клетки микроба лизировали 50 мM ЭДТА (Serva, Германия) и лизоцимом в концентрации 1 мг/мл. ДНК депротеинезировали фенолом и хлороформом, а затем экстрагировали спиртом. Для амплификации фрагмента гена bac использовали плазмидную ДНК Р6.
Фрагменты ДНК, соответствующие фрагментам гена Enterococcus faecium L3 и фрагменту гена bac, были амплифицированы в ПЦР с помощью Tag полимеразы («Ampli Tag», Perkin-Elmer, Cetus, USA) и амплификатора (BIO-RAD, USA). Олигонуклеотидные праймеры представлены в таблице 1. Проведена амплификация отдельных двух фрагментов гена Enterococcus faecium L3 с праймерами А1 и В1 и с праймерами С1 и D1 и фрагмента гена P6 с праймерами E1 и F1. В пробирки с 0,25 мкг геномной ДНК добавляли по 10 μМ каждого из специфических праймеров, фланкирующих исследуемую последовательность, буфер с магнием для полимеразы, по 0,2 мМ четырех дезоксирибонуклеотидтрифосфатов, объем доводили водой до 25 мкл и добавляли 0,5 мкл термостабильной Tag полимеразы. Пробирки помещали в амплификатор и инкубировали при 94°С 2 мин. Программа ПЦР состояла из: денатурации при 94°С - 30 сек, отжига праймеров - 55°С - 1 мин и синтеза - 72°С - 1 мин. Этот цикл повторялся 30 раз, после чего смесь инкубировалась при 72°С 10 мин. ПЦР продукты разделяли в 1% агарозном геле в горизонтальном электрофорезе. Выделение амплифицированных участков ДНК проводили с использованием набора «QIAquick Gel Extraction Kit» (Qiagen, CША). Анализ размера полученных фрагментов ДНК проводили, исходя из сравнения их электрофоретических подвижностей с элетрофоретической подвижностью маркера молекулярных весов (100 п.н. ДНК-маркер, Хеликон).
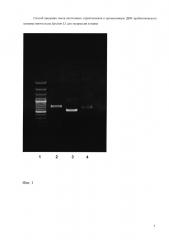
На фиг. 1 (Электрофореграмма амплифицированных ДНК-фрагментов)
1 - 100 п.н. ДНК - маркер (сверху вниз: 3000, 2000, 1000, 900, 800, 700, 600, 500, 400, 300, 200 и 100 нуклеотидных пар).
2 - продукт ПЦР с праймерами А1 и В1
3 - продукт ПЦР с праймерами С1 и D1
4 - продукт ПЦР с праймерами E1 и F1
Пример 2. Получение слитого гена entF-bac и его клонирование.
Синтез слитого фрагмента осуществляли с праймерами A1 и D1. Программа ПЦР состояла из: денатурации при 94°С - 30 сек, отжига праймеров - 55°С - 1 мин и синтеза - 72°С - 2 мин. Этот цикл повторялся 30 раз, после чего смесь инкубировалась при 72°С 10 мин. ПЦР продукты разделяли в 1% агарозном геле в горизонтальном электрофорезе. Выделение амплифицированного участка ДНК проводили с использованием набора «QIAquick Gel Extraction Kit» (Qiagen, CША). Анализ размера полученного фрагмента ДНК проводили, исходя из сравнения их электрофоретических подвижностей с элетрофоретической подвижностью маркера молекулярных весов (100 п.н. ДНК-маркер, Хеликон).
На фиг. 2 (Электрофореграмма амплифицированного слитого фрагмента ДНК):
1 - Продукт ПЦР (слитый фрагмент)
2 - 100 п.н. ДНК - маркер (сверху вниз: 3000, 2000, 1000, 900, 800, 700, 600, 500, 400, 300, 200 и 100 нуклеотидных пар).
Пример 3. Клонирование слитого фрагмента ДНК
Клонирование амплифицированного фрагмента ДНК осуществляли с использованием плазмиды pJET1.2, используя Clone JET™ PCR Cloning Kit (Fermentas). Реакционная смесь состояла из 1мкл PCR- продукта, 1 мкл ДНК-вектора pJET1.2 (50 ng/μl), 10 мкл лигазного буфера, 1 мкл T4 ДНК-лигазы и 7 мкл бидистиллированной воды. Лигазную смесь инкубировали при 220 С 5 мин. Лигазную смесь использовали для трансформации в гетерологичную систему E.coli DH5α. Среда для отбора трансформантов содержала 100 мкг/мл ампициллина. Получили 14 трансформантов, из которых были выделены плазмидные ДНК (фиг. 3).
На фиг. 3. (Электрофореграмма плазмид, выделенных из 14 трансформантов).
1-7 - плазмиды 1-7
8-14 - плазмиды 8-14
К - плазмида pJET1.2.
Как следует из чертежа, вставку содержали плазмиды 1, 4, 9, 10, 12 и 13.
Эти плазмиды были рестрицированы ферментами KpnI и HindIII (фиг. 4).
На фиг. 4. (Электрофореграмма рестрицированных плазмид KpnI и HindIII).
1 - плазмида 1, 2 - плазмида 4, 3 - плазмида 9, 4 - плазмида 10, 5 - плазмида 12, 6 - плазмида 13.
7 - 1 kb маркер (сверху вниз: 10000, 8000, 6000, 5000, 4000, 3500, 3000, 2500, 2000, 1500, 1000, 750, 500 и 250 нуклеотидных пар).
Как следует из чертежа, нужный фрагмент содержала плазмида 4. Клон, содержащий 4 плазмиду, обладал IgA-связывающей способностью.
Гибридная ДНК (entF-bac) была переклонирована в суицидную плазмиду pT7ERMB с геном устойчивости к эритромицину. Для этого была проведена амплификация плазмиды 4 с праймерами A1 и D2. ПЦР-продукт и плазмида pT7ERMB были рестрицированы ферментами BamHI и KpnI. Продукты рестрикции разделяли с помощью электрофореза в 1% агарозном геле. ДНК рестрикты выделяли из агарозы с помощью набора «QIAquick Gel Extraction Kit» (Qiagen, USA), лигировали и трансформировали в гетерологичную систему E.coli DH5α. Среда для отбора содержала 5 мкг/мл эритромицина. Из трансформантов были выделены 44 плазмиды. 11 плазмид содержали ожидаемую вставку и ген устойчивости к эритромицину и клоны, содержащие эти плазмиды, обладали IgA-связывающей активностью (фиг. 5).
На фиг. 5. (Электрофореграмма плазмид, выделенных из 21 трансформанта с 24 по 44 (из 44 полученных клонов).
1-21 - плазмиды 24-44
22 - эритромициновая плазмида pT7ERMB
Как следует из чертежа, вставка есть в 24, 26, 31, 33, 34, 40, 42, 43 и 44 плазмидах.
Рестрикция этих плазмид KpnI и BamHI подтвердили наличие нужной вставки (фиг. 6).
На фиг. 6. (Электрофореграмма рестрицированных плазмид KpnI и BamHI)
1 - исходная плазмида (нерестрицированная), 2 - 24, 3 - 25, 4 – 26, 5- 29, 6 - 31, 7 - 33, 8 - 34, 9 - плазмида pJET1.2.
1kb маркер (сверху вниз: 10000, 8000, 6000, 5000, 4000, 3500, 3000, 2500, 2000, 1500, 1000, 750, 500 и 250 нуклеотидных пар). Для дальнейшей работы выбрали плазмиду, выделенную из клона 34 и обозначенную как pentF-bac.
Плазмидную ДНК pentF-bac использовали как матрицу в ПЦР с праймерами B3 и B4. Амплификат выделяли после электрофореза в 1% агарозном геле и секвенировали. Нуклеотидная последовательность соответствовала известной нуклеотидной последовательности двух фрагментов гена энтерококка и встроенному между ними фрагменту bac гена [Suvorov A., Simanenkov V., Gromova L. et al. Prebiotics and probiotics potencial for human health, 104-112, (2011), Heden L.O., Frithz E., Lindahl G. Eur. J. Immunol., 21: 1481-1490, (1991)].
На фиг. 7а представлена нуклеотидная последовательность, состоящая из 1689 п.н. плазмидной ДНК pentF-bac.
На фиг. 7б показана аминокислотная последовательность слитого белка, состоящая из 563 аминокислотных остатков.
Пример 4. Электропорация энтерококков.
Для электропорации энтерококков культуру Еnterococcus faecium L3 сеяли в 3 мл бульона Tood-Hewitt (THB) («HiMedia», Индия) и выращивали в течение ночи при 37°С, затем пересевали в 50 мл бульона THB 1 мл ночной культуры и выращивали ее до оптической плотности 650 нм 0.3. После этого культуру помещали в лед и затем отмывали трижды в 20 мл 10% глицерола при температуре 4°С, полученный осадок суспендировали в 0.5 мл стерильного раствора глицерола, переосаждали и конечный осадок ресуспендировали в 0.3 мл того же раствора, разлили по 50 мкл в пробирки и проводили электропорацию в кювете с расстоянием между электродами 1 мм при напряжении 2100 В. Во льду к клеткам добавили ДНК (pentF-bac плазмиду, 300 нг). Оптимальная продолжительность импульса составила 4-5 миллисекунд. После проведения разряда тока в кювету добавляли 1 мл THB, инкубировали 1 час и высевали на чашки с селективной средой, которая содержала 2.5 мкг/мл эритромицина. Затем ожидали появления трансформантов через 24 часа.
В результате электропорации энтерококков созданной интегративной плазмидой pentF-bac были получены трансформанты. Отобранный Bac+ клон 2 дополнительно проверяли в реакции ПЦР с праймерами, соответствующими последовательности bac гена и последовательности ДНК энтерококков. Для этого из клона 2 выделяли ДНК, используя набор ДНК-экспресс (Литех, Россия). Реакция ПЦР, а также ДНК-секвенирование подтвердило, что полученный клон кодируется слитым геном, имеющим последовательность гена bac, и фрагментов гена энтерококков, такую же, как и полученную при секвенировании плазмидной ДНК pentF-bac. Клон энтерококков, экспрессирующий Bac, был обозначен как Еnterococcus faecium L3 Bac+ и выбран в качестве вакцинного препарата для дальнейшего исследования.
Пример 5. Иммунизация мышей живой пробиотической вакциной.
Иммуногенные свойства вакцинного штамма Еnterococcus faecium L3- Bac+ и протективную эффективность вакцинации изучали на двух равных группах самок беспородных мышей. В этих целях опытной группе мышей вводили Еnterococcus faecium L3-Bac+, а контрольной группе мышей вводили исходный штамм Еnterococcus faecium L3 орально в составе питьевой воды на 1, 2, 3, 6, 7, 22, 23 и 24 в дозе 2×108 на мышь в день. С этой целью суспензию бактерий помещали в бутылку с водой и заменяли ее только после того, как содержимое было полностью выпито. Обе экспериментальные группы находились в течение всего эксперимента на одной и той же диете. Через 35 дней от начала эксперимента в крови мышей, получавших вместе с питьевой водой штамм Еnterococcus faecium L3-Bac+, содержащий в составе пилей полипептид Р6 СГВ, были обнаружены Р6- специфические антитела класса G (фиг.8).
На фиг. 8. (Средний титр специфических IgG в сыворотках крови мышей после введения живой вакцины и пробиотика per os).
1 столбик - живая вакцина Еnterococcus faecium L3- Bac+
2 столбик - пробиотик Еnterococcus faecium L3
По оси ординат - 1/титр
Через 40 дней от начала эксперимента две группы мышей, получавшие и Еnterococcus faecium L3- Bac+ и исходный штамм Еnterococcus faecium L3, были заражены внутрибрюшинно Streptococcus agalactiae Н36 (Ibc) в дозе 3×10 7/мышь в объеме 0,5 мл. В каждую группу входило 20 мышей. Через 5, 24 и 48 часов от начала инфекции определяли содержание бактерий в селезенках 5-6 мышей из группы. С этой целью селезенки разрушали на измельчителе в одинаковых условиях и гомогенаты высевали на плотной среде кровяного агара капельным методом для дальнейшего подсчета. Количественные показатели выражали в абсолютных значениях -КОЕ/селезенку.
После внутрибрюшинного заражения Streptococcus agalactiae Н36 (Ibc) в дозе 3х107/мышь выявлены различия в динамике очищ