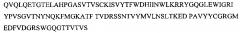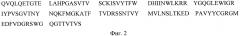Антитело мат40, которое связывается с доменом i экстраклеточной части рецептора эпидермального фактора роста her2/cd340, и его применение для лечения рака
Иллюстрации
Показать всеИзобретение относится к области иммунологии. Предложено антитело, которое связывается с рецептором эпидермального фактора роста HER2/CD340. Также рассмотрено применение данного антитела для лечения рака с суперэкспрессией HER2. Антитело по настоящему изобретению связывается с доменом I экстраклеточной части HER2, за счет чего достигается высокая эффективность лечения рака. 2 н. и 1 з.п. ф-лы, 4 ил., 2 табл., 8 пр.
Реферат
Область техники
Настоящее изобретение относится к новому антителу МАТ40 к человеческому рецептору эпидермальногофактора роста HER2/CD340 и к его применению для лечения рака у млекопитающих, включая человека.
Уровень техники
Разработка антител к доменам HER2/CD340 является актуальной задачей для терапии рака молочной железы. Установлено, что в 25-30% случаев рака молочной железы опухолевые клетки характеризуются повышенной экспрессией рецептора HER2. В настоящее время для терапии метастазирующих опухолей уже применяют препарат на основе моноклональных антител Герцептин. Однако большой процент случаев первичной и вторичной устойчивости к Герцептину свидетельствует о необходимости разработки дополнительных или альтернативных таргетных препаратов [1, 2].
Известны разработки антител для лечения рака молочной железы фирмы ДЖЕНЕНТЕК, ИНК. В патенте [3] описывается композиция для лечения рака, включающая основной вид антитела к HER2, которое связывается с доменом II в HER2.
Наиболее близкой к предмету изобретения является заявка США [4], в которой описано биспецифичное антитело к HER2 для применения в терапии рака. Данное антитело состоит из полипептидных лигандов, которые соединены линкером друг с другом. Первый полипептидный лиганд связывается с внеклеточным доменом I HER2, второй полипептидный лиганд связывается с внеклеточным доменом IV HER2.
Технической задачей данного изобретения является создание эффективного антитела для лечения рака молочной железы и расширения арсенала лекарственных средств для проведения специфической терапии рака.
Технический результат, обеспечивающий решение поставленной задачи, заключается в том, что за счет выбора области домена I HER2, с которой осуществляется взаимодействие антитела МАТ40, достигается высокая эффективность, которая аналогична применению Герцептина для лечения рака молочной железы.
Сущность изобретения
Одним из аспектов изобретения является антитело МАТ40, к человеческому рецептору эпидермального фактора роста HER2/CD340, которое связывается с доменом I для лечения рака молочной железы у млекопитающих, которое имеет аминокислотные последовательности вариабельной области тяжелой цепи SEQ ID NO: 2 и вариабельной области легкой цепи SEQ ID NO: 3.
В другом варианте осуществления изобретения рассматривается применение антитела МАТ40А в составе лекарственных средств для лечения рака, в том числе рака молочной железы, рака желудка и рака головного мозга.
Перечень фигур
На фиг. 1 представлен электрофоретический анализ образцов рекомбинантного белка Her2, где А - ДСН-электрофорез в восстанавливающих (1) и невосстанавливающих (2) условиях; Б - Анализ экспрессии Her2 в клетках-продуцентах через 2 сут (1-4), 4 сут (5-8), 6 сут (9-12), 8 сут (13-16), 10 сут (17-20), 12 сут (21-24); В - Анализ очистки рекомбинантного Her2: 1 - Her2-Fc; 2 - Her2-Fc после протеолиза фактором Ха; 3 - Her2 после очистки на колонке с протеин-G сефарозой.
На фиг. 2 представлена аминокислотная последовательность SEQ ID NO: 2 антитела МАТ40 вариабельной области тяжелой цепи HER2.
На фиг. 3 представлена аминокислотная последовательность SEQ ID NO: 3 антитела МАТ40 вариабельной области легкой цепи HER2.
На фиг. 4 представлены данные о противоопухолевой активности МАТ40 (столбец слева) и Герцептина (столбец справа) на клетках человеческой глиомы линии U251. Левые в паре столбцов - процент клеток, выживших после добавления 0,2 мг/мл МАТ40, Правые столбцы - процент клеток, выживших после добавления 0,2 мг/мл Герцептина. Культивирование клеток проводят в среде DMEM в присутствии 3,3%, 2,5% и 0,5% фетальной эмбриональной сыворотки (FBS).
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Her2/CD340-185 kDa трансмембранный рецептор с тирозинкиназной активностью, относящийся к семейству рецепторов эпидермального фактора роста [5, 6]. Основной особенностью Her2/CD340, определяющей его проонкогенные свойства, является способность активироваться без участия специфического лиганда. Рецептор может быть организован как в виде гомодимеров, так и взаимодействовать с другими членами семейства (Her1, Her3, Her4) [7]. Димеризация рецепторов приводит к автофосфорилированию тирозиновых остатков внутриклеточного домена и инициирует различные сигнальные процессы. Обнаружено несколько изоформ HER2/CD340. Самая длинная изоформа состоит 1255 а.о. (NM_004448, NP_004439). Первые 22 а.о. представляют сигнальную последовательность, внутриклеточный домен 686-1255 а.о. фосфорилирован по нескольким сайтам. Экстраклеточный домен 23-640 а.о. состоит из четырех субдоменов, гликозилирован в нескольких участках. Субдомен II участвует в образовании димерного комплекса. В отличие от других членов семейства субдомен I в молекуле HER2/CD340 находится в постоянном контакте с субдоменом III. Это взаимодействие обеспечивает «открытую» конформацию рецептора, необходимую для димеризации. Другим членам семейства для перехода в подобную конформацию необходим контакт с лигандом.
Другие изоформы Her2/CD340 представлены делеционными вариантами белка. Известна растворимая изоформа Her2/CD340, в которой отсутствуют трансмембранный и внутриклеточный части. Данный вариант белка выступает как конкурентный ингибитор трансмембранного рецептора. Наиболее известные ингибирующие антитела к HER2/CD340, Герцептин, взаимодействуют со IV доменом и Перьета блокируют II домен экстраклеточной части.
Настоящее изобретение основано на неожиданном наблюдении, что возможно получить антитело с высокой специфичностью и эффективностью при выборе сайтов (эпитопов) для связывания антитела с внеклеточным доменом I HER2/CD340. Для изготовления антитела разработан способ получения антитела МАТ40 к домену I HER2, который содержит аминокислотную последовательность вариабельной области тяжелой и легкой цепи. Основываясь на данных по исследованию эффективности противоопухолевой активности полученных антител МАТ40 in vitro на клетках человеческой глиомы линии U251, по сравнению с препаратом Герцептин можно предположить, что антитело МАТ40 проявит противоопухолевую активность в лекарственных средствах, применяемых для лечения рака при таких заболеваниях, как рак молочной железы, рак желудка или рак головного мозга.
Способ получения антитела МАТ40, специфически связывающего рецептор эпидермального фактора роста (HER2/ERBB2/neu/CD340), в том числе на поверхности опухолевой клетки, включает следующие этапы:
1) осуществляют выбор экстраклеточной части человеческого Her2 в области от 1 до 640 а.о.;
2) создают экспрессионный вектор для экспрессии рекомбинантного белка в виде гибридной молекулы, содержащей на N-конце сигнальную последовательность CD33 [8], а на С-конце Fc фрагмент IgG1 человека;
3) проверяют последовательность Her2, аннотированной в базе данных GenBank (NM_004448) секвенированием плазмиды Signal pIgplus - Her2;
4) осуществляют выбор клеточной культуры, трансфекцию клеток, наработку и очистку рекомбинантного Her2;
5) анализируют очищенные белковые препараты с помощью ДСН-ПААГ электрофореза;
6) проводят иммунизацию инбредных мышей линии balb/C с использованием Her2 в качестве иммуногена;
7) получают гибридомы методом слияния;
8) проводят анализ культуральных жидкостей на наличие Her2-специфических антител и отбирают кандидаты на дальнейшее моноклонирование;
9) определяют субдомены Her2, с которыми связываются полученные моноклональные антитела;
10) определяют нуклеотидную последовательность антител;
11) осуществляют наработку и очистку антитела МАТ40;
12) проверяют способность полученного антитела специфически узнавать белок HER2/ERBB2/neu как изолированном виде, так и находящийся на поверхности опухолевых клеток и противоопухолевую активность in vitro и на клетках человеческой глиомы линии U251.
Примеры конкретного осуществления предлагаемого изобретения.
Пример 1. Конструирование плазмидного вектора, кодирующего последовательность человеческого Her2
Для создания плазмидного вектора осуществляют выбор экстраклеточной части человеческого Her2 (1-640 а.о.), создают экспрессионный вектор для экспрессии рекомбинантного белка в виде гибридной молекулы, содержащей на N-конце сигнальную последовательность CD33, а на С-конце Fc фрагмент IgG1 человека; проверяют последовательность Her2, аннотированной в базе данных GenBank (NM_004448) секвенированием плазмиды Signal pIgplus - Her2.
В качестве антигена для иммунизации животных выбрали экстраклеточную часть человеческого рецептора эпидермального фактора роста HER2/CD340 (1-640 а.о.). Данная форма содержит все необходимые домены (эпитопы), для продукции специфических антител. Отсутствие трансмембранного домена облегчает процесс наработки белка в больших количествах в среде культивирования.
В качестве экспрессионного вектора использовали Signal Plus Ig (spIg). Вектор предназначен для экспрессии рекомбинантных белков в виде гибридных молекул, содержащих на N-конце сигнальную последовательность CD33, а на С-конце Fc фрагмент IgG1 человека. Сигнальная последовательность обеспечивает транспорт белка в среду культивирования, Fc фрагмент позволяет быстро и эффективно очистить белок из среды методом аффинной хроматографии. Линкер между целевым белком и Fc фрагментом содержит сайт для протеолитического фермента фактора Ха. Соответственно, в процессе очистки иммуноглобулиновый довесок может быть отщеплен от Her2.
Соответствие клонированного фрагмента последовательности Her2, аннотированной в базе данных GenBank (NM_004448), проверяли секвенированием плазмиды Signal pIgplus - Her2. Результаты секвенирования подтвердили, что последовательность Her2, клонированная в векторе Signal pIgplus, полностью соответствует фрагменту с 262 п.н. до 2181 п.н. последовательности (SEQ ID NO: 1) и кодирует экстраклеточную часть белка.
Таким образом, в результате был получен экспрессионный эукариотический вектор Signal pIgplus - Her2, кодирующий последовательность гибридного белка, состоящего из экстраклеточного домена Her2 и Fc-фрагмента IgG1 человека. Вектор наработан в количестве, достаточном для получения культуры клеток-продуцентов белка Her2-Fc.
Пример 2. Наработка и очистка рекомбинантного Her2 и анализ очищенных белковых препаратов с помощью ДСН-ПААГ электрофореза
Наработка рекомбинантного Her2 может быть осуществлена в организме животного, синтезирована химическим путем или проведена с помощью рекомбинантной экспрессии. Белок можно очистить с помощью любого метода, известного специалистам в данной области, применяемого для очистки белков, например с помощью хроматографии, путем центрифугирования или с помощью любой другой стандартной методики для очистки белков.
Для наработки рекомбинантного белка использовали культуру COS1 - фибробласты почки обезьяны Cercopithecus aethiops. Клеточную культуру инкубировали в термостатируемом СО2-инкубаторе при температуре +37°С и концентрации СО2 5,0%.
Трансфекцию клеток вектором Signal pIgplus - Her2 проводили с использованием реагента Turbofect (Fermentas) согласно прилагающейся к реагенту инструкции. После трансфекции заменяли культуральную жидкость на свежую ДМЕМ, содержащую 10% очищенной от антител ЭТС, ежедневно заменяли культуральную жидкость на свежую порцию среды. Пассажи клеток проводили с интервалом 2-3 дня.
Культуральную жидкость центрифугировали при 10 тыс. g 20 мин, затем фильтровали через фильтр с порами 0,22 мкм. Колонку с белком G (Объем - 1 мл, производитель - Pharmacia) уравновешивали десятью объемами фосфатно-солевого буфера (ФБР), следующего состава: 10 мМ Na2HPO4, 1,76 мМ KH2PO4, 2,7 мМ KCl, 137 мМ NaCl. Наносили 150 мл культуральной жидкости на колонку со скоростью 2 мл/мин. Промывали колонку пятью объемами ФБР. Рекомбинантный Her2 элюировали 100 мМ раствором глицина, рН 2,5. Собирали пять фракций по 0,5 мл. В каждую фракцию вносили 50 мкл 1М раствора Трис-HCl рН 9,0.
Препарат рекомбинантного Her2 диализовали против 0,15М раствора NaCl. Препарат концентрировали до конечной концентрации 0,8 мг/мл с помощью центрифужного концентратора Amicon Ultra-4, 10 кДа (Millipore).
Протеолитическое отщепление Fc фрагмента проводили с помощью коммерческого набора Factor Xa Cleavage Capture Kit (Novagen). Фактор Xa удаляли из реакционной смеси с помощью Xarrest™ агарозы в соответствии с инструкцией производителя. Проводили очистку смеси от Fc фрагмента с помощью аффинной хроматографии на колонке с протеин-G сефарозой, как описано выше.
Очищенные белковые препараты анализировали с помощью ДСН-ПААГ электрофореза.
На фиг. 1 представлены результаты ДСН-ПААГ электрофореза исследования. Видно, что рекомбинантный препарат гибридного белка Her2-Fc очищен от примесных белков (рисунок 3, образец A1). В условиях сохранения дисульфидных связей (рисунок 3 образец А2) белок находится в олигомерной форме. Также приведен сравнительный анализ экспрессии рекомбинантного белка через различные промежутки времени после трансфекции. Показано, что максимальный уровень экспрессии наблюдается на 8-10 сутки после трансфекции (образцы 13-16). В соответствии с рисунком посторонних примесей в препарате очищенного Her2 не обнаруживается, Молекулярный вес соответствует теоретическому (97-115 кДа) [9]. Выход белка составил 2 мг/л культуры.
Пример 3. Иммунизация животных с использованием Her2 в качестве иммуногена
Для получения моноклональных антител использовали инбредных мышей линии balb/C, сертифицированных на отсутствие специфических патогенов (spf-specific pathogen free), полученных из «Питомника лабораторных животных „Пущино"». Работу с животными проводили в строгом соответствии с законодательством Российской Федерации, положениями «Европейской конвенции о защите позвоночных животных, используемых для экспериментальных и других научных целей», требованиями и рекомендациями «Руководства по содержанию и использованию лабораторных животных». Животных содержали в специализированном помещении вивария Института теоретической и экспериментальной биофизики в режиме светового дня 12/12, постоянном наличии воды и специализированных кормов.
Для повышения иммунного ответа на введенный антиген использовали адъювант Фрейнда. Для первичной иммунизации использовали 1 мкг Her2 в эмульсии с полным адъювантом Фрейнда. Иммунизацию проводили по нескольким схемам:
- эмульсию объемом 0,4 мл вводили мышам асептически внутрибрюшинно;
- эмульсию объемом 0,2 мл вводили мышам асептически внутримышечно;
- эмульсию объемом 0,2 мл вводили мышам подкожно.
Для вторичной иммунизации использовали Her2 в эмульсии с неполным адъювантом Фрейнда. По сравнению с первой иммунизацией дозу антигена увеличили в 10 раз. Иммунизацию проводили внутрибрюшинно.
Пример 4. Получение гибридом методом слияния
Гибридомная технология известна с 1975 года. Классический метод заключается в гибридизации В лимфоцитов, синтезирующих антитела нужной специфичности, с опухолевой клеткой миеломного или плазмацитомного ряда. В результате образуется культура клеток, способных делиться неограниченное число раз и секретировать в окружающую среду моноклональные антитела. На базе гибридомной технологии уже получено огромное количество мышиных антител, используемых в научно-исследовательских и практических целях.
Все работы выполняли в стерильном боксовом помещении в ламинарном шкафу. Доставали из криобанка ампулу клеток мышиной плазмоцитомы Sp2/0 и размораживали в водяной бане на 37°С. Аккуратно переносили содержимое ампулы в 15-миллилитровую стерильную пробирку и медленно, каплями добавляли 9 мл подогретой среды 199, при этом интенсивно перемешивали содержимое пробирки. Чтобы обеспечить максимальный выход жизнеспособных клеток, эта процедуру выполняли в течение не менее 10 мин. Пассировали клетки при плотности не выше 300000/мл в течение по крайней мере одной недели с целью адаптировать клетки к сыворотке лота и подвести к среднелогарифмической стадии роста ко дню слияния. На день слияния готовили около 20 миллионов клеток плазмоцитомы. Отбирали кровь из хвостовой вены у иммунизированных мышей и определяли титр специфических антител. За 72 ч до проведения слияния выбранной мыши делали повторную внутрибрюшинную инъекцию 50 мкг Her2 в ФБР. За 48 ч повторяли инъекцию 50 мкг Her2 в ФБР. За 24 ч готовили фидерные клетки. Слияние клеток селезенки с клетками плазмоцитомы проводили при комнатной температуре в присутствии ПЭГ, растворенного в ДМСО. Замену среды повторяли каждые два дня. Через неделю после слияния готовили четыре 96-луночных планшета и два восьмилуночных стрипа для ИФА, сенсибилизированных антигеном Her2. Планшеты промывали дистиллированной водой и высушивали.
Пример 5. Анализ культуральных жидкостей на наличие Her2-специфических антител
Используя индивидуальные наконечники, с помощью восьмиканального автоматического дозатора из каждой лунки планшетов со слиянием отбирали по 100 мкл культуральной жидкости и переносили соответствующие лунки планшетов или стрипов с Her2. В качестве отрицательного контроля использовали моноклональное антитело LOB 3/11 против человеческого Fas (GeneTex), в качестве положительного контроля - смесь мышиных сывороточных антител против Her2 и проводили ИФА.
По результатам ИФА реактивности культуральных жидкостей превышали значения негативного контроля. Был сделан вывод, что слияние прошло с высоким выходом Her2-специфических гибридом, так, что в одной лунке оказалось 1 или более целевых, Her2-специфических гибридом. Поскольку планшеты оказались примерно одинакового качества, три из них были криоконсервированны.
Были отобраны 30 лунок кандидатов на дальнейшее моноклонирование. Выбор лунки определялся в пользу меньшего количества колоний, находящихся в лунке. В итоге было получено 12 индивидуальных гибридом, продуцирующих антитела, специфичных к Her2.
Препаративные количества моноклональных антител были получены из асцитных жидкостей мышей, привитых гибридомами. Для этого мышам линии BALB/c за 10 дней до введения клеток гибридом внутрибрюшинно вводили по 0,3 мл пристана для активации и привлечения макрофагов в перитонеальную полость. Затем внутрибрюшинно вводили по 1 миллиону клеток гибридом в 1 мл бессывороточной среды RPMI 1640. По мере развития опухоли мышей забивали и извлекали асцитную жидкость. Антитела подвергались очистке аффинной хроматографией на белок G сефарозе.
Пример 6. Определение субдомена Her2, с которым связываются полученные моноклональные антитела
В качестве антигена для иммунизации животных выбрали экстраклеточный домен человеческого Her2 (1-640 а.о.). Первые 22 а.о. представляют сигнальную последовательность, экстраклеточный домен 23-640 а.о. состоит из четырех субдоменов. Для выявления субдомена, к которому получены антитела, были сконструированы три плазмидных вектора, кодирующих различные субдомены экстраклеточной последовательности человеческого Her2. Первая конструкция содержит последовательность I и II субдоменов (1-355 а.о.), вторая III и IV субдоменов (353-640 а.о.) и третья II, III и IV субдоменов (178-640 а.о.).
В качестве экспрессионного вектора использовали Signal Plus Ig (spIg). Вектор предназначен для экспрессии рекомбинантных белков в виде гибридных молекул, содержащих на N-конце сигнальную последовательность CD33, а на С-конце Fc фрагмент IgG1 человека. Сигнальная последовательность обеспечивает транспорт белка в среду культивирования, Fc фрагмент позволяет быстро и эффективно очистить белок из среды методом аффинной хроматографии. Наработанные и очищенные рекомбинантные белки были проверены в иммунноферментом анализе с полученным моноклональным антителами, в качестве контроля нативности белков использовали продажные антитела к IV субдомену Her2 -Герцептин. Однозначно показано, что моноклональное антитело МАТ40 распознает I субдомен, в то время как другие антитела подобно Герцептину узнают IV субдомен.
Пример 7. Определение нуклеотидной последовательности антител
Амплификация кДНК цепей иммуноглобулинов из клеток гибридом, продуцирующих антитела, специфичные к Her2.
Фрагменты ДНК, кодирующие вариабельные области иммуноглобулинов мыши, амплифицировали в несколько этапов. На первом этапе проводили реакцию обратной транскрипции с использованием RevertAid обратной транскриптазы («Thermo Scientific))) согласно рекомендациям фирмы производителя. В качестве матрицы для синтеза кДНК использовали препараты тотальной РНК, выделенных из клеток гибридом. В качестве праймеров использовали специфические олигонуклеотиды, комплементарные к константным областям легкой и тяжелой цепей иммуноглобулинов мыши. Для синтеза кДНК вариабельной области тяжелой цепи иммуноглобулинов G мыши использовали праймер mGH (SEQ ID NO: 4) [10]
Для синтеза кДНК вариабельной области легкой цепи иммуноглобулинов мыши использовали праймеры mL1 (SEQ ID NO: 5)
и праймер mL2 (SEQ ID NO: 6)
Реакционная смесь объемом 20 мкл содержала: 1х буфер для RevertAid обратной транскриптазы, 1 мМ каждого дезоксинуклеозидтрифосфата, 5 мкг тотальной РНК, 20 ед. RiboLock ингибитора РНКаз («Thermo Scientific))), 100 пмоль специфического праймера и 200 ед. RevertAid обратной транскриптазы. Смесь, содержащую тотальную РНК, специфический праймер и дезоксинуклеозидтрифосфаты, последовательно прогревали при 95°С в течение 5 минут и 65°С в течение 5 минут, охлаждали на ледяной бане. К смеси добавляли буфер для RevertAid обратной транскриптазы RiboLock ингибитор РНКаз и RevertAid обратную транскриптазу. Реакционную смесь инкубировали при 50°С в течение 60 мин. Реакцию останавливали инкубацией реакционной смеси при 80°С в течение 10 мин.
На следующем этапе продукты обратной транскрипции использовали в качестве затравки для синтеза поли-дГ последовательности. Реакцию безматричного синтеза поли-дГ последовательности проводили с использованием терминальной дезоксинуклеозидтрансферазы («Thermo Scientific))). Реакционная смесь объемом 20 мкл содержала: 1х буфер для терминальной дезоксинуклеозидтрансферазы, 60 пмоль дГТФ, 30 ед. терминальной дезоксинуклеозид трансферазы и 2 мкл продуктов реакции обратной транскрипции. Реакционную смесь инкубировали при 37°С в течение 30 мин. Для инактивации фермента реакционную смесь инкубировали при 70°С в течение 10 мин.
На следующем этапе проводили полимеразную цепную реакцию с использованием «KOD Hot Start DNA Polymerase)) («Merck KGaA») согласно рекомендациям фирмы-производителя. Для амплификации фрагмента ДНК, кодирующего вариабельные области тяжелой цепи иммуноглобулинов мыши, использовали олигонуклеотиды Ad (SEQ ID NO: 7) [10]:
где D - A, G, Т; N - A, G, С, Т) и mGH (SEQ ID NO: 4). Для амплификации фрагмента ДНК, кодирующего вариабельные области легкой цепи иммуноглобулинов мыши, использовали олигонуклеотиды Ad (SEQ ID NO: 7) и mL1 (SEQ ID NO: 5) или mL2 (SEQ ID NO: 6).
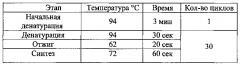
В качестве ДНК-матрицы использовали продукты реакции безматричного синтеза поли-дГ последовательности. Реакционная смесь объемом 25 мкл содержала 1х буфер для «KOD Hot Start DNA Polymerase)), по 8 пмоль каждого олигонулеотида, 200 нмоль каждого дезоксинуклеозидтрифосфата, 1,5 мМ MgSO4, 2 мкл продуктов реакции синтеза поли-дГ последовательности и 0,5 ед. «KOD Hot Start DNA Polymerase)). Амплификацию фрагмента ДНК проводили при следующих температурных режимах:
Продукты ПЦР анализировали электрофорезом в 0,8% агарозном геле. На фиг. 1 приведены данные электрофореза. Продукты полимеразной цепной реакции очищали с помощью набора «GeneJET PCR Purification Kit» («Thermo Scientific))) в соответствии с инструкцией производителя. ПЦР фрагменты элюировали в объеме 25 мкл.
Продукты амплификации использовали в качестве матричной ДНК в следующем раунде полимеразной цепной реакции. Для амплификации фрагмента ДНК, кодирующего вариабельные области тяжелой цепи иммуноглобулинов мыши, использовали олигонуклеотиды Ad1 (SEQ ID NO: 8) [10]:
и mGH (SEQ ID NO: 4). Для амплификации фрагмента ДНК, кодирующего вариабельные области легкой цепи иммуноглобулинов мыши, использовали олигонуклеотиды Ad1(SEQ ID NO: 8) и mL1 (SEQ ID NO: 5) или mL2 (SEQ ID NO: 6). Состав реакционной смеси и условия проведения реакции были аналогичными предыдущему этапу амплифиикации. Продукты ПЦР анализировали электрофорезом в 0,8% агарозном геле. Продукты полимеразной цепной реакции очищали с помощью набора «GeneJET PCR Purification Kit» («Thermo Scientific))) в соответствии с инструкцией производителя. ПЦР фрагменты элюировали в объеме 25 мкл.
Векторную ДНК pZErOR-2 гидролизовали эндонуклеазой рестрикции Есо32I («Thermo Scientific))) согласно рекомендациям фирмы производителя. Реакционная смесь объемом 20 мкл содержала: 1х буфер «R», 500 нг векторной ДНК pZErOR-2 и 10 ед. эндонуклеазы рестрикции Eco32I. Реакционную смесь инкубировали в течение 4 часов при 37°С, фермент инактивировали прогреванием реакционной смеси при 80°С в течение 20 мин. Продукты гидролиза очищали с помощью набора «GeneJET PCR Purification Kit» («Thermo Scientific))) в соответствии с инструкцией производителя. Фрагменты ДНК элюировали в объеме 25 мкл.
Линеаризованный вектор pZErOR-2 и ПЦР-фрашенты лигировали с использованием Т4 ДНК лигазы («Thermo Scientific))) согласно рекомендациям фирмы производителя. Реакционная смесь объемом 20 мкл содержала: 1х буфер для Т4 ДНК лигазы, 1 мМ АТФ, 1 ед. Т4 ДНК лигазы, 10 нг линеаризованного вектора pZErOR-2 и 500 нг ПЦР-фрагментов. Реакционную смесь инкубировали при 22°С в течение 2 часов.
Продуктами реакции лигирования трансформировали компетентные клетки Е.coli штамма ТОР10. Трансформацию клеток Е.coli проводили химическим методом: реакционную смесь добавляли к компетентным клеткам и инкубировали в течение 60 минут на ледяной бане. Клетки инкубировали на водяной бане при 42°С в течение 90 сек., охлаждали на ледяной бане в течение 15 мин. К клеткам добавляли 1 мл среды LB и инкубировали при 37°С в течение 60 мин. Трансформированные клетки высевали на чашки Петри с агаризованной средой LB, содержащей 30 мкг/мл канамицина. Клетки инкубировали при 37°С в течение 14-16 часов.
Для анализа колоний клеток Е.coli проводили полимеразную цепную реакцию с использованием Taq ДНК полимеразы («Thermo Scientific))) согласно рекомендациям фирмы производителя. Реакционная смесь объемом 25 мкл содержала 1х буфер для Taq ДНК полимеразы, 200 нмоль каждого дизоксинуклеозидтрифосфата, по 10 пмоль олигонуклеотидов m13r26 (SEQ ID NO: 9)
и m13f+9 (SEQ ID NO: 10)
и 2,5 ед. Taq ДНК полимеразы. В качестве матричной ДНК использовали суспендированные колонии клеток Е.coli в 5 мкл раствора 1% Тритона Х-100. Реакцию амплификации проводили при следующих условиях:
Продукты ПЦР анализировали электрофорезом в 0,8% агарозном геле. Из изолированных бактериальных колоний, содержащих рекомбинантные плазмиды, выделяли векторную ДНК, используя набор «GeneJET™ Plasmid Miniprep Kit» («Thermo Scientific))) согласно рекомендациям производителя. Для подтверждения получения запланированного рекомбинантного вектора проводили секвенирование клонированного фрагмента ДНК, используя олигонуклеотид m13r26 (SEQ ID NO: 9). [10].
На фиг. 2 представлена аминокислотная последовательность гипервариабельного участка тяжелой цепи антитела МАТ40 (SEQ ID NO: 2)
Участок вариабельного домена легкой цепи антитела, приведенный на фиг. 3, описывается следующей аминокислотной последовательностью (SEQ ID NO: 3)
Из-за того, что некоторые аминокислоты обладают высокой гомологией друг с другом, возможна модификация нуклеотидной последовательности фрагмента ДНК, кодирующего исходное антитело, например, посредством метода сайт-направленного мутагенеза, так что один или несколько аминокислотных остатков в определенном сайте будут заменены, вставлены или добавлены при условии сохранения активности антитела.
Пример 8. Проверка противоопухолевой активности полученных антител in vitro
Было проанализировано антипролиферативное действие антитела МАТ40 по сравнению с препаратом Герцептин. Результаты представлены на фиг. 4. Исследование проводилось на клеточной линии человеческой глиомы U251 с гиперэкспрессией HER2. Клетки высаживались в низкой плотности (30 т клеток/мл) в триплетах на 96-луночный планшет в среде, содержащей 10% сыворотки FCS. На следующий день среда заменялась на среду с низким содержанием сыворотки (1%), добавлялись различные концентрации тестируемых препаратов. Противоопухолевое действие оценивалось с помощью МТТ-метода. Для этого в каждую лунку добавляется 3-[4,5-диметилтиазолил-2-ел]-2,5-дифенилтетразолиум бромид (МТТ). Через 4 ч экспозиции при 37°С живые клетки восстанавливают желтый МТТ до темно-фиолетовых гранул формазана. Гранулы формазана растворяются в диметилсульфоксиде (ДМСО), количество восстановленного продукта измеряется фотометрически при длине волны 540 нм.
Таким образом, антитело МАТ40 блокирует пролиферацию клеточной линии человеческой глиомы U251 с гиперэкспрессией HER2 в концентрациях, сравнимых с концентрацией Герцептина.
Промышленное использование
В настоящем изобретении предлагается новое антитело МАТ40, которое специфическим образом связывается с HER2. Антитело МАТ40 сохраняет стабильность в процессе получения и использования in vivo. Антитела по настоящему изобретению нейтрализуют HER2 в биологических анализах, которые описаны в настоящей заявке на изобретение.
Описание, приведенное в настоящем изобретении, предназначено исключительно для описания конкретных осуществлений и не подразумевает ограничения сферы охвата настоящего изобретения, если не указано иное. Любые методы и материалы, аналогичные или идентичные приведенным в настоящем документе, могут использоваться в практическом применении настоящего изобретения для получения антитела МАТ40.
Новое антитело МАТ40, которое специфическим образом связывается с HER2, может найти терапевтическое применение для лечения рака, где рак представляет собой рак молочной железы, рак желудка или рак головного мозга. Высокая эффективность антитела МАТ40 позволяет повысить эффективность и сократить сроки лечения.
Литература
1. Nahta, R. HER2 therapy: Molecular mechanisms of trastuzumab resistance // Breast Cancer Research. - 2006. - Vol. 8. - No. 6. - P. 215-215.
2. Lavaud, P. Strategies to overcome trastuzumab resistance in HER2-overexpressing breast cancers: focus on new data from clinical trials // BMC Medicine. - 2014. - Vol. 12. - No. 1. - P. 132
3. Композиция антител к HER2: пат. РФ 2361880 / Као Юн-Сиан, Вандерлан М. 20.07.2009.
4. Bispecific HER2 ligands for cancer therapy: US patent Application №20150284463 / Tamaskovic R et al; 8.10.2015.
5. Gutierrez, С. HER 2: Biology, Detection, and Clinical Implications // Archives of pathology & laboratory medicine. - 2011. - Vol. 135. - №1. - P. 55-62.
6. Yarden, Y. Biology of HER2 and Its Importance in Breast Cancer // Oncology. - 2001. - Vol. 61. - suppl 2. - P. 1-13.
7. Rubin, I., Yarden Y. The basic biology of HER2 // Annals of oncology: official journal of the European Society for Medical Oncology / ESMO. - 2001. Vol. 12. - Suppl 1. P. S 3-8.
8. Garnache-Ottou F, Chaperot L, Biichle S, et al. Expression of the myeloid-associated marker CD33 is not an exclusive factor for leukemic plasmacytoid dendritic cells // Blood. - Vol. 105. - No. 3. - P. 1256-1264.
9. Carney, W.P. HER2 status is an important biomarker in guiding personalized HER2 therapy // Personalized Medicine. - 2005. - Vol. 2. - No. 4. - P. 317-324.
10. Ozawa T., Kishi H., and Muraguchi A. Amplification and analysis of cDNA generated from a single cell by 5'-RACE: application to isolation of antibody heavy and light chain variable gene sequences from single В cells // BioTechniques. - 2006. - Vol. 40. P. 469-478.
1. Антитело, которое связывается с доменом I экстраклеточной части рецептора эпидермального фактора роста HER2/CD340 для лечения рака молочной железы у млекопитающих, которое имеет аминокислотные последовательности вариабельной области тяжелой цепи SEQ ID NO: 2 и вариабельной области легкой цепи SEQ ID NO: 3.
2. Применение антитела по п. 1 для лечения рака с суперэкспрессией HER2.
3. Применение антитела по п. 2, где рак представляет собой рак молочной железы, рак желудка или рак головного мозга.