Производные 1,4-диоксида хиноксалин-2-карбонитрила, ингибирующие рост опухолевых клеток
Иллюстрации
Показать всеИзобретение относится к производным 1,4-диоксида хиноксалин-2-карбонитрила, соответствующим формуле:
,
а также фармацевтическим композициям на их основе. Технический результат: получены новые соединения, которые обладают антипролиферативной активностью и могут быть использованы для ингибирования роста опухолевых клеток. 3 н. и 6 з.п. ф-лы, 2 табл., 48 пр.
Реферат
Область техники
Изобретение относится к фармацевтической промышленности и касается производных 1,4-диоксида хиноксалин-2-карбонитрила, их структуры, методов получения и медицинского использования в качестве противоопухолевых агентов.
Уровень техники
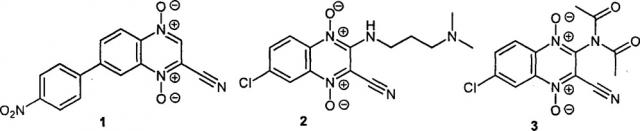
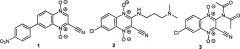
Известно, что некоторые производные 1,4-диоксида хиноксалин-2-карбонитрила проявляют высокую биологическую активность, в частности они активны в отношении возбудителей таких инфекционных заболеваний, как туберкулез, малярия, американский трипаносомоз (болезнь Шагаса) и др. В научной литературе имеются данные о том, что 1,4-диоксиды хиноксалин-2-карбонитрилы вызывают гибель опухолевых клеток. Например, описаны цитотоксические производные 3-незамещенного 1,4-диоксида хиноксалин-2-карбонитрила 1 [Monge A. et al. J. Med. Chem., 1995, 38, 4488.], а также 3-аминопроизводные (например соединения 2 и 3) [Monge A. et al. /. Med. Chem., 1995, 38, 1786; GB 2297089, 1996; Ismail M.M.F. et al. Eur. J. Med. Chem., 2010, 45, 2733], ряд из которых обладает большей селективностью действия на опухолевые клетки, находящиеся в условиях гипоксии, чем препарат сравнения тирапазамин
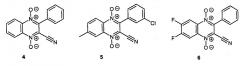
Недавно была обнаружена способность некоторых 1,4-диоксидов хиноксалин-2-карбонитрилов, имеющих липофильную арильную группу в положении 3 (например, соединения 4 и 5), более эффективно ингибировать рост опухолевых клеток в условиях гипоксии [Hu Y. et al. Molecules, 2012, 17, 9683]:
Общеизвестно, что использование противоопухолевых агентов может привести к снижению эффективности химиотерапии из-за развития у опухолевых клеток множественной лекарственной устойчивости (МЛУ), поэтому для практического применения перспективны цитотоксические производные, активных в отношении мультирезистентных опухолевых клеток. Одним из таких производных является недавно выявленный 1,4-диоксид 5,6-дифтор-3-фенилхиноксалин-2-карбонитрила (6), обладающий высокой активностью в отношении опухолевых клеток с активированными механизмами МЛУ [РСТ Int. Appl. WO 2015167350, 2015]. Однако недостатком описанных ранее противоопухолевых производных 1,4-диоксидов 3-арилхиноксалин-2-карбонитрилов 1, 4-6, является их низкая растворимость в фармацевтически приемлемых водных средах, что снижает потенциал их практического применения в медицине.
Раскрытие изобретения
Настоящее изобретение призвано получить противоопухолевые производные 1,4-диоксидов хиноксалин-2-карбонитрила, содержащие остаток диамина, повышающий растворимость соединений в фармацевтически приемлемых водных средах, обладающие высокой цитотоксичностью в отношении опухолевых клеток, находящихся в условиях гипоксии, а также в отношении опухолевых клеток с активированными механизмами МЛУ. Настоящее изобретение включает соединения, соответствующие формуле 7, их фармакологически приемлемые соли и композиции на их основе, пригодные для лечения онкологических заболеваний
где X - независимо означает арильный или гетарильный фрагмент, содержащий в своем составе 5 или 6 атомов, с одним или несколькими гетероатомами, выбранным из N, О и S, необязательно замещенный заместителем, выбранным из алкила, алкокси, алкилтио или галогена;
Y - независимо означает необязательно замещенный остаток диамина, непосредственно связанный одним из атомов азота с бензольным фрагментом хиноксалинового цикла. Примеры диаминов, пригодных для формирования структуры 7, включают без ограничения перечисленным диаминоалканы (например, без ограничения перечисленным 1,2-диаминоэтан, 1,3-диаминопропан), циклические диамины (например, без ограничения перечисленным пиперазин, спиропиперазин, 1,4-диазепин, 2,5-диазабицикло[2.2.1]гептан), амино- или аминоалкилпроизводные циклических аминов (например, без ограничения перечисленным 3-аминопиперидин, 4-аминопиперидин, 3-аминопирролидин), необязательно замещенные по атомам азота или углерода одним или несколькими заместителями, выбранным из алкила, арила, арилалкила, гидроксила, гидроксиалкила, галогеналкила;
Z - независимо означает атом водорода, галогена или алкила.
Очевидно, что некоторые диамины могут существовать в виде стереоизомеров. Настоящее изобретение включает все возможные стереоизомеры и геометрические изомеры, в виде оптически чистых соединений или смесей с различным содержанием оптических изомеров, включая их рацемические смеси.
Подразумевается, что кратные связи в хиноксалин-1,4-диоксидном ядре могут принимать различные резонансные формы, а заместители, находящиеся в хиноксалин-1,4-диоксидном ядре, если это возможно, могут находиться в различных таутомерных формах.
Настоящее изобретение относится также к фармацевтическим композициям, содержащим терапевтически эффективное количество, по меньшей мере, одного соединения формулы 7, или его фармацевтически приемлемых солей или сольватов.
Кроме того, настоящее изобретение относится к применению таких соединений в качестве терапевтически активных для лечения заболеваний человека, связанных с повышенной скоростью роста клеток (т.е. гиперпролиферацией), прежде всего онкологических заболеваний различного генеза, включая без ограничения перечисленным, карциномы, саркомы, меланомы, лимфомы, лейкемии и т.п. Также настоящее изобретение включает способ лечения, заключающийся во введении указанной выше фармацевтической композиции субъекту с заболеванием.
Соединения по настоящему изобретению могут быть получены различными способами. Описанные ниже схемы лишь иллюстрируют возможность синтеза заявленных структур. Исходные материалы и реагенты, которые используются при получении соединений формулы 7, являются коммерческими химическими соединениями, поставляемыми фирмами, такими, как Aldrich Chemical Co., или их можно получить методами, известными специалисту в данной области или описанными в литературе.
Если не указано иное, реакции, приведенные в описании заявки, предпочтительно проводят при атмосферном давлении от приблизительно -78°С до 180°С, более предпочтительно от 0°С до 120°С в инертном растворителе или без него.
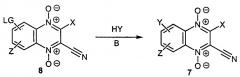
Одним из способов получения, заявленных в изобретении 1,4-диоксидов 3-арилхиноксалин-2-карбонитрилов, соответствующих формуле 7, является метод, основанном на замещении уходящих групп (LG) в положениях 6 или 7 диоксидов хиноксалин-2-карбонитрилов на остатки диаминов (Y) (схема А). При необходимости для достижения более полной конверсии исходных и/или более высокого выхода целевых продуктов при проведении реакции могут быть использованы дополнительные органические или неорганические основания (В), а для обеспечения селективности замещения, функциональные группы, содержащиеся в остатке диамина (Y) могут быть блокированы с помощью защитных групп с их последующим удалением.
Схема А
Исходные 1,4-диоксиды хиноксалин-2-карбонитрилы 8 могут быть получены различными методами, например, по методикам, описанным в литературе [РСТ Int. Appl. WO 2015167350, 2015; Torres E. et al. Eur. J. Med. Chem., 2013, 66, 324; Hu Y. et al. Molecules, 2012,17, 9683; Vicente E. et al. Eur. J. Med. Chem., 2008, 43, 1903; Zarranz B. et al. Arzneim. - Forsch. /Drug. Res., 2005, 55(12), 754].
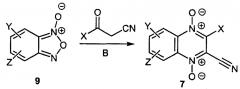
Другой возможный способ получения заявляемых соединений формулы 7, основан на реакции Бейрута бензофуроксанов 9, содержащих остаток диамина Y и ацилацетонитрилов в присутствии оснований В (схема Б). При необходимости для обеспечения селективности замещения, функциональные группы, содержащиеся в остатке диамина (Y) также могут быть блокированы с помощью защитных групп с их последующим удалением.
Схема Б
Исходные бензофуроксаны 9 и ацилацетонитрилы могут быть получены различными методами, описанными в литературе [Hu Y. et al. Molecules, 2012, 17, 9683].
Если не указано иное, термины, используемые в описании заявки и пунктах формулы изобретения, имеют значения, указанные ниже. Следует отметить, что, если не указано иное, используемые в описании и пунктах формулы формы единственного числа включают также формы множественного числа.
"Алкил" означает, если не указано иное, одновалентный насыщенный углеводородный радикал с прямой или разветвленной цепью или циклический радикал, включающий только атомы углерода и водорода и содержащий от 1 до включительно 6 атомов углерода. Примеры алкильных радикалов включают, без ограничения перечисленным, метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-бутил, пентил, н-гексил и т.п.
"Алкокси" означает радикал -OR, где R означает указанный выше алкильный радикал. Примеры алкоксирадикалов включают, без ограничения перечисленным, метокси, этокси, изопропокси, изобутокси и т.п.
"Амино" означает группы -NH2, -NHR1, -NR1R2, где R1 и R2 каждый независимо означает алкильные радикалы, указанные выше. Примеры аминорадикалов включают, без ограничения перечисленным, метиламино, этиламино, диметиламино, метилзтиламино, диэтиламино и т.п.
"Аминоалкил" означает алкильный радикал, указанный выше, замещенный аминогруппой, указанной выше. Примеры аминоалкильных радикалов включают, без ограничения перечисленным, аминометил, метиламинометил, диметиламинометил и т.п.
"Аминоалкиламино" означает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от двух до четырех атомов углерода, связанный с двумя аминогруппами, указанными выше, при условии, что к одному углеродному атому присоединено не более одной аминогруппы. Примеры аминоалкиламинорадикалов включают, без ограничения перечисленным, 2-аминоэтиламино, 2-(метиламино)этиламино, 2-(этиламино)этиламино, 2-[(2-гидроксиэтил)амино]этиламино, 2-аминопропиламино, 3-аминопропиламино и т.п.
"Арил" означает, если не указано иное, одновалентный циклический ароматический углеводородный радикал, содержащий один или более конденсированных циклов, из которых по меньшей мере один цикл является ароматическим, который необязательно замещен одним или несколькими заместителями, выбранным из группы, включающей алкил, алкилтио, алкокси, галоген, гидрокси, нитро, циано. Примеры арильных радикалов включают, без ограничения перечисленным, фенил, нафтил, бифенил, инданил, антрахинонил и т.п.
"Арилалкил" означает алкильный радикал, имеющий значения, указанные выше, замещенный в любом положении одним или несколькими необязательно замещенным арильным радикалом, указанным выше. Примеры арилалкильных радикалов включают, без ограничения перечисленным, бензил, бензгидрил, тритил, 2-фенилэтил, 3-фенилпропил, 2-фенилпропил и т.п.
"Галоген" означает радикал фтора, брома, хлора, йода.
"Галогеналкил" означает алкильный радикал, имеющий значения, указанные выше, замещенный в любом положении одним или более атомами галогена. Примеры галогеналкильных радикалов включают, без ограничения перечисленным, 1-фторметил, 1,2-дифторметил, трифторметил, 2,2,2-трифторэтил, хлорметил и т.п.
"Гетероарил" означает, если не указано иное, одновалентный ароматический карбоциклический радикал, содержащий один или более циклов, включающих в цикле один, два или три гетероатома (выбранных из N, О или S), и необязательно замещенный заместителем, выбранным из группы, включающей алкил, алкилтио, алкокси, галоген, гидрокси, нитро, циано. Примеры гетероарильных радикалов включают, без ограничения перечисленным, пирролил, тиофенил, фурил, имидазолил, оксазолил, тиазолил, пиразолил, пиранил, оксадиазолил, пиранил, пиридинил, хинолинил, изохинолинил, бензофурил, бензотиофенил, бензимидазолил, бензоксазолил, бензотиазолил, бензопиранил, индазолил, индолил, изоиндолил и т.п.
"Гидроксиалкил" означает алкильный радикал, указанный выше, замещенный одной или более, предпочтительно одной, двумя или тремя гидроксигруппами при условии, что к одному углеродному атому присоединено не более одной гидроксигруппы. Примеры гидроксиалкильных радикалов включают, без ограничения перечисленным, гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 2,3-дигидроксипропил и т.п.
"Диаминоалкан" означает насыщенный углеводород линейного строения, содержащий от двух до четырех атомов углерода, связанный с двумя аминогруппами, указанными выше, при условии, что к одному углеродному атому присоединено не более одной аминогруппы. Примеры диаминоалканов включают без ограничения перечисленным 1,2-диаминоэтан, 1,2-диметиламиноэтан, 2-метиламиноэтиламин, 2-диметиламиноэтиламин, 1,3-диаминопропан и т.п.
Термином "защитная группа" обозначается группа, подходящая для блокирования функциональной группы в условиях проведения реакции, как описано в литературе [Wuts P.G.M. Greene's Protective Groups in Organic Synthesis. J. Wiley & Sons, N.-J., 2014, 1360]. Пример таких групп для блокирования аминогруппы включает трет-бутоксикарбонил (Вое), адамантилоксикарбонильную (Adoc), флуоренилметилоксикарбонильную (Fmoc).
Термин "изомеры" означает соединения с одинаковой молекулярной формулой, но отличающиеся природой или последовательностью химических связей или пространственным расположением атомов. Изомеры, которые различаются пространственным расположением атомов, называются "стереоизомерами". Атом углерода, связанный с четырьмя разными заместителями, называется "хиральным центром".
"Инертный органический растворитель" означает растворитель, инертный в условиях описываемой в тексте реакции, включающий, например, бензол, толуол, ацетонитрил, тетрагидрофуран, N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон, диметилсульфоксид, сульфолан, хлороформ, дихлорметан, дихлорэтан, этилацетат, ацетон, метилэтилкетон, метанол, этанол, пропанол, изопропанол, трет-бутанол, диоксан, пиридин и т.п. Если не указано иное, растворители, использованные в реакциях по настоящему изобретению, являются инертными растворителями.
"Необязательный" или "необязательно" означает, что последующее событие или обстоятельство может произойти, но необязательно произойдет, и, что описание включает случаи, когда это событие или обстоятельство произойдет, и случаи, когда оно не произойдет. Например термин "необязательно замещенный" при использовании в связи с термином "арил", "фенил", "бензил", "бензоил", "гетероарил" или "гетероциклил" означает арил, фенил, бензил, бензоил, гетероарил или гетероциклил, который необязательно и независимо содержит от одного до четырех заместителей, предпочтительно один или два заместителя, выбранных из группы, включающей алкил, алкилтио, алкокси, галоген, гидрокси, нитро, циано и т.п.
"Сольваты" означает сольватированные формы, содержащие стехиометрическое или нестехиометрическое количество растворителя. Некоторые соединения способны удерживать в кристаллической решетке фиксированное количество молекул растворителя, образуя сольват. Гидраты образуются в том случае, если в качестве растворителя используется вода, а алкоголяты образуются в том случае, если растворителем является спирт.
"Субъект" означает млекопитающих, т.е. любого члена класса млекопитающих, включая, без ограничения перечисленным, человека, приматов, сельскохозяйственных животных, лабораторных животных и т.п., предпочтительно человека. Термин субъект не означает конкретный возраст или пол.
"Таутомеры" означает соединения, структуры которых отличаются пространственным расположением атомов, но находятся в равновесном состоянии. Соединения формулы 7 могут содержать группы, которые могут находиться в таутомерном равновесии. Подразумевается, что, если соединения формулы 7 могут существовать в таутомерных формах, то настоящее изобретение включает все таутомерные формы, а названия соединений не исключают любую таутомерную форму.
"Терапевтически эффективное количество" означает количество соединения, которое при введении субъекту для лечения патологического состояния является достаточным для оказания фармакологического действия при лечении патологического состояния субъекта. Терапевтически эффективное количество варьируется в зависимости от типа соединения, патологического состояния подлежащего лечению, тяжести болезни, возраста и относительного состояния здоровья субъекта, от способа и формы введения, от мнения лечащего врача или практикующего ветеринара и других факторов.
"Уходящая группа" означает группу, название которой обычно ассоциируется с ее использованием в синтетической органической химии, т.е. означает атом или группу, которая замещается в условиях реакции. Примеры уходящей группы включают, без ограничения перечисленным, галоген, алкан- или ариленсульфонилокси, (такие, как метансульфонилокси, этансульфонилокси, тиометил, бензолсульфонилокси, тозилокси и тиенилокси), алкокси, алкилтио, гидрокси и т.п.
"Фармакологическое действие" означает термин, используемый в описании заявки, включает результаты воздействия на субъект, при которых достигается предполагаемая цель терапии. Например, фармакологическое действие означает такие результаты воздействия, которые приводят к излечению или замедлению развития, предупреждению рецидива заболевания.
"Фармацевтически приемлемый" означает материал, который используют при получении фармацевтической композиции, и который обычно является безопасным, нетоксичным, безопасным в биологическом или ином отношении и включает материал, приемлемый как в ветеринарии, так и в фармацевтике.
"Фармацевтически приемлемые соли" соединения означают соли, которые являются фармацевтически приемлемыми и обладают необходимой фармакологической активностью исходного соединения. Такие соли включают кислотно-аддитивные соли неорганических кислот, таких, как хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота и т.п., или органических кислот, таких, как уксусная кислота, бензойная кислота, лимонная кислота, фумаровая кислота, глутаминовая кислота, гликолевая кислота, молочная кислота, малеиновая кислота, яблочная кислота, метансульфоновая кислота, пропионовая кислота, салициловая кислота, янтарная кислота, винная кислота, толуолсульфоновая кислота и т.п. Подразумевается, что фармацевтически приемлемые соли включают сольваты или кристаллические формы (полиморфные образования) указанной кислотно-аддитивной соли. Предпочтительными фармацевтически приемлемыми солями являются соли уксусной кислоты, соляной кислоты, серной кислоты, метансульфоновой кислоты, малеиновой кислоты, фосфорной кислоты, винной кислоты, лимонной кислоты, соли натрия, калия, кальция, цинка и магния.
"Хиральное соединение" означает соединение с одним или более хиральными центрами. Это соединение имеет две энантиомерные формы с противоположной хиральностью и может существовать как в виде отдельных энантиомеров, так и в виде смеси энантиомеров. Смесь, содержащая равные количества отдельных энантиомеров, называется "рацемической смесью". Соединения, содержащие более одного хирального центра, могут существовать в виде индивидуального диастереомера или в виде смеси диастереомеров, которая называется "диастереомерной смесью". При наличии хирального центра, стереизомеры можно охарактеризовать абсолютной конфигурацией (R или 5) этого хирального центра. Абсолютная конфигурация означает пространственное расположение заместителей у хирального центра. Указанные заместители, связанные с хиральным центром, классифицируются по правилу Кана, Ингольда и Прелога [Cahn et al., Angew. Chem., 1966, 75, 413].
"Циклический амин" означает циклическое, преимущественно насыщенное, соединение, в котором в образовании циклической системы участвует один атома азота. Примеры циклических аминов включают, без ограничения перечисленным, пиперидин, пирролидин, азепин и т.п.
"Циклический диамин" означает циклическое, преимущественно насыщенное, соединение, в котором в образовании циклической системы участвуют два атома азота. Примеры циклических диаминов включают, без ограничения перечисленным, пиперазин, спиропиперазин, 1,4-диазепин, 2,5-диазабицикло[2.2.1]гептан и т.п.
Типичные соединения по изобретению, способы их синтеза и биологическая активность приводятся в ряде примеров, описанных ниже.
Пример 1
1,4-Диоксид 6-(пиперазин-1-ил)-3-фенил-7-фторохиноксалин-2-карбонитрила гидрохлорид (7-1а)
К раствору 75 мг (0.25 ммоль) 1,4-диоксида 3-фенил-6,7-дифторохиноксалин-2-карбонитрила (8, X=C6H5, LG=F, Z=F, схема А), полученного по методу [РСТ Int. Appl. WO 2015167350, 2015], в тетрагидрофуране (4 мл) прибавляют JV-Boc-пиперазин (93 мг, 0.50 ммоль) и перемешивают реакционную смесь при 40°С. После завершения реакции (контроль по ТСХ) реакционную смесь экстрагируют этилацететом (2×10 мл), органический слой промывают водным (1%) раствором соляной кислоты (5 мл) и дистиллированной водой (10 мл), высушивают безводным сульфатом натрия и упаривают. Остаток очищают колоночной хроматографией (хлороформ-метанол, 50:1). Получают 103 мг (89%) Вос-производного 7-1а. Полупродукт растворяют в хлороформе (4 мл), прибавляют насыщенный раствор HCl в диэтиловом эфире (2 мл) и перемешивают 2 ч. Реакционную смесь упаривают, а остаток растворяют в кипящей дистиллированной воде (2 мл), горячий раствор фильтруют, прибавляют ацетон (10 мл) и диэтиловый эфир (10 мл) для осаждения продукта. Образовавшийся осадок отфильтровывают и промывают смесью ацетон-диэтиловый эфир (2:1, 10 мл), диэтиловым эфиром (2×10 мл) и гексаном (10 мл). Получают 64 мг (72%) 7-1а в виде оранжевого порошка. Т.пл. 215-217°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=340 нм, элюент: А - Н3РО4 (0.01 М) рН=2.6, В - MeCN; градиент В 20→60% (30 мин): Rt=11.5 мин, чистота 95.7%. УФ-спектр, нм (EtOH): 227, 235, 297, 341, 414. Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д., (J, Гц): 9.62 (с, 2Н, NH2+); 8.29 (д, J=12.8, 1Н, Н-8); 7.86 (д, J=8.1, 1H, Н-5); 7.74-7.71 (м, 2Н, С6Н5); 7.63-7.61 (м, 3Н, С6Н5); 3.63 (уш.м, 4Н, N(CH2)2); 3.30 (уш.м, 4Н, H2N(CH2)2). Найдено: m/z (ESI), 366.1355. [М+Н]+ C19H17FN5O2+. Вычислено: 366.1361.
Пример 2
1,4-Диоксид 7-(пиперазин-1-ил)-3-фенил-6-фторохиноксалин-2-карбонитрила гидрохлорид (7-1b)
К раствору 85 мг (0.25 ммоль) 6-(4-Вос-пиперазин-1-ил)-5-фторобензофуроксана (9, Z=F, Y=4-Вос-пиперазин-1-ил, схема Б) и 40 мг (0.275 ммоль) 3-оксо-3-фенилпропанонитрила (X=С6Н5, схема Б) в этаноле (4 мл) прибавляют карбонат калия (7 мг; 0.05 ммоль) и перемешивают реакционную смесь при комнатной температуре 12 ч. Выпавший осадок отфильтровывают и перекристаллизовывают из смеси петролейный эфир - хлороформ. Получают 73 мг (62%) Вос-производного 7-1b. Полупродукт растворяют в хлороформе (5 мл), прибавляют насыщенный раствор HCl в диэтиловом эфире (2 мл), перемешивают 30 мин и упаривают реакционную смесь. Остаток растворяют в кипящей дистиллированной воде (2 мл), горячий раствор фильтруют, прибавляют ацетон (10 мл) и диэтиловый эфир (10 мл) для осаждения продукта. Образовавшийся осадок отфильтровывают и промывают смесью ацетон-диэтиловый эфир (2:1, 10 мл), диэтиловым эфиром (2×10 мл) и гексаном (10 мл). Получают 56 мг (56%) 7-1b в виде оранжевого порошка. Т.пл. 233-235°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=294 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 15→70% (30 мин): Rt=15.6 мин, чистота 99.6%. УФ-спектр, нм (EtOH): 226, 236, 298, 341, 417. Спектр ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д., (Jt Гц): 9.41 (уш. с, 2Н, NH2+); 8.28 (д, J=13.0, 1Н, Н-5); 7.82 (д, J=8.3, 1Н, Н-8); 7.75-7.70 (м, 2Н, С6Н5); 7.64-7.59 (м, 3Н, С6Н5); 3.60-3.54 (уш.м, 4Н, N(CH2)2); 3.34-3.28 (уш.м, 4Н, H2N(CH2)2). Найдено: m/z (ESI), 366.1341. [М+Н]+ C19H17FN5O2+. Вычислено: 366.1361.
Пример 3
1,4-Диоксид 7-(пиперазин-1-ил)-3-фенилхиноксалин-2-карбонитрила гидрохлорид (7-1с)
К раствору 100 мг (0.30 ммоль) 1,4-диоксида 3-фенил-7-фторохиноксалин-2-карбонитрила (8, X=C6H5, LG=F, Z=Н, схема А), полученного по методу [Vicente Е. et al. Eur.J. Med. Chem., 2008, 43, 1903], и N-Boc-пиперазина (465 мг, 2.5 ммоль) в N,N-диметилформамиде (5 мл) прибавляют 4-(N,N-диметиламино)пиридин (2 мг, 0.02 ммоль), триэтиламин (30 мг, 0.3 ммоль) и перемешивают смесь при комнатной температуре 24 ч. После завершения реакции в реакционную смесь прибавляют ледяную воду (10 мл) и оставляют охлаждаться 1 ч. Выпавший осадок отфильтровывают, промывают водой и сушат. Получают 103 мг (89%) Вос-производного 7-1. Полупродукт растворяют в хлороформе (5 мл), прибавляют насыщенный раствор HCl в диэтиловом эфире (2 мл) и перемешивают 2 ч. Реакционную смесь упаривают, а остаток растворяют в кипящей дистиллированной воде (2 мл), горячий раствор фильтруют, прибавляют ацетон (20 мл) и диэтиловый эфир (10 мл) для осаждения продукта. Образовавшийся осадок отфильтровывают и промывают смесью ацетон-диэтиловый эфир (2:1, 10 мл), диэтиловым эфиром (2×10 мл) и гексаном (10 мл). Получают 58 мг (58%) 7-1 с в виде красных кристаллов. Т. пл. 163-165°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20→60% (30 мин): Rt=10.25 мин, чистота 95.0%. УФ-спектр, нм (EtOH): 223, 301, 367, 479. Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д., (J, Гц): 9.65 (уш.с, 1Н, NH2+); 8.32 (д, J=9.5, 1Н, Н-5); 7.88 (д, J=9.7, 1Н, Н-6); 7.79-7.44 (м, 6Н, С6Н5, Н-8); 3.78 (м, 4Н, СН2); 3.56-3.39 (м, 4Н, СН2). Найдено: m/z (ESI), 348.1442. [М+Н]+ C19H18N5O2+. Вычислено: 348.1455.
Пример 4
1,4-Диоксид 6-(пиперазин-1-ил)-3-фенил-7-хлорохиноксалин-2-карбонитрила гидрохлорид (7-1d)
К раствору 100 мг (0.30 ммоль) 1,4-диоксида 3-фенил-6,7-дихлорохиноксалин-2-карбонитрила (8, X=С6Н5, LG=Cl, Z=Cl, схема А), полученного по методу [Vicente Е. et al. Eur.J. Med. Chem., 2008, 43, 1903], в N,N-диметилформамиде (5 мл) прибавляют пиперазин (300 мг, 2.7 ммоль) и перемешивают смесь при комнатной температуре 2.5 ч. После завершения реакции (контроль по ТСХ) в реакционную смесь прибавляют ледяную воду (10 мл). Выпавший осадок отфильтровывают, промывают водой, сушат и перекристаллизовывают из ацетонитрила. Получают 101 мг (89%) свободного основания 7-1d. Полупродукт суспендируют в метаноле (5 мл), прибавляют насыщенный раствор HCl в диэтиловом эфире (2 мл) и перемешивают 30 мин. Смесь упаривают, а остаток растворяют в кипящей дистиллированной воде (2 мл), горячий раствор фильтруют, прибавляют ацетон (10 мл) и диэтиловый эфир (10 мл) для осаждения продукта. Образовавшийся осадок отфильтровывают и промывают смесью ацетон-диэтиловый эфир (2:1, 10 мл), затем диэтиловым эфиром (2×10 мл) и гексаном (10 мл). Получают 89 мг (79%) 7-1d в виде оранжевого порошка. Т. пл. 235-236°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - Н3РО4 (0.01 М) рН=2.6, В - MeCN; градиент В 20→60% (30 мин): Rt=13.3 мин, чистота 95.6%. УФ-спектр, нм (EtOH): 246, 302, 346, 414. Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 9.68 (уш.с, 2Н, NH2+); 8.53 (с, 1Н, Н-8); 7.96 (с, 1Н, Н-5); 7.75-7.61 (м, 5Н, С6Н5); 3.50 (уш.с, 4Н, СН2); 3.30 (уш.с, 4Н, СН2). Найдено: m/z (ESI), 382.1046. [М+Н]+ C19H17ClN5O2+. Вычислено: 382.1065.
Пример 5
1,4-Диоксид 3-(4-метоксифенил)-7-(пиперазин-1-ил)-6-фторохиноксалин-2-карбонитрила гидрохлорид (7-1е)
Получают по методике, аналогично приведенной в примере 2, из 6-(4-Вос-пиперазин-1-ил)-5-фторобензофуроксана (9, Z=F, Y=4-Вос-пиперазин-1-ил, схема Б) и 3-оксо-3-(4-метоксифенил)пропанонитрила (X=4-метоксифенил, схема Б). Выход 51%. Т. пл. 241-243°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=345 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20→60% (30 мин): Rt=12.5 мин, чистота 95.1%. УФ-спектр, нм (EtOH): 222, 279, 300, 347, 404. Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 9.51 (с, 2Н, +NH2); 8.26 (д, J=13.1, 1Н, Н-5); 7.80 (д, J=7.9, 1H, Н-8); 7.70 (д, J=8.5, 2Н, С6Н4); 7.15 (2Н, д, J=8.5, С6Н4); 3.86 (с, 3Н, СН3); 3.61-3.55 (уш.м, 4Н, СН2); 3.33-3.28 (уш.м, 4Н, СН2). Найдено: m/z (ESI), 396.1359. [М+Н]+ C20H19FN5O3+. Вычислено: 396.1466.
Пример 6
1,4-Диоксид 7-(пиперазин-1-ил)-6-фторо-3-(4-хлорофенил)хиноксалин-2-карбонитрила метансульфонат (7-1f)
К раствору 85 мг (0.25 ммоль) 6-(4-Вос-пиперазин-1-ил)-5-фторобензофуроксана (9, Z=F, Y=4-Вос-пиперазин-1-ил, схема Б) и 40 мг (0.275 ммоль) 3-оксо-3-(4-хлорофенил)пропанонитрила (X=4-хлорофенил, схема Б) в этаноле (4 мл) прибавляют карбонат калия (7 мг, 0.05 ммоль) и перемешивают реакционную смесь при комнатной температуре 12 ч. Выпавший осадок отфильтровывают и перекристаллизовывают из смеси петролейный эфир - хлороформ. Получают 80 мг (69%) Вос-производного 7-1f. Полупродукт растворяют в хлороформе (5 мл), прибавляют раствор метансульфокислоты (73 мг, 0.75 ммоль) в хлороформе (1 мл) и перемешивают 2 ч. Смесь упаривают, а остаток растворяют в кипящей дистиллированной воде (2 мл), горячий раствор фильтруют, прибавляют ацетон (10 мл) и диэтиловый эфир (10 мл) для осаждения продукта. Образовавшийся осадок отфильтровывают и промывают смесью ацетон-диэтиловый эфир (2:1, 10 мл), диэтиловым эфиром (2×10 мл) и гексаном (10 мл). Получают 72 мг (62%) 7-1f в виде оранжевого порошка. Т. пл. 245-247°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=280 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20→60% (30 мин): Rt=16.5 мин, чистота 97.2%. УФ-спектр, нм (EtOH): 219, 243, 283, 297, 367, 412. Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.99 (уш. с, 2Н, +NH2); 8.26 (д, J=12.9, 1Н, Н-5); 7.81 (д, J=8.1, 1Н, Н-8); 7.79-7.74 (м, 2Н, С6Н4); 7.73-7.68 (д, J=8.5, 2Н, СбН4); 3.60-3.54 (уш.м, 4Н, СН2); 3.45-3.40 (уш.м, 2Н, СН2); 3.33-3.30 (уш.м, 2Н, СН2); 2.40 (с, 3Н, CH3SO3-). Найдено: m/z (ESI), 400.0966. [М+Н]+ C19H16ClFN5O2+. Вычислено: 400.0971.
Пример 7
1,4-Диоксид 7-(пиперазин-1-ил)-3-(n-толил)-6-фторохиноксалин-2-карбонитрила метансульфонат (7-1g)
Получают по методике, аналогично приведенной в примере 6, из 6-(4-Вос-пиперазин-1-ил)-5-фторобензофуроксана (9, Z=F, Y=4-Вос-пиперазин-1-ил, схема Б) и 3-оксо-3-(n-толил)пропанонитрила (X=n-толил, схема Б). Выход 54%. Т. пл. 244-245°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=280 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 15→70% (35 мин): Rt=18.9 мин, чистота 98.5%. УФ-спектр, нм (EtOH): 218, 253, 281, 350, 439. Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.99 (уш. с, 2Н, +NH2); 8.25 (д, J=13.1, 1Н, Н-5); 7.79 (д, J=8.1, 1Н, Н-8); 7.63 (д, J=8.1, 2Н, С6Н4); 7.41 (д, 2Н, J=7.9, С6Н4); 3.60-3.51 (уш.м, 4Н, СН2); 3.40-3.32 (уш.м, 4Н, СН2); 2.42 (с, 3Н, CH3C6H4); 2.41 (с, 3Н, CH3SO3-). Найдено: m/z (ESI), 380.1501. [М+Н]+ C20H19FN5O2+. Вычислено: 380.1517.
Пример 8
1,4-Диоксид 7-(пиперазин-1-ил)-6-фторо-3-(3-фторофенил)хиноксалин-2-карбонитрила метансульфонат (7-1h)
Получают по методике, аналогично приведенной в примере 6, из 6-(4-Вос-пиперазин-1-ил)-5-фторобензофуроксана (9, Z=F, Y=4-Вос-пиперазин-1-ил, схема Б) и 3-оксо-3-(3-фторофенил)пропанонитрила (X=3-фторофенил, схема Б). Выход 48%. Т. пл. 240-241°С (с разл.). ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=280 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20→60% (30 мин): Rt=12.96 мин, чистота 98.0%. УФ-спектр, нм (EtOH): 221, 241, 286, 368. Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.95 (уш. с, 2Н, +NH2); 8.27 (д, J=13.1, 1Н, Н-5); 7.82 (д, J=8.1, 1Н, Н-8); 7.77-7.64 (м, 1Н, С6Н5); 7.62-7.54 (м, 2Н, С6Н5); 7.52-7.45 (м, 1H, С6Н5); 3.60-3.52 (уш.м, 4Н, СН2); 3.41-3.28 (уш.м, 4Н, СН2); 2.37 (с, 3Н, CH3SO3-). Найдено: m/z (ESI), 384.1263. [М+Н]+ C19H16F2N5O2+. Вычислено: 384.1267.
Пример 9
1,4-Диоксид 6-(пиперазин-1-ил)-3-(2-тиенил)-7-фторохиноксалин-2-карбонитрила гидрохлорид (7-1i)
Получают по методике, аналогично приведенной в примере 1, из 1,4-диоксида 3-(2-тиенил)-6,7-дифторохиноксалин-2-карбонитрила (8, X=С6Н5, LG=F, Z=F, схема А) и N-Boc-пиперазина. Выход 59%. Т. пл. >250°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4,6×250 мм, LW=340 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20→60% (30 мин): Rt=12.5 мин, чистота 95.3%. УФ-спектр, нм (EtOH): 225, 336, 415. Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д.: 8.46 (уш. с, 2Н, +NH2); 8.43-8.42 (уш.м, 1Н, C4H3S); 8.25 (д, J=12.6, 1H, Н-8); 8.12-8.09 (уш.м, 1Н, C4H3S); 7.90 (д, J=8.1, 1Н, Н-5); 7.43-7.40 (м, 1Н, C4H3S); 3.67-3.62 (уш.м, 4Н, СН2); 3.32-3.29 (уш.м, 4Н, СН2). Найдено: m/z (ESI), 380.1513. [М+Н]+ C20H19FN5O2+. Вычислено: 380.1517.
Пример 10
1,4-Диоксид 6-(пиперазин-1-ил)-3-(пиридин-4-ил)-7-фторохиноксалин-2-карбонитрила гидрохлорид (7-1j)
Получают по методике, аналогично приведенной в примере 1, из 1,4-диоксида 3-(пиридин-4-ил)-6,7-дифторохиноксалин-2-карбонитрила (8, X=С6Н5, LG=F, Z=F, схема А) и N-Boc-пиперазина. Выход 43%. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4,6×250 мм, LW=340 нм, элюент: А - H3PO4 (0.01 М) рН=2,6, В - MeCN; градиент В 20→60% (30 мин): Rt=10.3 мин, чистота 96.1%. УФ-спектр, нм (EtOH): 226, 338, 419. Найдено: m/z (ESI), 367.1319. [М+Н]+ C18H16FN6O2+. Вычислено: 367.1313.
Пример 11
1,4-Диоксид 7-(4-метилпиперазин-1-ил)-3-фенил-6-фторохиноксалин-2-карбонитрила гидрохлорид (7-2а)
К раствору 65 мг (0.25 ммоль) 6-(4-метилпиперазин-1-ил)-5-фторобензофуроксана (9, Z=F, Y=4-метилпиперазин-1-ил, схема Б) и 40 мг (0.275 ммоль) 3-оксо-3-фенилпропанонитрила (X=C6H5, схема Б) в этаноле (4 мл) прибавляют карбонат калия (7 мг; 0.05 ммоль) и перемешивают реакционную смесь при комнатной температуре в 12 ч. Выпавший осадок отфильтровывают и перекристаллизовывают из смеси петролейный эфир - хлороформ. Получают 72 мг (73%) свободного основания 7-2а. Продукт растворяют в хлороформе (4 мл). К полученному раствору прибавляют насыщенный раствор НСl в диэтиловом эфире (1 мл) и перемешивают в течение 30 минут. Реакционную смесь упаривают, а остаток растворяют в кипящей дистиллированной воде (2 мл), после чего к горячему раствору прибавляют ацетон (6 мл) и диэтиловый эфир (10 мл). Образовавшийся осадок отфильтровывают и промывают смесью ацетон-диэтиловый эфир (2-1, 10 мл), диэтиловым эфиром (2×10 мл) и гексаном (10 мл). Получают гидрохлорид 7-2а в виде оранжевого порошка. Выход 74 мг (66%). Т. пл. 218-220°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4,6×250 мм, LW=290 нм, элюент: А-H3PO4 (0.01 М) рН=2.6, В-MeCN; градиент В 15→70% (35 мин): Rt=15.7 мин, чистота 97.7%. УФ-спектр, нм (EtOH): 220, 242, 291, 359. Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 11.48 (уш.с, 1H, +NHCH3); 8.27 (д, J=13.1, 1Н, Н-5); 7.82 (д, J=8.1, 1Н, Н-8); 7.74-7.71 (м, 2Н, С6Н5); 7.61-7.60 (м, 3Н, С6Н5); 3.84 (уш.м, 2Н, СН2); 3.50 (уш.м, 4Н, СН2); 3.27 (уш.м, 2Н, СН2); 2.82 (с, 3Н, +NHCH3). Найдено: m/z (ESI), 380.1491. [М+Н]+ C20H19FN5O2+. Вычислено: 380.1517.
Пример 12
1,4-Диоксид 7-(4-метилпиперазин-1-ил)-3-фенилхиноксалин-2-карбонитрила гидрохлорид (7-2b)
Получают по методике, аналогично приведенной в примере 4, из 1,4-диоксида 3-фенил-7-фторохиноксалин-2-карбонитрила (8, X=C6H5, LG=F, Z=Н, схема А) и N-метилпиперазина. Выход 90%. Т. пл. 159-161°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20→60% (30 мин): Rt=10.6 мин, чистота 96.9%. УФ-спектр, нм (EtOH): 299, 368, 472. Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.30 (д, J=9.7, 1Н, Н-5); 7.87 (дд, J=9.7, J=2.7, 1Н, Н-6); 7.72 (тд, J=3.8, J=2.2, 2Н, С6Н5); 7.61-7.56 (м, 3Н, С6Н5, Н-8); 7.49 (д, J=2.69, 1H, С6Н5); 3.55-3.46 (м, 4Н, СН2); 2.50-2.44 (м, 4Н, СН2); 2.25 (с, 3Н, СН3). Найдено: m/z (ESI), 362.1636. [М+Н]+ C20H20N5O2+. Вычислено: 362.1612.
Пример 13
1,4-Диоксид 6-(4-метилпиперазин-1-ил)-3-фенил-7-хлорохиноксалин-2-карбонитрила гидрохлорид (7-2с)
Получают по методике, аналогично приведенной в примере 4, из 1,4-диоксида 3-фенил-6,7-дихлорохиноксалин-2-карбонитрила (8, X=С6Н5, LG=Cl, Z=Сl, схема А) и N-метилпиперазина. Выход 93%. Т. пл. 195-196°С. ВЭЖХ (колонка Kromasil-100-5-мкм С-18 4.6×250 мм, LW=300 нм, элюент: А - H3PO4 (0.01 М) рН=2.6, В - MeCN; градиент В 20→60% (30 мин): Rt=13.2 мин, чистота 95.7%. УФ-спектр, нм (EtOH): 228, 246, 302, 343, 414. Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 8.48 (с, 1Н, Н-8); 7.91 (с, 1Н, Н-5); 7.81-7.54 (м, 5Н, С6Н5); 3.25 (уш.с, 4Н, N-CH2); 2.58 (уш.с, 4Н, СН2); 2.26 (с, 3Н, СН3). Найдено: m/z (ESI), 396.1216. [М+Н]+ C20H19ClN5O2+. Вычислено: 396.1222.
Пример 14
1,4-Диоксид 6-(4-этилпиперазин-1-ил)-3-фенил-7-фторохиноксалин-2-карбонитрила гидрохлорид (7-3а)
К раствору 75 мг (0.25 ммоль) 1,4-диоксида 3-фенил-6,7-дифторохиноксалин-2-карбонитрила (8, X=С6Н5, LG=F, Z=F, схема А), п