Гидрохлориды 1-алкил-3-метил-8-пиперазино-7-(тиетанил-3)ксантина, проявляющие антитромботический эффект посредством блокирования рецепторов тромбоцитов гп iib-iiia
Иллюстрации
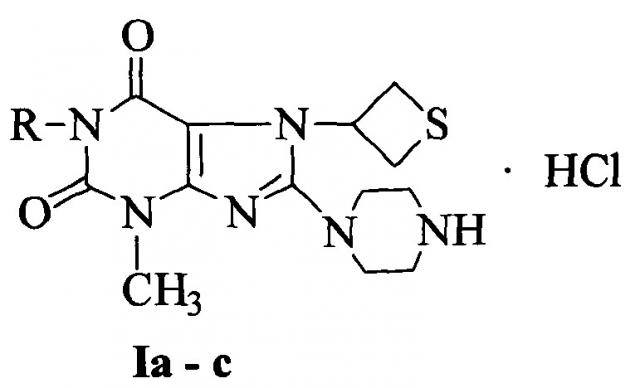
Показать всеИзобретение относится к гидрохлоридам 1-алкил-3-метил-8-пиперазино-7-(тиетанил-3)ксантина общей формулы:
,
где R=СН2-СН=CH2 (Ia), C3H7-изо (Ib), С5Н11-н (Ic), обладающим антитромботическим эффектом посредством блокирования рецепторов тромбоцитов ГП IIb-IIIa. 4 з.п. ф-лы, 2 табл., 5 пр.
Реферат
Предлагаемое изобретение относится к фармацевтической химии, фармакологии и медицине и может быть использовано для создания новых лекарственных средств, проявляющих антитромботический эффект посредством связывания с рецепторами тромбоцитов ГП IIb-IIIa.
В качестве антиагрегационного средства, блокирующего тромбоцитарные рецепторы ГП IIb-IIIa, известен разрешенный к клиническому применению L-цистеинамид, N6-(аминоиминометил)-N2-(3-меркапто-1-оксопропил)-L-лизилглицил-L-α-аспартил-L-триптофи-L-пропил-,циклический(1-6)-дисульфид (Эптифибатид, «Интегрилин», Glaxo Operations UK Limited, Великобритания) [A randomized trial assessing the impact of three different glycoprotein IIb/IIIa antagonists on glycoprotein IIb/IIIa platelet receptor inhibition and clinical endpoints in patients with acute coronary syndromes. Holmes LE, Gupta R, Rajendran S, Luu J, French JK, Juergens CP. Cardiovasc Ther. 2016 Jun 21. doi: 10.1111/1755-5922.12203.].
В качестве прототипа и препарата сравнения взят тирофибан ("Аграстат", Correvio, Великобритания, представляющий собой N-(бутилсульфаонил)-4-[4-(4-пиперидин)бутокси]-L-фенилаланина моногидрохлорид моногидрат, как единственный селективный непептидный синтетический блокатор рецепторов тромбоцитов GP IIb-IIIa, применяемый в медицинской практике [Vascul Pharmacol. 2016 Glycoprotein IIb/IIIa inhibitors: The resurgence of tirofiban. King S, Short M, Harmon С.].
Задачей изобретения является расширение арсенала биологически активных веществ, обладающих антитромботическим эффектом посредством блокирования рецепторов тромбоцитов ГП IIb-IIIa.
Технический результат - получение биологически активных веществ, проявляющих антитромботический эффект посредством блокирования рецепторов тромбоцитов ГП IIb-IIIa.
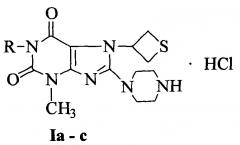
Сущность изобретения: гидрохлориды 1-алкил-3-метил-8-пиперазино-7-(тиетанил-3)ксантина общей формулы:
,
где R=СН2-СН=СН2 (Ia), С3Н7-изо (Ib), С5Н11-н (Ic),
проявляющие антитромботический эффект посредством блокирования рецепторов тромбоцитов ГП IIb-IIIa. При этом соединение Ia представляет собой 1-аллил-3-метил-8-пиперазино-7-(тиетанил-3)ксантина гидрохлорид; соединение Ib представляет собой 3-метил-8-пиперазино-1-изо-пропил-7-(тиетанил-3)ксантина гидрохлорид; соединение Ic представляет собой 3-метил-1-н-пентил-8-пиперазино-7-(тиетанил-3)ксантина гидрохлорид.
Заявляемые соединения синтезируют следующим образом.
Соединения Ia, b синтезировали из 8-бром-3-метил-7-(тиетанил-3)ксантина (Алкилирование производных ксантина и бензимидазола эпитиохлоргидрином / Ф.А. Халиуллин, В.А. Катаев, Ю.В. Строкин // Химия гетероцикл. соединений. - 1991. - №4. - С. 516-518.) в 3 стадии. Взаимодействием 8-бром-3-метил-7-(тиетанил-3)ксантина с бромистым аллилом или бромистым изо-пропилом синтезировали 1-аллил- и 1-изо-пропил-8-бром-3-метил-7-(тиетанил-3)ксантины. При кипячении последних с 3-кратным мольным избытком пиперазина гексагидрата в этаноле выделяли 8-пиперазинозамещенные 1-аллил- и 1-изо-пропил-3-метил-7-(тиетанил-3)ксантины соответственно, взаимодействием которых в среде диоксана с 5% раствором хлористого водорода в этаноле получали гидрохлориды 1-аллил- и 1-изо-пропил-3-метил-8-пиперазино-7-(тиетанил-3)ксантина.
Соединение Ic синтезировали из 8-бром-3-метил-1-н-пентил-7-(тиетанил-3)ксантина (Тиетанильная защита в синтезе 1-алкил-8-бром-3-метил-3,7-дигидро-1H-пурин-2,6-дионов / Ф.А. Халиуллин, Ю.В. Шабалина, P.M. Шaрафутдинов // ЖОрХ. - 2010. - Т. 46, №5. - С. 698-701.) реакцией с пиперазина гексагидратом в этаноле и последующим взаимодействием полученного 3-метил-1-н-пентил-8-пиперазино-7-(тиетанил-3)ксантина в среде диоксана с 5% раствором хлористого водорода в этаноле.
Оценка связывания с тромбоцитарными рецепторами ГП IIb-IIIa
Эффект связывания заявленных соединений и аграстата с тромбоцитарными рецепторами ГП IIb-IIIa определяли методом проточной цитометрии на крови здоровых доноров-мужчин в возрасте 18-24 лет. Исследование было одобрено этическим комитетом ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России (№2 от 17.10.2012). Информированное согласие было получено у всех участников исследования до забора крови. Взятие крови проводили из локтевой вены в стерильных условиях с использованием систем вакуумного забора крови BD Vacutainer® (Dickinson and Company, США). В качестве стабилизатора венозной крови использовали 3,8% раствор цитрата натрия в соотношении 9:1. Для исключения влияния других форменных элементов крови вся исследовательская работа была проведена на образцах обогащенной тромбоцитами плазмы (PRP). Образцы богатой тромбоцитами плазмы получали центрифугированием цитратной крови при 100 g в течение 10 минут. В работе использовалась центрифуга ОПН-3.02 (ОАО ТНК «ДАСТАН», Киргизия). Далее определяли эффект связывания с тромбоцитарными рецепторами ГП IIb-IIIa флюорисцентно-меченными антителами против CD61 и CD41a. Для этого вносили по 10 мкл PRP в пластиковые пробирки, разводили в 100 раз фосфатно-солевым буферным раствором (PBS). Образцы инкубировали 5 мин при комнатной температуре. После инкубации с исследуемым веществом и препаратами сравнения образцы PRP инкубировали 20 мин при комнатной температуре с моноклональными антителами CD41a, мечеными РЕ (фикоэритрином) и CD61, мечеными FITC (флюоресцеинизотиоционатом), (Becton Dickinson, США), согласно рекомендациям производителя. Цитофлюориметрический анализ проводили на приборе BD FACSCanto II (Becton Dickinson Immunocytometry Systems, США), используя программное обеспечение «FACSDiva». Параметры настройки прибора были одинаковы для всех измерений. Для каждой пробы собирали не менее 10000 событий. «Тромбоцитарное окно» выделяли по параметрам прямого (FCS) и малоугольного (SSC) светорассеяния в логарифмической шкале координат. Оценивали количество позитивных клеток (%) по CD41a и CD61. Результат представлен в IC50 - концентрации, связывающей 50% тромбоцитарных рецепторов ГП IIb-IIIa по интегринам CD41a и CD61. В качестве препаратов сравнения были выбраны: препарат прототип - N-(бутилсульфаонил)-4-[4-(4-пиперидин)бутокси]-L-фенилаланина моногидрохлорид моногидрат (Тирофибан, "Аграстат", Correvio, Великобритания) и L-цистеинамид, N6-(аминоиминометил)-N2-(3-меркапто-1-оксопропил)-L-лизилглицил-L-α-аспартил-L-триптофи-L-пропил-,циклический(1-6)-дисульфид (Эптифибатид, «Интегрилин», Glaxo Operations UK Limited, Великобритания).
Антитромботический эффект
Изучение антитромботического эффекта заявленных соединений и аграстата проведено на 120 белых беспородных мышах-самцах половозрелого возраста массой 20-22 г с использованием модели генерализованного коллаген-адреналинового тромбоза по методу DiMinno G. и Silver M.J. [DiMinno G.S. Mouse antithrombotic assay: a simple method for the evaluation of antithrombotic agents in vivo. Potentiation of antithrombotic activity by ethyl alcohol / G.S. DiMinno // J. Pharmacol. Exp. Ther. - 1983. - V. 225. - P. 57-60.]. В хвостовую вену мышей вводили смесь растворов коллагена и адреналина (0,5 мг/кг и 0,06 мг/кг соответственно). В качестве критерия эффективности исследуемых соединений отмечали количество выживших животных по сравнению с контрольной группой. За 1 час до моделирования тромбоэмболии внутривенно вводили исследуемые соединения в эквимолярных дозах. В качестве препаратов сравнения были выбраны: препарат прототип - N-(бутилсульфаонил)-4-[4-(4-пиперидин)бутокси]-L-фенилаланина моногидрохлорид моногидрат (Тирофибан, «Аграстат», Correvio, Великобритания) и L-цистеинамид, N6-(аминоиминометил)-N2-(3-меркапто-1-оксопропил)-L-лизилглицил-L-α-аспартил-L-триптофи-L-пропил-,циклический(1-6)-дисульфид (Эптифибатид, «Интегрилин», Glaxo Operations UK Limited, Великобритания). Контрольной группе мышей вводился физиологический раствор в аналогичных объемах.
Обработка результатов
Результаты исследования обработаны с применением статистического пакета Statistica 10,0 (StatSoft Inc, США). Проверку на нормальность распределения фактических данных выполняли с помощью критерия Шaпиро-Уилка. Для описания групп использованы медиана и межквартильный интервал. Дисперсионный анализ проводили с помощью критерия Краскела-Уоллиса. Критический уровень значимости р для статистических критериев принимали равным 0,05. Выживаемость оценивали от времени инъекции в хвостовую вену взвеси коллагена и адреналина до момента гибели или истечения 14 суток наблюдений. Анализ выживаемости проведен при помощи метода Каплана-Мейера. Различия выживаемости между группами оценивались при помощи критерия Вилкоксона. Величину IC50 заявленных соединений и препарата сравнения рассчитывали с помощью нелинейного фиттинга кривых, описывающих процент позитивных по CD41a и CD61 клеток по логарифмическому уравнению с 4 параметрами, используя программное обеспечение GraphPad Prism (GraphPad Software, Inc., США).
Пример 1. Синтез соединения Ia
К раствору 0,34 г (6 ммоль) гидроксида калия в 2 мл воды добавляют 1,59 г (5 ммоль) 8-бром-3-метил-7-(тиетанил-3)ксантина. В полученную смесь добавляют 40 мл диметилформамида и 0,73 г (6 ммоль) бромистого аллила. Перемешивают при комнатной температуре в течение 2 часов. К реакционной смеси добавляют 25 мл воды, осадок отфильтровывают, промывают водой, сушат. Получают 1,45 г (81%) 1-аллил-8-бром-3-метил-7-(тиетанил-3)ксантина. Очищают кристаллизацией из этанола. Белое кристаллическое вещество, растворяется в хлороформе, диметилформамиде, при нагревании в этаноле. Т.пл. 155-157°C.
Элементный анализ:
| Найдено, %: | С 40,6 Н 3,4 N 15,6 - C12H13BrN4O2S |
| Вычислено, %: | С 40,4 Н 3,7 N 15,7 |
ИК Спектр (KBr), ν, см-1: 1600, 1663, 1703 (С=С вал., C=N вал., С=O вал.).
Спектр ЯМР 1Н (300 МГц, DMFA-d7), δ, м.д.: 3,35-3,44 [2Н, м, S(CH)2], 3,47 (3H, с, 3-СН3), 4,28-4,37 [2Н, м, S(CH)2], 4,60 (2Н, д, 1-СН2, J 5,3 Гц), 5,11-5,23 (2Н, м, СН2), 5,86-6,05 (2Н, м, СН и 7-СН).
Раствор 1,18 г (3,3 ммоль) 1-аллил-8-бром-3-метил-7-(тиетанил-3)ксантина и 1,92 г (9,9 ммоль) пиперазина гексагидрата в 40 мл этанола кипятят в течение 5 часов. Охлаждают, фильтруют. Фильтрат упаривают в вакууме, к остатку прибавляют воду, осадок отфильтровывают, промывают водой, сушат. Получают 0,83 г (69%) 1-аллил-3-метил-8-пиперазино-7-(тиетанил-3)ксантина. Очищают кристаллизацией из этанола. Белое кристаллическое вещество, растворяется в хлороформе, диметилформамиде, при нагревании в этаноле. Т.пл. 159-161°C.
Элементный анализ:
| Найдено, %: | С 53,1 Н 6,5 N 23,0 - C16H22N6O2S |
| Вычислено, %: | С 53,0 Н 6,1 N 23,2 |
ИК Спектр (KBr), ν, см-1: 1610, 1655, 1699 (С=С вал., C=N вал, С=O вал.), 3317 (N-H вал.).
Спектр ЯМР 1Н (300 МГц, CDCl3), δ, м.д.: 3,10-3,18 [4Н, м, 4'-N(CH2)2], 3,19-3,33 [6Н, м, 1'-N(CH2)2 и S(CH)2], 3,52 (3H, с, 3-СН3), 4,31-4,40 [2Н, м, S(CH)2], 4,68 (2Н, д, 1-СН2, J 5,0 Гц), 5,13-5,32 (2Н, м, СН2), 5,43-5,56 (1Н, м, 7-СН), 5,89-6,03 (1Н, м, СН).
К раствору 0,36 г (1 ммоль) 1-аллил-3-метил-8-пиперазино-7-(тиетанил-3)ксантина в 10 мл диоксана добавляют 5% раствор хлористого водорода в этаноле до рН 2-3. Охлаждают, выпавший осадок отфильтровывают, промывают диоксаном, сушат. Получают 0,30 г (75%) соединения Ia. Т.пл. 253°C разл. (из этанола).
Элементный анализ:
| Найдено, %: | С 48,0 Н 5,9 N 21,0 - C16H23ClN6O2S |
| Вычислено, %: | С 48,2 Н 5,8 N 21,1 |
ИК Спектр (KBr), ν, см-1: 1607, 1655, 1707 (С=С вал, C=N вал, С=O вал.), 2430-2520, 2550-2860 (N+Н2 вал.).
Заявляемое соединение представляет собой белое кристаллическое вещество, растворимое в воде, диметилформамиде, при нагревании в этаноле, хлороформе.
Пример 2. Синтез соединения Ib
К раствору 0,67 г (12 ммоль) гидроксида калия в 4 мл воды добавляют 3,17 г (10 ммоль) 8-бром-3-метил-7-(тиетанил-3)ксантина. В полученную смесь добавляют 80 мл диметилформамида и 1,48 г (12 ммоль) бромистого изо-пропила. Перемешивают при температуре 50-55°C в течение 11 часов. Охлаждают, к реакционной смеси добавляют 160 мл 0,5% раствора гидроксида калия, осадок отфильтровывают, промывают водой, сушат. Получают 1,83 г (51%) 8-бром-3-метил-1-изо-пропил-7-(тиетанил-3)ксантина. Очищают кристаллизацией из этанола. Белое кристаллическое вещество, растворяется в хлороформе, диметилформамиде, при нагревании в этаноле. Т.пл. 189-190°C.
Элементный анализ:
| Найдено, %: | С 40,3 Н 4,5 N 15,3 - C12H15BrN4O2S |
| Вычислено, %: | С 40,1 Н 4,2 N 15,6 |
ИК Спектр (KBr), ν, см-1: 1612, 1653, 1700 (С=С вал, C=N вал, С=O вал.).
Спектр ЯМР 1Н (500,13 МГц; CDCl3), δ, м.д.: 1,51 [6Н, д, (СН3)2, J 6,9 Гц], 3,29-3,33 [2Н, м, S(CH)2], 3,50 (3H, с, 3-СН3), 4,37-4,42 [2Н, м, S(CH)2], 5,33-5,42 (1H, м, 1-СН), 5,99-6,07 (1Н, м, 7-СН).
Спектр ЯМР 13С (125,76 МГц; CDCl3), δ, м.д.: 19,42 [(СН3)2], 29,65 (3-СН3), 34,87 [S(CH2)2], 46,13 (1-СН), 52,90 (7-СН), 109,41 (С5), 126,67 (С8), 149,08 (С4), 150,65 (С2), 154,43 (С6).
Раствор 1,08 г (3 ммоль) 8-бром-3-метил-1-изо-пропил-7-(тиетанил-3)ксантина и 1,75 г (9 ммоль) пиперазина гексагидрата в 20 мл этанола кипятят в течение 5 часов. Охлаждают, фильтруют. Фильтрат упаривают в вакууме, к остатку прибавляют воду, осадок отфильтровывают, промывают водой, сушат. Получают 0,84 г (77%) 3-метил-8-пиперазино-1-изо-пропил-7-(тиетанил-3)ксантина. Очищают растворением в разведенной хлористоводородной кислоте, фильтрованием и осаждением из фильтрата 5% раствором гидроксида калия. Белое кристаллическое вещество, растворяется в хлороформе, диметилформамиде, этаноле. Т.пл. 197-198°C.
Элементный анализ:
| Найдено, %: | С 52,9 Н 6,9 N 23,0 - C16H24N6O2S |
| Вычислено, %: | С 52,7 Н 6,6 N 23,1 |
ИК Спектр (KBr), v, см-1: 1618, 1649, 1692 (С=С вал, C=N вал, С=O вал.), 3331 (N-Нвал.).
Спектр ЯМР 1Н (500,13 МГц; CDCl3), δ, м.д.: 1,48 [6Н, д, (СН3)2, J 6,9 Гц], 3,01-3,04 [4Н, м, 4'-N(CH2)2], 3,10-3,13 [4Н, м, 1'-N(CH2)2], 3,20-3,24 [2Н, м, S(CH)2], 3,45 (3H, с, 3-СН3), 4,31-4,36 [2Н, м, S(CH)2], 5,33-5,41 (1Н, м, 1-СН), 5,43-5,52 (1Н, м, 7-СН).
Спектр ЯМР 13С (125,76 МГц; CDCl3), δ, м.д.: 19,49 [(СН3)2], 29,46 (3-СН3), 35,68 [S(CH2)2], 45,29 (1-СН), 45,42 [4'-N(CH2)2], 51,39 (7-СН), 52,54 [1'-N(CH2)2], 105,41 (С5), 148,81 (С4), 151,21 (С2), 154,99 (С6), 156,20 (С8).
К раствору 0,84 г (2,3 ммоль) 3-метил-8-пиперазино-1-изо-пропил-7-(тиетанил-3)ксантина в 20 мл диоксана добавляют 5% раствор хлористого водорода в этаноле до рН 2-3. Охлаждают, выпавший осадок отфильтровывают, промывают диоксаном, сушат. Получают 0,50 г (54%) соединения Ib. Т.пл. 256°C разл. (из этанола).
Элементный анализ:
| Найдено, %: | С 48,3 Н 6,0 N 20,8 - C16H25ClN6O2S |
| Вычислено, %: | С 47,9 Н 6,3 N 21,0 |
ИК Спектр (KBr), ν, см-1: 1609, 1647, 1693 (С=С вал, C=N вал, С=O вал.), 2410-2500, 2560-2840 (N+Н2 вал.).
Заявляемое соединение представляет собой белое кристаллическое вещество, растворимое в воде, диметилформамиде, при нагревании в этаноле, хлороформе.
Пример 3. Синтез соединения Ic
Раствор 1,16 г (3 ммоль) 8-бром-3-метил-1-н-пентил-7-(тиетанил-3)ксантина и 1,75 г (9 ммоль) пиперазина гексагидрата в 40 мл этанола кипятят в течение 5 часов. Охлаждают, фильтруют. Фильтрат упаривают в вакууме, к остатку прибавляют воду, осадок отфильтровывают, промывают водой, сушат. Получают 1,01 г (86%) 3-метил-1-н-пентил-8-пиперазино-7-(тиетанил-3)ксантина. Очищают растворением в разведенной хлористоводородной кислоте, фильтрованием и осаждением из фильтрата 5% раствором гидроксида калия. Белое кристаллическое вещество, растворяется в хлороформе, диметилформамиде, этаноле. Т.пл. 112-114°C.
Элементный анализ:
| Найдено, %: | С 55,0 Н 7,0 N 21,8 - C18H28N6O2S |
| Вычислено, %: | С 55,1 Н 7,2 N 21,4 |
ИК Спектр (KBr), ν, см-1: 1611, 1653, 1699 (С=С вал, C=N вал, С=O вал.), 3328, 3341 (N-H вал.).
Спектр ЯМР 1Н (500,13 МГц; CDCl3), δ, м.д.: 0,89 (3H, т, СН3, J 6,6 Гц), 1,32-1,39 [4Н, м, (СН2)2], 1,63-1,69 (2Н, м, СН2), 3,16-3,29 [10Н, м, 2N(CH2)2 и S(CH)2], 3,51 (3H, с, 3-СН3), 4,01-4,06 (2Н, м, 1-СН2), 4,34-4,38 [2Н, м, S(CH)2], 5,45-5,53 (1H, м, 7-СН).
К раствору 0,39 г (1 ммоль) 3-метил-1-н-пентил-8-пиперазино-7-(тиетанил-3)ксантина в 10 мл диоксана добавляют 5% раствор хлористого водорода в этаноле до рН 2-3. Охлаждают, выпавший осадок отфильтровывают, промывают диоксаном, сушат. Получают 0,36 г (84%) соединения Ic. Т.пл. 250°C разл. (из этанола).
Элементный анализ:
| Найдено, %: | С 50,2 Н 6,9 N 19,2 - C18H29ClN6O2S |
| Вычислено, %: | С 50,4 Н 6,8 N 19,6 |
ИК Спектр (KBr), ν, см-1: 1611, 1659, 1705 (С=С вал, C=N вал, С=O вал.), 2410-2515, 2580-2825 (N+H2 вал.).
Заявляемое соединение представляет собой белое кристаллическое вещество, растворимое в воде, диметилформамиде, при нагревании в этаноле, хлороформе.
Пример 4
На модели генерализованного коллаген-адреналинового тромбоза заявленные соединения эффективнее аграстата и интегрилина препятствовали развитию тромбоза. Выживаемость в контрольной группе составила 0,0%, в группе интегрилина - 65,0%, аграстата - 75,5%, в группе заявленных соединений выживаемость не зависимо от соединения превышала 80% (таблица 1).
Пример 5
Применяемые в клинической практике препараты группы блокаторов рецепторов тромбоцитов ГП IIb-IIIa имеют разное сродство с этим рецептором по интегринам CD41a и CD61. Аграстат не обладает эффектом связывания с рецептором ГП IIb-IIIa по интегринам CD41a и CD61. Интегрилин связывается с рецептором только по интегрину CD41a. Все заявленные соединения имеют сродство с тромбоцитарным рецептором ГП IIb-IIIa по интегринам CD41a и CD61 (таблица 2).
Примечание: * - уровень статистической значимости различий признаков контрольной и опытной групп (p1<0,01).
Примечание: прочерк - связывание не происходит
1. Гидрохлориды 1-алкил-3-метил-8-пиперазино-7-(тиетанил-3)ксантина общей формулы:
,
где R = СН2-СН=СН2 (Ia), С3Н7-изо (Ib), С5Н11-н (Ic).
2. Соединение по п. 1, представляющее собой 1-аллил-3-метил-8-пиперазино-7-(тиетанил-3)ксантина гидрохлорид.
3. Соединение по п. 1, представляющее собой 3-метил-8-пиперазино-1-изо-пропил-7-(тиетанил-3)ксантина гидрохлорид.
4. Соединение по п. 1, представляющее собой 3-метил-1-н-пентил-8-пиперазино-7-(тиетанил-3)ксантина гидрохлорид.
5. Соединения по п. 1, обладающие антитромботическим эффектом посредством блокирования рецепторов тромбоцитов ГП IIb-IIIa.