Хиральные диацилгидразиновые лиганды для модуляции экспрессии экзогенных генов с помощью экдизон-рецепторного комплекса
Иллюстрации
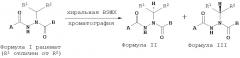
Показать всеИзобретение относится к способу получения энантиомерно обогащенного соединения, имеющего Формулу III, где А представляет собой (С1-С6)алкил-O-, фенил-(С1-С6)алкил-O-; арил, выбранный из фенила, нафтила, бензо[1,3]диоксола, 2,3-бензо[1,4]диоксина, который возможно замещен 1-3 заместителями, где заместители выбраны из (С1-С6)алкила, (С3-С7)циклоалкила, (С1-С6)алкил-O-, гидрокси, амино и галогено; или гетероарил, имеющий четыре или пять атомов углерода и один гетероатом, выбранный из кислорода, азота и серы, который возможно замещен 1-3 заместителями, где заместители выбраны из (С1-С6)алкила, (С3-С7)циклоалкила, (С1-С6)алкил-O-, гидрокси, амино и галогено; В представляет собой фенил, возможно замещенный 1-3 заместителями, где заместители выбраны из (С1-С6)алкила, (С3-С7)циклоалкила, (С1-С6)алкил-O-, гидрокси, амино и галогено; и R1 и R2 независимо представляют собой (С1-С6)алкил, фенил-(С1-С6)алкил-, гидрокси-(С1-С6)алкил, (С3-С7)циклоалкил, (С2-С6)алкенил или (С2-С6)алкинил; при условии, что R1 отличается от R2; где абсолютной конфигурацией асимметрического атома углерода, несущего R1 и R2, является R-конфигурация; включающему (а) взаимодействие ацилгидразина Формулы XI с кетоном Формулы XII с образованием соединения Формулы XIII, где R1 отличается от R2, (б) восстановление соединения Формулы XIII в присутствии хирального катализатора с образованием соединения Формулы R-XIV и (в) взаимодействие соединения Формулы R-XIV с соединением Формулы B-CO-LG, где LG представляет собой уходящую группу, с образованием соединения, имеющего Формулу III. Технический результат - хиральные диацилгидразиновые лиганды для модуляции генов. 5 з.п. ф-лы, 25 ил., 11 табл.
, ,
Реферат
Область изобретения
Настоящее изобретение относится к областям биотехнологии, генной инженерии и медицинской химии. В одном воплощении данное изобретение относится к области экспрессии гена. В другом воплощении данное изобретение относится к диацилгидразиновым лигандам и хиральным диацилгидразиновым лигандам для естественных и мутантных ядерных рецепторов и к их применению в индуцируемой системе генной экспрессии на основе ядерного рецептора, и к способам модуляции экспрессии гена в клетке-хозяине с использованием таких лигандов и индуцируемой системы экспрессии гена.
Предшествующий уровень техники
В данном описании изобретения упоминаются различные публикации, содержание которых включено посредством ссылки во всей их полноте. Однако цитирование любой ссылки в данном описании изобретения не следует истолковывать как признание того, что эта ссылка является "предшествующим уровнем техники" для настоящей заявки.
В области генной инженерии точное регулирование генной экспрессии является полезным средством для исследования, воздействия на развитие и регуляции развития и других физиологических процессов. Генная экспрессия является сложным биологическим процессом, включающим ряд специфических взаимодействий белок-белок. Для инициации генной экспрессии, так чтобы продуцировалась РНК, необходимая в качестве первой стадии белкового синтеза, активатор транскрипции нужно приблизить к промотору, который регулирует транскрипцию гена. Обычно сам активатор транскрипции ассоциирован с белком, имеющим по меньшей мере один ДНК-связывающий домен, который связывается с ДНК-связывающими сайтами, присутствующими в промоторных участках генов. Таким образом, для того, чтобы произошла экспрессия гена, белок, содержащий ДНК-связывающий домен и домен трансактивации, расположенный на должном расстоянии от ДНК-связывающего домена, необходимо привести в правильное положение в промоторном участке гена.
В традиционном трансгенном подходе используется специфический для данного типа клетки промотор для запуска экспрессии сконструированного трансгена. ДНК-конструкция, содержащая трансген, сначала встраивается в геном хозяина. При инициации посредством активатора транскрипции, в данном клеточном типе происходит экспрессия трансгена.
Другим средством регуляции экспрессии чужих генов в клетках являются индуцируемые промоторы. Примеры использования таких индуцируемых промоторов включают промотор PR1-a, прокариотические системы репрессор-оператор, системы иммуносупрессант-иммунофилин, и системы активации транскрипции высших эукариот, такие как системы рецепторов стероидных гормонов, и описаны ниже.
Промотор PR1-a из табака индуцируется в условиях системного ответа приобретенной устойчивости после патогенной атаки. Применение PR1-a может быть ограничено, так как он часто реагирует на эндогенные вещества и внешние факторы, такие как патогены, УФ-В излучение и загрязнения. Были описаны системы генной регуляции на основе промоторов, индуцируемые с помощью теплового шока, интерферона и тяжелых металлов (Wurn et al., Proc. Natl. Acad. Sci. USA 55: 5414-5418 (1986); Arnheiter et ah, Клетка 62: 51-61 (1990); Filmus et al, Nucleic Acids Research 20: 27550-27560 (1992)). Однако такие системы имеют ограничения из-за их воздействия на экспрессию генов-немишеней. Такие системы также являются ликовыми.
Прокариотические системы репрессор-оператор используют бактериальные репрессорные белки и уникальные операторные ДНК последовательности, с которым они связываются. Как тетрациклиновые ("Tet"), так и лактозные ("Lac") системы репрессор-оператор из бактерий Escherichia coli использовали в растениях и животных для контроля генной экспрессии. В Tet-системе тетрациклин связывается с репрессорным белком TetR, вызывая конформационное изменение, которое высвобождает репрессорный белок из оператора, что в результате позволяет произойти транскрипции. В Lac-системе lac-оперон активируется в ответ на присутствие лактозы или синтетических аналогов, таких как изопропил-b-O-тиогалактозид. К сожалению, использование таких систем ограничивается нестабильной химией лигандов, то есть тетрациклина и лактозы, их токсичностью, их естественным присутствием или относительно высоких уровней, требующихся для индукции или репрессии. По тем же причинам пригодность таких систем в животных ограничена.
Иммуносупрессивные молекулы, такие как FK506, рапамицин и циклоспорин А, могут связываться с иммунофилинами FKBP12, циклофилином и так далее. С использованием данной информации была разработана общая стратегия сближения любых двух белков просто путем помещения FK506 на каждый из двух белков или путем помещения FK506 на один и циклоспорина А на другой белок. Синтетический гомодимер FK506 (FK1012) или соединение, полученное путем слияния FK506-циклоспорина (FKCsA), затем можно использовать для индуцирования димеризации этих молекул (Spencer et al, Science 262: 1019-24 (1993); Belshaw et al, Proc Natl Acad Sci USA 93: 4604-7 (1996)). ДНК-связывающий домен Gal4, слитый с FKBP12, и активаторный домен VP16, слитый с циклофилином, и соединение FKCsA использовали, чтобы продемонстрировать гетеродимеризацию и активацию репортерного гена под контролем промотора, содержащего Gal4-связывающие сайты. К сожалению, такая система включает иммуносупрессанты, которые могут иметь нежелательные побочные эффекты и, вследствие этого, ограничивают ее использование для различных применений по переключению генов у млекопитающих.
Также были использованы системы активации транскрипции у высших эукариот, такие как системы рецепторов стероидных гормонов. Рецепторы стероидных гормонов являются членами суперсемейства ядерных рецепторов и обнаружены в клетках позвоночных и беспозвоночных. К сожалению, использование стероидных соединений, которые активируют рецепторы, для регуляции генной экспрессии, особенно у растений и млекопитающих, ограничено из-за их участия во многих других естественных биологических путях в таких организмах. С целью преодоления таких затруднений была разработана альтернативная система с использованием экдизоновых рецепторов насекомых (EcR).
Рост, линька и развитие насекомых регулируются стероидным гормоном экдизоном (гормоном линьки) и ювенильными гормонами (Dhadialla et al, Annu. Rev. Entomol. 43: 545-569 (1998)). Молекулярная мишень для экдизона у насекомых состоит по меньшей мере из экдизонового рецептор (EcR) и белок Ultraspiracle (USP). EcR является членом суперсемейства стероидных ядерных рецепторов, которые отличаются характерными ДНК- и лиганд-связывающими доменами, и доменом активации (Koelle et al, Клетка, 67: 59-71 (1991)). EcR-рецепторы восприимчивы к ряду стероидных соединений, таких как понастерон А и муристерон А. Недавно были описаны нестероидные соединения с экдистероидной агонистической активностью, включая имеющиеся в продаже инсектициды тебуфенозид и метоксифенозид, которые представляет на мировом рынке Rohm and Haas Company (смотри WO 96/27673 и US 5530028). Оба аналога имеют исключительные профили безопасности в других организмах.
Экдизоновые рецепторы насекомых (EcR) гетеродимеризуются с Ultraspiracle (USP), имеющимся у насекомых гомологом ретиноидного X-рецептора млекопитающих (RXR), и связывают экдистероиды и элементы ответа экдизоновых рецепторов и активируют транскрипцию реагирующих на экдизон генов. Комплексы EcR/USP/лиганд играют важные роли в развитии и размножении насекомого. EcR имеет пять модулярных доменов, домены A/B (трансактивация), С (ДНК-связывание, гетеродимеризация), D (шарнир, гетеродимеризация), E (связывание лиганда, гетеродимеризация и трансактивация) и F (трансактивация). Некоторые из этих доменов, такие как A/B, C и E, сохраняют свою функцию, когда они конденсированы с другими белками.
Строго регулируемые индуцируемые системы экспрессии гена или "переключатели гена" полезны для различных применений, таких как генная терапия, крупномасштабное продуцирование белков в клетках, высокопроизводительные клеточные скрининговые анализы, функциональная геномика и регулирование свойств трансгенных растений и животных.
В первом варианте генного переключателя на основе EcR использовали EcR Drosophila melanogaster (DmEcR) и RXR Mus musculus (MmRXR) и обнаружили, что эти рецепторы в присутствие стероида, понастерона A, трансактивируют репортерные гены в клеточных линиях млекопитающих и у трансгенных мышей (Christopherson et al, Proc. Natl. Acad. Sci. U.S.A. 59: 6314-6318 (1992); No et al., Proc. Natl. Acad. Sci. U.S.A. 95: 3346-3351 (1996)). Позже Suhr etal, Proc. Natl. Acad. Sci. 95: 7999-8004 (1998) показали, что нестероидный агонист экдизона, тебуфенозид, индуцировал высокий уровень трансактивации репортерных генов в клетках млекопитающих при помощи EcR Bombyx mori (BmEcR) в отсутствие экзогенного гетеродимерного партнера.
В WO 97/38117 и W099/58155 раскрыты способы модуляции экспрессии экзогенного гена, в которых ДНК-конструкция, содержащая экзогенный ген, и экдизоновый элемент ответа активируется с помощью второй ДНК-конструкции, содержащей экдизоновый рецептор, который в присутствие лиганда, вследствие этого, и возможно в присутствие рецептора, способного действовать в качестве молчащего партнера, связывается с экдизоновым элементом ответа для индуцирования экспрессии гена. Выбранные экдизоновые рецепторы выделяли из Drosophila melanogaster. Обычно такие системы требуют присутствия молчащего партнера, предпочтительно ретиноидного Х-рецептора (RXR), с целью обеспечения оптимальной активации. В клетках млекопитающих экдизоновый рецептор насекомых (EcR) гетеродимеризуются с ретиноидным X-рецептором (RXR) и регулирует экспрессию генов-мишеней лиганд-зависимым способом. В WO 99/02683 раскрыто, что экдизоновый рецептор, выделенный из шелкопряда Bombyx mori, функционирует в системах млекопитающих без необходимости в экзогенном димерном партнере.
В US 6265173 B1 раскрыто, что различные члены суперсемейства стероидных/тиреоидных рецепторов могут объединяться с рецептором Ultraspiracle из Drosophila melanogaster (USP) или его фрагментами, содержащими по меньшей мере домен димеризации USP, для использования в системе экспрессии гена. В US 5880333 раскрыта EcR Drosophila melanogaster и гетеродимерная система Ultraspiracle (USP), используемая в растениях, в которых домен трансактивации и ДНК-связывающий домен расположены на двух разных гибридных белках. К сожалению такие системы на основе USP являются конститутивными в животных клетках и, вследствие этого, являются неэффективными для регуляции экспрессии репортерного гена.
В каждом из данных случаев домен трансактивации и ДНК-связывающий домен (или в виде нативного EcR, как в WO 99/02683, или в виде модифицированного EcR, как в WO 97/38117) внедряли в одну молекулу, и другие гетеродимерные партнеры, или USP или RXR, использовали в их нативном состоянии.
Недостатки описанной выше системы регуляции гена, основанной на EcR, включают значительную фоновую активность в отсутствие лигандов и непригодность таких систем для использования как в растениях, так и у животных (смотри US 5880333). Следовательно, в данной области техники существует потребность в улучшенных системах на основе EcR для точного модуляции экспрессии экзогенных генов как в растениях, так и у животных. Такие улучшенные системы могли бы стать полезными для таких применений, как генная терапия, крупномасштабное продуцирование белков и антител, высокопроизводительные клеточные скрининговые анализы, функциональная геномика и регуляция свойств трансгенных животных. Для некоторых применений, таких как генная терапия, может быть желательно иметь индуцируемую систему экспрессии генов, которая хорошо реагирует на синтетические нестероидные лиганды и в то же время невосприимчива к естественным стероидам. Таким образом, улучшенные системы, которые являются простыми, компактными и зависят от лигандов, которые являются относительно недорогими, общедоступными и низкотоксичными для хозяина, будут полезны для регуляции биологических систем.
Недавно было показано, что индуцируемая система экспрессии гена на основе экдизонового рецептора, в которой домен трансактивации и ДНК-связывающий домен отделены друг от друга путем размещения их на двух разных белках, приводит к существенно сниженной фоновой активности в отсутствие лиганда и значительно повышенной активности по сравнению с фоном в присутствии лиганда (смотри WO 01/70816 A1, включенную в данное описание изобретения во всей ее полноте посредством ссылки). Такая двухгибридная система представляет собой значительно улучшенную индуцируемую систему модуляции экспрессии гена по сравнению с двумя системами, раскрытыми в заявках WO 97/38117 и WO 99/02683. В двухгибридной системе используется способность пары взаимодействующих белков приводить домен активации транскрипции в более благоприятное положение относительно ДНК-связывающего домена так, что когда ДНК-связывающий домен связывается с ДНК-связывающим сайтом гена, домен трансактивации более эффективно активирует промотор (смотри, например, US 5283173). Кратко, двухгибридная система экспрессии гена содержит две кассеты экспрессии гена; первую, кодирующую ДНК-связывающий домен, слитый с полипептидом ядерного рецептора, и вторую, кодирующую домен трансактивации, конденсированный с другим полипептидом ядерного рецептора. В присутствие лиганда взаимодействие первого полипептида со вторым полипептидом эффективно связывает ДНК-связывающий домен с доменом трансактивации. Фоновая активность в отсутствие лиганда существенно понижена, поскольку ДНК-связывающий домен и домен трансактивации находятся на двух разных молекулах.
Двухгибридная система также обеспечивает улучшенную чувствительность к нестероидным лигандам, например диацилгидразинам, по сравнению со стероидными лигандами, например понастероном А ("PonA") или муристероном A ("MurA"). Значит, по сравнению со стероидами, нестероидные лиганды обеспечивают более высокую активность при более низкой концентрации. Кроме того, так как трансактивация, основанная на переключателях генов EcR, часто является зависимой от клеточной линии, легче адаптировать системы генных переключателей для получения максимальной возможности трансактивации для каждого применения. Более того, в двухгибридной системе устранены некоторые побочные эффекты сверхэкспрессии RXR, которая часто имеет место при использовании в качестве партнера гетероди мерного рецептора немодифицированного RXR. В одной двухгибридной системе домен связывания нативной ДНК и домен трансактивации удалены из EcR или RXR, и в результате эти гибридные молекулы имеют меньшую возможность взаимодействовать с другими рецепторами стероидного гормона, присутствующего в клетке, что приводит к пониженным побочным эффектам. Дополнительные системы генных переключателей включают системы, описанные ниже, каждая из которых включена посредством ссылки: US 7091038; WO 2004078924; EP 1266015; US 20010044151; US 20020110861; US 20020119521; US 20040033600; US 20040197861; US 20040235097; US 20060020146; US 20040049437; US 20040096942; US 20050228016; US 20050266457; US 20060100416; WO 2001/70816; WO 2002/29075; WO 2002/066612; WO 2002/066613; WO 2002/066614; WO 2002/066615; WO 2005/108617; US 6258603; US 20050209283; US 20050228016; US 20060020146; EP 0965644; US 7304162; US 7304161; MX 234742; KR 10-0563143; AU 765306; AU 2002-248500; и AU 2002-306550.
С улучшением в системах регуляции генов на основе экдизоновых рецепторов происходит увеличение их использования для различных применений, что приводит к увеличению спроса на лиганды с более высокой активностью чем те, что имеются в наличие в настоящее время. В US 6258603 B1, US 2005/0209283 A1 и US 2006/0020146 A1 (и патентах, указанных здесь) раскрыты дибензоилгидразиновые лиганды. Однако существует потребность в дополнительных лигандах с улучшенными фармакологическими свойствами. Заявители обнаружили хиральные диацилгидразиновые лиганды, которые не были описаны ранее, и которые обладают неожиданной биологической активностью и способностью неожиданным образом модулировать экспрессию трансгенов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены диацилгидразиновые лиганды Формулы I и хиральные диацилгидразиновые лиганды Формул II или III для применения с индуцируемыми системами экспрессии гена на основе экдизоновых рецепторов, полезные для модуляции экспрессии представляющего интерес гена-мишени в клетке-хозяине. Хиральные диацилгидразиновые лиганды по изобретению являются энантиомерно обогащенными либо R- либо S-стереоизомером. Заявители обнаружили, что эти новые хиральные диацилгидразиновые лиганды удивительно эффективны. Таким образом, настоящее изобретение является полезным для таких применений как генная терапия, крупномасштабное продуцирование белков и антител, скрининговые клеточные анализы, функциональная геномика, протеомика, метоболомика и регуляция свойств трансгенных организмов, где является желательным контроль уровней экспрессии гена. Преимущество настоящего изобретения состоит в том, что в нем предлагаются средства регуляции генной экспрессии и адаптации уровней экспрессии для удовлетворения требованиям пользователя.
Настоящее изобретение относится к соединениям Формулы I
где
A представляет собой алкокси, арилалкилокси или арилокси;
B представляет собой возможно замещенный арил или возможно замещенный гетероарил; и
R1 и R2 независимо представляют собой возможно замещенный алкил, арилалкил, гидроксиалкил, галогеноалкил, возможно замещенный циклоалкил, возможно замещенный алкенил, возможно замещенный алкинил, возможно замещенный гетероцикл, возможно замещенный арил или возможно замещенный гетероарил;
или его фармацевтически приемлемые соли, гидраты, кристаллические формы или аморфные формы.
В другом воплощении настоящее изобретение относится к энантиомерно обогащенными соединениям Формулы II
где
A представляет собой алкокси, арилалкилокси, арилокси, арилалкил, возможно замещенный арил или возможно замещенный гетероарил;
B представляет собой возможно замещенный арил или возможно замещенный гетероарил; и
R’ и R” независимо представляют собой возможно замещенный алкил, арилалкил, гидроксиалкил, галогеноалкил, возможно замещенный циклоалкил, возможно замещенный алкенил, возможно замещенный алкинил, возможно замещенный гетероцикл, возможно замещенный арил или возможно замещенный гетероарил;
при условии, что R1 отличается от R2;
где абсолютной конфигурацией асимметрического атома углерода, несущего R1 и R2, преимущественно является S;
или его фармацевтически приемлемые соли, гидраты, кристаллические формы или аморфные формы.
В другом воплощении настоящее изобретение относится к энантиомерно обогащенным соединениям Формулы III
где
A представляет собой алкокси, арилалкилокси, арилокси, арилалкил, возможно замещенный арил или возможно замещенный гетероарил;
B представляет собой возможно замещенный арил или возможно замещенный гетероарил; и
R1 и R2 независимо представляют собой возможно замещенный алкил, арилалкил, гидроксиалкил, галогеноалкил, возможно замещенный циклоалкил, возможно замещенный алкенил, возможно замещенный алкинил, возможно замещенный гетероцикл, возможно замещенный арил или возможно замещенный гетероарил;
при условии, что R1 отличается от R2;
где абсолютной конфигурацией асимметрического атома углерода, несущего R1 и R2, преимущественно является R;
или его фармацевтически приемлемые соли, гидраты, кристаллические формы или аморфные формы.
В одном воплощении настоящее изобретение относится к N-(1-трет-бутил-бутил)-N’-(2-этил-3-метоксибензоил)гидразиду (R)-3,5-диметилбензойной кислоты, имеющему энантиомерный избыток по меньшей мере 95%, или к его фармацевтически приемлемой соли, гидрату, кристаллической форме или аморфной форме.
В другом воплощении настоящее изобретение относится к фармацевтической композиции, содержащей N-(1-трет-бутил-бутил)-N’-(2-этил-3-метоксибензоил)гидразид (R)-3,5-диметилбензойной кислоты, имеющий энантиомерный избыток по меньшей мере 95%, или его фармацевтически приемлемую соль, гидрат, его кристаллическую форму или аморфную форму.
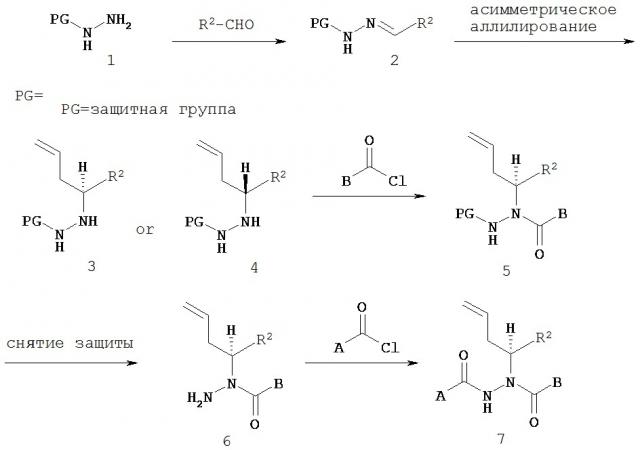
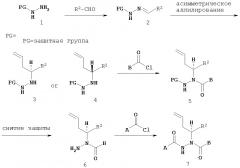
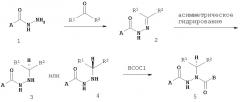
Настоящее изобретение также относится к способу получения соединения Формулы IV
где
A представляет собой арилалкил, возможно замещенный арил или возможно замещенный гетероарил;
B представляет собой возможно замещенный арил или возможно замещенный гетероарил;
R2 представляет собой возможно замещенный алкил, арилалкил, гидроксиалкил, галогеноалкил, возможно замещенный циклоалкил, возможно замещенный алкенил, возможно замещенный алкинил, возможно замещенный гетероцикл, возможно замещенный арил или возможно замещенный гетероарил;
при условии, что R2 отличается от -CR8R9CHR10CR11R12; и
R8, R9, R10, R11 и R12 независимо выбраны из водорода, алкила, циклоалкила, гетероцикла, арила или гетероарила;
где асимметрический атом углерода, к которому присоединен R2, является энантиомерно обогащенным либо R- либо S-изомером;
включающий:
а) взаимодействие соединения Формулы V
с соединением Формулы VI
где
X и Y независимо представляют собой О или NR, при этом R представляет собой алкил или арил;
Ca и Cb независимо представляют собой асимметрический атом углерода в S-конфигурации или асимметрический атом углерода в R-конфигурации;
R14 и R15 независимо представляют собой алкил или арил;
R13 представляет собой галоген, водород, алкил, алкокси или OSO2CF3;
R7 представляет собой алкил, арилалкил или арил; и
R2, R8, R9, R10, R11 и R12 имеют значения, указанные выше;
с образованием соединения Формулы VII;
б) восстановление соединения Формулы VII с образованием соединения Формулы VIII;
в) взаимодействие соединения Формулы VIII с соединением Формулы B-CO-LG, где LG представляет собой уходящую группу, с образованием соединения Формулы IX;
г) удаление группы R7CO2- из соединения Формулы IX с образованием соединения Формулы X; и
д) взаимодействие соединения Формулы Х с соединением Формулы A-CO-LG, где LG представляет собой уходящую группу, с образованием соединения Формулы IV.
Настоящее изобретение также относится к способам модуляции экспрессии гена в клетке-хозяине с использованием системы модуляции экспрессии гена с диацилгидразиновым лигандом Формулы I или хиральным диацилгидразиновым лигандом Формулы II или III.
В одном воплощении настоящее изобретение относится к применению диацилгидразинового лиганда Формулы I или хирального диацилгидразинового лиганда Формулы II или III в индуцируемой системе экспрессии гена, которая имеет пониженный уровень фоновой экспрессии гена и реагирует на субмикромолекулярные концентрации лиганда.
В другом воплощении изобретение относится к способу модуляции экспрессии гена-мишени в клетке-хозяине, где клетка-хозяин содержит первую кассету экспрессии гена, содержащую первый полинуклеотид, кодирующую первый полипептид, содержащую:
1) домен трансактивации;
2) ДНК-связывающий домен; и
3) лиганд-связывающий домен ядерного рецептора группы H;
и вторую кассету экспрессии гена, содержащую:
1) элемент ответа, способный связываться с указанным ДНК-связывающим доменом;
2) промотор, который активируется доменом трансактивации; и
3) указанный ген-мишень;
включающий приведение в контакт указанной клетки-хозяина с диацилгидразиновым лигандом Формулы I или хиральным диацилгидразиновым лигандом Формулы II или III; где экспрессия гена-мишени модулируется.
В другом воплощении изобретение относится к способу регуляции экспрессии эндогенного или гетерологичного гена в трансгенном субъекте, включающему приведение лиганда в контакт с экдизон-рецепторным комплексом в клетках субъекта, где клетки дополнительно содержат ДНК-связывающую последовательность для экдизон-рецепторного комплекса в комбинации с лигандом, и где образование комплекса «экдизон-рецепторный комплекс-лиганд-ДНК-связывающая последовательность» индуцирует экспрессию гена, и где лиганд представляет собой диацилгидразиновый лиганд Формулы I или хиральный диацилгидразиновый лиганд Формулы II или III; где экспрессию эндогенного или гетерологичного гена в трансгенном субъекте регулируется.
В другом воплощении изобретение относится к способу модуляции экспрессии гена-мишени в клетке-хозяине, включающему стадии:
а) введение в клетку-хозяина системы модуляции экспрессии гена, содержащей:
1) первую кассету экспрессии гена, которая способна экспрессироваться в клетке-хозяине, где указанная первая кассета экспрессии гена содержит полинуклеотидную последовательность, которая кодирует первый гибридный полипептид, содержащий:
(а) ДНК-связывающий домен, который распознает элемент ответа, ассоциированный с геном, экспрессия которого подлежит модулированию; и
(б) лиганд-связывающий домен экдизонового рецептора;
2) вторую кассету экспрессии гена, которая способна экспрессироваться в клетке-хозяине, где указанная вторая кассета экспрессии гена содержит полинуклеотидную последовательность, которая кодирует второй гибридный полипептид, содержащий:
(а) домен трансактивации; и
(б) лиганд-связывающий домен химерного ретиноидного X-рецептора; и
3) третью кассету экспрессии гена, которая способна экспрессироваться в клетке-хозяине, где указанная третья кассета экспрессии гена содержит полинуклеотидную последовательность, включающую:
(а) элемент ответа, распознаваемый с помощью ДНК-связывающего домена первого гибридного полипептида;
(б) промотор, который активируется доменом трансактивации второго гибридного полипептида; и
(в) ген, экспрессия которого подлежит модулированию; и
(б) введение в клетку-хозяина диацилгидразинового лиганда Формулы I или хирального диацилгидразинового лиганда Формулы II или III; где экспрессия гена в клетке-хозяине модулируется.
В другом воплощении настоящее изобретение относится к способу продуцирования полипептида, включающему стадии:
а) селекции клетки, которая является по существу нечувствительной к воздействию диацилгидразинового лиганда Формулы I или хирального диацилгидразинового лиганда Формулы II или III;
б) введения в клетку:
1) ДНК-конструкции, содержащей:
(а) экзогенный ген, кодирующий полипептид; и
(б) элемент ответа;
где ген находится под контролем элемента ответа; и
2) экдизон-рецепторного комплекса, содержащего:
(а) ДНК-связывающий домен, который связывается с элементом ответа;
(б) связывающий домен для указанного лиганда; и
(в) домен трансактивации; и
в) воздействие на клетку указанного лиганда; при котором продуцируется полипептид.
Данное воплощение изобретения обеспечивает преимущество контролируемого во времени продуцирования полипептида клеткой. Более того, в тех случаях, когда накопление такого полипептида может повредить клетку, экспрессия полипептида может быть ограничена короткими периодами воздействия на указанную клетку соединений по настоящему изобретению. Такой контроль является особенно важным, когда экзогенный ген представляет собой терапевтический ген. Терапевтические гены могут быть привлечены для продуцирования полипептидов, который контролирует необходимые функции, такие как продуцирование инсулина у пациентов с диабетом. Также они могут быть использованы для продуцирования повреждающих или даже летальных белков, таких как белки, летальные для раковых клеток. Также такой контроль может быть важным, когда уровни продуцируемого белка могут привести к метаболическому уменьшению роста или репродукции, например у трансгенных растений.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1: Схема конструкции-переключателя CVBE и репортерной конструкции 6XEcRE Lac Z. Фланкируют обе структуры длинные концевые повторы, G418 и пуромицин представляют собой селектируемые маркеры, CMV представляет собой цитомегаловирусный промотор, VBE представляет собой кодирующую последовательность для аминокислот 26-546 из EcR Bombyx mori, вставленную ниже домена трансактивации VP16, 6XEcRE представляет собой шесть копий экдизонового элемента ответа, lacZ кодирует репортерный фермента P-галактозидазу.
Фиг.2A-2B: Сравнение с помощью хиральной ВЭЖХ (A) рац-, (Б) (R)- и (B) (S)-3,5-диметилбензойной кислоты. N-(1-трет-бутил-бутил)-N’-(2,6-дихлорбензоил)гидразида.
Фиг.3: График, демонстрирующий сравнение in vivo рац-, (R)- и (S)-2-этил-3-метокси-бензойной кислоты N’-(1-трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида при индукции экспрессии гена терапевтической системы RheoSwitch® у мышей. Черные кружки представляют собой S-энантиомер, черные треугольники представляют собой рацемат, и белые кружки представляют собой R-энантиомер.
Фиг.4: Таблица серий образцов или рацемата и R-энантиомера 2-этил-3-метокси-бензойной кислоты N’-(трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида. Образцы R-энантиомера, полученного посредством быстрой кристаллизации/осаждения из смеси либо метанол/вода или толуол/гептан, давали одинаковую картину дифракции рентгеновских лучей на порошке (данные не показаны), и имели по существу одинаковую точку плавления ([толуол/гептан] 166,2-167,1°C, [CH3OH/H2O] 166,5-167,4°C) по сравнению друг с другом и по сравнению со стандартом, полученным при кристаллизации из CH3OH (165,1-166,5°C). Образцы двух отдельных препаратов рацемата, полученных при выпаривании метанола, показывали одинаковую точку плавления (170-171°C, 169-170°C) в пределах погрешности эксперимента и незначительные варьирования по чистоте.
Фиг.5: Таблица, показывающая распределение по размерам частиц микронизированного R-энантиомера 2-этил-3-метокси-бензойной кислоты N’-(1-трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида. D (об, 0,1): распределение по объему, 10% частиц имеют такой же размер или менее. D (об, 0,5): распределение по объему, 50% частиц имеют такой же размер или менее. D (об, 0.9): распределение по объему, 90% частиц имеют такой же размер или менее.
Фиг.6: Таблица, показывающая распределение по размерам частиц микронизированного рацемата 2-этил-3-метокси-бензойной кислоты N’-(1-трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида. D (об, 0,1): распределение по объему, 10% частиц имеют такой же размер или менее. D (об, 0,5): распределение по объему, 50% частиц имеют такой же размер или менее. D (об, 0.9): распределение по объему, 90% частиц имеют такой же размер или менее.
Фиг.7: Таблица, показывающая результаты анализа насыпной плотности и плотности утряски микронизированного рацемата и R-энантиомера 2-этил-3-метоксибензойной кислоты N’-(1-трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида.
Фиг.8: Данные термогравиметрического анализа/дифференциального термического анализа (TGA/DTA) (термическая кривая) микронизированного рацемата и R-энантиомера 2-этил-3-метокси-бензойной кислоты N’-(1-трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида демонстрируют разные кристаллические формы. Номера серий: REH-28-9-1 и REH-28-4-2; масса образца 7,71994 мг. Выход сигнала в единицах мкВ на мг образца (мкВ/мг); термогравиметрия - изменение массового процента образца (TG%). Оба вещества показали эндотермический эпизод в профиле DTA. Начальная температура для R-энантиомера (163,6°C) была значительно ниже, чем у рацемата (171,2°C). Теплота плавления R-энантиомера (59,8 мкВ.с/мг) также была значительно ниже чем у рацемата (80,8 мкВ.с/мг).
Фиг.9: Таблица, показывающая качественное исследование сравнительной растворимости рацемата и R-энантиомера 2-этил-3-метокси-бензойной кислоты N’-(трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида в фармацевтических эксципиентах.
Фиг.10: Таблица, показывающая результаты анализа термодинамического равновесия (90°C в течение 5 минут или указанного времени; обработка 2) с последующим охлаждением до комнатной температуры и затравки рацемата и R-энантиомера 2-этил-3-метокси-бензойной кислоты N’-(1-трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида в фармацевтических эксципиентах. Обработка 1 представляет собой результат перемешивания при комнатной температуре в течение ≤2,5 ч.
Фиг.11: Таблица, показывающая растворимость (мкМ) рацемата и R-энантиомера 2-этил-3-метокси-бензойной кислоты N’-(1-трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида в 20%-ном PEG 1000 в дистиллированной воде, рН 7,0.
Фиг.12: Таблица, показывающая растворимость рацемата и R-энантиомера N’-(1-трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида 2-этил-3-метокси-бензойной кислоты в водном полисорбате 80.
Фиг.13: Таблица, показывающая двустороннюю проникающую способность рацемата и R-энантиомера 2-этил-3-метокси-бензойной кислоты N’-(1-трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида через клеточные монослои Caco-2. aКлассификация проходимости: (Papp A-B)<1,0×10-6 см/с = НИЗКАЯ; (Papp A-B)>1,0×10-6 см/с = ВЫСОКАЯ; bЗначительная утечка: утечка >3,0 и (Papp B-A)>1,0×10-6 см/с.
Фиг.14: Таблица, показывающая проникающую способность рацемата и R-энантиомера 2-этил-3-метокси-бензойной кислоты N’-(1-трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида в клетки MDR1-MDCK. Классификация: A-B Papp>3,0 и соотношение утечки <3,0: высокое. А-В Papp>3,0 и 10 > отношение утечки >3,0: среднее. A-B Papp>3,0 и отношение утечки >10: низкое. A-B Papp<3,0: низкое.
Фиг.15: Таблица, показывающая стабильность рацемата и R-энантиомера 2-этил-3-метокси-бензойной кислоты N’-(1-трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида в микросомах печени человека.
Фиг.16: Таблица, показывающая режим дозирования рацемата и R-энантиомера 2-этил-3-метокси-бензойной кислоты N’-(1-трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида /препаратов Labrasol у мышей C57BL/6N:Crl. aBвeдeниe дозы в течение 9 суток (первые 18 самок/в группе,) или 12 суток (следующие 18 самок/в группе); bВключены в качестве возможных замен.
Фиг.17: Микроснимки немикронизированного и микронизированного образцов рацемата 2-этил-3-метокси-бензойной кислоты N’-(1-трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида. Указана шкала отсчета 50 микрон.
Фиг.18: Таблица, показывающая уровни рацемата и R-энантиомера 2-этил-3-метокси-бензойной кислоты N’-(1-трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида в сыворотке крови, введенного в Labrasol с 4 уровнями дозирования (3, 10, 30 и 50 мг/кг/сутки) через 9 суток после введения лекарственного средства и часов после суточной дозы.
Фиг.19: Таблица, показывающая уровни рацемата и R-энантиомера 2-зтил-3-метокси-бензойной кислоты N’-(1-трет-бутил-бутил)-N’-(3,5-диметилбензоил)гидразида в сыворотке крови, введенного в Labrasol с 4 уровнями дозирования (3, 10, 30 и 50 мг/кг/сутки) через 12 суток после введения лекарственного средства и часов после суточной дозы.
Фиг.20: Диаграммное изображение плазмиды pCMV/GEVY(DEF). Плазмида pCMV/GEV/Y(DEF) состоит из доменов D, Е и F из EcR Choristoneura fumiferana, содержащих мутации V390I/Y410E/E274V, слитых по направлению транскрипции с дрожжевой GAL4-DBD (aa 1-147) и помещенных под контроль промотора CMV и нижележащего SV40 сигнала полиаденилирования в векторе pBESfD (Promega Corporation, Madison, WI, USA). DEF-домены показанных EcR амплифицировали, используя праймеры, сконструированные на основе последовательностей из 20-25 нуклеотидов на 5’- и 3’-концах. Сайты ферментной рестрикции BamH I и Xba I были добавлены к праймерам 5’ и 3’ соответственно. Продукты ПЦР обрабатывали соответствующими ферментами рестрикции и клонировали в вектор pBIND.
Фиг.21: Диаграммное изображение вектора pCMV/VP16-Hs-LmRXR. Вектор pCMV/W16-Hs-LmRXR содержит химерный RXR из RXRP Homo sapiens (спираль 1-8 домена Е) и RXR Locusta migratoria (спираль 9-12 домена E), слитые по направлению транскрипции от домена активации VP16 и помещенные под контроль промотора CMV в вектор pBIND.
Фиг.22: Диаграммное изображение репортерного вектора p6xGAL4RE-TTR-SEAP. Индуцируемый репортерный вектор SEAP p6xGAL4RE-TTR-SEAP содержит репортерный ген щелочной фосфатазы, секретируемой человеком, помещенный под контроль индуцируемого промотора, состоящего из 6 копий элемент ответа Gal4, против направления транскрипции от транстиретинового промотора (TTR).
Фиг.23: Диаграммное изображение Ad-RTS-hlL-12, где участки E1 и E3 удалены, и компоненты RTS-IL12 компоненты замещают участок E1.
Фиг.