Способ выявления ингибиторов супрессии супрессора опухолевого роста pdcd4 в опухолевых клетках и генетическая конструкция plucpdcd4 для его осуществления
Иллюстрации
Показать всеПредложенная группа изобретений относится к области медицины. Предложены cпособ выявления ингибиторов супрессии супрессора опухолевого роста Pdcd4 в опухолевых клетках и генетическая конструкция pLucPdcd4, представляющая собой плазмиду, кодирующую репортерный белок, представляющий собой химеру люциферазы светлячка с белком Pdcd4 человека. Предложенная группа изобретений позволяет идентифицировать вещества с известной (рапамицин и LY294002) и предполагаемой (Compound 401) способностью ингибировать супрессию Pdcd4 в опухолевых клетках как ингибиторы супрессии супрессора опухолевого роста Pdcd4. 2 н. и 2 з.п. ф-лы, 4 ил., 6 пр.
Реферат
Область техники, к которому относится настоящее изобретение
Настоящее изобретение относится к области разработки лекарственных препаратов для лечения онкологических заболеваний, в частности, к выявлению веществ, потенциально обладающих противоопухолевой активностью.
Предшествующий уровень техники настоящего изобретения
Онкологические заболевания продолжают оставаться одной из основной причин смертности, несмотря на существенный прогресс в разработке новых стратегий их лечения. Одно из основных мест в лечении онкологических заболеваний занимают лекарственные препараты, представляющие собою малые молекулы. Основным требованием для таких малых молекул является их селективное токсическое воздействие на опухолевые клетки в сочетании с отсутствием токсического действия на нормальные клетки организма. Исторически мишенью первых препаратов с противоопухолевой активностью являлся процесс клеточного деления, одна из основных характеристик опухолевых клеток. В этом случае селективность воздействия на опухолевые клетки достигалась за счет дифференциации по принципу присутствия процесса клеточного деления. В настоящее время процесс клеточного деления продолжает оставаться одной из мишеней при разработке противоопухолевых препаратов с различными механизмами действия. Однако одна из современных тенденций в области разработки новых противоопухолевых препаратов состоит в специфическом воздействии на молекулярные мишени, существенные - и, желательно, уникальные - для опухолевых клеток. Такой рационально обоснованный подход основан на выявлении таких мишеней с последующим поиском малых молекул, специфически воздействующих на эту мишень.
Супрессор опухолевого роста Pdcd4 (Programmed cell death 4) часто ингибирован в опухолях различного происхождения, и снижение его уровня, как было показано в ряде исследований, способствует прогрессии злокачественного фенотипа опухоли (Вихрева и др., 2010). Это валидирует Pdcd4 как молекулярную мишень в области онкологии, и вещества, обладающие способностью восстанавливать уровень Pdcd4 в опухолевых клетках, потенциально обладают противоопухолевой активностью.
Сегодня известно несколько молекулярных механизмов, активация которых приводит к супрессии Pdcd4 в опухолевых клетках. К их числу относится индуцируемая PI3K-Akt-mTOR-S6K1 (фосфоиноситид-3-киназа - протеинкиназа Akt - протеинкиназа mTOR - S6 киназа-1) сигнальным путем протеолитическая деградация белка Pdcd4 (Dorrello et al., 2006), которой также способствует активация MEK-ERK сигнального пути (Schmid et al., 2008), микроРНК-зависимая дестабилизация транскрипта Pdcd4 и ингибирование трансляции с него (например, Lu et al., 2008; Asangani et al., 2008; Zhu et al., 2008), mTOR- и GSK3beta-зависимое ингибирование транскрипции гена Pdcd4 (Вихрева и др., 2012; Vikhreva et al., 2014). Таким образом, уровень белка Pdcd4 в клетке является интегральным индикатором активации сразу нескольких про-онкогенных процессов, что делает Pdcd4 привлекательным для использования в качестве индикатора при поиске веществ с противоопухолевой активностью, поскольку одновременно позволяет выявлять широкий спектр таких веществ в отношении их мишеней и механизмов действия.
Ранее была разработана тест-система для выявления веществ с противоопухолевой активностью, в качестве индикатора в которой использовалось ингибирование протеолитической деградации Pdcd4 (Blees et al., 2010), и которая является ближайшим аналогом настоящего изобретения. С использованием этой системы был выявлен ряд веществ, стабилизирующих белок Pdcd4 и воздействующих на различные внутриклеточные процессы (Blees et al., 2010; Grkovic et al., 2011; Zhao et al., 2011; Blees et al., 2012; Bajer et al., 2014; Grkovic et al., 2014; Schmid et al., 2016), что свидетельствует о перспективности концепции использования Pdcd4 как индикатора при поиске новых веществ с противоопухолевой активностью. Описанная ранее тест-система основана на продукции в клетках химеры репортерного белка, состоящего из люциферазы светлячка и фрагмента белка Pdcd4, определяющего его PI3K-Akt-mTOR-S6K1-зависимую деградацию. Однако эта тест-система обладает рядом недостатков, сужающих ее функциональность.
Во-первых, тест-система способна выявлять вещества, которые влияют (прямо или косвенно) только на процесс деградации белка Pdcd4, в то время как спектр молекулярных механизмов дерегуляции Pdcd4 в опухолевых клетках, как это изложено в деталях выше, значительно шире, в частности, включает ингибирование транскрипции.
Во-вторых, дизайн тест-системы предполагает химическую индукцию деградации Pdcd4 в клетках с мониторингом воздействия исследуемых веществ в отношении восстановления исходного уровня химерного репортерного белка. При этом снижение активности репортерного белка в результате воздействия индуктора протеолитической деградации Pdcd4 составляет около 50%, что существенно сужает динамический диапазон системы детекции, который еще больше снижается при установке порога отсечки, который составляет 50% от максимального эффекта (Blees et al., 2010), то есть полезный диапазон системы скрининга составляет 75%-100% от исходного уровня активности репортерного белка, что может приводить к ложно-негативным результатам.
В-третьих, описанная ранее тест-система, детектируя увеличение сигнала, хотя и исключает получение ложно-позитивных результатов при наличии неспецифической токсичности у исследуемого вещества, при сочетании такой токсичности со специфической активностью в отношении Pdcd4 не позволяет идентифицировать такие вещества как стабилизаторы Pdcd4 (Blees et al., 2010).
Перечисленные недостатки и ограничения описанной ранее тест-системы на основе Pdcd4 могут приводить к существенному числу ложно-негативных результатов, означающих не-идентификацию новых перспективных веществ с противоопухолевой активностью.
Раскрытие настоящего изобретения
Настоящее изобретение стало возможным на основании того факта, что супрессия Pdcd4 в опухолевых клетках имеет причинно-следственную связь с прогрессией опухоли, и, соответственно, вещества, воздействие которых восстанавливает уровень Pdcd4, обладают противоопухолевой активностью, а также на основании известного факта, что супрессия Pdcd4 в опухолевых клетках может происходить благодаря активации множественных различных про-онкогенных внутриклеточных процессов, являющихся мишенями при создании противоопухолевых препаратов, что делает Pdcd4 интегральным индикатором воздействия на них, позволяя единовременно выявлять по признаку восстановлению уровня Pdcd4 вещества, мишенями которых могут являться различные про-онкогенные внутриклеточные процессы.
Настоящее изобретение относится к способу идентификации веществ, воздействие которых приводит к восстановлению уровня белка Pdcd4 в опухолевых клетках, который, по сравнению с известным подобным способом (Blees et al., 2010), имеет ряд принципиальных отличий.
В настоящем изобретении предлагаемый способ позволяет детектировать воздействие, приводящее к отмене ингибирования транскрипционной активности промотора гена Pdcd4, а не только к стабилизации белка за счет супрессии его протеолитической деградации, что отличает настоящее изобретение от ближайшего аналога.
Существенным отличием предложенного способа является использование клеток, в которых уровень Pdcd4 уже снижен за счет активации про-онкогенных процессов. Это позволяет увеличить динамический диапазон отклика системы, и снизить вероятность получения ложно-негативных результатов.
В отличие от ближайшего аналога, предложенный способ позволяет выявлять вещества, способные увеличивать уровень Pdcd4, но обладающие (например, при используемой при проведении исследования концентрации) неспецифической токсичностью.
Как и в ближайшем аналоге, в настоящем изобретении использован принцип продукции репортерного белка (люциферазы светлячка), «слитого» с белком Pdcd4. За счет убиквитинилирования Pdcd4 химерный белок претерпевает деградацию, а при ингибировании процессов, приводящих к деградации Pdcd4, уровень химерного белка, содержащего функциональную люциферазу, увеличивается, что выражается в увеличении интенсивности люминесценции. В отличие от ближайшего аналога, в котором в химере с люциферазой использован фрагмент белка Pdcd4, определяющий его деградацию, в настоящем изобретении химерный белок включает практически полноразмерный (без первых 15 аминокислотных остатков) белок Pdcd4.
Принципиальным отличием от ближайшего аналога в настоящем изобретении является использование второго репортерного белка с конститутивной экспрессией. В качестве такого белка была выбрана часто используемая для этих целей в паре с люциферазой светлячка люцифераза Renilla, экспрессия которой контролируется конститутивным промотором тимидинкиназы вируса простого герпеса первого типа. Введение второго репортерного белка с конститутивной экспрессией, являющееся общепринятым приемом, позволяет соотносить активность химерного репортерного белка с активностью второго репортерного белка, которая не должна специфически изменяться в результате воздействия исследуемых веществ. В частности, такое воплощение изобретения, предполагающее нормировку сигнала химерного репортерного белка на конститутивный сигнал второго репортерного белка, позволяет проводить коррекцию на присутствие у исследуемых веществ неспецифической токсичности, и, тем самым, избегать получения обусловленных ею ложно-отрицательных результатов.
На основании вышесказанного, ключевыми составляющими, позволяющими реализовать настоящее изобретение, являются (1) линия опухолевых клеток, в которых уровень Pdcd4 снижен за счет про-онкогенных процессов, приводящих к одновременной индукции убиквитин-зависимой деградации белка Pdcd4 и ингибированию активности промотора гена Pdcd4, и (2) генетическая конструкция, кодирующая репортерный белок, состоящий из химеры люциферазы светлячка и белка Pdcd4, продукция которого контролируется фрагментом 5'-области гена Pdcd4 человека, содержащим цис-действующие элементы, опосредующие супрессию транскрипции гена Pdcd4 в опухолевых клетках.
Из существующего уровня техники (Vikhreva et al., 2014) известно, что ингибирование транскрипции гена Pdcd4 наблюдается в клетках линий рака легкого Calu-I и NCI-H1299. Поэтому эти две клеточные линии могут использоваться для осуществления настоящего изобретения при условии, что в них в наблюдаемую супрессию Pdcd4 также вносит вклад убиквитин-зависимая протеолитическая деградация белка Pdcd4. Поскольку известно, что убиквитин-зависимая протеолитическая деградация белка Pdcd4 определяется PI3K-Akt-mTOR-S6K1-зависимым фосфорилированием серина-67 белка Pdcd4, что создает условия для его убиквитинилирования, соответствие конкретной линии клеток поставленному условию может быть проверено путем исследования увеличения уровня белка Pdcd4 в ответ на ингибирование одного из компонентов этого сигнального пути. Однако, поскольку ингибиторы mTOR, как известно, приводят к активации транскрипции гена Pdcd4 в этих клетках (Vikhreva et al., 2014), исследование изменения уровня эндогенного белка Pdcd4 в клетках в ответ на обработку ингибиторами PI3K-Akt-mTOR-S6K1 сигнального пути не позволяет сделать вывод об изменении именно стабильности белка. Поэтому для определения пригодности клеточной линии для осуществления настоящего изобретения следует использовать анализ изменения количества экзогенного белка Pdcd4, находящегося под контролем конститутивного промотора. Для возможности отличия экзогенного белка от эндогенного, стандартно применяется принцип слияния экзогенного белка с небольшим эпитопом для его детекции или с другим белком. В последнем случае так же часто используется в качестве партнера для образования химерного белка белки, обладающие собственной активностью. В этом случае изменение количества белка может отслеживаться по изменению такой активности. В частности, широко используется для этих целей белок люцифераза светлячка. Описанный подход может быть применен для определения конкретной линии клеток для практической реализации настоящего изобретения. Поскольку клетки линии NCI-H1299 не обеспечивают увеличения интенсивности люминесценции при продукции в них химерного белка, состоящего из люциферазы светлячка и белка Pdcd4, продукция которого контролируется конститутивным промотором, в ответ на воздействие ингибитора mTOR рапамицина, а клетки линии Calu-I обеспечивают ее, то, в соответствии с одним из вариантов осуществления настоящего изобретения, в качестве опухолевых клеток, в которых уровень эндогенного белка Pdcd4 снижен из-за супрессии транскрипции гена Pdcd4 и убиквитин-зависимой протеолитической деградации белка Pdcd4, могут применяться клетки линии Calu-I.
Второй ключевой составляющей, позволяющей реализовать настоящее изобретение, является генетическая конструкция, кодирующая репортерный белок, состоящий из химеры люциферазы светлячка и белка Pdcd4, продукция которого контролируется фрагментом 5'-области гена Pdcd4 человека, содержащим цис-действующие элементы, опосредующие супрессию транскрипции гена Pdcd4. Структурные элементы генетической конструкции (фрагмент 5'-области гена Pdcd4 человека, содержащий цис-действующие элементы, опосредующие супрессию транскрипции гена Pdcd4, и химера люциферазы светлячка и белка Pdcd4) обеспечивают детекцию стабилизации общего уровня белка Pdcd4 за счет воздействия на процесс его убиквитин-зависимой протеолитической деградации и активность промотора гена Pdcd4. Как отмечено выше, используемый фрагмент 5'-области гена Pdcd4 человека должен обеспечивать супрессию транскрипции гена Pdcd4 в ответ на активацию про-онкогенных процессов в опухолевых клетках. Как известно из уровня техники (Vikhreva et al., 2014), такой фрагмент 5'-области гена Pdcd4 человека может представлять собой последовательности нуклеотидов, состоящую из 550 нуклеотидов ниже сайта инициации транскрипции гена Pdcd4 человека и от 2851 до 225 нуклеотидов выше сайта инициации транскрипции гена Pdcd4 человека, что достаточно для mTOR-зависимой супрессии транскрипции гена Pdcd4. Поскольку фрагмент 5'-области гена Pdcd4 человека, представляющий собой последовательность нуклеотидов, состоящую из 225 нуклеотидов выше и 550 ниже сайта инициации транскрипции гена Pdcd4 человека, обеспечивает наибольший уровень транскрипции при контроле продукции репортерного белка, при этом обладая наименьшим размером (Vikhreva et al., 2014), то в соответствии с одним из вариантов осуществления настоящего изобретения в качестве фрагмента 5'-области гена Pdcd4 человека, обеспечивающего супрессию транскрипции гена Pdcd4 в ответ на активацию про-онкогенных процессов в опухолевых клетках, был использован фрагмент 5'-области гена Pdcd4 человека, представляющий собой последовательность нуклеотидов, состоящую из 225 нуклеотидов выше и 550 ниже сайта инициации транскрипции гена Pdcd4 человека.
В соответствии с настоящим изобретением, генетической конструкцией, позволяющей осуществить его, является плазмида pLucPdcd4. В соответствии с описанными выше предпочтительными вариантами осуществления изобретения, генетическая конструкция pLucPdcd4 представляет собой плазмиду, созданную на основе вектора pGL3-Basic (Promega, США), которая предназначена для анализа транскрипционной активности фрагментов ДНК, клонируемых в полилинкер плазмиды, по активности репортерного гена люциферазы светлячка. В плазмиде pLucPdcd4 в полилинкер плазмиды клонирован фрагмент 5'-области гена Pdcd4 человека, представляющий собой последовательность нуклеотидов, состоящую из 225 нуклеотидов выше и 550 ниже сайта инициации транскрипции гена Pdcd4 человека. Также в плазмиду с помощью генно-инженерных модификаций внесены модификации, состоящие в удалении кДНК люциферазы светлячка и инсерцией вместо нее кДНК, кодирующей химерный белок, состоящий из люциферазы светлячка и аминокислоты 16-469 белка Pdcd4, при этом слияние кДНК люциферазы светлячка с удаленным кодоном терминации трансляции и фрагмента кДНК Pdcd4 человека осуществлено таким образом, что рамки считывания люциферазы светлячка и белка Pdcd4 совпадают, обеспечивая продукцию химерного белка, состоящего из люциферазы светлячка и белка Pdcd4 человека.
Таким образом, настоящее изобретение позволяет расширить набор способов поиска веществ с противоопухолевой активностью, а именно, таких веществ, являющихся ингибиторами супрессии супрессора опухолевого роста Pdcd4 в опухолевых клетках, и позволяет единовременно выявлять такие вещества, воздействующие на различные внутриклеточные про-онкогенные процессы, а именно приводящие к супрессии транскрипции гена Pdcd4 и индукции убиквитин-зависимой деградации белка Pdcd4.
Список цитированной литературы
1. Вихрева П.Н., Шепелев M.B., Коробко Е.В., Коробко И.В. Свойства и функции супрессора опухолевого роста PDCD4 и возможности их использования в онкологии. Мол. Генет.
2. Микробиол. Вирусол. 2010; (2): 3-11. Вихрева П.Н., Коробко Е.В., Коробко И.В. Регуляция экспрессии супрессора опухолевого роста Pdcd4 протеинкиназой GSK3b в клетках рака легкого. Докл. Акад. Наук. 2012; 442(6); 825-827.
3. Asangani I.A., Rasheed S.A., Nikolova D.A., Leupold J.H., Colburn N.H., Post S., Allgayer H. MicroRNA-21 (miR-21) post-transcriptionally downregulates tumor suppressor Pdcd4 and stimulates invasion, intravasation and metastasis in colorectal cancer. Oncogene. 2008 Apr 3; 27 (15): 2128-36.
4. Bajer M.M., Kunze M.M., Blees J.S., Bokesch H.R., Chen H., Brauss T.F., Dong Z., Gustafson K.R., Biondi R.M., Henrich C.J., McMahon J.B., Colburn N.H., Schmid T., B. Characterization of pomiferin triacetate as a novel mTOR and translation inhibitor. Biochem Pharmacol. 2014 Apr 1; 88 (3): 313-21.
5. Ballou L.M., Selinger E.S., Choi J.Y., Drueckhammer D.G., Lin R.Z. Inhibition of mammalian target of rapamycin signaling by 2-(morpholin-1-yl)pyrimido[2,1-alpha]isoquinolin-4-one. J Biol Chem. 2007 Aug 17; 282 (33): 24463-70.
6. Blees J.S., Schmid T., Thomas C.L., Baker A.R., Benson L., Evans J.R., Goncharova E.I., Colburn N.H., McMahon J.B., Henrich C.J. Development of a high-throughput cell-based reporter assay to identify stabilizers of tumor suppressor Pdcd4. J Biomol Screen. 2010 Jan; 15 (1): 21-9.
7. Blees J.S., Bokesch H.R., D., Schulz K., Milke L., Bajer M.M., Gustafson K.R., Henrich C.J., McMahon J.B., Colburn N.H., Schmid T., B. Erioflorin stabilizes the tumor suppressor Pdcd4 by inhibiting its interaction with the E3-ligase β-TrCP1. PLoS One. 2012; 7 (10): e46567.
8. Brunn G.J., Williams J., Sabers C., Wiederrecht G., Lawrence J.C. Jr., Abraham R.T. Direct inhibition of the signaling functions of the mammalian target of rapamycin by the phosphoinositide 3-kinase inhibitors, wortmannin and LY294002. EMBO J. 1996 Oct 1; 15 (19): 5256-67.
9. Dorrello N.V., Peschiaroli A., Guardavaccaro D., Colburn N.H., Sherman N.E., Pagano M. S6K1- and betaTRCP-mediated degradation of PDCD4 promotes protein translation and cell growth. Science. 2006 Oct 20; 314 (5798): 467-71.
10. Grkovic T., Blees J.S., Colburn N.H., Schmid T., Thomas C.L., Henrich C.J., McMahon J.B., Gustafson K.R. Cryptocaryols A-H, α-pyrone-containing 1,3-polyols from Cryptocarya sp. implicated in stabilizing the tumor suppressor Pdcd4. J Nat Prod. 2011 May 27; 74(5): 1015-20.
11. Grkovic T., Blees J.S., Bayer M.M., Colburn N.H., Thomas C.L., Henrich C.J., Peach M.L., McMahon J.B., Schmid T., Gustafson K.R. Tricyclic guanidine alkaloids from the marine sponge Acanthella cavernosa that stabilize the tumor suppressor PDCD4. Mar Drugs. 2014 Aug 21; 12 (8): 4593-601.
12. Lu Z., Liu M., Stribinskis V., Klinge C.M., Ramos K.S., Colburn N.H., Li Y. MicroRNA-21 promotes cell transformation by targeting the programmed cell death 4 gene. Oncogene. 2008 Jul 17; 27 (31): 4373-9.
13. Schmid T., Jansen A.P., Baker A.R., Hegamyer G., Hagan J.P., Colburn N.H. Translation inhibitor Pdcd4 is targeted for degradation during tumor promotion. Cancer Res. 2008 Mar 1; 68 (5): 1254-60.
14. Schmid T., Blees J.S., Bajer M.M., Wild J., Pescatori L., Cuzzucoli Crucitti G., Scipione L., Costi R., Henrich C.J., B., Colburn N.H., Di Santo R. Diaryl Disulfides as Novel Stabilizers of Tumor Suppressor Pdcd4. PLoS One. 2016 Mar 16; 11 (3): e0151643.
15. Vikhreva P.N., Shepelev M.V., Korobko I.V. mTOR-dependent transcriptional repression of Pdcd4 tumor suppressor in lung cancer cells. Biochim Biophys Acta. 2014 Jan; 1839 (1): 43-9.
16. Zhao L.X., Huang S.X., Tang S.K., Jiang C.L., Duan Y., Beutler J.A., Henrich C.J., McMahon J.B., Schmid T., Blees J.S., Colburn N.H., Rajski S.R., Shen B. Actinopolysporins A-C and tubercidin as a Pdcd4 stabilizer from the halophilic actinomycete Actinopolyspora erythraea YIM 90600. J Nat Prod. 2011 Sep 23; 74 (9): 1990-5.
17. Zhu S., Wu H., Wu F., Nie D., Sheng S., Mo Y.Y. MicroRNA-21 targets tumor suppressor genes in invasion and metastasis. Cell Res. 2008 Mar; 18 (3): 350-9.
Краткое описание фигур
Далее изобретение будет более подробно раскрыто со ссылкой на отдельные иллюстративные фигуры.
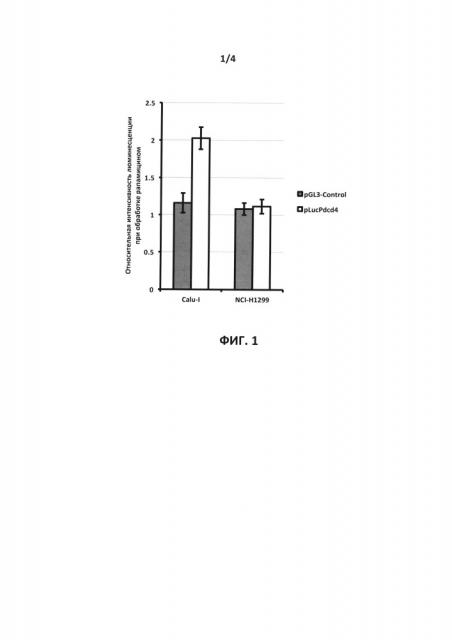
На фиг. 1 показаны результаты определения относительной активности люциферазы в ответ на обработку рапамицином клеток линий Calu-I и NCI-H1299, трансфицированных генетическими конструкциями pGL3-Control или pGL3-[Luc-Pdcd4] для продукции люциферазы светлячка или химерного белка, состоящего из люциферазы светлячка и белка Pdcd4, соответственно, под контролем конститутивного промотора, демонстрирующие отсутствие увеличения активности люциферазы, определенной по интенсивности люминесценции клеточных лизатов, в ответ на обработку трансфицированных клеток рапамицином в случае клеток линии NCI-H1299, и присутствие увеличения активности для клеток линии Calu-I.
На фиг. 2 схематически изображена генетическая конструкция pLucPdcd4. Обозначен фрагмент 5'-области гена Pdcd4 человека, представляющий собой последовательность нуклеотидов, состоящую из 225 нуклеотидов выше и 550 ниже сайта инициации транскрипции (Pdcd4 promoter), контролирующий продукцию химерного белка (Luc-Pdcd4), состоящего из люциферазы светлячка (Luc) и белка Pdcd4 (Pdcd4). Отмечены сайты узнавания рестриктаз NcoI и XbaI, использованных при замене в векторе pGL3-Control кДНК люциферазы светлячка на кДНК химерного белка, и сайт узнавания рестриктазы NdeI, использованного для слиянии кДНК люциферазы светлячка и Pdcd4.
На фиг. 3 приведены результаты определения относительной активности люциферазы в ответ на обработку рапамицином клеток линии Calu-I, трансфицированных генетическими конструкциями pGL3[+225--550], pGL3-[Luc-Pdcd4] или pLucPdcd4 для продукции люциферазы светлячка под контролем фрагмента 5'-области гена Pdcd4 человека, химерного белка, состоящего из люциферазы светлячка и белка Pdcd4, под контролем конститутивного промотора, и химерного белка под контролем фрагмента 5'-области гена Pdcd4 человека, соответственно, демонстрирующие усиление эффекта увеличения активности люциферазы, определенной по интенсивности люминесценции клеточных лизатов, в ответ на обработку трансфицированных клеток рапамицином, при комбинации в генетической конструкции фрагмента 5'-области гена Pdcd4 человека для контроля продукции репортерного белка, и химерного белка, состоящего из люциферазы светлячка и белка Pdcd4, в качестве репортерного белка.
На фиг. 4 показаны результаты определения относительной активности люциферазы в ответ на обработку клеток линии Calu-I, трансфицированных генетической конструкцией pLucPdcd4, рапамицином (Rap), ингибитором LY294002 (LY2) или ингибитором Compound 401 (401), демонстрирующие возможность выявления рапамицином, ингибитора LY294002 и ингибитора Compound 401 как ингибиторов супрессии супрессора опухолевого роста Pdcd4 с применением описанного способа.
Описание конкретных примеров осуществления изобретения
Пример 1. Конструирование генетической конструкции для продукции репортерного белка, представляющего собой химеру люциферазы светлячка и белка Pdcd4 человека под контролем конститутивного промотора.
Генетическая конструкция для продукции репортерного гена, представляющего собой химеру люциферазы светлячка и белка Pdcd4 человека под контролем конститутивного промотора (плазмида pGL3-[Luc-Pdcd4]), была сконструирована на основе вектора pGL3-Control (Promega, США), представляющего собой плазмиду для продукции люциферазы светлячка под контролем промотора и энхансера вируса SV40.
Для этого кДНК люциферазы светлячка амплифицировали на матрице вектора pGL3-Control с праймерами 5'-ccatggaagacgccaaaaac-3' и 5'-gatatetegacatatgcaeggcgatctttccgc-3' для удаления ко дона терминации транскрипции и введения сайта узнавания рестриктазы NdeI на 3'-конце кДНК с сохранением сайта узнавания рестриктазы NcoI в районе AUG-кодона кДНК люциферазы. Аналогично амплифицировали фрагмент кДНК Pdcd4 человека, кодирующий белок Pdcd4 человека без 15 N-концевых аминокислотных остатков и содержащий ко дон терминации трансляции Pdcd4, используя праймеры 5'-catatgcctgataacttaagtgac-3' и 5'-gatateteagtagetetctggttt-3', вводя при этом на 3'-конце фрагмента кДНК Pdcd4 сайт узнавания рестриктазы EcoRV, а на 5'-конце - сайт узнавания рестриктазы NdeI таким образом, чтобы при сшивании амплифицированных фрагментов кДНК люциферазы светлячка и кДНК Pdcd4 рамка считывания Pdcd4 совпадала с рамкой считывания люциферазы светлячка. Фрагменты двух амплифицированных кДНК последовательно клонировались в стандартный вектор для субклонирования, сшиваясь между собой по сайту узнавания рестриктазы NdeI. Полученная гибридная кДНК, кодирующая химерный белок, состоящий из люциферазы светлячка и белка Pdcd4 человека, вырезали с использованием рестриктаз NcoI и EcoRV, и клонировали в вектор pGL3-Control вместо кДНК люциферазы светлячка, вырезанной с использованием рестриктаз NcoI и XbaI (для вставки химерной кДНК после расщепления рестриктазой XbaI вектора pGL3-Control концы продуктов рестрикции достраивались с использованием фрагмента Кленова ДНК-полимеразы).
Полученная генетическая конструкция использовалась при выборе опухолевых клеток для осуществления настоящего изобретения путем анализа присутствия вклада убиквитин-зависимой протеолитической деградации белка Pdcd4 в общую супрессию уровня белка Pdcd4 в них.
Пример 2. Выбор опухолевых клеток.
Из существующего уровня техники (Vikhreva et al., 2014) известно, что ингибирование транскрипции гена Pdcd4 наблюдается в клетках линий рака легкого Calu-I и NCI-H1299. Поэтому эти две клеточные линии могут использоваться для осуществления настоящего изобретения, но только при условии, что в них в общую супрессию уровня белка Pdcd4 также вносит вклад убиквитин-зависимая протеолитическая деградация белка Pdcd4.
Для определения присутствия убиквитин-зависимой протеолитической деградации белка Pdcd4 в клетках линий Calu-I и NCI-H1299 клетки рассевали в лунки 24-луночного планшета и транзиторно трансфицировали генетической конструкцией для продукции репортерного белка, представляющего собой химеру люциферазы светлячка и белка Pdcd4 человека, под контролем конститутивного промотора, или вектором pGL3-Control, используя реагент Unifectin-56 (Русбиолинк, Россия). Через 24 часа после трансфекции к клеткам добавляли или не добавляли рапамицин (до концентрации 20 нг/мл) и инкубировали 18 часов. После инкубации из клеток готовили лизаты и проводили определение активности люциферазы светлячка (измерение сигнала люминесценции) в них с использованием набора Luciferase Assay System (Promega, США). Каждая экспериментальная точка (комбинация линии клеток, трансфицированной плазмиды и присутствия/отсутствия ингибитора) повторялась 3 раза с последующим усреднением результатов измерений и расчетом для каждой трансфицированной генетической конструкции относительного уровня интенсивности люминесценции, нормированного на уровень интенсивности люминесценции клеток, не обработанных ингибиторами.
В результате было установлено, что при трансфекции клеток плазмидой pGL3-Control обработка рапамицином не приводила к существенному изменению активности люциферазы (Фиг. 1) в обеих клеточных линиях, что свидетельствует об отсутствии неспецифического эффекта рапамицина на продукцию люциферазы. Также отсутствовало выраженное увеличение относительной люминесценции в ответ на обработку рапамицином при трансфекции клеток линии NCI-H1299 генетической конструкцией для продукции репортерного белка, представляющего собой химеру люциферазы светлячка и белка Pdcd4 человека, под контролем конститутивного промотора (Фиг. 1). В тоже время, в аналогичном эксперименте с клетками линии Calu-I наблюдалось существенное (около 2 раз) увеличение относительной люминесценции при обработке клеток рапамицином (Фиг. 1).
Таким образом, в клетках линии Calu-I, но не в клетках линии NCI-H1299, наблюдается увеличение активности химерного белка, состоящего из люциферазы светлячка и белка Pdcd4, в ответ на обработку рапамицином, являющимся ингибитором протеинкиназы mTOR, активация которой, как известно, приводит к фосфорилированию белка Pdcd4 по серину-67 и его последующей убиквитин-зависимой протеолитической деградации (Dorrello et al., 2006). Этот результат позволяет сделать вывод, что клетки Calu-I, но не клетки NCI-H1299, могут быть использованы при практическом воплощении настоящего изобретения, поскольку в них также описана супрессия уровня Pdcd4 за счет ингибирования транскрипции гена Pdcd4 (Vikhreva et al., 2014).
Пример 3. Конструирование генетической конструкции pLucPdcd4.
Генетическая конструкция pLucPdcd4 для продукции репортерного белка, представляющего собой химеру люциферазы светлячка и белка Pdcd4 человека, под контролем фрагмента 5'-области renaPdcd4 человека, представляющего собой последовательность нуклеотидов, состоящую из 225 нуклеотидов выше и 550 ниже сайта инициации транскрипции гена Pdcd4 человека, была сконструирована на основе описанной ранее плазмиды (Vikhreva et al., 2014), созданной на основе вектора pGL3-Basic (Promega, США) и содержащей репортерный ген люциферазы под контролем фрагмента 5'-области гена Pdcd4 человека, представляющего собой последовательность нуклеотидов, состоящую из 225 нуклеотидов выше и 550 ниже сайта инициации транскрипции гена Pdcd4 человека (плазмида pGL3[+225--550]). Для получения плазмиды pLucPdcd4, в плазмиде pGL3[+225--550] фрагмент ДНК, кодирующий люциферазу светлячка, был вырезан по сайтам узнавания рестриктаз NcoI (содержит AUG-кодон люциферазы светлячка) и XbaI (находится сразу за кодоном терминации трансляции люциферазы светлячка), и заменен на фрагмент, кодирующий химерный белок, состоящий из люциферазы светлячка и белка Pdcd4 человека, создание которой описано в Примере 1. Структура генетической конструкции pLucPdcd4 подробно проиллюстрирована на Фиг. 2.
Пример 4. Демонстрация возможности одновременного выявления воздействия вещества на ингибирование промотора гена Pdcd4 и протеолитическую деградацию белка Pdcd4.
Настоящее изобретение предусматривает возможность одновременного выявления веществ, воздействующих на внутриклеточные процессы, ингибирующие транскрипцию гена Pdcd4, и на процессы, стимулирующие убиквитин-зависимую деградацию белка Pdcd4. Для демонстрации практической реализации этого отличия настоящего изобретения по сравнению с существующим аналогом, клетки линии Calu-I были транзиторно трансфицированы плазмидами плазмидой pGL3-[Luc-Pdcd4], pGL3[+225--550] или pLucPdcd4 совместно с плазмидой pRL-TK (Promega, США) для продукции репортерного белка люциферазы Renilla, экспрессия которого контролируется конститутивным промотором, в соотношении 1:1, и обработаны рапамицином, как это описано в Примере 2. Приготовление лизатов трансфицированных клеток и измерение интенсивности люминесценции люцефераз светлячка и Renilla осуществлялось с использованием набора Dual-Luciferase Reporter Assay System (Promega, США). Измеренные интенсивности люминесценции люцеферазы светлячка нормировались на интенсивности люминесценции люциферазы Renilla, после чего для клеток, тарифицированных каждой генетической конструкцией, проводилось вычисление относительной активности нормированной интенсивности люминесценции люциферазы светлячка в лизатах клеток, обработанных рапамицином, относительно активности нормированной интенсивности люминесценции люциферазы светлячка в лизатах клеток, не обработанных рапамицином. Полученные результаты определения относительных активностей люциферазы в нескольких независимых экспериментах (с тремя повторами экспериментальных точек в каждом эксперименте) были усреднены и представлены на Фиг. 3. Как видно из полученных результатов, при использовании плазмид pGL3-[Luc-Pdcd4] и pGL3[+225--550] наблюдается увеличение относительной интенсивности люминесценции около 2 раз. Это свидетельствует о супрессивном влиянии использованного ингибитора mTOR рапамицина на ингибирование активности промотора гена Pdcd4 и активации убиквитин-зависимой деградации белка Pdcd4 в клетках линии Calu-I, соответственно. В то же время, при трансфекции плазмиды pLucPdcd4 (предположительно позволяющей детектировать одновременно супрессивное влияние исследуемых веществ на ингибирование активности промотора гена Pdcd4 и активацию убиквитин-зависимой деградации белка Pdcd4) в результате воздействия рапамицина, как известно, супрессивно воздействующего на оба этих процесса (Vikhreva et al., 2014; Dorrello et al., 2006), наблюдалось в среднем 3.23-кратное увеличение относительной интенсивности люминесценции, что существенно и достоверно (Р=0.026 и Р=0.0133; рассчитано с использованием программного обеспечения GraphPad QuickCalcs, http://www.graphpad.com/quickcalcs/) выше увеличения относительного увеличения интенсивности люминесценции в случае использования плазмид pGL3-[Luc-Pdcd4] и pGL3[+225--550], соответственно.
Представленные результаты экспериментов убедительно демонстрируют, что реализованный вариант воплощения настоящего изобретения позволяет одновременно выявлять воздействие исследуемого вещества и на ингибирование активности промотора гена Pdcd4, и на активацию убиквитин-зависимой деградации белка Pdcd4. Наряду с этим, представленные результаты демонстрируют, что при одновременном воздействии на ингибирование активности промотора гена Pdcd4 и на активацию убиквитин-зависимой деградации белка Pdcd4, в осуществленном варианте воплощения настоящего изобретения наблюдается увеличение измеряемого сигнала, свидетельствующее об аддитивности вклада ингибирования активности промотора гена Pdcd4 и ингибирования активации убиквитин-зависимой деградации белка Pdcd4 при применении генетической конструкции pLucPdcd4.
Наряду с вышеизложенным, следует отметить, что даже при воздействии даже только на один из молекулярный путь супрессии уровня Pdcd4 в опухолевых клетках - ингибирование активности промотора гена Pdcd4 или ингибирование активации убиквитин-зависимой деградации белка Pdcd4, наблюдается 2-кратное увеличение отклика описанной системы, которым является увеличение относительной интенсивности люминесценции при воздействии исследуемым веществом. При принятии стандартно используемой величины отсечки ложно-негативных сигналов, равной 50% максимального отклика (максимальный отклик в этом случае, как видно из Фиг. 3, составляет 100% от базального уровня), динамический диапазон предложенного в настоящем изобретении способа выявления веществ составляет 50%, что в 2 раза превышает динамический диапазон описанного ранее аналога (Blees et al., 2010), который составляет 25%.
Пример 5. Описание технической реализации способа выявления ингибиторов супрессии Pdcd4 в опухолевых клетках
С учетом результатов, описанных в Примере 4, техническая реализация настоящего изобретения в его варианте, предусматривающем использование клеток линии Calu-I и фрагмента 5'-области гена Pdcd4 человека, представляющего собой последовательность нуклеотидов, состоящую из 225 нуклеотидов выше и 550 ниже сайта инициации транскрипции гена Pdcd4 человека, для контроля продукции репортерного белка, представляющего собой химеру люциферазы светлячка с белком Pdcd4 человека (генетическая конструкция pLucPdcd4), предусматривает следующие манипуляции:
- рассев клеток линии Calu-I в лунки 24-луночного планшета в количестве 40000 клеток в лунку;
- проведение трансфекции клеток на следующий день смесью плазмид pLucPdcd4 и pRL-TK в соотношении 1:1;
- смену культуральной среды через 24 часа с добавлением или без добавления исследуемого вещества;
- инкубацию в течение 18 часов после смены культуральной среды и добавления исследуемого вещества;
- приготовление лизатов клеток и измерение активностей люцифераз (интенсивностей люминесценции) светлячка и Renilla; нормирование для каждого лизата активности люциферазы светлячка на активность люциферазы Renilla;
- вычисление активности нормированной активности люциферазы светлячка для клеток, обработанных исследуемым веществом, относительно активности люциферазы светлячка для клеток, не обработанных исследуемым веществом. Относительная активность люциферазы светлячка для клеток, обработанных исследуемым веществом, равная или превышающая 1.5 (в соответствии с общепринятыми пороговыми значениями, равным 50% от базального уровня (Blees et al., 2010)), является признаком того, что исследуемое вещество является ингибитором супрессии Pdcd4 в опухолевых клетках.
Пример 6. Апробация способа выявления ингибиторов супрессии Pdcd4 в опухолевых клетках на примере веществ с известной или предполагаемой способностью ингибировать супрессию Pdcd4 в опухолевых клетках
Предпочтительный вариант воплощения настоящего изобретения с использованием клеток линии Calu-I и генетической конструкции pLucPdcd4 в соответствии с вариантом его технической реализацией, изложенной в Примере 5, был применен для подтверждения возможности выявления в качестве ингибиторов супрессии Pdcd4 веществ, обладающих известной способностью ингибировать супрессию эндогенного Pdcd4 в опухолевых клетках (ингибитора mTOR рапамицина и ингибитора PI3-киназ и протеинкиназы mTOR LY294002 (Vikhreva et al., 2014)), а также - на основании известных молекулярных механизмов ингибирования Pdcd4 в опухолевых клетках - ингибитора протеинкиназы mTOR Compound 401 (Ballou et al., 2007), который, на основании этого, также предположительно обладает способностью ингибировать супрессию Pdcd4 в опухолевых клетках.
Результаты апробации способа выявления вышеперечисленных веществ как ингибиторов супрессии Pdcd4 в опухолев