Твёрдофазный способ получения биоактивного композита для наращивания ткани на основе гиалуроновой кислоты и микрочастиц полилактида или его сополимеров и способ получения имплантата на основе этого композита
Иллюстрации
Показать всеГруппа изобретений относится к области медицины. Описан способ получения биоактивного композита для наращивания ткани, включающий гиалуроновую кислоту или ее соль в качестве матрицы и микрочастицы полилактида или его сополимеров с гликолидом как наполнитель, заключающийся в том, что осуществляют взаимодействие твердофазных порошков гиалуроновой кислоты или ее соли и полилактида или его сополимеров с гликолидом в условиях одновременного воздействия давления в пределах от 20 до 50 МПа и деформации сдвига в механохимическом реакторе при температуре от 20 до -20°С. Способ позволяет в одностадийном режиме получить биоактивный композит для наращивания ткани с высоким выходом и необходимым содержанием наполнителя для образования высокопластичного биоразлагаемого имплантата на основе этого композита. 3 н. и 11 з.п. ф-лы, 8 ил., 11 пр.
Реферат
Изобретения относятся к области эстетической, пластической и реконструкционной косметологии/медицины, а именно к биоактивным композитам для наращивания ткани на основе гиалуроновой кислоты и микрочастиц полилактида или его сополимеров, имплантатам (наполнителям) на их основе, используемым для коррекции эстетических и возрастных изменений кожи и способам их получения.
Главная цель пластических хирургов, дерматологов и фармацевтических компаний является разработка биосовместимых материалов с длительным эффектом клинического долголетия для использования их в качестве эстетических лицевых наполнителей объема мягких тканей агентами. Идеальные свойства имплантатов мягких тканей - это биосовместимость, неиммуногенность, неконцерогенность, способность придать разумный клинический внешний вид и создать длительный эффект, простота использования и минимальные тенденции мигрировать в отдаленные места организма.
В настоящее время известны имплантаты, которые можно разделить на не биоразлагаемые (постоянные) или биологические (временные). Примерами постоянных имплантатов могут служить жидкий силикон (например, Silikon®), твердые частицы кремния в виде суспензии (например, Bioplastique®), микросферы полиметилметакрилата в растворе бычьего коллагена (например, Artecoll®), частицы акрилового гидрогеля распределенного в гиалуроновой кислоте (например, Dermalive®), частицы гидроксиапатита кальция (например, Radiesse®, который ранее назывался Radiance), и различные композиции в полиакриламидном геле (например, Aquamid®). Многие из них являются наполнителями длительного срока действия, что связанно с определенным риском и иммунной реакцией на присутствие инородного тела в организме [Vargas-Machuca I, Gonzalez-Guerra Е, Angulo J, et al. 2006. Facial granulomas secondary to Dermalive microimplants: report of a case with histopathologic differential diagnosis among the granlomas secondary to different injectable permanent filler materials. Am J Dermatopathol, 28:173-7]. Временные имплантаты представляют собой микрочастицы гиалуроновой кислоты сшитой 1,4-бутандиолдиглицидиловым эфиром (БДДЕ) или диглицидиловым эфиром диэтиленгликоля (ДЕГ), например (Restylane®), полимолочной кислоты (например, New-Fill®), аллогенного человеческого коллагена из тканевой культуры собственного жира (например, CosmoDerm®), ксеногенного коллагена, такого как бычий коллаген (например, Zyderm®) и бычьего коллагена сшитого глутаревым альдегидом (например, Zyplast®).
До недавнего времени бычий коллаген рассматривался как ʺзолотой стандартʺ для увеличения мягких тканей лица. Тем не менее, использование бычьего коллагена связано с 3-5% риском нежелательной реакцией - гиперчувствительностью [Lowe NJ, Maxwell СA, Lowe PL, et al. 2001. Hyaluronic acid skin fillers: adverse reactions and skin testing. J Am Acad Dermatol, 45:930-3], что требует предварительного тестирования на коже до начала лечения [Narins RS, Brandt F, Leyden J, et al. 2003. A randomized, double-blind, multicenter comparison of the effi cacy and tolerability of Restylane versus Zyplast for the correction of nasolabial folds. Dermatol Surg, 29:588-95].
На сегодняшний день не существует универсально кожного наполнителя, хотя производители продуктов на основе гиалуроновой кислоты утверждают, что их продукция близка к идеальному заполнению ткани. Известные внутридермальные и внутритканевые имплантаты на основе гиалуроновой кислоты неживотного происхождения, сшитые химическими добавками в трехмерную структуру, и стабилизированные в растворе, на первый взгляд являются наиболее безопасными [например, патент RU 2456299 С2, 20.07.2012]. Сама молекула гиалуроновой кислоты не несет функциональной нагрузки и является инертным, биологически совместимым с тканями наполнителем. Однако, в этом случае, производители не учитывают потенциальные долгосрочные побочные эффекты, связанные с применением именно сшитой гиалуроновой кислоты. Количество сшивающего агента в имплантате должно быть минимальным, именно от него зависит частота осложнений: чем ниже его количество, тем выше качество сшитой гиалуроновой кислоты, тем ниже токсичность имплантата на ее основе.
Таким образом, важнейшим элементом практически во всех методах заместительной терапии является полимерная основа. Полимер имитирует множество внеклеточных матриц, находящихся в тканях. Внеклеточный матрикс состоит из различных аминокислот и сахаров, может контролировать структуру ткани, регулирует функцию клеток и обеспечивает диффузию питательных веществ, метаболитов - рост клеток. На сегодняшний день изучено достаточно много различных типов полимеров, которые используются в заместительной терапии. Из тех препаратов, что были перечислены выше, наиболее широко используются гиалуроновая кислота (ГК) и алифатические полиэфиры, в частности полимолочная кислота или полилактид (PLA) и сополимеры (ПМГК) из этих материалов. В организме человека полимолочная кислота гидролизуется до молочной кислоты или лактата, после чего принимает участие в регуляторно-обменных функциях организма. Молекула молочной кислоты в два раза меньше молекулы глюкозы и в четыре раза меньше звена гиалуроновой кислоты - с легкостью сама проходит через клеточные мембраны, стимулируя клеточные процессы. Поскольку она присутствует в любом живом организме, она обладает минимальной побочной реакцией и обеспечивает широкий диапазон возможных медицинских применений.
Известен инъекционный имплантат для подкожного или внутрикожного введения человеку в виде инъекции и способы его получения [патент RU 2214283 С2, 20.10.2003]. Имплантат состоит из биологически разрушающихся микросфер/микрочастиц полимолочной кислоты и/или ее сополимеров с гликолевой кислотой в виде суспензии в геле. Основным гелеобразующим компонентом является карбоксиметилцеллюлоза (КМЦ) или гидроксипропилметилцеллюлоза (ГПЦ) в концентрации 0,1-7,5 мас.%. Концентрация микросфер или микрочастиц в геле 50-300 г/л. Согласно изобретению получение хорошей дисперсии микросфер или микрочастиц и гомогенность геля обеспечивается использованием поверхностно-активного вещества (ПАВ) полиоксиэтиленсорбитанмоноолеата (Твин 80) или гиалуроновой кислоты. Протокол получения имплантата в случае готовой к употреблению суспензии (в шприцах или флаконах) включает стадии: предварительное получение микросфер полимера молочной кислоты, приготовление геля необходимой вязкости для удержания микросфер полимолочной кислоты и последующее распределение микросфер полимолочной кислоты в геле. В качестве способа получения микросфер полимера молочной кислоты, приводится протокол получения лиофилизированных частиц полимолочной кислоты. В данном источнике способ получения микросфер представлен в виде 4-х примеров. Так, в примерах №1-3 - приводится растворный способ получения микросфер полимолочной кислоты в органических растворителях, таких как этилацетат, дихлорметилен, хлороформ, а в примере №4 - в твердом теле - криоизмельчение. В заявленном изобретении размер частиц регулируется в результате сплавления отдельных частиц (исходных частиц) полимолочной кислоты при одновременном перемешивании частиц полимолочной кислоты.
К недостаткам известных способов получения имплантата можно отнести следующее. Растворный способ получения микросфер полимолочной кислоты в органических растворителях требует последующего удаления органических растворителей, вредных для живого организма, а также требует процедуры очистки полученных частиц от остатков растворителя. Полученные частицы при хранении слеживаются (слипаются). После того как частицы будут получены и очищены, их необходимо равномерно распределить в геле. Распределение в геле осуществляют с помощью ультразвука. Действие ультразвука «губительно» для гиалуроновой кислоты, и частично губительно для таких полисахаридов, как КМЦ. В целом известные способы более трудоемкие, затратные и несут определенные риски загрязнения конечного продукта (имплантата) продуктами окисления полисахаридов, что опасно для человека. Криоизмельчение - процесс энергоемкий с невысокой производительностью. Процесс сопровождается повышенной деструкцией (разрушением макроцепей) полимеров. Также как и для предыдущих способов, частицы, полученные в результате криозмельчения, необходимо распределить в геле с помощью ультразвука. Также недостатками является то, что основным гелеобразующим компонентом для получения имплантата является карбоксиметилцеллюлоза (КМЦ) или гидроксипропилметилцеллюлоза (ГПЦ), которые являются чужеродными для организма человека и могут вызвать побочные реакции при введении имплантата.
В указанном выше источнике упоминается, что диспергирование частиц в среде для лиофилизации осуществляется с помощью ультразвука. В случае, если в качестве гелеобразователя была бы гиалуроновая кислота, то ультразвуковая обработка неизбежно привела к деструкции макромолекулы полисахарида, т.е. к полному распаду гиалуроновой кислоты на низкомолекулярные фрагменты [Т. Miyazaki, С. Yomota, S. Okada. Ultrasonic depolymerization of hyaluronic acid // Polymer Degradation and Stability 74 (2001) 77-85].
В предложенном нами изобретении распределение частиц осуществляется в твердой фазе путем механохимического диспергирования - в порошке гиалуроновой кислоты, где отсутствует кислород (или находится в существенно меньшем количестве, чем в растворе) [М. Neil J.D., Wiebkin O.W., Betts W.H. Depolymerisation of HA after exposure to oxygen derived free radicals // Ann. Rheum. Dis. - 1985. - Vol. 44. - No. 11. - P. 780-789]. В результате окисление полимера незначительно, а снижение вязкости при достижение гомогенизации происходит максимум на 15%. В то время, как при озвучивание в растворе процесс окисления происходит неравномерно и вязкость падает более чем на 200% в зависимости от мощности УЗ диспергатора. Таким образом, нет необходимости вводить в рецептуру имплантата такие загустители, как КМЦ или ГПЦ и дополнительные стабилизаторы, как ПАВ, чужеродные для организма человека.
Известны различные твердофазные способы получения биоактивных композитов на основе гиалуроновой кислоты или ее соли [патент RU 2416389 С1, опубл. 20.04.2011, патент RU 2532032 С1, опубл. 27.10.2014 и др.].
Однако из уровня техники не известен способ получения биоактивного композита для наращивания ткани, включающего гиалуроновую кислоту или ее соль в качестве матрицы и микрочастицы полилактида или его сополимеров с гликолидом как наполнитель. А также не известен способ получения имплантата на основе этого композита.
Задачей предлагаемой группы изобретений является создание экологически безопасного, принципиально нового способа получения в одностадийном режиме биоактивного композита для наращивания ткани на основе гиалуроновой кислоты или ее соли, наполненной микрочастицами полилактида или его сополимеров с гликолидом, способного образовывать имплантаты в виде гидрогеля, а также - способа получения имплантата на основе этого композита.
Для решения поставленной задачи предложен способ получения биоактивного композита для наращивания ткани, включающего гиалуроновую кислоту или ее соль в качестве матрицы и микрочастицы полилактида или его сополимеров с гликолидом как наполнитель, заключающийся в том, что осуществляют взаимодействие твердофазных порошков гиалуроновой кислоты или ее соли и полилактида или его сополимеров с гликолидом в условиях одновременного воздействия давления в пределах от 20 до 50 МПа и деформации сдвига в механохимическом реакторе при температуре от 20 до -20°С.
В качестве соли гиалуроновой кислоты используют соль, выбранную из ряда: тетраалкиламмониевая, литиевая, натриевая, калиевая, кальциевая, магниевая, бариевая, цинковая, алюминиевая, медная, золотая или смешанная соль гиалуроновой кислоты из вышеуказанного ряда или гидросоль гиалуроновой кислоты.
Солью гиалуроновой кислоты является натриевая соль, или смешанная соль, или гидронатриевая соль.
Молекулярная масса гиалуроновой кислоты составляет от 2 до 3000 кД.
Предпочтительно используют натриевую соль гиалуроновой кислоты с молекулярной массой 2200 кД.
В качестве полилактида используют L-полилактид, D-полилактид, D,L-полилактид.
Молекулярная масса полилактида составляет от 2 до 300 кД.
Предпочтительно используют D,L-полилактид с молекулярной массой 15-60 кД.
Мольное соотношение соли гиалуроновой кислоты к полилактиду находится в пределах от 1:0,15 до 1:1,20.
К основным компонентам композита может быть дополнительно введен сухой фосфатный буфер в качестве наполнителя. Для приготовления фосфатных буферов используют гидрофосфаты калия или натрия и дигидрофосфаты калия или натрия, а также вспомогательные вещества хлорид калия или хлорид натрия соответственно. Состав каждого из буферов выбирается такой, чтобы значение рН было от 6.5 до 8.
В качестве сополимера полилактида с гликолидом используют сополимеры с соотношением лактид:гликолид от 98:2 до 2:98.
Молекулярная масса сополимера полилактида с гликолидом составляет от 2 до 300 кД.
Предложен также биоактивный композит для наращивания ткани, включающий гиалуроновую кислоту или ее соль в качестве матрицы и микрочастицы полилактида или его сополимеров с гликолидом как наполнитель, полученный вышеуказанным способом.
Предложен также способ получения имплантата для подкожного или внутрикожного введения человеку в виде инъекции, содержащего биологически разрушающиеся микрочастицы полилактида или его сополимеров с гликолидом в виде суспензии в геле гиалуроновой кислоты или ее соли, заключающийся в том, что к биоактивному композиту добавляют воду или буферный водный раствор.
Способ получения биоактивного композита на основе гиалуроновой кислоты и микрочастиц полилактида или его сополимеров с гликолидом осуществляют в одностадийном технологическом режиме в отсутствие жидкой среды, без больших энерго-, трудо- и водозатрат, и получение при этом целевых продуктов с высоким выходом и необходимым содержанием наполнителя (полилактида или его сополимеров с гликолидом). При этом степень наполнения композита полилактидом или его сополимерами с гликолидом составляет от 3 до 20 мас.%. Микрочастицы имеют размер от 1 до 100 мкм, при этом частиц с размером 2-10 мкм (92%), 10-30 мкм (8%) и с размером частиц ≥100 мкм (0,1%).
Таким образом, предлагаемый нами подход - это создание двухфазных наполнителей (филлеров) гиалуроновой кислоты с диспергированными до заданного размера в твердой фазе нерастворимыми в воде биополимерами, а именно микросферами полимолочной кислоты (полилактида) или ее сополимеров. Такие системы, образуют гидрогели и могут быть введены в организм. Как результат - регенерация и репарация ткани с минимальным хирургическим вмешательством. Гидрогели с высоконаполненными частицами полимолочной кислоты или ее сополимеров имеют структурное сходство с компонентами организма и считаются биосовместимыми. Гидрогелевые имплантаты нашли многочисленное применение в тканевой инженерии, в том числе традиционной эстетической, пластической и реконструкционной косметологии. Следует отметить, что при этом при добавлении воды или буферного раствора больше необходимого (эффективного для образования гидрогеля) количества, биоактивный композит способен растворятся в воде или в буферном водном растворе (например, калий-фосфатном буферном растворе, натрий-фосфатном буферном растворе) с образованием суспензии микрочастиц полилактида или его сополимеров в растворе гиалуроновой кислоты или ее соли.
Группа изобретений проиллюстрирована следующими примерами.
Пример 1. Мольное соотношение ГК:PLA=1:0,17
48,5 г (12,1⋅10-2 моль) порошкообразной натриевой соли ГК и 1,5 г (20,8⋅10-3 моль) полилактида гомогенизируют в пьяной бочке в течение 1 часа 30 мин. Затем однородную порошкообразную смесь подают в зону питания двухшнекового компаудера (экструдера), где материал захватывают транспортирующие элементы и перемещают его по длине цилиндра при вращении. Во второй и третьей зоне материал подвергается деформации сдвига, благодаря смесительным элементам, состоящим из кулачков, набранных по пять штук с углом поворота между кулачками 45°, 90° и 45° (обратный). Размещение элементов под разными углами способствует образованию запоров в движении материала и вследствие этого его лучшему перемешиванию и физическим воздействиям. Эффект смешения массы увеличивается за счет ее смещения как в радиальном, так и в осевом направлениях.
Компаудер имеет измеритель скорости вращения шнеков, показания которого пропорциональны величине потребляемого напряжения, и измерителем нагрузки на шнеках, показывающим величину постоянного тока привода в процентах (%).
Процесс проводится при автоматической загрузке материала, скорость подачи композиционной смеси поддерживалась такой, чтобы удерживать заданный уровень нагрузки на шнеках. Скорости вращения шнеков выбирали в пределе от 5÷30 об⋅мин-1. Нагрузка (по току): без нагрузки - 5%, а в режиме твердотельного реакционного смешения оптимально поддерживается 10÷12%. Температура в первой зоне, во второй и в третьей зоне составляет 5°С. Цикл повторяется 2 раза. Продолжительность процесса составляет 1,5 минуты при давлении 20 МПа. Выход продукта составляет 48,0 г (96,0%). Размер частиц PLA составляет 2-10 мкм (70%), 10-30 мкм (25%) и фракция PLA, где размер частиц >100 мкм (5%). Степень наполнения композита PLA составляет 3,0 мас.%.
Пример 2.
Выполнен аналогично примеру 1, однако в отличие от него мольное соотношение порошкообразной натриевой соли ГК:PLA=1:0,29. Тогда берем 237,5 г (59,2⋅10-2 моль) порошкообразной натриевой соли ГК и 12,5 г (173,6⋅10-3 моль) полилактида.
Продолжительность процесса составляет 4.5 минуты при давлении 20 МПа. Выход продукта составляет 246,5 г (98,6%). Размер частиц PLA составляет 2-10 мкм (70%), 10-30 мкм (25%) и фракция PLA, где размер частиц >100 мкм (5%). Степень наполнения композита PLA составляет 5,0 мас.%.
Пример 3.
Выполнен аналогично примеру 1, однако, в отличие от него мольное соотношение порошкообразной натриевой соли ГК:PLA=1:0,61. Тогда берем 540,0 г (1,35 моль) порошкообразной натриевой соли ГК и 60,0 г (0,83 моль) полилактида.
Цикл повторяется 2 раза. Продолжительность процесса составляет 8 минут при давлении 20 МПа. Выход продукта составляет 597,0 г (99,5%). Размер частиц PLA составляет 2-10 мкм (45%), 10-30 мкм (35%) и фракция PLA, где размер частиц >100 мкм (20%). Степень наполнения композита PLA составляет 10,0 мас.%.
Пример 4.
Выполнен аналогично примеру 1, однако, в отличие от него мольное соотношение порошкообразной натриевой соли ГК:PLA=1:1,39. Тогда берем 8 кг (19,95 моль) порошкообразной натриевой соли ГК и 2 кг (27,78 моль) полилактида.
Цикл повторяется 2 раза. Скорость вращения шнеков составляла 80 об⋅мин-1. Продолжительность процесса - 18 минут при давлении 20 МПа. Выход продукта составляет 597,0 г (99,97%). Размер частиц PLA составляет 2-10 мкм (45%), 10-30 мкм (35%) и фракция PLA, где размер частиц >100 мкм (20%).. Степень наполнения композита PLA составляет 20,0 мас.%.
Пример 5.
Выполнен аналогично примеру 3, однако, в отличие от него процесс в режиме твердотельного реакционного смешения проводится при нагрузке 20÷25%. Продолжительность процесса составляет 7.5 минуты при давлении 50 МПа. Выход продукта составляет 597,0 г (99,5%). Размер частиц PLA составляет 2-10 мкм (35%), 10-30 мкм (35%) и фракция PLA, где размер частиц>100 мкм (30%). Степень наполнения композита PLA составляет 10,0 мас.%.
Пример 6.
Выполнен аналогично примеру 3, однако, в отличие от него цикл повторяется 7 раз. Продолжительность процесса составляет 16.5 минуты при давлении 20 МПа. Выход продукта составляет 597,0 г (99,5%). Размер частиц PLA составляет 2-10 мкм (60%), 10-30 мкм (25%) и фракция PLA, где размер частиц >100 мкм (15%). Степень наполнения композита PLA составляет 10,0 мас.%.
Пример 7.
Выполнен аналогично примеру 1, однако, в отличие от него перед тем, как смешать ГК с PLA проводят предварительную стадию экструзии порошкообразной ПМК.
Исходный порошок PLA (2-10 мкм) в количестве 45 г (625⋅10-3 моль) подают в зону питания двухшнекового компаудера (экструдера), где материал захватывают транспортирующие элементы и перемещают его по длине цилиндра при вращении. Во второй и третьей зоне материал подвергается деформации сдвига, благодаря смесительным элементам, состоящим из кулачков, набранных по пять штук с углом поворота между кулачками 45°, 90° и 45° (обратный). Размещение элементов под разными углами способствует образованию запоров в движении материала и физическим воздействиям.
Процесс проводится при автоматической загрузке материала, скорость подачи композиционной смеси поддерживалась такой, чтобы удерживать заданный уровень нагрузки на шнеках. Скорости вращения шнеков выбирали в пределе от 5÷30 об⋅мин-1. Нагрузка (по току): без нагрузки - 5%, а в режиме твердотельного реакционного смешения оптимально поддерживается 10÷12%. Температура в первой зоне, во второй и в третьей зоне составляет 5°С. Цикл повторяется 2 раза. Выход продукта составляет 43,0 г (95,6%). Продолжительность процесса составляет 4.5 минуты при давлении 20 МПа. Размер частиц PLA составляет 20-150 мкм. Полученная композиция просеивается на ситах с размером отверстия на свету 100 мкм (0,1 мм). Затем отобранная фракция PLA (20-80 мкм) в количестве 40 г (555,6⋅10-3) и 387,0 г (965,2⋅10-3 моль) порошкообразной натриевой соли ГК гомогенизируют в пьяной бочке и экструдируют согласно примеру 1. Выход продукта составляет 425,7 г (99,7%). Размер частиц PLA составляет 20-80 мкм. Степень наполнения композита PLA составляет 9,4 мас.%.
Пример 8.
Выполнен аналогично примеру 7, однако, в отличие от него полученная композиция просеивается на ситах с размером отверстия на свету 50 мкм (0,05 мм). В результате получаем фракцию PLA (20-40 мкм) в количестве 30 г, которую гомогенизируют в пьяной бочке с 387,0 г (965,2⋅10-3 моль) порошкообразной натриевой соли ГК и экструдируют согласно примеру 1. Выход продукта составляет 415,0 г (99,5%). Размер частиц PLA составляет 2-10 мкм (10%), 20-40 мкм (90%). Степень наполнения композита PLA составляет 7,2 мас.%.
Пример 9.
Выполнен аналогично примеру 3, однако, в отличие от него мольное соотношение порошкообразной натриевой соли ГК:PLA =1:0,62. Тогда берем 810,0 г (2,02 моль) порошкообразной натриевой соли ГК и 90,0 г (1,25 моль) полилактида. Для повышения монодисперстности композиции ГК-PLA в систему вводят наполнитель - фосфатный буфер в количестве 1458 г. Соотношение ГК:фосфатный буфер =1:1,8 по массе.
Цикл повторяется 2 раза. Продолжительность процесса составляет 8 минут при давлении 20 МПа. Выход продукта составляет 597,0 г (99,5%). Размер частиц PLA составляет 2-10 мкм (92%), 10-30 мкм (8%) и фракция PLA, где размер частиц >100 мкм (0,1%). Степень наполнения композита PLA составляет 10,0 мас.%. Наличие в композиции фосфатов способствует получению более монодисперсного состава и образованию межмолекулярных водородных связей ГК-фосфат-ГК, обеспечивая, тем самым, повышение вязкости за счет межмолекулярных сшивок ГК и стабильность дисперсии в водной фазе. Стабильность дисперсии в водной среде при подкожном введении позволяет достигнуть достаточно продолжительный эстетический эффект.
Пример 10.
Выполнен аналогично примеру 3, однако, в отличие от него берем 720,0 г (1,75 моль) порошкообразной цинковой соли ГК и 80,0 г (0,83 моль) полилактида. Температурный режим в первой зоне составляет 10°С, во второй -5°С и в третьей зоне составляет -20°С.
Цикл повторяется 2 раза. Продолжительность процесса составляет 8 минут при давлении 50 МПа. Выход продукта составляет 597,0 г (99,5%). Размер частиц сополимера полилактид-гликолид составляет 2-5 мкм (80%), 8-10 мкм (20%) и фракция сополимера полилактид-гликолид, где размер частиц >100 мкм (0,1%). Степень наполнения композита сополимером полилактид-гликолид составляет 10,0 мас.%.
Пример 11.
Полученные биоактивные композиты (см. примеры 1-10) способны образовывать гидрогели при добавлении к ним необходимого количества воды или буферного водного раствора. Для приготовления имплантата в виде гидрогеля необходимо растворить в заданном количестве дистиллированной воды заданное количество композита, используя следующую формулу:
m (композита, грамм смеси)=С1/С2 * V, где
m - абсолютно сухая навеска композита, необходимая для приготовления имплантата заданной концентрации по гиалуроновой кислоте, грамм
С1 - заданная концентрация имплантата по гиалуроновой кислоте, %
С2 - концентрация гиалуроновой кислоты в абсолютно сухом композите, %
V - заданный объем имплантата, мл.
По результатам исследований оптимальное содержание PLA в композиции с ГК составило ~10% от всей смеси.
Поскольку основное действие имплантата направлено на восстановление подкожной ткани, то для оценки метаболической активности клеток (фибробластов и макрофагов) был сделан МТТ-анализ. Исследования проведены для составов, описанных в примерах 1-4 и 9.
Результаты исследования поясняются графическими изображениями.
Фиг. 1 - Относительная жизнеспособность клеток линии L929 после 24 ч культивирования в присутствии суспензии PLA/ГК: в зависимости от концентрации суспензии (а) и содержания PLA в составе суспензии (б).
Фиг. 2 - Относительная жизнеспособность клеток линии RAW 264.7 после 24 ч культивирования в присутствии суспензии PLA/ГК: в зависимости от концентрации суспензии (а) и содержания PLA в составе суспензии (б).
Фиг. 3 - I группа - корректоформ М (ГК+полимолочная кислота) - 3 сутки. Фрагменты слабоокрашенной ГК разделены фибрином, макрофагами и фибробластами. Внизу в центре - частица PLA, окруженная скоплением макрофагов и нейтрофилов. Окраска гематоксилином и эозином, увеличение X 400.
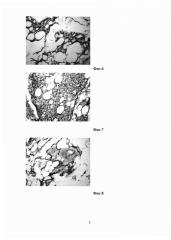
Фиг. 4 - I группа - корректоформ М (ГК+полимолочная кислота) - 3 сутки. В центре частицы полимолочной кислоты, окруженные макрофагами. Вокруг - ячейки со слабоокрашенной ГК, разделенные между собой фибрином, макрофагами и фибробластами. Окраска гематоксилином и эозином, увеличение X 400.
Фиг. 5 - I группа - корректоформ М (ГК+полимолочная кислота) - 3 сутки. Грануляционная ткань, врастающая в фибрин. Окраска гематоксилином и эозином, увеличение X 400.
Фиг.6 - I группа - корректоформ М: ГК+полимолочная кислота - 10 сутки. Участки фиброзированной грануляционной ткани в жировой клетчатке на месте введения корректоформа М. Окраска гематоксилином и эозином, увеличение X 400.
Фиг. 7 - I группа - корректоформ М (ГК+полимолочная кислота) - 30 сутки. Участок жировой клетчатки с многочисленными частицами PLA, которые подвергаются макрофагальной резорбции, и отдельными ячейками с ГК. Окраска гематоксилином и эозином, увеличение X 400.
Фиг. 8 - I группа - корректоформ М (ГК+полимолочная кислота) - 90 сутки. Участок жировой клетчатки с частицами PLA, окруженный тонкой соединительно-тканной микрокапсулой. Окраска гематоксилином и эозином, увеличение X 400.
В исследованиях in vitro было показано, что жизнеспособность клеток зависит от содержания частиц в суспензии, и ее концентрации. Так, жизнеспособность клеток линии L929 увеличивалась при снижении концентрации суспензии в среде (Фиг. 1 и 2). При этом наблюдалось значительное повышение жизнеспособности клеток (от 110 до 120%) при низких (1 и 2.5 мг/мл) концентрациях суспензий (Фиг. 1 б). Кроме того, увеличение содержания PLA в смеси приводило к увеличению жизнеспособности клеток L929. Максимальная жизнеспособность наблюдалась после инкубации клеток линии L929 с суспензией, содержащей 10% PLA и суспензией, содержащей 10% PLА с Н3РО4, а увеличение содержания PLA до 20% приводило к снижению жизнеспособности клеток (по сравнению с содержанием PLA 10%). При увеличении концентрации суспензии в среде до 10 мг/мл происходило некоторое снижение жизнеспособности клеток, однако оно было незначительным (до 90%).
В случае клеток линии RAW 264.7 при увеличении концентрации суспензии в среде (или р-ра ГК) жизнеспособность клеток падала (до 70%). При этом никаких внешних различий в морфологии и плотности клеточного монослоя в случае клеток обеих линий выявлено не было.
Нужно отметить, что увеличение содержания частиц PLA в суспензии без ГК, не оказывало влияния на жизнеспособность клеток L929 (Фиг. 1 б), она колебалась около значения 95% для всех изученных концентраций PLA. В случае же линии RAW 264.7 жизнеспособность клеток напрямую зависела от концентрации частиц PLA и снижалась в случае наибольшей концентрации частиц до 50%.
Таким образом, оптимальное содержание PLA в композиции с ГК составило ~10% от всей смеси (пример 3).
Оценку поведения имплантата, приготовленного из композита, по примеру 3 - возможность резорбции и тканевая реакция при введении имплантата в подкожно-жировую клетчатку выполнены на 36 белых лабораторных крысах-самцах массой тела 140-150 г. Животных содержали в стандартных условиях вивария, по 3 особи в клетке, кормление - комплексным гранулированным лабораторным кормом при постоянном свободном доступе к воде.
Методика эксперимента: животным, наркотизированным комбинацией «золетил-рометар», в межлопаточной области спины слева от средней линии подкожно стерильной иглой вводили по 1-1,5 мл изучаемых гель-суспензий.
Выполнено 3 группы исследований по 12 животных в каждой.
Животных выводили из опыта через 3; 10; 30 и 90 суток после введения материала.
Визуально оценивали макроскопическую картину состояния имплантированных гелей и окружающих тканей. Инкапсулированные имплантаты геля иссекали вместе с окружающими тканями. Отобранный для гистологического исследования материал фиксировали в 10%-ном растворе нейтрального формалина, проводили через спирты возрастающей концентрации, заливали в парафин. Микротомные срезы толщиной 4-6 мкм окрашивали гематоксилином и эозином. Изучение и анализ гистологических препаратов проводили с использованием светового микроскопа Olympus ВХ51, оснащенного цифровой видеокамерой SDU («Спецтелетехника», Россия). Микрофотографирование гистологических препаратов проводилось помощью этой камеры и программы Launch Cam_View.
Результаты макроскопического и гистологического изучения имплантата гель-суспензий гиалуроновой кислоты
Макроскопически на 3 сутки гель-суспензия ГК-PLA обнаружен в месте введения в виде компактных плоских пластин, сохранивших прозрачность. Окружающие ткани не изменены.
Гистологически на 3 сутки после введения материала в подкожной клетчатке образуется крупная гранулема, состоящая из имплантата и грануляционной ткани, формирующейся вокруг имплантата и между его фрагментами. ГК разволокнена на отдельные мелкие фрагменты, окруженные либо фибрином, либо тонкими тяжами макрофагов и фибробластов вместе с фибрином. ГК в основном гомогенна и слабо окрашена, местами она мелкоячеиста (Фиг. 3). В ней видны частицы различных размеров (в среднем от 100 мк), состоящие из полимолочной кислоты (Фиг. 4). Полимолочная кислота не окрашивается гематоксилином и эозином, но она несколько более плотная, чем ГК. Вокруг частиц PLA образуются скопления макрофагов с единичными нейтрофилами (см. Фиг. 3 и 4).
Кроме таких участков видны поля формирующейся грануляционной ткани, окружающей имплантат (Фиг. 5). Они состоят из тяжей фибробластов и новообразованных сосудов капиллярного типа, а также многочисленных макрофагов и лимфоцитов с единичными нейтрофилами. Фибробласты и сосуды грануляционной ткани врастают в фибрин и ГК. В самой грануляционной ткани частиц PLA не обнаруживаются.
На 10 сутки при визуальном осмотре имплантат присутствует в месте введения в виде компактного округлого образования плотноэластической консистенции, окруженного капсулой.
Гистологически на месте введения материала видна жировая клетчатка и капсула, в которой выявляются очаги фиброзирующейся грануляционной ткани (Фиг. 6). Эта ткань состоит из тяжей фибробластов, коллагеновых волокон и небольшого количества макрофагов. Местами обнаруживаются частицы PLA, окруженные макрофагами и фибробластами.
На 30 сутки при осмотре места имплантации определяются уплотнения в виде конгломератов неопределенной формы, несколько уменьшенного объема по сравнению с первоначальным имплантатом.
Гистологически у двух животных из трех на месте введения обнаружена жировая клетчатка, а в ней участки фиброза (коллагеновые волокна и фибробласты) с единичными частицами PLA. Гистологическая картина близка к вышеописанной на 10 сутки. У одного животного в жировой клетчатке осталась более крупная гранулема, которая сформирована из менее зрелой грануляционной ткани, состоящей из многочисленных сосудов, макрофагов, лимфоцитов и фибробластов (Фиг. 7). В этой ткани сохранились еще немногочисленные мелкие ячейки, содержащие прозрачную ГК, а также увеличенное количество частиц PLA. При этом PLA начинает становиться менее плотной и с нечеткими границами. Таким образом, частицы PLA подвергаются макрофагальной резорбции.
На 90 сутки в месте введения отмечены уплотнения в заметно уменьшенном объеме.
Гистологически у двух животных из трех на месте введения препарата обнаруживается жировая ткань с очень небольшими участками фиброза и единичными частицами PLA. У одного животного участки фиброзированной жировой клетчатки встречаются чаще, они более крупные и содержат сравнительно большое количество частиц PLA (Фиг. 8). Некоторые частицы располагаются близко друг другу и окружены очень тонкой соединительно-тканной микрокапсулой, содержащей немногочисленные коллагеновые волокна, макрофаги и фибробласты, реже единичные многоядерные гигантские клетки инородных тел.
Таким образом,
1. Все препараты после имплантации под кожу крысам вызывают умеренную воспалительную реакцию, затем - пролиферативную реакцию, формирование грануляционной ткани и образование соединительнотканной капсулы вокруг имплантата. Эта капсула созревает, а грануляционная ткань постепенно прорастает внутрь имплантата, разделяя гель на фрагменты. ГК с различной скоростью резорбируется макрофагами и лизируется под воздействием тканевых гиалуронидаз. Полимерные частицы, суспендированные в геле, сохраняются дольше.
2. Скорость рассасывания гиалуроновой кислоты и суспендированных в ней частиц, а также особенности тканевой реакции различны.
3. Окруженный капсулой, гель остается в месте введения до конца наблюдений (90 суток). При этом в полости капсулы, окружающей гель скапливается фибринозный экссудат.
4. При имплантации в подкожную клетчатку вызывает наиболее выраженную тканевую реакцию. Уже на 3-и сутки имплантат начинает прорастать грануляционной тканью. Гиалуроновая кислота резорбируется постепенно, к 30-м суткам остаются лишь ее следы. Частицы полимолочной кислоты также постепенно резорбируются макрофагами, но через 30 суток после имплантации они еще присутствуют в толще фиброзно-рубцовой ткани, замещающей имплантат.
Имплантат обладает эффектами бифазных филлеров, и при этом равномерно интегрируется в тканях как монофазный гель. Неоспоримым преимуществом имплантата является его пластичность, идеальная интеграция в тканях, хорошее удержание объема и комфортность при введении для испытуемого даже без использования анестезии.
Особенности и преимущества
- Стойкое филинговое действие, высокая пластичность, равномерная биодеградация.
- Быстрый результат после процедуры, не требующий докоррекции.
- Отсутствие выраженного отека.
- Максимально комфортно и безболезненно для пациента.
Инновационный высокопластичный имплантат гарантированно восполняет необходимый объем, легко проходя через иглы и канюли небольшого диаметра.
1. Способ получения биоактивного композита для наращивания ткани, включающего гиалуроновую кислоту или ее соль в качестве матрицы и микрочастицы полилактида или его сополимеров с гликолидом как наполнитель, заключающийся в том, что осуществляют взаимодействие твердофазных порошков гиалуроновой кислоты или ее соли и полилактида или его сополимеров с гликолидом в условиях одновременного воздействия давления в пределах от 20 до 50 МПа и деформации сдвига в механохимическом реакторе при температуре от 20 до -20°С.
2. Способ по п. 1, заключающийся в том, что в качестве соли гиалуроновой кислоты используют соль, выбранную из ряда: тетраалкиламмониевая, литиевая, натриевая, калиевая, кальциевая, магниевая, бариевая, цинковая, алюминиевая, медная, золотая или смешанная соль гиалуроновой кислоты из вышеуказанного ряда или гидросоль гиалуроновой кислоты.
3. Способ по п. 1, заключающийся в том, что солью гиалуроновой кислоты является натриевая соль, или смешанная соль, или гидронатриевая соль.
4. Способ по п. 1, заключающийся в том, что молекулярная масса гиалуроновой кислоты составляет от 2 до 3000 кД.
5. Способ по п. 1, заключающийся в том, что предпочтительно используют натриевую соль гиалуроновой кислоты с молекулярной массой 2200 кД.
6. Способ по п. 1, заключающийся в том, что в качестве полилактида используют L-полилактид, D-полилактид