Способ предупреждения развития системного воспалительного ответа у кардиохирургических пациентов после искусственного кровообращения
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к сердечнососудистой хирургии и перфузиологии. Выполняют мембранную сорбцию следующих медиаторов воспаления: интерлейкин 6, интерлейкин 8 и интерлейкин 10. При этом в случае наличия у пациента двух и более факторов риска развития системного воспаления: предполагаемая длительность искусственного кровообращения более 80 мин; повторные операции на сердце; наличие сахарного диабета, хронического инфекционного очага, сорбцию медиаторов воспаления осуществляют при помощи полиметилметакрилатовой мембраны, которую устанавливают в контур аппарата искусственного кровообращения через роликовый насос, работающий со скоростью 300 мл/мин. В частном случае для снижения объема циркулирующей крови и/или уменьшения степени инфузионной гемодилюции в кардиотомном резервуаре открывают порт гемофильтра и осуществляют спонтанную ультрафильтрацию. Способ может быть использован для предупреждения и/или снижения выраженности системного воспалительного ответа у пациентов после кардиохирургических вмешательств с длительным периодом искусственного кровообращения. 1 з.п. ф-лы, 5 табл., 4 пр.
Реферат
Изобретение относится к области медицины, в частности к сердечно-сосудистой хирургии и перфузиологии, и может быть использовано для предупреждения и/или снижения выраженности системного воспалительного ответа (СВО) у пациентов после кардиохирургических вмешательств с длительным периодом искусственного кровообращения.
Возникновению системного воспалительного ответа (СВО) при искусственном кровообращении (ИК) способствуют многие факторы: контакт крови с чужеродными нефизиологическими поверхностями, хирургическая травма, реперфузионный синдром, высвобождение эндотоксина. В развитии СВО также играет роль активация комплемента, высвобождение воспалительных цитокинов, активация лейкоцитов, реакция эндотелия, что в свою очередь приводит к выработке различных веществ (свободные кислородные радикалы, NO, фактор активации тромбоцитов, метаболиты арахидоновой кислоты), которые также оказывают повреждающее действие. Возникающий каскад воспалительных реакций принимает непосредственное участие в развитии послеоперационных осложнений, таких как избыточный системный воспалительный ответ, дыхательная, почечная и печеночная недостаточность, неврологические осложнения, кровотечения. Все это может привести к возникновению полиорганной недостаточности у пациента. Поэтому разработка методов, которые позволили бы удалять данные факторы из крови пациента в течение перфузии и тем самым снизить выраженность развития СВО и избежать послеоперационных осложнений, остается актуальной.
Известен способ предупреждения развития системного воспалительного ответа за счет удаления из кровотока лейкоцитов путем включения в перфузионный контур фильтра со специальным экраном для удаления лейкоцитов и недопущения последних в системный кровоток (Chen Y.F., Tsai W.C., Lin С.С. et al. Effect of leukocyte depletion on endothelial cell activation and transendothelial migration of leukocytes during cardiopulmonary bypass. Ann Thorac Surg 2004; 78: 2: 634-642). Недостатком способа является увеличение сопротивления кровотоку; создание условий для турбулентности потока и формирования микроэмболизаций.
Известен способ модифицированной ультрафильтрации крови в условиях искусственного кровообращения в раннем постперфузионном и в интраоперационном периодах (Tallman RD., Dumond М., Brown D. Inflammatory mediator removal by zero-balance ultrafiltration during cardiopulmonary bypass. Perfusion 2002; 17: 2: 111-115). Недостатком способа является возможность удаления лишь незначительных объемов жидкости, что не позволяет осуществить клинически и лабораторно значимый перенос медиаторов системного воспаления через полупроницаемую мембрану гемофильтра.
Известен способ периоперационного плазмафереза при кардиохирургических вмешательствах, где начиная с этапа перикардиотомии и до этапа окончания искусственного кровообращения, всю кровь, истекающую в рану, и кардиоплегический раствор эвакуируют с использованием аппарата для реинфузии типа Cell Saver (Предупреждение системного воспалительного ответа при хирургической коррекции клапанных пороков сердца./ Звягин Р.Ю., Шукевич Д.Л., Головкин А.С., Плотников Г.П. и др. // Клиническая физиология кровообращения - 2012. - №3. - С. 56-61). Кровь, собранная в Cell Saver, проходит несколько этапов обработки: фильтрация, центрифугирование, разделение крови на форменные элементы и плазму, отмывание и возвращение форменных элементов через гемотрансфузионный фильтр в систему кровотока, при этом полученную плазму удаляют.
Основными недостатками известного способа является наличие дополнительного контура, который сам является провоцирующим моментом в формировании СВО, а также удаление молекул всего цитокинового спектра - как провоспалительных, так и противовоспалительных факторов и плазменных компонентов гемостаза.
Известно использование гемофильтра для экстракорпорального очищения крови у пациентов с острой и хронической почечной недостаточностью, изготовленного из полиметилметакрилата (РММА) (Путинцев М.Д. Феноменальные достижения гемодиализа в Японии и мембрана полиметилметакрилат (РММА) [Электронный ресурс] М.Д. Путинцев. - Электрон. текстовые дан. // Режим доступа: http://www.toray-medical.ru/filtryzer/pmmal.pdf), когда в гемодиализатор устанавливали синтетическую мембрану из РММА для снижения эффекта «последиализной усталости», связанной с выбросом цитокинов.
Недостатком способа является необходимость использования специального диализного оборудования, а проведение гемодиафильтрации не показано кардиохирургическим пациентам во время искусственного куровообращения.
Наиболее близким к заявляемому является способ гемоадсорбции, предназначенный для дополнительной терапии пациентов с повышенным уровнем цитокинов в условиях синдрома системного воспалительного ответа (F. Bruenger, L. Kizner, J. Weile, M. Morshuis, and J.F. Gummert / First successful combination of ECMO with cytokine removal therapy in cardiogenic septic shock: a case report // The International Journal of Artificial Organs, vol. 38, no. 2, pp. 113-116, 2015), при котором у пациента с острым респираторным дистресс-синдромом и кардиогенным септическим шоком на фоне экстракорпоральной мембранной оксигенации (ЭКМО) и механической поддержи левого желудочка, дополнительно в контур аппарата для вено-венозной гемофильтрации устанавливали систему CitoSorb, предназначенную для элиминации широкого спектра воспалительных медиаторов, а также различных белков и метаболитов.
Недостатком способа является недифференцированное удаление как воспалительных, так и противовоспалительных цитокинов, а также невозможность при необходимости проводить ультрафильтрацию для снижения степени гемодилюции как одного из пусковых компонентов СВО. Кроме того, стоимость процедуры крайне высока и зачастую превосходит себестоимость самого вмешательства.
Техническим результатом предложенного изобретения является повышение эффективности мероприятий, направленных на снижение риска развития системного воспалительного ответа у кардиохирургических пациентов с длительным периодом искусственного кровообращения, за счет использования полиметилметакрилатовой мембраны (ПММ) в гемофильтре, установленном в контуре аппарата искусственного кровообращения.
Сущность способа заключается в том, что перед оперативным вмешательством у пациента оценивают наличие следующих факторов риска: предполагаемая длительность ИК более 80 минут, операции «redo» (репротезирования клапанов сердца или повторное аорто-коронарное шунтирование (реАКШ)), наличие инфекционного очага. При наличии двух или более факторов риска в контур аппарата ИК, через роликовый насос, работающий со скоростью 300 мл/мин, устанавливают гемофильтр с полиметилметакрилатовой мембраной. Таким образом, осуществляется сорбция провоспалительных цитокинов: интерлейкина 6 (IL-6) и интерлейкина 8 (IL-8), а также противовоспалительного цитокина - интерлейкина 10 (IL-10) без снижения перфузионной скорости ИК и необходимости подключения дополнительного контура гемофильтрации. Кроме того, при необходимости снижения объема в кардиотомном резервуаре и/или снижения степени инфузионной гемодилюции открывают порт гемофильтра и осуществляют спонтанную ультрафильтрацию с коэффициентом, соответствующим техническим характеристикам гемофильтра.
В качестве ранних и чувствительных маркеров выраженности СВО хорошо изучены провоспалительные цитокины IL-6 и IL-8, а также антивоспалительный IL-10.
IL-6 является важнейшим медиатором острой фазы воспаления и благодаря особенностям синтеза и скорости распада демонстрирует выраженную динамику в случае активации воспалительного ответа. IL-8 ранний и мощный медиатор воспаления, относящийся к группе хемокинов, и один из самых мелких по размерам цитокинов (8kDa). Параллельно с активацией продукции провоспалительных цитокинов в организме запускается синтез антивоспалительных цитокинов и представляет собой ранний адаптивный процесс, при этом IL-10 известен как фактор, ингибирующий синтез провоспалительных цитокинов и снижающий активность моноцитов.
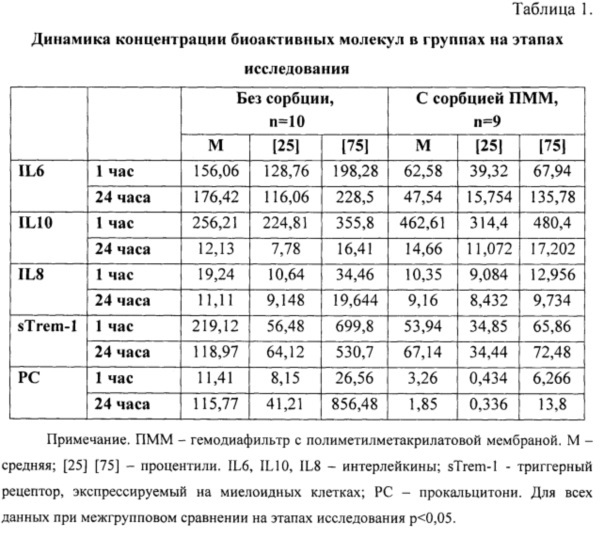
Для объективизации эффективности сорбции колонок ПММА было проведено исследование концентрации биоактивных молекул в крови пациента через 1 час (непосредственные результаты) после окончания процедуры искусственного кровообращения и 24 ч после ИК (отдаленные результаты), данные представлены в таблице 1.
Дополнительно определяли концентрации прокальцитонина (PC) и Strem-1. Прокальцитонин (PC) - используется как показатель септического компонента воспалительного ответа и представляет собой небольшой белок, состоящий из 116 аминокислотных остатков и имеющий молекулярную массу около 13-14,5 кДа. Растворимая форма триггерного рецептора, экспрессируемого на миелоидных клетках (sTREM-1), увеличивается в крови при различных формах СВО (септических и несептических) и коррелирует с тяжестью процесса.
Анализ полученной динамики биоактивных молекул у пациентов с проведенной сорбцией ПММ и не прошедших процедуру показал, что использование колонок позволяет снизить уровень воспалительных цитокинов, а также триггерных компонентов и маркеров септического СВО.
Через 1 час после проведенной сорбции содержание IL6 в крови было достоверно ниже, чем в группе пациентов, не прошедших данную процедуру. При этом отмечалась тенденция к более низким концентрациям IL6 далее через 1 сутки после сорбции, что указывает на пролонгированное снижение интенсивности воспалительного ответа за счет сорбирования на ПММ и удаления из циркуляции молекул активации.
Кроме того, уровень антивоспалительного IL10 через 1 час после процедуры характеризовался недостоверно более высокими значениям по сравнению с аналогичными показателями у пациентов, не подвергшихся процедуре сорбции, что характеризует повышение адаптивной антивоспалительной реакции организма и опосредованное снижение уровня воспалительного ответа. IL10 повышается в крови кратковременно (первые часы после воздействия факторов, запускающих СВО), поэтому через 1 сутки после процедуры его уровень был низким и не имел различий в группах пациентов.
Медиана значений концентрации sTREM-1 в крови через 1 час после процедуры почти в 4 раза ниже аналогичных показателей в группе пациентов, не пошедших сорбцию ПММ, однако широкий диапазон значений и малое количество пациентов не позволили выявить статистически значимые различия. Тем не менее сорбционный эффект в отношении sTREM-1 можно считать зарегистрированным. Медиана концентрации sTREM-1 в крови через 1 сутки после процедуры оказалась в 2 раза ниже по сравнению с показателями в группе без сорбции, однако статистической значимости не зарегистрировано.
Таким образом, снижение концентрации провоспалительных цитокинов и отдельных маркеров СВО в крови сразу после процедуры доказывает сорбционный эффект ПММ колонок в отношении триггерных факторов СВО и провоспалительных цитокинов. Более низкие значения исследуемых показателей через 1 сутки после процедуры доказывают опосредованный положительный эффект удаления стимулирующих СВО компонентов из циркуляции.
Ниже приведены примеры реализации предложенного способа.
Пример 1. Больной А., 51 года, диагноз: соединительнотканная дисплазия, недостаточность митрального клапана, состояние после протезирования протезом «Кемкор» и РЧА по методике «лабиринт» (2006 г.), дисфункция биопротеза, недостаточность трикуспидального клапана II-IIIст., постоянная нормосистолическая форма фибрилляции предсердий, ХСН 2а, ФК 3. Выполнено репротезирование митрального клапана биопротезом «Неокор» и пластика трикуспидального клапана на опорном кольце. Длительность ИК 112 мин, пережатия аорты - 82 мин. С началом перфузии в контуре ИК включен гемодиафильтр «BK-2.1Р.» (Toray, Япония) при кровотоке 300 мл/мин. Стандартная анестезия (ТВА), перфузия с индексом 2,7 л/мин/м2, защита кустодилом. Суммарный гидробаланс 10,5 мл/кг. Кровопотеря 450 мл, трансфузия 2-х доз СЗП. В постперфузионном периоде - без инотропной поддержки. Пробуждение по окончании вмешательства, экстубация через 35 мин. Динамика маркеров СВО представлена в таблице.
Послеоперационный период без особенностей - без проявлений органных дисфункций, перевод из реанимации через 16 ч, выписка из стационара на 8-е стуки.
Пример 2. Больной К., 54 г., диагноз: ревматическая болезнь сердца, митральный стеноз, состояние после биопротезирования митрального клапана (2010 г.), дисфункция биопротеза, постоянная нормосистолическая форма фибрилляции предсердий, ХСН 2а, ФК 3. Выполнено репротезирование митрального клапана биопротезом «Неокор» и пластика трикуспидального клапана на опорном кольце. Длительность ИК 108 мин, пережатия аорты - 84 мин. Стандартная анестезия (ТВА), перфузия с индексом 2,7 л/мин/м2, защита кустадиолом. Суммарный гидробаланс 12,5 мл/кг. Кровопотеря 550 мл, трансфузия 2-х доз СЗП. В постперфузионном периоде - вазоплегия, потребовавшая вазопрессорной коррекции и волемии.
Динамика маркеров СВО представлена в таблице.
В послеоперационном периоде - проявления развернутого СВО (возрастающая потребность в вазопрессорах, ацидоз, гипергликемия, гипертермия, лейкоцитоз), почечная дисфункция (снижение темпа диуреза при нарстающих дозах стимуляции), потребовавшая проведения продолженной гемодиафильтрации, продленная ИВЛ 44 ч в связи с острым легочным повреждением. Стабилизация состояния и перевод из реанимации на 5-е сутки, госпитальный период 18 дней.
Пример 3. Больной М., 46 лет, диагноз: диссекция восходящего отдела аорты, II типа по DeBakey, гемоперикард; сопутствующий: сахарный диабет 2 типа, субкомпенсированный, целевой гикированный гемоглобин 7,8 г/л. По экстренным показаниям выполнено протезирование грудного отдела и дуги аорты по типу «hemi-arch». Длительность ИК 186 мин, пережатия аорты - 142 мин, арест 48 мин (Т°24 С). С началом перфузии в контуре ИК включен гемодиафильтр «BK-2.1Р.» (Toray, Япония) при кровотоке 300 мл/мин. Стандартная анестезия (ТВА), перфузия с индексом 2,7 л/мин/м2, защита кустодилом. Суммарный гидробаланс 20,5 мл/кг. Кровопотеря 1650 мл, трансфузия 6-ти доз СЗП, 4 дозы эритроцитарной массы, 12 доз тромбокнцетрата. В постперфузионном периоде - инотропная поддержка адреналином в терапевтическом диапазоне. Пробуждение и экстубация через 1,5 ч по окончании операции. Динамика маркеров СВО представлена в таблице.
Послеоперационный период без особенностей - без проявлений органных дисфункций, перевод из реанимации через 14 ч, госпитальный период 10 суток.
Пример 4. Больной П., 59 года, диагноз: соединительнотканная дисплазия, недостаточность митрального клапана, состояние после протезирования протезом «Кемкор» и РЧА по методике «лабиринт» (2009 г.), дисфункция биопротеза, постоянная нормосистолическая форма фибрилляции предсердий, ХСН 2а, ФК 3, сахарный диабет инсулинзависмый, субкомпенсированный, целевой гликированный гемоглобин 6,3 г/л; железодефицитная анемия ср. ст. тяжести (Hb 81 г/л). Выполнено репротезирование митрального клапана биопротезом «Неокор». Длительность ИК 68 мин, пережатия аорты - 56 мин. С началом перфузии в контуре ИК включен гемодиафильтр «BK-2.1Р.» (Toray, Япония) при кровотоке 300 мл/мин. Стандартная анестезия (ТВА), перфузия с индексом 2,5 л/мин/м2, защита кустодилом. Суммарный гидробаланс 15,5 мл/кг. Кровопотеря 650 мл, трансфузия 4-х доз СЗП, 2-х тромбоконцентрата, 2-х доз эритроцитарной массы. На 30 мин перфузии в связи с избыточном гидробалансом и снижением гематокрита в контуре ИК (21%) начата пассивная ульрафильтрация через гемодифильтр, с суммарным удалением 800 мл ультрафильтрата, гематокрит на окончание перфузии 29%. В постперфузионном периоде - без инотропной поддержки. Пробуждение по окончании вмешательства, экстубация через 15 мин. Динамика маркеров СВО представлена в таблице.
Послеоперационный период без особенностей - без проявлений органных дисфункций, глюкоза крови в пределах физиологической нормы пациента без дополнительной коррекции, гемотрансфузий не потребовалось. Перевод из реанимации через 18 ч, выписка из стационара на 7-е стуки.
Таким образом, данный способ используется в клинике анестезиологии НИИ КПССЗ г. Кемерово и позволяет профилактировать развитие системного воспаления, связанного с длительным искусственным кровообращением, и органных дисфункций как его осложнений.
1. Способ предупреждения развития системного воспаления у кардиохирургических пациентов после искусственного кровообращения, включающий мембранную сорбцию следующих медиаторов воспаления: интерлейкин 6, интерлейкин 8 и интерлейкин 10, отличающийся тем, что при наличии у пациента двух и более факторов риска развития системного воспаления: предполагаемая длительность искусственного кровообращения более 80 мин; повторные операции на сердце; наличие сахарного диабета, хронического инфекционного очага, сорбцию медиаторов воспаления осуществляют при помощи полиметилметакрилатовой мембраны, которую устанавливают в контур аппарата искусственного кровообращения через роликовый насос, работающий со скоростью 300 мл/мин.
2. Способ по п. 1, отличающийся тем, что для снижения объема циркулирующей крови и/или уменьшения степени инфузионной гемодилюции в кардиотомном резервуаре открывают порт гемофильтра и осуществляют спонтанную ультрафильтрацию.