Соединения хинина, способ их получения и их медицинское применение
Иллюстрации
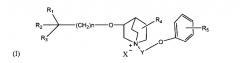
Показать всеИзобретение относится к соединению формулы I:
или его фармацевтически приемлемые соль или оптический изомер, где в формуле I: n выбран из 1-7, R1 обозначает С3-С7 гидрокарбил, который может быть незамещенным или необязательно замещенным галогеном, алкокси, алкоксикарбонилом, гетероциклилом или арилом; R2 обозначает арил или гетероарил, содержащий один или более гетероатомов, выбранных из N, О или S, который может быть незамещенным или необязательно замещенным одним или более заместителями из галогена, фенила, -OR6, -SR6, -NR6R7, -NHCOR6, -CONR6R7, -CN, -NO2, -COOR6, -CF3 или линейного или разветвленного С1-С4 гидрокарбила, R6 и R7 могут обозначать атом водорода или линейный или разветвленный С1-С4 гидрокарбил; R3 обозначает гидроксил, галоген, алкокси или ацилокси, при этом алкокси или ацилокси могут быть незамещенными или необязательно замещенными галогеном, гидроксилом, алкокси, гидрокарбилом, алкоксигидрокарбилом, гетероциклилом или арилом; R4 и R5 могут быть или могут отсутствовать, и, независимо, могут означать, без ограничения, заместитель, такой как галоген, гидроксил, алкокси, гидрокарбил, алкоксигидрокарбил, гетероциклил или арил, когда эти радикалы содержатся. Y обозначает линейный или разветвленный С1-С7 алкил или -(СН2-О-СН2)m-, которые могут быть необязательно замещены галогеном, гидроксилом, алкокси, алкоксиалкилом, ненасыщенным гидрокарбилом, циклическим гидрокарбилом или гетероциклилом, при этом m равен 1-3; Х- обозначает остаток кислоты или гидроксил, указанные соединения характеризуются селективным антагонистическим действием на подтипы M1 и М3 рецепторов, но незначительно влияют на подтип М2 рецептора. 14 н. и 10 з.п. ф-лы, 5 табл., 33 пр.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к соединениям хинина, их оптическим изомерам и к способу их получения и к композициям, их содержащим, для медицинских целей и, в частности, к новым антагонистам М рецептора, обладающим селективным действием на подтипы М рецептора, которые оказывают сильное воздействие на подтипы рецептора М3 и М1, но не оказывают сильного воздействия на подтип рецептора М2.
Уровень техники
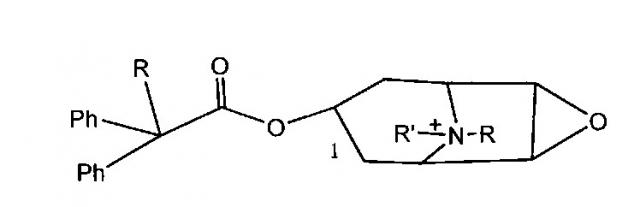
В некоторых патентных документах сообщается, что соединение, представляющее собой хининовую структуру, используется для получения антихолинергического эффекта. Например, соединение, описанное в патенте CN 200810112248.1 и в патенте CN 200910223255.3, имеет структуру, показанную ниже, где R обозначает метил, этил, пропил, изопропил или циклопропил; и X обозначает атом галогена.
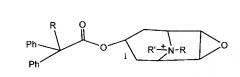
В патенте FR 2012964 описано соединение, имеющее структуру, показанную ниже, где R обозначает Н, гидроксил или алкил с 1-4 атомами углерода; R1 обозначает фенил или тиенил; и R2 обозначает циклогексил, циклопентил или тиенил.
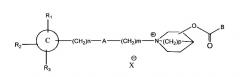
В патенте США №5654314 описано соединение следующей структуры:
В международной заявке WO 01/04118 раскрыта следующая структура:
Указанные выше соединения имеют большие недостатки, такие как быстро исчезающая эффективность, медленное действие или значительные токсические и побочные эффекты или т.п., проявляющиеся при лечении ринита, послепростудного ринита, хронического трахеита, гиперчувствительности дыхательных путей, астмы, хронической обструктивной болезни легких, кашля, недержания мочи, частого мочеиспускания, синдрома ленивого мочевого пузыря, спазмов мочевого пузыря, воспаления мочевого пузыря и желудочно-кишечных заболеваний, таких как синдром раздраженного кишечника, спастический колит, а также дуоденальные язвы и язвы желудка.
Соединения согласно данному изобретению преодолевают недостатки описанных выше соединений и, в частности, характеризуются более длительной эффективностью, быстрым действием, более низкой токсичностью и меньшими побочными эффектами при лечении хронического трахеита, гиперчувствительности дыхательных путей, астмы и хронической обструктивной болезни легких по сравнению с известными соединениями. Благодаря их хорошей стабильности, соединения согласно данному изобретению пригодны для изготовления состава для ингаляции, который вводится один раз в день для лечения хронической обструктивной болезни легких и, в частности, пригодны для изготовления дозированного аэрозоля типа раствора для ингаляции, который вводится один раз в день. Настоящее изобретение относится к синтезу такого соединения, получению фармацевтической композиции, содержащей указанное соединение, и к их фармацевтическому применению.
Соединение согласно данному изобретению может быть также использовано для лечения указанных выше респираторных заболеваний, таких как ринит, послепростудный ринит, хронический трахеит, гиперчувствительность дыхательных путей, астма и хроническая обструктивная болезнь легких и т.п., в комбинации с агонистами β2-рецептора, стероидным гормоном, антиаллергическими лекарствами, противовоспалительными средствами, противоинфекционными лекарствами, антагонистами фосфолипазы IV и т.п.
Раскрытие изобретения
Новый селективный антагонист подтипов М рецептора согласно данному изобретению может быть представлен структурной формулой (I):
где в формуле (I):
n выбран из 1~7, предпочтительно 1~3, наиболее предпочтительно, когда n обозначает 1;
R1 обозначает С3-С7гидрокарбил, который может быть незамещенным или может быть замещен, без ограничения, галогеном, алкокси, алкоксикарбонилом, гетероциклилом или арилом; предпочтительно незамещенным циклоалкилом, и наиболее предпочтительно циклопентилом или циклогексилом.
R2 обозначает арил, то есть фенил, гетероарил, содержащий один или более гетероатомов (гетероатом может представлять собой N, О или S), нафтил или дифенил, которые могут быть незамещенными или могут быть замещены, при этом заместитель (-и) может (могут) быть одним или более заместителем из галогена, гидроксила, фенила, -OR6, -SR6, -NR6R7, -NHCOR6, -CONR6R7, -CN, -NO2, -COOR6, -CF3 или линейного или разветвленного C1-C4 гидрокарбила; незамещенный фенил, пиридил, фурил и тиенил являются предпочтительными; R6 и R7 могут быть атомом водорода, линейным или разветвленным гидрокарбилом или совместно могут образовать циклогидрокарбил.
R3 обозначает гидроксил, галоген, алкокси или ацилокси, при этом алкокси или ацилокси могут быть незамещенными или могут быть замещены, без ограничения, галогеном, гидроксилом, алкокси, гидрокарбилом, алкоксигидрокарбилом, циклогидрокарбилом, гетероциклом или арилом; предпочтительно гидроксилом или метоксилом, и наиболее предпочтительно гидроксилом.
R4 и R5 могут быть или могут отсутствовать, и, соответственно, могут означать, без ограничения, заместитель, такой как галоген, гидроксил, гидрокарбилокси, гидрокарбил, гидрокарбилоксигидрокарбил, гетероциклил, арил и т.п., когда эти радикалы содержатся.
Y обозначает линейный или разветвленный C1-С7 алкил или -(СН2-O-СН2)m- (где m равен 1-3), которые могут быть необязательно замещены, предпочтительно замещены галогеном, гидроксилом, алкокси, алкоксиалкилом, ненасыщенным гидрокарбилом, циклогидрокарбилом или гетероциклилом; предпочтительно метилом, этилом, пропилом или -(СН2-О-СН2)-; и наиболее предпочтительно этилом или пропилом;
X- обозначает остаток кислоты или гидроксида, предпочтительно фармацевтически приемлемый остаток кислоты, примеры таких соединений включают соль, полученную из неорганической кислоты, такую как гидрохлорид, гидробромид, йодид, нитрат, карбонат, бикарбонат, фосфат, гидрофосфат, дигидрофосфат, сульфат, дисульфат, сульфит, гидросульфит или фосфит; и соль, полученную из сравнительно нетоксичной органической кислоты, такой как, без ограничения, уксусная кислота, пропионовая кислота, изомасляная кислота, малоновая кислота, бензойная кислота, янтарная кислота, субериновая кислота, фумаровая кислота, миндальная кислота, фталевая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, лимонная кислота, винная кислота, метансульфоновая кислота, глюкуроновая кислота или галактоновая кислота или т.п. Примеры включают также соль аминокислоты, такой как аргинин, или т.п.
Соединение, представленное формулой (I), может содержать один или более хиральных центров, и один оптический изомер или смесь различных оптических изомеров также охвачены данным изобретением.
Следующие соединения могут конкретно иллюстрировать содержание данного изобретения, но не ограничивают его объем.
1. (2S,3R)-3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
2. (2S,3S)-3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
3. (2R,3R)-3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
4. (2R,3S)-3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
5. (2S,3R),(2R,3S)-3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
6. (2R,3R),(2S,3S)-3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
7. (2S,3R)-3-[(2-циклогексил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
8. (2S,3S)-3-[(2-циклогексил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
9. (2R,3R)-3-[(2-циклогексил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
10. (2R,3S)-3-[(2-циклогексил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
11. (2R,3S),(2S,3R)-3-[(2-циклогексил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
12. (2R,3R),(2S,3S)-3-[(2-циклогексил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
13. (2S,3R)-3-[(2-циклобутил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
14. (2S,3S)-3-[(2-циклобутил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
15. (2R,3S)-3-[(2-циклобутил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
16. (2R,3R)-3-[(2-циклобутил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
17. (2R,3S),(2S,3R)-3-[(2-циклобутил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
18. (2R,3R),(2S,3S)-3-[(2-циклобутил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
19. (2S,3R)-3-[(2-циклопропил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
20. (2R,3S)-3-[(2-циклопропил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
21. (2S,3S)-3-[(2-циклопропил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
22. (2R,3R)-3-[(2-циклопропил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
23. (2R,3S),(2S,3R)-3-[(2-циклопропил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
24. (2R,3R),(2S,3S)-3-[(2-циклопропил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
25. (2S,3R)-3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
26. (2R,3R)-3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
27. (2R,3R)-3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-феноксиметил-1-азабицикло [2,2,2] октана бромид
28. (3R,3R)-3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-феноксиметоксиметил-1-азабицикло[2,2,2] октана бромид
29. (3R,3R)-3-[(2-циклопентил-2-гидрокси-2-нафтил)этокси]-1-(3-феноксипропил)-1-азабицикло [2,2,2] октана бромид
30. (2R,3R)-3-[(2-циклопентил1-2-гидрокси-2-(о-хлорфенил))этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2] октана бромид
31. (2R,3R)-3-[(2-циклопентил1-2-гидрокси-2-(3-пиридил))этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
32. (2R,3R)-3-[(2-циклопентил-2-гидрокси-2-(2-фурил))этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
33. (2R,3R)-3-[(2-циклопентил-2-метокси-2-(3-пиридил))этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
Настоящее изобретение предусматривает следующий способ получения соединения структурной формулы (I):
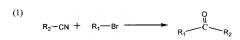
Стадия 1: 1-R1-1-R2 оксиран получали согласно способам, описанным в литературе(1-2) (1. Guangling Wen, Peijin Wu, Improvement on the synthesis method of 3-(2-phenyl-2-cyclopentylethoxyl) quinuclidine hydrochloride, Bullet of the Academy of Millitary Medical Sciences, 1988:470 turn to 402; 2. Peijin Wu, Liuhong Yun, Synthesis of anticholinergic drug of 2-(l-naphthyl)-2-cyclopentyl-2-hydroxylethoxyl cyclohydrocarbyl amine compounds, Chinese Journal of Medicinal Chemistry 1999.6, 9 (2), p. 102-105), и арилгидрокарбилкетон (некоторые виды арилгидрокарбилкетонов были получены по реакции арилцианида с реактивом Гриньяра, приготовленным путем взаимодействия гидрокарбилбромида с магнием в THF, см. схему (1) ниже) реагировал с диметилсульфатом, диметилсульфидом и гидридом натрия с образованием 1-арил-1-гидрокарбилоксирана, то есть интермедиата 1 (см. схему (2) ниже).
Стадия 2. Получение 3-[(2-R1-2-R2-2-гидрокси)этокси]-1-азабицикло[2,2,2]октана в виде свободного основания
Интермедиат 2 может быть получен путем взаимодействия интермедиата 1 с хинуклидинолом (или хинуклидинолом, замещенным R4) в присутствии NaH.
К коммерчески доступным производным 3-хинуклидинола добавляли DMSO, затем добавляли гидрид натрия и полученную смесь выдерживали для реакции при 20-60°С и затем охлаждали до комнатной температуры, и к этой смеси добавляли раствор 1-R1-1-R2-оксирана в DMSO, затем после окончания прикапывания, полученную смесь нагревали при температуре 20-70°С на масляной бане в течение 0.5-12 ч для проведения реакции. Для получения ледяной бани добавляли ледяную воду при внутренней температуре равной 30°С или менее. Реакционную смесь экстрагировали изопропиловым эфиром, эфирные слои соединяли и промывали насыщенным водным раствором NaCl. Органический слой высушивали над безводным сульфатом натрия, осушитель удаляли путем фильтрации и растворитель удаляли в роторном испарителе с получением интермедиата 2 в виде красного маслянистого вещества.
Стадия 3: Очистка 3-[(2-R1-2-R2-2-гидрокси)этокси]-1-азабицикло[2,2,2]октана в виде свободного основания методом колоночной хроматографии и процедура очистки.
Образец описанного выше интермедиата 2 выделяли на колонке с силикагелем, используя аммонированный дихлорметан или трихлорметан и метанол в качестве подвижной фазы и TLC для мониторинга чистоты образца. Интермедиат 2 является смесью, содержащей разные оптические изомеры в зависимости от структуры оптических изомеров хинуклидинола, и в случае указанной системы элюирования, если хинуклидинол имеет S-конфигурацию, интермедиат 2 будет включать два вида конфигураций (2R,3S) и (2S,3S), и может быть очищен с получением двух видов свободных оснований, (2R,3S) и (2S,3S), в зависимости от последовательности элюирования; если хинуклидинол имеет R-конфигурацию, интермедиат 2 будет включать два вида конфигураций (2R,3R) and (2S,3R), и может быть очищен с получением двух видов свободных оснований, (2S,3R) и (2R,3R), в зависимости от последовательности элюирования; если хинуклидинол является рацематом, интермедиат 2 будет включать четыре вида конфигураций (2R,3S), (2S,3S), (2R,3R), (2S,3R), и может быть очищен с получением двух видов свободных оснований, (2R,3S), (2S, 3R) и (2S,3S), (2R,3R), в зависимости от последовательности элюирования. Выделенное свободное основание называется интермедиатом 3.
В трехгорлую колбу добавляли фенол с последующим добавлением гидроксида натрия и раствора Z-Y-Z (где Z обозначал атом галогена) в абсолютном этаноле, и затем происходила реакция полученной смеси при кипячении с обратным холодильником на масляной бане, происходило осаждение белого твердого продукта до практического окончания реакции фенола (мониторинг проводили методом TLC (условия при TLC: петролейный эфир/этилацетат = 5.0 мл/1.0 мл). После завершения реакции твердый продукт удаляли путем фильтрации и растворитель удаляли из фильтрата при 50°С или менее при пониженном давлении при помощи водяного насоса, получая при этом маслянистый продукт, содержащий твердое вещество белого цвета, к которому добавляли петролейный эфир и оставляли на ночь. Осажденный твердый продукт удаляли путем фильтрации и растворитель удаляли из фильтрата при 25-40°С при пониженном давлении водяным насосом, получая при этом маслянистый продукт желтого цвета. Этот маслянистый продукт перегоняли при пониженном давлении, получали бесцветный прозрачный маслянистый продукт, то есть интермедиат 4.
Стадия 5: Получение соединения формулы (I)
Интермедиат 2 или интермедиат 3 помещали в колбу формы "баклажан" с последующим добавлением хлороформа, получали прозрачный раствор желтого цвета, к которому добавляли интермедиат 4 и ацетонитрил, затем полученную смесь перемешивали при комнатной температуре в течение 10-90 ч в атмосфере азота, об окончании реакции следили при помощи TLC (условия TLC: хлороформ/метанол/аммиачная вода = 5.0 мл/1.5 мл/2 к). После завершения реакции растворитель удаляли из реакционного раствора в роторном испарителе при температуре 25-40°С при пониженном давлении водяным насосом, получая при этом маслянистое вещество желтого цвета, к которому добавляли этиловый эфир для осаждения большого количества твердого продукта, который отфильтровывали с отсасыванием с получением твердого вещества почти белого цвета, а именно, титульного соединения формулы (I).
Соединение формулы (I) подвергали взаимодействию с Ag2O для замены галогена гидроксильной группой, которая затем может быть превращена в радикал другой кислоты по реакции с этой другой кислотой. Примеры солей фармацевтически приемлемых кислот включают соль, полученную из неорганической кислоты, такую как гидрохлорид, гидробромид, йодид, нитрат, карбонат, бикарбонат, фосфат, гидрофосфат, дигидрофосфат, сульфат, дисульфат, сульфит, гидросульфит или фосфит; и соль, полученную из сравнительно нетоксичной органической кислоты, такой как, без ограничения, уксусная кислота, пропионовая кислота, изомасляная кислота, малоновая кислота, бензойная кислота, янтарная кислота, субериновая кислота, фумаровая кислота, миндальная кислота, фталевая кислота, бензосульфоновая кислота, п-толуолсульфоновая кислота, лимонная кислота, винная кислота, метансульфоновая кислота, глюкуроновая кислота или галактоновая кислота или т.п. Примеры включают также соль аминокислоты, такой как аргинин или т.п.
Любая фармацевтическая композиция, содержащая одно или более соединений формулы (I), описанных выше, входит в объем настоящего изобретения, путь ее введения может быть, например, оральным, топическим, внутривенным, внутримышечным, внутриартериальным, внутрибрюшинным, ректальным, вагинальным, эндоназальным или ингаляционным. Композиция согласно данному изобретению может быть составлена так, что она является композицией быстрого действия, быстрого высвобождения или длительного действия. Кроме того, соединение вводится скорее топическим путем, а не системным, и в соответствии с репрезентативными примерами композиция согласно данному изобретению содержит лекарства, которые вводятся млекопитающим, предпочтительно людям.
Композиция, содержащая одно или более соединений согласно данному изобретению и подходящие эксципиенты, может вводиться неоднократно или эта композиция может вводиться непрерывно. Подходящие участки для введения включают, но без ограничения, носовую полость, легкое, кровеносный сосуд, мышцу, бронхи и кишечник и желудок. Композиция может быть в виде жидкой дозированной формы, лиофилизированного порошка, твердого или полутвердого продукта, раствора, суспензии, эмульсии, таблеток, пилюль, капсул, порошка, суппозитория, состава для удерживающей клизмы, аэрозоля, порошка для аэрозоля или т.п., предпочтительно в виде стандартной единичной лекарственной формы, подходящей для введения точной дозы. Примеры подходящих эксципиентов включают, но без ограничения, воду, физиологический раствор, лактозу, глюкозу, сахарозу, сорбит, маннит, крахмал, гуммиарабик, фосфат кальция, альгинат, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, сироп, метилцеллюлозу, этилцеллюлозу, гидроксипропилметилцеллюлозу и полиакриловую кислоту. Композиция может также включать смазывающий агент, такой как тальк, стеарат магния и минеральное масло; смачивающий агент; эмульгатор; суспендирующий агент; консервант, такой как метил-, этил- и пропилоксибензоат; регулятор рН, такой как неорганические и органические кислоты и основания; подсластитель и корригент.
В случае парентерального введения композиция может быть в виде стерильного раствора для инъекции и асептически упакованного порошка. Состав для инъекции предпочтительно получают с рН 4.5-7.5.
Фармацевтическая композиция по изобретению может быть в виде оральной лекарственной формы, включая таблетку, капсулу, саше, эмульсию, суспензию, раствор, сироп, эликсир, небулы, пилюли, пастилки, порошка, гранулы и препарат с пролонгированным высвобождением. Подходящие эксципиенты для орального введения включают маннит, лактозу, крахмал, стеарат магния, натриевую соль сахарина, тальк, целлюлозу, глюкозу, желатин, сахарозу, карбонат магния и т.п. наполнители фармацевтической степени чистоты. В случае таблеток для орального введения обычно добавляются традиционно применяемые носители, включающие лактозу и микрокристаллическую целлюлозу, и смазывающий агент, такой как стеарат магния; в случае капсул подходящие носители включают лактозу и сухой кукурузный крахмал; когда для орального введения требуется суспензия, активные ингредиенты смешивают с эмульгатором и суспендирующим агентом, и, если это желательно, добавляют некоторые подсластители, корригенты или красители.
Например, порошок, раствор или суспензия для легочного введения, для назального спрея, орального, топического или внутривенного введения могут быть изготовлены путем растворения или диспергирования одного или более соединений по изобретению и необязательно одного или более фармацевтически приемлемых носителей вспомогательных добавок в носителе, таком как физиологический раствор, водный раствор глюкозы, глицерин, этанол или т.п. Готовят жидкие композиции, и фармацевтический состав в виде жидкой суспензии или раствора может быть получен при использовании стерильной жидкости, такой как масло, вода, этанол и их комбинация; в случае ингаляции для введения в легкие, для назального спрея, для орального или внутривенного введения могут быть добавлены фармацевтически приемлемое поверхностно-активное вещество, суспендирующий агент или эмульгатор; суспензия может содержать масло, такое как арахисовое масло, кунжутное масло, хлопковое масло, кукурузное масло и оливковое масло; суспензия может также содержать эфиры жирных кислот, такие как этилолеат, изопропилмиристат, жирные глицериды и ацетилированные жирные глицериды. Суспензия может также включать спирт, такой как этанол, изопропанол, гексадеканол, глицерин и пропандиол; простой эфир, такой как полиэтиленгликоль; нефтяной углеводород, такой как минеральное масло и вазелин. В составе суспензии может быть также применена вода.
Композиция может быть в виде пилюли, таблетки или капсулы, и, следовательно, композиция может включать один или более разбавителей, таких как лактоза, сахароза, дикальцийфосфат и т.п.; дезинтегрирующий агент, такой как крахмал или его производные; смазывающий агент, такой как стеарат магния и т.п.; и/или связующее, такое как крахмал, гуммиарабик, поливинилпирролидон, желатин, целлюлоза и ее производные. Пилюли, таблетки или капсулы могут быть изготовлены любым способом, известным специалисту в данной области.
Альтернативно, фармацевтическая композиция согласно данному изобретению может быть в виде суппозитория для ректального введения. Такие суппозитории могут быть получены путем смешения лекарственного средства с подходящим нераздражающим эксципиентом, который является твердым при комнатной температуре, но становится жидким при ректальной температуре и тогда высвобождает лекарственное средство в задний проход. Такие эксципиенты включают масло какао, пчелиный воск, полиэтиленгликоль, глицерилстеарат и/или гидрированные глицериды кокосового масла. Композиция, подходящая для ректального введения, может также включать ректальную клизму, которая содержит одно или более соединений по изобретению и фармацевтически приемлемый носитель (например, 50% водный раствор этанола или физиологический раствор), такой носитель является физиологически совместимым с задним проходом и/или прямой кишкой. Ректальная клизма включает наконечник, защищенный инертным колпачком, который предпочтительно изготовлен из полиэтилена, содержащего смазку, такую как белый вазелин, и предпочтительно защищенный обратным клапаном для предотвращения обратного вытекания лекарственного средства. Ректальная клизма имеет достаточную длину, предпочтительно 2 дюйма, чтобы ее можно было вставить в прямую кишку через анальное отверстие.
Фармацевтическая композиция согласно данному изобретению может быть в форме, подходящей для топического введения, особенно когда терапевтические мишени включают участки или органы, в которые эта композиция может быть легко введена топическим способом, болезни этих органов включают заболевания легкого, назальной слизистой оболочки и трахей. Топические составы, подходящие для введения в эти органы, легко приготовить. В случае топического введения композиция, содержащая одно или более соединений по изобретению, может быть в виде назального спрея, раствора для ингаляции, порошка для дозированной ингаляции, раствора для дозированной ингаляции, суспензии для дозированной ингаляции и т.п.
Для введения состава для ингаляции композиция в виде сухого порошка или жидкости может быть помещена в разбрызгиватель. Такие композиции приготавливают в соответствии с методиками, известными в области фармакологии, и композиция в виде жидкости может быть получена в физиологическом растворе вместе с фенилкарбинолом или другими подходящими консервантами, веществом, облегчающим абсорбцию, повышающим биодоступность, фторуглеводородом и/или другим традиционным солюбилизатором или диспергатором.
В аэрозоле для дозированной ингаляции раствора, содержащего одно или более соединений формулы (I), латентный растворитель включает один или более растворителей, выбранных из абсолютного этанола, глицерина и диолов, или их смесь, при этом диолы включают, но без ограничения, этиленгликоль, пропандиол, полиэтиленгликоль 200, полиэтиленгликоль 300, полиэтиленгликоль 400, полиэтиленгликоль 600, полиэтиленгликоль 800 и т.п. Пропеллент (распыляющее вещество) в таком аэрозоле включает одно вещество, выбранное из тетрафторэтана (HFA-134a) и гептафторпропана (HFA-227ea) или их смесь. Поверхностно-активное вещество в указанном аэрозоле включает одно или более веществ, выбранных из олеиновой кислоты; олигомера молочной кислоты (OLA); сорбитанов, таких как Span 20, Span 65, Span 80, Span 85; полиоксиэтиленсорбитанов, таких как Tween 20, Tween 80; полиоксиэтиленовых эфиров жирных спиртов, таких как Bri j30, Bri j35, Cremophor; сополимера полиоксиэтилена и полиоксипропилена, такого как Pluronic F-68; полиэтиленгликольстеаратов, таких как Solutol HS15; фосфолипидов, таких как гранулестен, лецитин. Предпочтительными являются олеиновая кислота, лецитин или их смесь. Содержание соединения формулы I в аэрозоле составляет 0.005~1% по весу, предпочтительно 0.02~0.5%. Содержание латентного растворителя в аэрозоле для ингаляции равно 5~40% по весу, предпочтительно 17.5-29.975%. Содержание поверхностно-активного вещества в аэрозоле для ингаляции равно 0~5% по весу, предпочтительно 0.005~2%. Содержание пропеллента в аэрозоле для ингаляции равно 54~90% по весу, предпочтительно 70~80%.
В случае дозированной ингаляции порошка, содержащего одно или более соединений формулы I по изобретению, указанный инертный носитель включает разбавитель и смазывающее вещество, при этом указанный разбавитель представляет собой одно или более веществ из глюкана, арабинозы, лактозы, маннита, ксилита, сахарозы, фруктозы, сорбита, мальтозы, аминокислоты и глюкозы или их смеси, а указанным смазывающим веществом является стеарат магния или бензоат натрия.
В случае применения дозируемых капель в нос или назального спрея, содержащих одно или более соединений формулы I, указанный инертный носитель представляет собой одно или более соединений, выбранных из бензалконийхлорида, бензалконийбромида, фенилкарбинола, бензойной кислоты, трихлор-трет.бутанола, п-оксибензоатов, сорбиновой кислоты, фенола, тимола и летучего масла, или их смесей.
Более того, данное изобретение предусматривает применение указанной фармацевтической композиции для изготовления лекарственных веществ для предотвращения или лечения различных острых и хронических обструктивных заболеваний дыхательных путей, таких как хроническая обструктивная болезнь легких, бронхиальная астма; а также острый или хронический ринит и послепростудный ринит у млекопитающих и людей.
Соединения формулы (I) и другие активные ингредиенты (например, беклометазона дипропионат, хлортриметон, нафазолин или фенетерол) вводятся в комбинации, которая может быть использована для лечения различных острых и хронических обструктивных заболеваний дыхательных путей, таких как хроническая обструктивная болезнь легких, бронхиальная астма; а также различные риниты.
Для того, чтобы быстро получить терапевтические эффекты и устранить токсические и побочные эффекты при применении лекарства, предполагается, чтобы дневная доза соединения по изобретению составляла 10-1000 мкг, и оптимально, 40-500 мкг.
Помимо указанных репрезентативных лекарственных форм, как известно специалистам в данной области, в данное изобретение также включены другие фармацевтически приемлемые эксципиенты, носители и лекарственные формы. Следует иметь в виду, что конкретные дозы и схема терапевтического лечения для любого конкретного пациента зависят от различных факторов, которые включают активность используемого конкретного соединения, возраст, вес, общее состояние здоровья, пол, систему питания пациента, время введения и скорость выделения, комбинированную терапию, диагноз терапевтов и степень серьезности конкретной болезни, подвергающейся лечению. Количество активных ингредиентов может также зависеть от вида конкретного соединения и других терапевтических лекарств (если они используются) в композиции.
Осуществление изобретения
Получение репрезентативных соединений:
[Пример 1] (2S,3R)-3-[(2-циклопентил1-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
Стадия 1: Получение 1-фенил-1-циклопентилоксирана
1-фенил-1-циклопентилоксиран получали по реакции коммерчески доступного циклопентилфенилкетона в качестве исходного вещества в соответствии с публикацией(1).
Стадия 2: Получение свободного основания 3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-азабицикло [2,2,2]октана из S-3-хинуклидинола
К 18.72 г (147 ммол) коммерчески доступного S-3-хинуклидинола добавляли 190 мл DMSO с последующим добавлением 7.56 г (190 ммол) гидрида натрия, полученную смесь подвергали взаимодействию при 20-60°С в течение 0.5-12 ч и затем охлаждали до комнатной температуры и добавляли раствор 35.72 г (190 ммол) 1-фенил-1-циклопентилоксирана (приготовленного) в 45 мл DMSO, и затем после завершения прикапывания полученную смесь нагревали при температуре 20-70°С на масляной бане для осуществления реакции в течение 0.5-12 ч. Для получения ледяной бани добавляли 120 мл ледяной воды при внутренней температуре бани 30°С или менее. Реакционную смесь экстрагировали изопропиловым эфиром, 100 мл × 3; соединяли эфирные слои и промывали насыщенным водным раствором NaCl, 100 мл × 3. Органический слой сушили над безводным сульфатом натрия в течение ночи, удаляли осушитель путем фильтрации и удаляли растворитель при пониженном давлении с получением 55.7 г свободного основания 3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-азабицикло[2,2,2]октана в виде маслянистого вещества красного цвета с выходом 97.39%. Полученный продукт имел конфигурацию (2R,3S),(2S,3S) свободного основания 3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-азабицикло[2,2,2]октана.
Стадия 3: Очистка свободного основания 3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-азабицикло[2,2,2]октана методом колоночной хроматографии и процедура очистки
В литературе(3) (3. Bingdahl В, Resul В and Dahlbom R. Facile preparation of the enantiomers of 3-acetoxyquinuclidine and 3-quinuclidinol. Acta Pharm Suec, 1979; 16: 281-283), и в литературе(4-5) (4. Jianhua Gao, Guangling Wen, Qikai Zhang, Synthesis and separation of optically pure hydroxyl ether compounds. Acta Pharmaceutica Sinica, 1987; 22 (9): 708-710; 5. Xiangyu Han. Study on the stereoselective synthesis of chiral M receptor antagonists. Reports from Postdoctoral Research Station in Academy of Military Medical Sciences, p.p. 39-40, 2005, Beijing. (Medical Library of Chinese PLA: R914, 20050537)) сообщалось, что хиральная R-или S-конфигурация 3-хинуклидинола в виде сырого продукта реагировала с рацематом 2-фенил-2-циклопентилоксирана или его R- или S-энантиомером, при этом могут быть получены четыре оптических изомера при проведении колоночной хроматографии. Указанные выше литературные источники описывают их абсолютную конфигурацию и в соответствии с номенклатурой хиральный атом углерода в молекуле хинуклидинола обозначается как "3", а хиральный атом углерода, соединенный с арилом, обозначается как "2". В Таблице 1 приведены величины удельного вращения четырех видов чистых хиральных оптических изомеров свободного основания 3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-азабицикло [2,2,2]октана.
Условия измерения удельного вращения: температура 26°С, растворителем являлся метанол и концентрация составляла 0.4%-1%.
Соединение со стадии 2 выделяли на колонке с силикагелем, используя аммонированный дихлорметан или трихлорметан и метанол в качестве подвижной фазы и TLC для мониторинга чистоты образца. Применяя эту систему элюирования, образец смеси обеих конфигураций (2R,3S) и (2S,3S) свободного основания 3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-азабицикло [2,2,2]октана может быть очищен с получением двух видов свободного основания, (2R,3S) и (2S,3S), в зависимости от последовательности элюирования, при этом получали 23.5 г свободного основания (2R,3S)-3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-азабицикло[2,2,2]октана с выходом 86.46% и 21.1 г свободного основания (2S,3S)-3-[(2-циклопентил-2-гидрокси-2-фнил)этокси]-1-азабицикло [2,2,2]октана с выходом 77.63%. Измеренная величина удельного вращения [а]D26 у (2R,3S) была равна +43.95, а измеренная величина удельного вращения [а]D26 (2S,3S) была равна -9.33.
Синтез и идентификация других оснований чистых оптических изомеров соответствовали способам синтеза и очистки описанных чистых оптических изомеров свободного основания 3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-азабицикло-[2,2,2]октана, и сразу же после кватернизации основания получалось титульное соединение, способ получения различных титульных соединений будет проиллюстрирован подробно конкретными примерами синтеза конкретных соединений ниже. Кроме того, когда использовали рацемат хинуклидинола в качестве исходного вещества, полученное основание представляло собой смесь четырех видов оптических изомеров до разделения методом колоночной хроматографии, и конечное титульное соединение также было смесью четырех видов оптических изомеров. Все эти чистые оптические изомеры и смеси оптических изомеров в различных отношениях входят в объем настоящего изобретения.
Стадия 4: Получение 3-бромпропоксибензола
9.507 г (101 ммол) фенола добавляли в трехгорлую колбу объемом 150 мл с последующим добавлением 4.253 г (106 ммол) гидроксида натрия и раствора 52.17 г (258 ммол) 1,3-дибромпропана в 30 мл абсолютного этанола, полученную смесь затем нагревали для проведения реакции и нагревали с обратным холодильником на масляной бане, при этом осаждался белый продукт, пока реакция фенола не была практически завершена, мониторинг осуществляли методом TLC (условия TLC: петролейный эфир/этилацетат = 5.0 мл/1.0 мл). После окончания реакции удаляли твердый продукт путем фильтрации, и растворитель удаляли из фильтрата при температуре 50°С или менее при пониженном давлении с помощью водяного насоса, получая при этом маслянистое вещество, содержащее твердый продукт белого цвета, к которому добавляли петролейный эфир и оставляли на ночь. Осажденное твердое вещество удаляли путем фильтрации и растворитель удаляли из фильтрата при температуре 25-40°С при пониженном давлении с помощью водяного насоса, получали маслянистое вещество желтого цвета. Это маслянистое вещество перегоняли при пониженном давлении, собирали фракцию при 121-123°С/8 мм Hg, получали 12.786 г бесцветного прозрачного маслянистого вещества с выходом 58.9% и степенью чистоты равной 95.60% (определялась методом GC (ГХ)).
1HNMR (CDCl3) (м.д.): δ 7.17-6.77 (m, 5Н), δ 3.96 (t, 2H), δ 3.32 (t, 2H), δ 2.21 (m, 2Н).
Стадия 5: (2R,3S)-3-[(2-циклопентил-2-гидрокси-2-фенил)этокси]-1-(3-феноксипропил)-1-азабицикло[2,2,2]октана бромид
2.871 г (9.1 ммол) (2R,3S)-основания, полученного на стадии 3, добавляли в колбу формы баклажан объемом 100 мл и растворяли, добавляя 18 мл хлороформа, получали прозрачный раствор желтого цвета, к которому добавляли 11.034 г (51.3 ммол) 3-бромпропоксибензола и 50 мл ац