Способ проведения мульти-анализов редких клеток, экстрагированных или выделенных из биологических образцов фильтрацией
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к клинической онкологии для ранней диагностики инвазивного рака. Для этого выделяют или экстрагируют циркулирующие раковые клетки из биологического образца вертикальной фильтрацией через фильтр с размером пор между 3 и 100 мкм, который позволяет удерживать свободно циркулирующие опухолевые редкие клетки, но не препятствует прохождению через фильтр более мелких клеток. Выделенные клетки анализируют методом цитоморфологии, молекулярного анализа или анализа ДНК и/или РНК. Результаты определения используют для диагностики инвазивного рака, выбора таргетного лечения и мониторинга развития устойчивости к лекарственным средствам. Изобретение обеспечивает неинвазивный тест биологического образца для ранней диагностики инвазивного рака у пациентов с подозрением на наличие злокачественных опухолей. 17 з.п. ф-лы, 4 табл., 3 ил., 4 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение включает выделение редких клеток из биологических образцов фильтрацией и последующий анализ этих редких клеток и их компонентов. Редкие клетки имеют признаки или появляются в биологических образцах с частотами, которые отличают их от других типов клеток. Типы редких клеток включают редкие опухолевые или редкие злокачественные опухолевые клетки, редкие типы эндотелиальных клеток, редкие фетальные клетки и редкие инфицированные белые кровяные клетки (лейкоциты).
Уровень техники
Редкие клетки. Редкие клетки присутствуют в абсолютном и относительно низком количестве в биологических образцах, полученных из человека или животных. Наличие редких клеток часто коррелирует с конкретным заболеванием, расстройством или состоянием. Например, редкие опухолевые клетки могут быть обнаружены в крови объектов, с опухолями или злокачественными опухолями.
Типы редких клеток. Существует много различных типов редких клеток и редкие клетки неисключительно могут быть:
- эпителиальными клетками и их предшественниками, мезенхимальными клетками и их предшественниками, зрелыми и незрелыми эндотелиальными клетками и их предшественниками, фибробластами и их предшественниками, и меланоцитами и их предшественниками;
моноцитами и макрофагами и их предшественниками, активированными лимфоцитами и их предшественниками, клетками плазмы и их предшественниками, эозинофилами и их предшественниками, базофилами и их предшественниками и мегакариоцитами и их предшественниками;
- стволовыми клетками любого подтипа;
- фетальными клетками любого происхождения и типа, включая лимфоидные, эритроидные, миелоидные, стволовые фетальные клетки, трофобластные клетки, такие как цитотрофобласты и синцитиотрофобласты, и эмбриональные клетки; и
- опухолевые клетки любого происхождения и типа и любой степени дифференцировки, включая стволовые опухолевые клетки, опухолевые микроэмболы, агрегированные опухолевые клетки, коллективные опухолевые клетки любого типа, и атипичные клетки любого происхождения и типа.
Некоторые типы редких клеток являются патологическими клетками. Примеры таких патологических клеток включают опухолевые или злокачественные опухолевые клетки, такие как клетки, полученные или происходящие из рака легкого, рака простаты, рака толстой кишки, рака молочной железы, рака поджелудочной железы, рака почки, рака печени, рака желудка, рака пищевода, и любого типа карциномы, саркомы, миеломы, меланомы, остеосаркомы, нейробластомы, лейкоза и лимфомы.
Редкие клетки также ассоциированы с состояниями, в которых количество редких клеток в биологическом образце увеличивается или снижается при патологии. Они включают:
- эндотелиальные клетки, присутствующие в патологически более высоких количествах в крови пациентов со злокачественным новообразованием, или пациентов с сердечно-сосудистыми расстройствами, такими как приступ стенокардии;
- клетки, несущие внутриклеточные вирусы, бактерии или другие патогенные агенты, такие как HIV, HBV, HPV, шигелла, лейшмания, бацилла туберкулеза, инфицированные моноциты, инфицированные макрофаги, инфицированные лимфоциты, активированные лимфоциты; и
- клетки, несущие мутации, которые ассоциированы с генетическими заболеваниями, такие как фетальные клетки, пораженные генетическим расстройством, таким как анеуплоидия 21, 13, 18, XXY, ХО, талассемия, муковисцидоз, спинальная мышечная атрофия, Болезнь Дюшенна, болезнь Хантингтона, и т.д., и клетки, несущие генетические мутации или обладающие молекулярными характеристиками, связанными с восприимчивостью к определенным патологиям, таких как вирусные инфекции, воспаления, хронические дегенеративные заболевания, болезнь Альцгеймера, диабет, нарушения обмена веществ.
Редкие клетки также могут быть ассоциированы с непатологическими состояниями, такими как беременность.
Редкие клетки, как правило, могут представлять одну клетку из от около 103 до около 1010 клеток, от около 104 до около 1010 клеток, от около 105 до около 1010 клеток, от около 106 до 1010 клеток, от около 107 до около 1010 клеток, или даже от около 108 до около 1010 клеток клеточной популяции в биологической жидкости. Редкие клетки, как правило, могут представлять менее, чем 500 клеток в 1 мл биологической жидкости, менее, чем 200 клеток в 1 мл биологической жидкости, менее, чем 100 клеток в 1 мл биологической жидкости, менее, чем 50 клеток в 1 мл биологической жидкости, или даже менее, чем 10 клеток в 1 мл биологической жидкости. Например, известно, что циркулирующие опухолевые клетки (англ. circulating tumor cells, СТС), как правило, присутствуют в количестве 1-10 или 1-500 СТС на 6×106 лейкоцитов, около 2×108 тромбоцитов и около 4×109 эритроцитов на мл крови [75].
Существующие способы выделения редких клеток.
Редкие клетки могут быть экстрагированы или выделены из биологических образцов. Экстрагированные клетки являются клетками, экстрагированными из жидкого образца без отделения от других клеток. Выделенные клетки являются редкими клетками, выделенными из других типов клеток, присутствующих в жидком образце. Пропорция редких относительно нередких клеток, экстрагированных или выделенных из биологических образцов, варьирует таким образом, что степень чистоты выделенных или экстрагированных редких клеток может быть вариабельной.
Некоторые способы были предложены для экстракции или выделения редких клеток из биологических образцов; в частности, сообщалось о нескольких способах выделения опухолевых или фетальных клеток из крови. Однако эти способы не решали тройную проблему экстракции или выделения редких клеток с (i) минимальными или отсутствующими потерями, (ii) экстракции или выделения редких клеток с минимальной или отсутствующей ошибкой выборки, и (iii) экстракции или выделения редких клеток путем, который позволяет осуществить их гибкое или одновременное применение во множестве аналитических процедур.
Способы, которые только извлекают некоторые из редких клеток в образце, количественно ухудшают применение выделенных или экстрагированных клеток в последующих аналитических процедурах. Эти способы также могут внести ошибку выборки.
Ошибка выборки происходит, когда способ экстракции или выделения приводит к потере одного из нескольких типов выбранных редких клеток в образце. Например, способ, который выделяет опухолевые клетки из образца крови путем связывания редких опухолевых клеток с антителами против эпителиальных клеток приводит к потере редких опухолевых клеток, которые не экспрессируют антигены эпителиальных клеток, которые связываются с антителом.
Грубые процедуры экстракции или выделения или процедуры, которые в ином случае изменяют детектируемые признаки выделенных или экстрагированных редких клеток компрометируют их применение в последующих аналитических процедурах.
Диагностическая важность редких клеток. Обнаружение и описание редких клеток и их применение в диагностике и терапии, как ожидается, будет иметь возрастающую важность в медицине, ветеринарии и науке. Редкие клетки особенно ценны для применения в персонализированной медицине или тераностике, способе индивидуализированной диагностической терапии для пациента, основанной на его или ее конкретных генетических характеристиках и на характеристиках его или ее редких клеток. В данных условиях редкие клетки необходимо анализировать множественными подходами, обеспечивающими их диагностическую идентификацию и широкое описание. Как пример, редкие клетки, выделенные из крови пациентов, пораженных злокачественным новообразованием, могут быть охарактеризованы с помощью молекулярных анализов, целью которых является обнаружение генных мутаций с прогностическим и/или тераностическим значением. Однако если осуществляются только молекулярные анализы, нацеленные на генные мутации, без анализов, имеющих целью диагностику наличия или отсутствия опухолевых клеток в крови, результаты теста могут зависеть от ошибки. Фактически если редкие клетки, выделенные из крови данного пациента, не содержат опухолевых клеток, отсутствие генной мутации в выделенных редких клетках не будет служить указанием на отсутствие генной мутации в циркулирующих опухолевых клетках. Поэтому множественные анализы, осуществленные на редких клетках, экстрагированных или выделенных из биологических образцов, необходимы для того, чтобы получить надежную информацию, которая будет использоваться для выбора целевых методов лечения, следовать их эффективности и для детекции возможно лекарственной устойчивости.
Более того, редкие клетки, экстрагированные или выделенные из крови или других биологических образцов, могут быть использованы в качестве альтернативы образцам, полученных через инвазивные или полухирургические способы, включающие неисключительно хирургические или полухирургические вмешательства, биопсию, лапаратоцентез, парацентез, спинальную пункцию, амниоцентез, биопсию ворсин хориона и кордоцентез. В данных условиях редкие клетки представляют ценный материал, который необходим для детального исследования путем множественных анализов для диагностики и/или тераностического применения или для интенсивной молекулярной и/или генетической характеризации.
Редкие клетки, полученные из рака легкого. Рак легкого является наиболее распространенной неоплазией и основной причиной связанной с опухолями смертностью в мире [1-5]. Несмотря на недавние успехи в лечении резектированных раков легкого и более эффективном лечении метастатических опухолей, показатель эффективности лечения пациентов с раком легкого остается низким. Однако недавнее открытие ведущих онкогенных мутаций в карциномах легкого и растущая разработка таргетных терапий демонстрирует новые ободряющие результаты у пациентов с поздней стадией [6-8]. В числе таких терапий используются гефитиниб и эрлотиниб, тирозин-киназные ингибиторы, созданные против рецептора эпидермального фактора роста (EGFR), который обнаруживает активирующую тирозин мутацию в 10-20% аденокарцином [7, 9]. Совсем недавно была идентифицирована геномная перестройка, в которую вовлечены гены киназы анапластической лимфомы (ALK) (2р23) и белка-4, подобного белку, ассоциированному с микротрубочками эхинодерма (EML4) (2р21), в подмножестве пациентов с раком легкого, имеющих явный благоприятный ответ на низкомолекулярный ингибитор ALK (кризотиниб) [7, 10-13]. Реаранжировка гена ALK была обнаружена в 1-7% немелкоклеточного рака легкого (англ. non-small cell lung cancer, NSCLC) согласно большинству из серии без KRAS и EGFR ассоциированных мутаций в большинстве опухолей [10, 12-14]. Специфические гистологические признаки, характеризующие это подмножество ALK-положительных аденокарцином легкого, демонстрируют солидный или ацинарный паттерн роста, решетчатую структуру, наличие слизистых клеток (кольцевидные клетки или бокаловидные клетки), обильную внеклеточную слизь, утрату роста по стенкам альвеол, и утрату значимого ядерного плеоморфизма [14]. Более того, пациенты с опухолями с реаранжировкой ALK были моложе, чаще были мужчинами, в большинстве серий, и никогда не были курильщиками/бывшими незаядлыми курильщиками [12, 14].
Циркулирующие опухолевые клетки (СТС) могут быть выделены из более чем 40% пациентов с раком легкого в соответствии с сериями и способами [15-17]. Более того, прогноз пациентов с раком легкого, как в поздней, так и в ранней стадиях заболевания коррелирует с наличием и количеством СТС [15, 16]. СТС могут быть выделены различными прямыми и непрямыми способами [18, 19]. Геномные изменения, особенно мутации происходящие в гене EGFR, были продемонстрированы в СТС, выделенных у пациентов с NSCLC [20].
Авторы ранее продемонстрировали, что СТС могут быть выделены различными способами, даже в ранней стадии заболевания из пациентов, подвергнутых хирургии карциномы легкого [15, 21]. Более того, наличие и количество СТС было ассоциировано с плохим прогнозом [15]. Интересно, что при использовании прямого способа, в котором СТС выделяются согласно их размеру (англ. ISET, Isolation by Size of Epithelial Tumor cells, выделение клеток эпителиальной опухоли по размеру) авторы определили злокачественные цитопатологические критерии, которые позволяют осуществить хорошее описание СТС по злокачественным признакам [22, 23]. Кроме того, путем применения подхода иммуноцитохимии (англ. immunocytochemistry, ICC) к СТС, выделенным с помощью ISET из пациентов с NSCLC, наша группа и другая группа показали, что варьирующее количество СТС демонстрирует фенотип эпителиально-мезенхимального перехода (ЕМТ) [17, 21, 24, 25].
Об оценке реаранжировки гена ALK в СТС, выделенных из пациентов с раком легкого, не сообщалось. Такая оценка является уместной клинической целью для неинвазивного предварительного скрининга пациентов с раком легкого для того, чтобы избежать потенциальной смертности, связанной с биопсией легкого и удалением опухолевой ткани.
Трофобластные редкие клетки. Сообщалось о неинвазивных способах выделения трофобластных клеток из материнской крови, например, как описано в патенте США 7,651,838, выданном 26 января 2010 года. Однако существует потребность в способах получения трофобластных клеток из образцов шейки посредством полностью неинвазивного и безопасного (например, без риска индукции невынашивания) подхода. Такие способы должны сообразно выделять трофобластные клетки из беременных женщин, для того, чтобы данный подход был полезен для неинвазивного пренатального диагноза генетических дефектов, заболеваний или расстройств (Imudia AN, Kumar S, Diamond MP, DeChemey AH, Armant DR. Transcervical retrieval of fetal cells in the practice of modern medicine: a review of the current literature and future direction. Fertil Steril. 2010: 93:1725-30). Например, диагноз фетальной трисомии по 21 хромосоме у беременных женщин может быть достигнут путем экстракции чистой ДНК и анализа чистой фетальной ДНК секвенированием следующего поколения. Если количество свободной фетальной ДНК слишком низкое и для надежных результатов о наличии или отсутствии фетальной анеуплоидии не может быть получено достаточное количество, то, таким образом, для осуществления неинвазивного пренатального диагноза могут быть проанализированы фетальные клетки. В патенте США 7,651,838 описано выделение трофобластных клеток из крови с помощью неинвазивного способа. Трофобластные клетки могут быть выделены или экстрагированы из образцов шейки, но не было известно как сообразно и неинвазивно (без риска индукции невынашивания) получить трофобластные клетки из образцов шейки, из цервикальной слизи, из образцов, полученных из слизистой мембраны (Imudia AN, et al Fertil Steril. 2010: 93:1725-30).
Авторы искали решение проблемы, описанной выше, путем экстракции редких клеток из биологических образцов, таких как кровь и слизистые секреты, с использованием фильтрации и других процедур выделения и анализа, описанных в данном документе.
Раскрытие изобретения
Способы, описанные в данном документе, решают эти проблемы и задачи с помощью фильтрации в качестве наиболее подходящего пути экстракции или выделения редких клеток из биологических образцов. После экстракции или выделения фильтрацией, редкие клетки находятся в состоянии, подходящем для множественных или даже одновременных аналитических процедур. Этот способ эффективно выделяет или экстрагирует редкие клетки из биологического образца, идентифицирует редкие клетки, и затем молекулярно характеризует редкие клетки для диагностических целей, и для выбора, руководства, отслеживания лечения и в частности, для выбора целевых обработок и для отслеживания ответа и/или устойчивости к нему.
Изобретение включает различные режимы анализа или описания редких клеток. Они включают (i) применение количественного и качественного анализа редких клеток, выделенных фильтрацией для диагностических или тераностических целей и для последующего выбора терапии; (ii) «качественный анализ» включает множественные анализы, осуществленные на тех же самых редких клетках, выделенных фильтрацией. Множественные анализы на том же самом образце позволяют избежать проблем, связанных с условиями, в которых редкие клетки являются неизбыточными, или с биологическими образцами, которые содержат низкое количество редких клеток; (iii) «количественный анализ», включающий выделение нефиксированных (свежих) редких клеток фильтрацией позволяющей их культивирование и анализ РНК; (iv) использование циркулирующих опухолевых клеток, выделенных фильтрацией для ранней диагностики инвазивных злокачественных опухолей; и (v) использование трофобластных клеток, выделенных из образцов слизистой шейки матки, для неинвазивной пренатальной диагностики генетических расстройств.
В одном из этих аспектов, изобретение является способом для идентификации, диагностики или обеспечения прогноза состояния, расстройства или заболевания, ассоциированного с редкими клетками, включающего (а) выделение или экстракцию редких клеток путем проведения биологического образца через фильтр и извлечение выделенных редких клеток на фильтре; где фильтр имеет размер пор, плотность пор или другие физические характеристики, которые пропускают редкие клетки, но которые препятствуют прохождению других типов клеток; (b) определение цитоморфологии, и/или иммуномечения, и/или молекулярного анализа выделенных или экстрагированных редких клеток. Этот процесс может быть использован для выделения, экстракции, концентрирования или в ином случае очистки редких клеток в представляющем интерес биологическом образце. Биологический образец может быть любым, который содержит или который предположительно содержит редкие клетки. Биологический образец включает кровь и другие внеклеточные жидкости, биологические жидкости, отличные от крови, такие как амниотические жидкости, водянистая влага и стекловидное тело, желчь, сыворотка крови, плазма крови, грудное молоко, цереброспинальная жидкость, ушная сера, эндолимфа, перилимфа, женский эякулят, желудочный сок, слизь, включая отделяемое носа, флегма и другой материал, собранный из слизистой мембраны, перитонеальная жидкость, плевральная жидкость, слюна, кожное сало, сперма, пот, слезы, вагинальный секрет, рвотная масса и моча. Такие биологические образцы предпочтительно получают неинвазивно, однако образцы могут быть получены из биопсийных тканей или из клеточных суспензий, сделанных из твердых или полутвердых тканевых образцов.
Биологический образец может быть получен из представляющего интерес объекта, такого как объект, имеющий злокачественную опухоль или опухоль, предположительно имеющий злокачественную опухоль или опухоль, или имеющий риск развития злокачественной опухоли или опухоли. Образцы также могут быть получены из объекта, о котором известно, что он имеет, предположительно имеет или имеет риск развития любого другого состояния, расстройства или заболевания, ассоциированного с или вызванного редкими клетками, такого как незлокачественные пролиферативные состояния, расстройства или заболевания. Например, биологический образец может быть получен из объекта, у которого воспалительное и/или дегенеративное состояние, расстройство или заболевание, или у которого подразумевается наличие или имеется риск воспалительного и/или дегенеративного состояния, расстройства или заболевания; из объекта, у которого имеется сердечнососудистое состояние, расстройство или заболевание, или у которого подразумевается наличие или имеется риск сердечнососудистого состояния, расстройства или заболевания; или из объекта, у которого имеется инфекционное состояние, расстройство или заболевание, или которого подразумевается наличие или имеется риск инфекционного состояния, расстройства или заболевания.
В способе, описанном выше, в стадии (а) редкие клетки могут быть выделены, экстрагированы или сконцентрированы или, в ином случае, очищены путем проведения биологического образца через поликарбонатный фильтр, PET (полиэтилен терефталат), или другой подходящий пористый фильтр или материал и путем выделения клеток на поликарбонатной фильтре.
Биологический образец может быть свежим, таким как образец, недавно забранный из объекта, хранимым образцом, таким как законсервированный, охлажденный или замороженный образец, или образец, подвергнутый другой обработке, такой как фиксация. В зависимости от типа биологического образца, он может быть обработан муколитическим агентом, антикоагулятном, протеазой или обработкой с литическим агентом, который селективно удаляется определенные типы клеток в биологическом образце, в условиях сохранения редких клеток в образце.
Перед проведением через фильтр биологический образец может быть разведен или в ином случае обработан для облегчения выделения, экстракции, концентрации или очистки редких клеток.
Редкие клетки, которые выделены, экстрагированы, сконцентрированы или в ином случае очищены процессом фильтрации, описанным в данном документе, могут быть перенесены на подложку перед дальнейшими анализами как в (b) или для культивирования.
Редкие клетки могут быть собраны индивидуально для молекулярного анализа после их выделения или экстракции с помощью фильтрации, или множество или все редкие клетки, выделенные или экстрагированные из биологического образца фильтрацией, могут быть собраны для анализа в (b). Более того, выделенные или экстрагированные редкие клетки могут быть культивированы или размножены перед анализом в (Ъ). Например, редкие клетки могут быть культивированы в присутствии или отсутствии специфического лекарственного средства или агента, такого как биологический, химический или радиологический агент, для определения их ответа на лекарственное средство, или по сравнению с редкими клетками, которые не были обработаны. Этот способ может быть использован для селективных обработок, направленных на редкие клетки, выделенные из конкретного пациента или для отслеживания ответа пациента на обработку или отслеживания развития устойчивости к лечению конкретным лекарственным средством или агентом.
Перед анализом в (b) выделенные или экстрагированные редкие клетки могут быть зафиксированы или окрашены либо in situ на фильтре, используемом для их выделения, либо после удаления с фильтров. Например, выделенные или экстрагированные редкие клетки могут быть проанализированы в (b) молекулярным анализом in situ после или перед окрашиванием или иммуноокрашиванием, либо на фильтре, либо на другом субстрате; или (b) могут включать цитоморфологический анализ выделенных или экстрагированных редких клеток in situ на фильтре или другой подложке, на которую выделенные редкие клетки (или впоследствии культивируемые или размноженные редкие клетки) перенесены. Выделенные или экстрагированные редкие клетки могут быть проанализированы или оценены другими способами, которые не требуют их прикрепления к подложке.
В способах, описанных в данном документе, (b) может включать молекулярный анализ белков, нуклеиновых кислот или других компонентов выделенных или экстрагированных редких клеток in situ на фильтре или другом субстрате, на который редкие клетки, или культивируемые редкие клетки, нанесены. Например, молекулярный анализ в (b) может включать молекулярный анализ белков, пептидов или полипептидов, выделенных или экстрагированных редких клеток; ДНК, РНК или микроРНК выделенных или экстрагированных редких клеток; или других компонентов редких клеток, помимо полипептидов или нуклеиновых кислот.
Процессы, описанные в данном документе, могут также включать (b1) визуализацию изображений выделенных или экстрагированных редких клеток после цитоморфологического анализа, иммуномечения или in situ молекулярного анализа и/или (Ь2) запись изображений выделенных или экстрагированных редких клеток после цитоморфологического анализа, иммуномечения или in situ молекулярного анализа.
В другом воплощении изобретение направлено на способ обнаружение наличия или отсутствия редких клеток, включающий (а) выделение, экстракцию, концентрирование или в иному случае очистку редких клеток, путем проведения биологического образца через фильтр и извлечение редких клеток на фильтре; где фильтр имеет размер пор, плотность пор или другие физические характеристики, которые удерживают редкие клетки, но позволяют пройти другим типам клеток; (b) необязательно, культивирование выделенных или экстрагированых редких клеток; (с) необязательно, фиксирование или окрашивание выделенных или экстрагированных редких клеток или необязательно культивируемых редких клеток; и (d) анализ выделенных или экстрагированных редких клеток из (а), (b) или (с) с помощью иммуномечения, и/или in situ молекулярного анализа ДНК, РНК и/или микроРНК, и/или молекулярного анализа белковых молекул редких клеток. Этот способ может использовать те же типы биологических образцов, что и описанные выше, и может выделять или экстрагировать редкие клетки после разведения биологического образца или предварительной обработки биологического образца, как описано выше. Редкие клетки после фильтрации также могут быть зафиксированы или использованы свежими или подвергнуты другим обработкам или стадиям, описанным выше. В стадии (d) выделенные, сконцентрированные, экстрагированные или в ином случае очищенные редкие клетки могут быть лизированы или использованы в интактном виде.
При лизисе выделенных или экстрагированных редких клеток (d) возможна детекция мутантного(ых) белка(ов) и/или мутантной РНК и/или мутации(ий) ДНК, ассоциированных с состоянием, расстройством или заболеванием. Например, редкие клетки могут быть лизированы для выделения полипептидов или других иммунологических компонентов, содержащихся внутри редких клеток, лизированных для выделения, концентрирования или в ином случае очистки компонентов, которые должны быть обнаружены, или лизированы для выделения нуклеиновых кислот для молекулярного анализа.
Этот способ может дополнительно включать выбор таргетного лечения для персонализированной медицины, для оценки эффективности лечения, или для обнаружения возможной устойчивости к лечению, основанном на обнаружении мутантной ДНК, и/или мутантной РНК, и/или мутантного(ых) белка(ов) в лизированных редких клетках. Например, после лизиса редких клеток (d) может быть осуществлено обнаружение наличия или отсутствия мутаций ALK в лизированных редких клетках; обнаружение наличия или отсутствия мутаций ALK в лизированных редких клетках, где указанный процесс дополнительно включает выбор лечения для объекта, затем определение эффективности лечения или обнаружение устойчивости к лечению на основе наличия или отсутствия мутации ALK; обнаружение наличия или отсутствия мутации K-RAS и/или EGFR в лизированных редких клетках, где указанный способ дополнительно включает выбор лечения объекта, затем определение эффективности лечения, или обнаружение устойчивости к лечению, основанном на наличии или отсутствии мутации K-RAS и/или EGFR; или обнаружение наличия или отсутствия мутации B-RAF и/или HER2 в лизированных редких клетках, где указанный способ дополнительно включает выбор лечения объекта, затем определение эффективности лечения, или обнаружение устойчивости к лечению, основанном на наличии или отсутствии мутаций B-RAF и/или HER2.
Изобретение также относится к персонализированному лечению, включающему повторы способов, описанных выше, с использованием биологических образцов, полученных из одного и того же объекта в различные периоды времени. Например, образцы редких клеток могут быть выделены из объекта до обработки лекарственным средством или другим агентом, снова или несколько раз в течение курса лечения, или снова после окончания лечения. Это позволяет дать долгосрочную оценку эффективности лечения.
Таким образом биологические образцы, полученные из одного и того же пациента перед и после лечения, в различные временные точки в ходе лечения состояния, или в ходе различных режимов лечения состояния, расстройства или заболевания, ассоциированного с редкими клетками. Такое персонализированное лечение также может включать (е) и/или (f), которые включают дополнительно сравнение количества редких клеток между образцами, полученными в различные моменты времени для определения эффективности схемы лечения или для детекции устойчивости схемы лечения, где снижение относительного количества детектированных редких клеток указывает на относительную эффективность схемы лечения, и где увеличение относительного количества детектированных редких клеток указывает на устойчивость к или неэффективность схемы лечения; и необязательно, (f) выбор эффективного персонализированного таргетного лечения для объекта на основании (е).
Тип или идентичность или происхождение редких клеток могут быть определены, например, иммунологически, путем окрашивания, по внешнему виду, или молекулярным анализом их белков, нуклеиновых кислот или других компонентов. Например, (d) может включать анализ выделенных или экстрагированных редких клеток, включающий определение статуса эпителиально-мезенхимального перехода редких клеток; может включать анализ выделенных или экстрагированных редких клеток, включающий определение статуса стволовых редких клеток; или может включать анализ выделенных или экстрагированных редких клеток путем определения наличия у редких клеток сигнатуры генной экспрессии, ассоциированной с метастатическими или инвазивными клетками, или определения экспрессии у редких клеток детерминант, ассоциированных с метастазированием или инвазией.
Способ, описанный здесь, также дополнительно может включать постановку раннего диагноза состояния, расстройства или заболевания, ассоциированного с редкими клетками, на основании (d) или прогноз состояния. Например, способы, описанные выше, могут включать постановку раннего диагноза злокачественной опухоли и/или инвазивной злокачественной опухоли, ассоциированной с редкими клетками, на основании (d); могут включать постановку раннего диагноза органа, из которого произошла злокачественная опухоль и/или инвазивная злокачественная опухоль; или могут включать постановку раннего диагноза инфекционного состояния, расстройства или заболевания, ассоциированного с редкими клетками на основании (d).
Способы, описанные здесь, могут дополнительно включать оценку эффективности лекарственного средства-кандидата или кандидатного лечения на молекулярные характеристики редких клеток, и выбор лекарственного средства или лечения, которые уменьшают количество редких клеток в объекте по сравнению с контролем, не получавшим лекарственное средство или лечение, и выбор лекарственного средства или лечения, которое уменьшает относительное количество редких клеток или модифицирует молекулярные или иммунологические характеристики редких клеток по сравнению с контролем.
Способы, описанные здесь, также могут включать оценку склонности и/или риска развития у объекта состояния, расстройства или заболевания, ассоциированного с исходным уровнем, или контрольное значение, указывающее на склонность или повышенный риск развития указанного состояния, расстройства или заболевания, или где молекулярное или иммунологическое изменение в редких клетках по сравнению с исходным уровнем или контрольным значением указывает на склонность или повышенный риск развития указанного состояния, расстройства или заболевания. Например, они могут включать оценку склонности и/или риска развития у объекта генетического состояния, расстройства или заболевания; злокачественной опухоли, опухоли или неопластического состояния, расстройства или заболевания; или инфекционного состояния, расстройства или заболевания.
В дополнение к процессам и способам, описанным здесь, настоящее изобретение также относится к набору, содержащему, по меньшей мере, один из одного или нескольких фильтров для экстракции или выделения редких клеток из биологической жидкости, один или несколько буферов, разбавителей или других агентов для обработки биологической жидкости перед фильтрацией, один или несколько буферов для суспендирования, отмывки или иной обработки редких клеток после того, как они будут экстрагированы или выделены из биологической жидкости, один или несколько буферов для переноса выделенных или экстрагированных редких клеток с фильтра на другую подложку, один или несколько цитоморфологических и/или цитохимических реактивов или других клеточных красителей, или буферов к этому, одно или несколько антител или других реагентов для иммунномечения редких клеток или буферов к этому, один или несколько реактивов для in situ анализа редких клеток на фильтре или другой подложке, один или несколько литических агентов или лизирующих буферов для лизиса редких клеток, одно или несколько антител или других реактивов для молекулярного анализа белков редких клеток или буферов к этому, один или несколько зондов, праймеров, нуклеотидов, ферментов или других реактивов для молекулярного анализа нуклеиновых кислот редких клеток, в том числе с помощью ПНР.
Изобретение также направлено на композиции, включающие одну или несколько редких клеток, выделенных, сконцентрированных, эктрагированных или в ином случае очищенных путем проведения биологического образца через фильтр и извлечения выделенных редких клеток на фильтре; где фильтр имеет размер пор, плотность пор или другие физические характеристики, которые позволяют удержать редкие клетки, но которые позволяют проходить другим типам клеток, а также на фильтр, или другую подложку, содержащую редкие клетки.
Набор, содержащий инструменты, оборудование и/или реактивы, для окончания как стадии фильтрации, так и различных типов множественных анализов, осуществляемых после фильтрации, может быть собран для облегчения способов, описанных выше.
Краткое описание чертежей
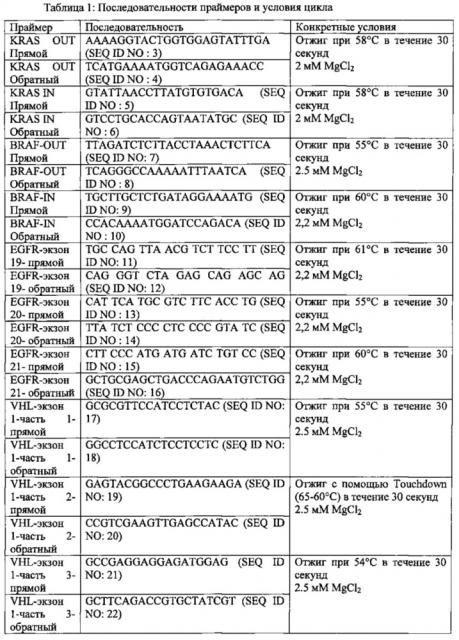
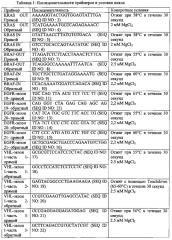
Фигура 1А. А (Случай 1) и В (Случай 2). A1 и В1. Циркулирующие опухолевые клетки, демонстрирующие интенсивное и цитоплазматическое окрашивание (балл 3+) с некоторыми мембранными утолщениями (стрелки) (ALK-иммуноокрашивание с использованием мАт 5 A4, иммунопероксидазы, исходное увеличение × 1000; измерительная полоска: 16 μΜ). А2 и В2. Ядра циркулирующих клеток гибридизованные двхцветным 2р23 LSI ALK локус-специфичным сплит-зондом. Два зонда (3', красный; 5', зеленый) демонстрируют различное разделение красного и зеленого сигналов (стрелки-указатели), что указывает на реаранжировку в 2р23 локусе гена ALK. Зонды дают перекрывающиеся сигналы в ядрах без реаранжировки (стрелки). Выделенные 3' сигналы (красный) также наблюдаются (звездочки) (исходное увеличение × 1000; измерительная полоска: 16 μм). A3 и В3. Циркулирующие клетки, демонстрирующие цитоморфологические критерии, выделяли способом ISET (исходное увеличение × 1000; MGG окрашивание; измерительная полоска: 16 μм). С. Один пациент с отрицательным FISH ALK и отрицательным IHC ALK в тканевой опухоли. C1. Циркулирующие опухолевые клетки, не демонстрируют окрашивание (балл 0) (ALK-иммуноокрашивание с использованием мАт 5A4, иммунопероксидаза, исходное увеличение × 1000; измерительная полоска: 16 μм). С2. Ядра циркулирующих клеток, гибридизованные двухцветным 2р23 LSI ALK локус-специфичным сплит-зондом. Два зонда (3', красный; 5', зеленый) демонстрируют перекрывающиеся сигналы в ядре без реаранжировки (стрелки). Разделение сигналов не детектировалось в этих опухолевых клетках (исходное увеличение × 1000; измерительная полоска: 16 μм). С3. Циркулирующие клетки, демонстрирующие цитоморфологические критерии, выделяли способом ISET (исходное увеличение × 1000; MGG окрашивание; измерительная полоска: 16 μм). D. Клетки Н22213 выделяли способом ISET. DI ALK-иммуноокрашивание с использованием мАт 5A4 (иммунопероксидаза, исходное увеличение × 1000), демонстрирует интенсивное и цитоплазматическое окрашивание (балл 3+) с некоторыми мембранными утолщениями (стрелки). D2. FISH с использованием двухцветного 2р23 LSI ALK локус-специфичной сплит-зонда на опухолевой клеточной линии Н2228, внесенной в периферическую кровь и далее выделенной с помощью способа ISET. Два зонда (3', красный; 5', зеленый) демонстрируют различное разделение красного и зеленого сигналов (стрелки-указатели), что указывает на реаранжировку в локусе 2р23,