Новые антиинвазивные соединения
Иллюстрации
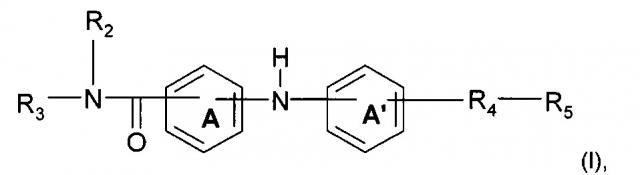
Показать всеИзобретение относится к соединениям формулы (I) или их фармацевтически приемлемым солям, которые могут найти применение для предупреждения, и/или ингибирования, и/или лечения рака. В формуле (I) А и А' независимо представляют собой фениленовую группу или пиридиленовую группу; R2 представляет собой атом водорода или алкильную группу (С1-С4); R3 представляет собой 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-пиримидинильную группу, 4-пиримидинильную группу или 5-пиримидинильную группу; R4 представляет собой карбонильную группу или сульфонильную группу; R5 представляет собой группу -NH-(CH2)a-NR6R7 или 4-метилпиперазинильную группу, причем а представляет собой целое число от 1 до 4, R6 и R7 независимо представляют собой алкильную группу (С1-С4) или R6 и R7 вместе с атомом азота, с которым они связаны, образуют гетероциклическую группу, которую выбирают из 4-метилпиперазинильной группы, морфолиногруппы, пирролидинильной группы и пиперидиногруппы. Изобретение относится также к способу получения соединений формулы (I) и содержащей их фармацевтической композиции. 3 н. и 13 з.п. ф-лы, 6 табл., 17 пр.
Реферат
В общем, настоящее изобретение относится к применению соединений для получения композиций, применяемых для лечения рака.
В большей части видов рака смертность обусловлена не первичной опухолью, а скорее вторичными метастазами. Данное злокачественное развитие, которое приводит к инвазии опухоли и клинически определяется появлением метастазов, представляет собой окончательный результат первичной потери клеточной адгезии и повышения клеточной подвижности, которые вместе позволяют инвазивной клетке покидать исходное место опухоли и колонизировать разные ткани-мишени.
Метастазы рассматривают, как признак повторно возникающего неконтролируемого злокачественного развития рака. Во время данного процесса опухолевые клетки завершают свою злокачественную трансформацию путем повышения своей способности к миграции. Раковые клетки могут затем распространяться и образовывать опухолевые очаги в отдаленных местах. Распространение раковых клеток в организме представляет собой результат ряда событий, называемого "метастатическим каскадом": инвазия тканей вокруг опухоли, венозная или лимфатическая интравазация, миграция и установление в удаленном месте новой колонии, которая устойчива ко всем защитным механизмам организма.
Метастатическая инвазия, против которой не существует эффективного возможного способа лечения, доступного в настоящее время, представляет собой бесспорно главную причину смерти. В связи с частотой видов рака, диагностируемых на метастатической стадии, и безвыходным положением с терапевтической точки зрения, которое они представляют, разработка молекул, которые специфично нацелены на метастатическую инвазию, таким образом, представляет собой крайне важное требование к качественному изменению в способах лечения рака.
В документе WO 2009/087238 описаны соединения, которые могут быть применимы для лечения рака. Как видно ниже в данном документе, в примере 17 приведены сравнительные данные, где близкое соединение, как описано в указанном документе, неожиданно является менее активным в тесте инвазии, чем заявленное соединение.
В настоящее время обнаружили, что производные формулы (I), как определено ниже в данном документе, способны предотвращать, как проиллюстрировано в экспериментальных данных ниже в данном документе, инвазивное развитие метастатических видов рака, и на основе такой активности соединения применимы для лечении рака.
Вследствие этого, настоящее изобретение относится к соединениям формулы (I) и их фармацевтически приемлемым солям как таковым, как определено ниже.
Кроме того, настоящее изобретение относится к соединениям формулы (I), как определено ниже, для применения в качестве лекарственных средств и более конкретно для применения для предупреждения и/или ингибирования, и/или лечения рака.
Кроме того, настоящее изобретение относится к способу предупреждения, ингибирования или лечения рака, который включает по меньшей мере одну стадию, заключающуюся во введении пациенту, нуждающемуся в этом, эффективного количества соединения, как определено ниже в формуле (I), или одной из его фармацевтически приемлемых солей.
Настоящее изобретение дополнительно относится к способу получения указанных соединений формулы (I).
Согласно настоящему изобретению также предложены фармацевтические композиции, содержащие по меньшей мере одно из указанных соединений формулы (I).
Согласно одному аспекту предмет настоящего изобретения относится к соединению формулы (I):
где А и А' независимо представляют собой фениленовую группу или пиридиленовую группу;
R2 представляет собой атом водорода или алкильную группу (C1-C4);
R3 представляет собой 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-пиримидинильную группу, 4-пиримидинильную группу или 5-пиримидинильную группу;
R4 представляет собой карбонильную группу или сульфонильную группу; и
R5 представляет собой группу NH-(CH2)a-NR6R7 или 4-метилпиперазинильную группу, причем а представляет собой целое число от 1 до 4, R6 и R7 независимо представляют собой алкильную группу (С2-С4) или R6 и R7 вместе с атомом азота, с которым они связаны, образуют гетероциклическую группу, которую выбирают из 4-метилпиперазинильной группы, морфолиногруппы, пирролидинильной группы и пиперидиногруппы;
или любой из его фармацевтически приемлемых солей.
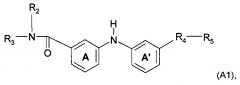
Согласно предпочтительному воплощению настоящее изобретение относится к соединению формулы (I), где группа -NH- между А и A' и группа -R4-R5 находятся в мета-положении друг от друга относительно A'.
Согласно предпочтительному воплощению настоящее изобретение относится к соединению формулы (А1):
где A, A', R2, R3, R4 и R5 являются такими, как определено выше.
Настоящее изобретение охватывает воплощения, которые описаны ниже в данном документе, где положения замещающих групп в положениях А и A' соответствуют структуре формулы (А1), как описано выше, то есть мета-положению в отношении А и мета-положению в отношении A'.
Согласно другому предпочтительному аспекту настоящее изобретение относится к соединению формулы (I), как определено выше, где
А и A' независимо представляют собой фениленовую группу или пиридиленовую группу;
R2 представляет собой атом водорода или метильную группу;
R3 представляет собой 2-пиридильную группу, 4-пиридильную группу или 4-пиримидинильную группу;
R4 представляет собой карбонильную группу или сульфонильную группу; и
R5 представляет собой группу -NH-(CH2)a-NR6R7 или 4-метилпиперазинильную группу, причем а представляет собой целое число от 2 до 3, R6 и R7 представляют собой этильную группу или R6 и R7 вместе с атомом азота, с которым они связаны, образуют гетероциклическую группу, которую выбирают из 4-метилпиперазильной группы, морфолиногруппы, пирролидинильной группы и пиперидиногруппы;
или любой из его фармацевтически приемлемых солей.
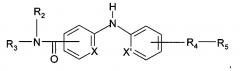
Согласно более предпочтительному аспекту настоящее изобретение относится к соединению формулы (I'):
где X и X' независимо представляют собой СН или N;
R2 представляет собой атом водорода или метильную группу;
R3 представляет собой 2-пиридильную группу, 4-пиридильную группу или 4-пиримидинильную группу;
R4 представляет собой карбонильную группу или сульфонильную группу; и
R5 представляет собой группу -NH-(CH2)a-NR6R7 или 4-метилпиперазинильную группу, причем а представляет собой целое число от 2 до 3, R6 и R7 представляют собой этильную группу или R6 и R7 вместе с атомом азота, с которым они связаны, образуют гетероциклическую группу, которую выбирают из 4-метилпиперазинильной группы, морфолиногруппы, пирролидинильной группы и пиперидиногруппы;
или любой из его фармацевтически приемлемых солей.
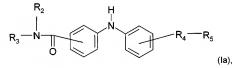
Согласно конкретному воплощению дополнительный предмет настоящего изобретения представляет собой соединение формулы (Iа):
где R2, R3, R4 и R5 являются такими, как определено выше;
или любую из его фармацевтически приемлемых солей.
Согласно предпочтительному воплощению настоящее изобретение относится к соединению формулы (Iа), где группа -R4-R5 находится в мета-положении относительно группы -NH- между двумя фенильными группами.
Согласно более предпочтительному воплощению настоящее изобретение относится к соединению формулы (Iа), как описано выше, где R4 представляет собой карбонильную группу, и R2, R3 и R5 являются такими, как определено выше,
или любой из его фармацевтически приемлемых солей.
Также описано соединение формулы (Ib):
где R2, R3, R4 и R5 являются такими, как определено выше;
или любая из его фармацевтически приемлемых солей.
Согласно предпочтительному воплощению настоящее изобретение относится к соединению формулы (Ib), где группа -R4-R5 находится в мета-положение относительно группы -NH- между фенильной группой и пиридиновой группой.
Более предпочтительно, в формуле (Ib), R2 представляет собой атом водорода; R3 представляет собой 4-пиридильную группу; R4 представляет собой карбонильную группу; и R5 представляет собой группу NH-(CH2)a-NR6R7, причем а представляет собой целое число 3, R6 и R7 представляют собой этильную группу; или любой из его фармацевтически приемлемых солей.
Согласно другому конкретному воплощению дополнительно настоящее изобретение относитися к соединению формулы (Iс):
где R2, R3, R4 и R5 являются такими, как определено выше;
или любой из его фармацевтически приемлемых солей.
Согласно предпочтительному воплощению настоящее изобретение относится к соединению формулы (Iс), где группа -R4-R5 находится в мета-положении относительно группы -NH- между фенильной группой и пиридиновой группой.
Согласно более предпочтительному воплощению настоящее изобретение относится к соединению формулы (Iс), как описано выше, где R2 представляет собой атом водорода или метильную группу; R3 представляет собой 4-пиридильную группу или 4-пиримидинильную группу; R4 представляет собой карбонильную группу; и R5 представляет собой группу NH-(CH2)a-NR6R7, причем а представляет собой целое число 3, R6 и R7 представляют собой этильную группу; или R6 и R7 вместе с атомом азота, с которым они связаны, образуют гетероциклическую группу, которая представляет собой 4-метилпиперазинильную группу; или любой из его фармацевтически приемлемых солей.
Согласно другому конкретному воплощению дополнительным объектом настоящего изобретения является соединение формулы (Id):
где R2, R3, R4 и R5 являются такими, как определено выше;
или любая из его фармацевтически приемлемых солей.
Согласно предпочтительному воплощению настоящее изобретение относится к соединению формулы (Id), где группа -R4-R5 находится в мета-положении относительно группы -NH- между двумя пиридиновыми группами.
Согласно более предпочтительному воплощению настоящее изобретение относится к соединению формулы (Id), как определено выше, где R2 представляет собой атом водорода; R3 представляет собой 4-пиридильную группу; R4 представляет собой карбонильную группу; и R5 представляет собой группу NH-(CH2)a-NR6R7, причем а представляет собой целое число 3, R6 и R7 представляют собой этильную группу или R6 и R7 вместе с атомом азота, с которым они связаны, образуют гетероциклическую группу, которая представляет собой 4-метилпиперазинильную группу; или любой из его фармацевтически приемлемых солей.
Согласно другому конкретному воплощению дополнительным объектом настоящего изобретения является соединение формулы (Iе):
где R2, R3, R4 и R5 являются такими, как определено выше;
или любая из его фармацевтически приемлемых солей.
Согласно предпочтительному воплощению настоящее изобретение относится к соединению формулы (Ib), где группа -R4-R5 находится в мета-положении относительно группы -NH- между фенильной группой и пиридиновой группой.
Согласно более предпочтительному воплощению настоящее изобретение относится к соединению формулы (Iе), как определено выше, где R2 представляет собой атом водорода; R3 представляет собой 4-пиридильную группу; R4 представляет собой карбонильную группу или сульфонильную группу; и R5 представляет собой группу -NH-(CH2)a-NR6R7, причем а представляет собой целое число 3, R6 и R7 представляют собой этильную группу или R6 и R7 вместе с атомом азота, с которым они связаны, образуют гетероциклическую группу, которую выбирают из 4-метилпиперазинильной группы; морфолиногруппы, пирролидинильной группы и пиперидиногруппы; или любой из его фармацевтически приемлемых солей.
Согласно предпочтительному воплощению настоящего изобретения соединение формулы (I) выбрано из следующих соединений:
(1) N-(3-(диэтиламино)пропил)-3-((3-(пиридин-4-илкарбамоил)фенил)амино)бензамид
(2) 3-((4-((3-(диэтиламино)пропил)карбамоил)фенил)амино)-N-(пиридин-4-ил)бензамид
(3) N-(3-морфолинопропил)-3-((3-(пиридин-4-илкарбамоил)фенил)амино)бензамид
(4) N-(пиридин-4-ил)-3-((3-((3-(пирролидин-1-ил)пропил)карбамоил) фенил)амино)бензамид
(5) 3-((3-(N-(3-(диэтиламино)пропил)сульфамоил)фенил)амино)-N-(пиридин-4-ил)бензамид
(6) N-(3-(4-метилпиперазин-1-ил)пропил)-3-((3-(пиридин-4-илкарбамоил) фенил)амино)бензамид
(7) N-(3-(пиперидин-1-ил)пропил)-3-((3-(пиридин-4-илкарбамоил)фенил)амино)бензамид
(8) 3-((3-(4-метилпиперазин-1-карбонил)фенил)амино)-N-(пиридин-4-ил)бензамид
(9) 3-((3-(N-(3-(пиперидин-1-ил)пропил)сульфамоил)фенил)амино)-N-(пиридин-4-ил)бензамид
(10) 3-((3-(N-(2-(пиперидин-1-ил)этил)сульфамоил)фенил)амино)-N-(пиридин-4-ил)бензамид
(11) N-(3-(диэтиламино)пропил)-3-((3-(пиридин-2-илкарбамоил)фенил)амино)бензамид
(12) 3-((3-(N-(3-морфолинопропил)сульфамоил)фенил)амино)-N-(пиридин-4-ил)бензамид
(13) N-(3-(диэтиламино)пропил)-3-((4-(пиридин-4-илкарбамоил)фенил)амино)бензамид
(14) N-(3-морфолинопропил)-3-((4-(пиридин-4-илкарбамоил)фенил)амино)бензамид
(15) 4-((3-(N-(3-морфолинопропил)сульфамоил)фенил)амино)-N-(пиридин-4-ил)бензамид
(16) N-(пиридин-4-ил)-4-((3-(N-(2-(пирролидин-1-ил)этил)сульфамоил)фенил)амино)бензамид
(17) 3-((3-((3-(диэтиламино)пропил)карбамоил)фенил)амино)-N-метил-N-(пиридин-4-ил)бензамид
(18) N-метил-N-(пиридин-4-ил)-3-((3-((3-(пирролидин-1-ил)пропил)карбамоил)фенил)амино)бензамид
(19) 3-((3-(N-(3-(диэтиламино)пропил)сульфамоил)фенил)амино)-N-метил-N-(пиридин-4-ил)бензамид
(20) N-метил-3-((3-((3-(4-метилпиперазин-1-ил)пропил)карбамоил)фенил)амино)-N-(пиридин-4-ил)бензамид
(21) N-метил-3-((3-((3-(пиперидин-1-ил)пропил)карбамоил)фенил)амино)-N-(пиридин-4-ил)бензамид
(22) N-метил-3-((3-((3-морфолинопропил)карбамоил)фенил)амино)-N-(пиридин-4-ил)бензамид
(23) N-метил-3-((3-(N-(3-морфолинопропил)сульфамоил)фенил)амино)-N-(пиридин-4-ил)бензамид
(24) N-метил-3-((3-(N-(3-(пиперидин-1-ил)пропил)сульфамоил)фенил)амино)-N-(пиридин-4-ил)бензамид
(25) N-(3-(диэтиламино)пропил)-3-((3-(пиримидин-4-илкарбамоил)фенил) амино)бензамид
(26) 3-((3-(N-(3-(диэтиламино)пропил)сульфамоил)фенил)амино)-N-(пиримидин-4-ил)бензамид
(27) 3-((3-(N-(3-(пиперидин-1-ил)пропил)сульфамоил)фенил)амино)-N-(пиримидин-4ил)бензамид
(28) N-(пиримидин-4-ил)-3-((3-((3-(пирролидин-1-ил)пропил)карбамоил)фенил)амино)бензамид
(29) N-(3-(пиперидин-1-ил)пропил)-3-((3-(пиримидин-4-илкарбамоил) фенил)амино)бензамид
(30) N-(3-морфолинопропил)-3-((3-(пиримидин-4-илкарбамоил)фенил)амино)бензамид
(31) N-(3-(4-метилпиперазин-1-ил)пропил)-3-((3-(пиримидин-4-илкарбамоил)фенил)амино)бензамид
(32) N-(3-(диэтиламино)пропил)-5-((3-(пиридин-4-илкарбамоил)фенил)амино)никотинамид
(33) N-(3-(диэтиламино)пропил)-2-((3-(пиридин-4-илкарбамоил)фенил)амино)изоникотинамид
(34) N-(3-(4-метилпиперазин-1-ил)пропил)-2-((3-(пиридин-4-ил)карбамоил)-фенил)амино)изоникотинамид
(35) N-(3-(диэтиламино)пропил)-6-((3-(пиридин-4-илкарбамоил)фенил)амино)пиколинамид
(36) N-(3-(диэтиламино)пропил)-6-((4-(пиридин-4-илкарбамоил)фенил)амино)пиколинамид
(37) N-(3-(диэтиламино)пропил)-6-((3-(метил(пиридин-4-ил)карбамоил)фенил)амино)пиколинамид
(38) N-(3-(диэтиламино)пропил)-2-((3-(метил(пиридин-4-ил)карбамоил)фенил)амино)изоникотинамид
(39) 2-((3-(метил(пиридин-4-ил)карбамоил)фенил)амино)-N-(3-(4-метилпиперазин-1-ил)пропил)изоникотинамид
(40) N-(3-(диэтиламино)пропил)-6-((3-(пиримидин-4-илкарбамоил)фенил)амино)пиколинамид
(41) N-(3-(диэтиламино)пропил)-2-((3-(пиримидин-4-илкарбамоил)фенил)амино)изоникотинамид
(42) N-(3-(4-метилпиперазин-1-ил)пропил)-2-((3-(пиримидин-4-илкарбамоил)фенил)амино)изоникотинамид
(43) N-(3-(диэтиламино)пропил)-6-((4-(пиридин-4-илкарбамоил)пиридин-2-ил)амино)пиколинамид
(44) N-(3-(диэтиламино)пропил)-2-((4-(пиридин-4-илкарбамоил)пиридин-2-ил)амино)изоникотинамид
(45) N-(3-(4-метилпиперазин-1-ил)пропил)-2-((4-(пиридин-4-илкарбамоил)пиридин-2-ил)амино)изоникотинамид
(46) 2-((3-(N-(3-(диэтиламино)пропил)сульфамоил)фенил)амино)-N-(пиридин-4-ил)изоникотинамид
(47) 2-((3-((3-(диэтиламино)пропил)карбамоил)фенил)амино)-N-(пиридин-4-ил)изоникотинамид
(48) 2-((3-((3-морфолинопропил)карбамоил)фенил)амино)-N-(пиридин-4-ил)изоникотинамид
(49) N-(3-(пиперидин-1-ил)пропил)-3-((3-(пиридин-4-илкарбамоил)фенил)амино)бензамид
(50) N-(пиридин-4-ил)-2-((3-((3-(пирролидин-1-ил)пропил)карбамоил)фенил)амино)изоникотинамид
(51) 2-((3-((3-(4-метилпиперазин-1-ил)пропил)карбамоил)фенил)амино)-N-(пиридин-4-ил)изоникотинамид
Соединения по изобретению могут существовать в форме свободных оснований или солей присоединения с фармацевтически приемлемыми кислотами.
Подходящие физиологически приемлемые соли присоединения кислоты соединений формулы (I) включают гидробромид, тартрат, цитрат, трифторацетат, аскорбат, гидрохлорид, тартрат, трифлат, малеат, мезилат, формиат, ацетат и фумарат.
Соединения формулы (I), (I'), (Ia), (Ib), (с), (Id) и (Ie) или их соли могут образовывать сольваты (например, гидраты), и изобретение включает все такие сольваты.
Вследствие этого, настоящее изобретение распространяется на соединения от (1) до (51), их фармацевтически приемлемые соли, их сольваты и их гидраты, как таковые.
В контексте настоящего изобретения термин:
- "алкил (C1-C4)", в том виде, как он используется в данном документе, соответственно относится к нормальному, вторичному или третичному насыщенному углеводороду C1-C4. Примерами являются метил, этил, 1-пропил, 2-пропил, бутил, изобутил, трет-бутил, но они не ограничиваются ими, и
- термин "пациент" может распространяться на людей или млекопитающих, таких как кошки или собаки.
Соединение формул (I), (I'), (Ia), (Ib), (Ic), (Id) и (Ie) может содержать один или более асимметрических атомов углерода. Они могут таким образом существовать в форме энантиомеров или диастереоизомеров. Данные энантиомеры, диастереоизомеры и их смеси, включая рацемические смеси, включены в объем настоящего изобретения.
Согласно другому аспекту настоящее изобретение относится к соединению формул (I), (I'), (Ia), (Ib), (Ic), (Id) и (Iе) для применения в качестве лекарственного средства.
Согласно другому аспекту настоящее изобретение относится к соединению формул (I), (I'), (Ia), (Ib), (Ic), (Id) и (Iе) для применения для предупреждения и/или ингибирования, и/или лечения рака.
Согласно настоящему изобретению термин "предотвращение" или "предупреждение" означает снижение риска начала или замедление возникновения данного явления, а именно рака.
Соединения по настоящему изобретению могут быть получены традиционными способами органического синтеза, применяемыми на практике специалистами в данной области техники. Общие последовательности реакций, изложенные ниже, представляют общий способ, применимый для получения соединений по настоящему изобретению, и не являются ограничивающими в объеме или применимости.
Соединения общей формулы (I) могут быть получены согласно нижеприведенной схеме 1.
Синтез основан на реакции сочетания, начинающейся с галогенароматического соединения формулы (III), где R4 и R5 являются такими, как определено выше, и X представляет собой атом хлора, атом йода или атом брома.
В соответствии с путем (А) соединение формулы (III) помещают в протонный растворитель, такой как трет-бутанол. Затем добавляют соединение формулы (II), в котором R2, R3 и А являются такими, как определено выше, в молярном соотношении, находящемся в интервале от 1 до 1,5, относительно соединения формулы (III) в присутствии неорганического основания, такого как Cs2CO3 или K2CO3, в молярном соотношении, находящемся в интервале от 1 до 2, в присутствии дифосфина, такого как ксантфос (Xantphos) (4,5-бис(дифенилфосфино)-9,9-диметилксантен) или X-Phos (2-Дициклогексилфосфино-2',4',6'-триизопропилбифенил), в количестве, находящемся в интервале от 2 мол. % до 10 мол. %, относительно общего количества соединения формулы (III), и в присутствии органометаллического катализатора, такого как Pd(OAc)2 или Pd2dba3, в количестве от 2 мол. % до 10 мол. %, относительно общего количества соединения формулы (III). Реакционную смесь затем можно нагревать при температуре, находящейся в интервале от 80 до 120°C, например, при 90°C, и перемешивать в течение времени, находящегося в интервале от 15 до 25 часов, например, в течение 20 часов, в атмосфере инертного газа и, например, аргона. Реакционную смесь можно концентрировать под сниженным давлением, и остаток можно разбавлять органическим растворителем, таким как этилацетат. Органическую фазу можно промывать водой, декантировать и высушивать над сульфатом магния. Наконец, твердое вещество можно высушивать под вакуумом в течение ночи с получением продукта (I).
Исходные соединения формулы (II) и (III) доступны или могут быть получены согласно способам, известным специалисту в данной области техники.
Более конкретно, соединения формулы (II) (т.е. соответственно (IIа) и (IIс)), при использовании для получения соединений формул (Ia) и (Ic), могут быть получены согласно приведенной ниже схеме 2.
Получение промежуточных соединений формулы (II) для соединений формул (Ia) и (Ic), причем один из X1 или Х2 представляет собой N, и оставшийся из и Х2 представляет собой СН (R3 представляет собой пиридильную группу).
Как показано на схеме 2, промежуточные соединения формул (IIа) и (IVa) применимы для получения соединений формулы (Iа) согласно изобретению, и промежуточные соединения формул (IIс) и (IVc) применимы для получения соединений формулы (Iв) согласно изобретению.
В соответствии с путем (В) аминопиридин, добавляемый в молярном соотношении, находящемся в интервале от 1 до 1,5, относительно нитробензоилхлорида, помещают в водный раствор неорганического основания, такого как гидроксид натрия, в молярной концентрации, находящейся в интервале от 2 М до 5 М. К раствору добавляют полярный апротонный растворитель, такой как дихлорметан, реакционную смесь можно охлаждать до 0°C с помощью ледяной бани, и раствор нитробензоилхлорида в полярном апротонном растворителе, таком как дихлорметан, можно добавлять по каплям. Затем реакционную смесь можно перемешивать при комнатной температуре в течение времени, находящегося в интервале от 15 до 24 часов, например, 18 часов, в атмосфере инертного газа, например, аргона. Полученный осадок можно фильтровать, промывать водой и дихлорметаном и высушивать под вакуумом в течение ночи с получением продукта (IVa) или (IVc).
В соответствии с путем (С) соединение формулы (IVa) или (IVc) и 10% Pd/C в соотношении, находящемся в интервале от 2% до 10% относительно количества бензамида, помещают в протонный растворитель, такой как этанол. Затем реакционную смесь можно перемешивать при комнатной температуре в течение времени, находящегося в интервале от 5 до 20 часов, например, 16 часов, в атмосфере H2. Затем реакционную смесь можно фильтровать, и фильтрат можно концентрировать при пониженном давлении с получением продукта (IIa) или (IIс).
В соответствии с путем (D) 4-(метиламино)пиридин помещают в полярный апротонный растворитель, такой как дихлорметан. Нитробензоилхлорид затем добавляют в молярном соотношении, находящемся в интервале от 1 до 1,5, относительно 4-(метиламино)пиридина, в присутствии органического основания, такого как N,N-диизопропилэтиламин или триэтиламин, в молярном соотношении, находящемся в интервале от 1 до 2, в присутствии нуклеофильного катализатора, такого как диметиламинопиридин, в молярном соотношении, находящемся в интервале от 0,1 до 1. Реакционную смесь можно затем перемешивать при комнатной температуре в течение времени, находящегося в интервале от 5 до 20 часов, например, 18 часов, в атмосфере инертного газа, например, аргона. Органическую фазу можно промывать водой, декантировать и высушивать над сульфатом магния. Наконец, твердое вещество можно высушивать под вакуумом, в течение ночи с получением продукта (IVa) или (IVc).
Более конкретно, соединения формулы (II), при применении для получения соединений формулы (Ia) и (Ic) в одном случае или (Id) и (Ie) в другом случае, можно получать согласно приведенной ниже схеме 3.
Получение промежуточных соединений формулы (II) для соединений формул (Ia) и (Ic), причем X: представляет собой СН и X2 представляет собой N (R2 представляет собой пиримидинильную группу), и для соединений формул (Id) и (Ie), причем X1 представляет собой N и Х2 представляет собой СН (R3 представляет собой пиридильную группу).
Как показано на схеме 3, промежуточные соединения формул (IIа) и (Va) применимы для получения соединений формулы (Iа) согласно изобретению, промежуточные соединения формул (IIс) и (Vc) применимы для получения соединений формулы (Iс) согласно изобретению, промежуточные соединения формул (IId) и (Vd) применимы для получения соединений формулы (Id) согласно изобретению и промежуточные соединения формул (IIе) и (Ve) применимы для получения соединений формулы (Iе) согласно изобретению.
В соответствии с путем (Е) производное карбоксильной кислоты помещают в полярный апротонный растворитель, такой как дихлорметан. Аминопроизводное затем добавляют в молярном соотношении от 1 до 1,5, относительно группировки карбоновой кислоты, в присутствии агента реакции сочетания, такого как EDCI.HCl (1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид), в молярном соотношении, находящемся в интервале от 1 до 3, в присутствии органического основания, такого как N,N-диизопропилэтиламин или триэтиламин, в молярном соотношении, находящемся в интервале от 1 до 3, и в присутствии нуклеофильного катализатора, такого как диметиламинопиридин в молярном отношении, находящемся от 0,1 до 1. Затем реакционную смесь можно перемешивать при комнатной температуре в течение времени, находящегося в интервале от 5 до 20 часов, например, 18 часов, в атмосфере инертного газа, например, аргона. Полученный осадок можно фильтровать и промывать водой и дихлорметаном. Органический фильтрат можно промывать водой, декантировать и высушивать над сульфатом магния. Наконец, твердые остатки можно собирать и высушивать под вакуумом в течение ночи с получением продукта (Va), (Vc), (Vd) или (Ve).
Аналогично, для получения соединений формулы (Ib) можно использовать или схему 2, или схему 3.
Химические структуры и спектроскопические данные для некоторых соединений формулы (I) изобретения проиллюстрированы соответственно в следующей таблице I и таблице II.
Среди указанных соединений формулы (I) соединения (1), (3), (4), (5), (6), (7), (9), (10), (12), (20), (25), (28), (29), (30), (31), (34), (35), (40), (41), (42), (44), (45), (48), (49) и (51) или одна из их фармацевтически приемлемых солей представляют особый интерес.
Следующие примеры подробно иллюстрируют получение соединений (1), (4), (5), (6) (7), (20), (25), (31), (35), (39), (41), (44), (47) и (51) по изобретению. Структуры полученных продуктов подтверждали по меньшей мере посредством спектров ЯМР.
Пример 1: соединение (1) в таблице I
В соответствии с путем (В) 4-аминопиридин (4,2 г, 44 ммоль, 1,1 экв.) помещали в 3 н. водный раствор NaOH (56 мл), и к раствору добавляли дихлорметан (24 мл). Реакционную смесь охлаждали до 0°C с помощью ледяной бани, и по каплям добавляли раствор 3-нитробензоилхлорида (7,4 г, 40 ммоль, 1 эквивалент (экв.)) в дихлорметане (40 мл). Реакционную смесь затем перемешивали при комнатной температуре в течение 18 часов в инертной атмосфере аргона. Полученный осадок фильтровали и промывали водой и дихлорметаном с получением 3-нитро-N-(пиридин-4-ил)бензамида (2,5 г, 26%).
1Н ЯМР (300 МГц, d6-DMSO) δ 10,91 (s, 1Н), 8,80 (s, 1Н), 8,52 (d, J=5,5 Гц, 2Н), 8,47 (d, J=7,9 Гц, 1Н), 8,41 (d, J=7,9 Гц, 1Н), 7,86 (t, J=7,9 Гц, 1Н), 7,79 (d, J=5,3 Гц, 2Н).
В соответствии с путем (С) 3-нитро-N-(пиридин-4-ил)бензамид (1,5 г, 6,2 ммоль, 1 экв.) и 10% Pd/C (250 мг) помещали в EtOH (50 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов в атмосфере H2. Реакционную смесь затем фильтровали на целите, промывали EtOH, и фильтрат концентрировали при пониженном давлении с получением 3-амино-N-(пиридин-4-ил)бензамида (1,24 г, 94%).
1Н ЯМР (300 МГц, d6-DMSO) δ 10,44 (s, 1Н), 8,44 (d, J=6,3 Гц, 2Н), 7,77 (d, J=6,3 Гц, 2Н), 7,18 (t, J=7,9 Гц, 1Н), 7,12-7,03 (m, 2Н), 6,78 (d, J=7,9 Гц, 1Н), 5,38 (s, 2Н).
N,N-диэтилпропилендиамин (8,7 мл, 55 ммоль, 1,1 экв.) помещали в 3 н. водный раствор NaOH (71 мл), и к раствору добавляли дихлорметан (30 мл). Реакционную смесь охлаждали до 0°C с помощью ледяной бани, и по каплям добавляли раствор 3-бромбензоилхлорида (6,6 мл, 50 ммоль, 1 экв.) в дихлорметане (50 мл). Реакционную смесь затем перемешивали при комнатной температуре в течение 18 часов в инертной атмосфере аргона. При декантации органическую фазу промывали водой, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением 3-бром-N-(3-диэтиламино-пропил)бензамида (15,6 г, 100%).
1Н ЯМР (300 МГц, CDCl3) δ 9,15 (br s, 1Н), 7,91 (s, 1Н), 7,75 (d, J=7,9 Гц, 1Н), 7,58 (d, J=7,9 Гц, 1Н), 7,29 (t, J=7,9 Гц, 1Н), 3,56 (dd, J=10,3, 5,8 Гц, 2Н), 2,67-2,53 (m, 6Н), 1,74 (квинт., J=5,7 Гц, 2Н), 1,04 (t, J=7,1 Гц, 6Н).
В соответствии с путем (А) реакционную смесь 3-бром-N-(3-диэтиламино-пропил)бензамида (291 мг, 0,9 ммоль, 1 экв.), 3-амино-N-(пиридин-4-ил)бензамида (300 мг, 1,4 ммоль, 1,5 экв.), Pd2(dba)3 (42 мг, 0,046 ммоль, 5 мол. %), XPhos (44 мг, 0,09 ммоль, 10 мол. %) и K2CO3 (514 мг, 3,72 ммоль, 4 экв.) в трет-BuOH (4 мл) нагревали при 90°C и перемешивали в течение 20 часов в инертной атмосфере аргона. Реакционную смесь затем концентрировали при пониженном давлении, и полученный остаток разводили этилацетатом. Органическую фазу промывали водой, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Полученный осадок очищали посредством колоночной хроматографии на силикагеле с получением N-(3-(диэтиламино)пропил)-3-((3-(пиридин-4-илкарбамоил)фенил)амино)бензамида (1) (230 мг, 57%).
Пример 2: соединение (4) в таблице I
В соответствии с путем (В) 4-аминопиридин (4,2 г, 44 ммоль, 1,1 экв.) помещали в 3 н. водный раствор NaOH (56 мл), и к раствору добавляли дихлорметан (24 мл). Реакционную смесь охлаждали до 0°C с помощью ледяной бани, и по каплям добавляли раствор 3-нитробензоилхлорида (7,4 г, 40 ммоль, 1 экв.) в дихлорметане (40 мл). Реакционную смесь затем перемешивали при комнатной температуре в течение 18 часов в инертной атмосфере аргона. Полученный осадок фильтровали и промывали водой и дихлорметаном с получением 3-нитро-N-(пиридин-4-ил)бензамида (2,5 г, 26%).
1Н ЯМР (300 МГц, d6-DMSO) δ 10,91 (s, 1Н), 8,80 (s, 1Н), 8,52 (d, J=5,5 Гц, 2Н), 8,47 (d, J=7,9 Гц, 1Н), 8,41 (d, J=7,9 Гц, 1Н), 7,86 (t, J=7,9 Гц, 1Н), 7,79 (d, J=5,3 Гц, 2Н).
В соответствии с путем (С) 3-нитро-N-(пиридин-4-ил)бензамид (994 мг, 4,1 ммоль, 1 экв.) и 10% Pd/C (218 мг) помещали в EtOH (20,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов в атмосфере H2. Реакционную смесь затем фильтровали на целите, промывали EtOH, и фильтрат концентрировали при пониженном давлении с получением 3-амино-N-(пиридин-4-ил)бензамида (900 мг, 100%).
1Н ЯМР (300 МГц, d6-DMSO) δ 10,42 (s, 1Н), 8,44 (d, J=6,3 Гц, 2Н), 7,75 (d, J=6,3 Гц, 2Н), 7,16 (t, J=7,9 Гц, 1Н), 7,10-7,01 (m, 2Н), 6,76 (d, J=7,9 Гц, 1Н), 5,36 (s, 2Н).
3-(Пирролидин-1-ил)пропиламин (1,4 мл, 11 ммоль, 1,1 экв.) помещали в 3 н. водный раствор NaOH (14 мл), и к раствору добавляли дихлорметан (6 мл). Реакционную смесь охлаждали до 0°C с помощью ледяной бани, и по каплям добавляли раствор 3-бромбензоилхлорида (1,3 мл, 10 ммоль, 1 экв.) в дихлорметане (10 мл). Реакционную смесь затем перемешивали при комнатной температуре в течение 18 часов в инертной атмосфере аргона. При декантации органическую фазу промывали водой, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением 3-бром-N-(3-пирролидин-1-ил-пропил)бензамида (2,9 г, 94%).
1Н ЯМР (300 МГц, CDCl3) δ 9,19 (s, 1Н), 7,82 (s, 1Н), 7,77 (d, J=7,9 Hz, 1Н), 7,58 (d, J=7,9 Гц, 1H), 7,29 (t, J=7,9 Гц, 1H), 3,57 (dd, J=9,4, 4,8 Гц, 2H), 2,72 (t, J=4,8 Гц, 2H), 2,58 (s, 4Н), 1,86 (s, 4Н), 1,78 (t, J=4,8 Гц, 2H).
В соответствии с путем (А) реакционную смесь 3-бром-N-(3-диэтиламино-пропил)бензамида (611 мг, 1,97 ммоль, 1 экв.), 3-амино-N-(пиридин-4-ил)бензамида (630 мг, 2,96 ммоль, 1,5 экв.), Pd2(dba)3 (90 мг, 0,095 ммоль, 5 мол. %), XPhos (94 мг, 0,19 ммоль, 10 мол. %) и K2CO3 (1,1 мг, 7,88 ммоль, 4 экв.) в трет-BuOH (8 мл) нагревали при 90°C и перемешивали в течение 20 часов в инертной атмосфере аргона. Реакционную смесь затем концентрировали при пониженном давлении, и полученный остаток разводили этилацетатом. Органическую фазу промывали водой, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали посредством колоночной хроматографии на силикагеле с получением N-(пиридин-4-ил)-3-((3-((3-(пирролидин-1-ил(пропил)карбамоил)фенил)амино)бензамида (4) (427 мг, 49%).
Пример 3: соединение (5) в таблице I
В соответствии с путем (В) 4-аминопиридин (4,2 г, 44 ммоль, 1,1 экв.) помещали в 3 н. водный раствор NaOH (56 мл), и к раствору добавляли дихлорметан (24 мл). Реакционную смесь охлаждали до 0°C с помощью ледяной бани, и по каплям добавляли раствор 3-нитробензоилхлорида (7,4 г, 40 ммоль, 1 экв.) в дихлорметане (40 мл). Реакционную смесь затем перемешивали при комнатной температуре в течение 18 часов в инертной атмосфере аргона. Полученный осадок фильтровали и промывали водой и дихлорметаном с получением 3-нитро-N-(пиридин-4-ил)бензамида (994 мг, 20%).
1Н ЯМР (300 МГц, d6-DMSO) δ 10,91 (s, 1Н), 8,80 (s, 1Н), 8,52 (d, J=5,5 Гц, 2Н), 8,47 (d, J=7,9 Гц, 1Н), 8,41 (d, J=7,9 Гц, 1H), 7,86 (t, J=7,9 Гц, 1H), 7,79 (d, J=5,3 Гц, 2H).
В соответствии с путем (С) 3-нитро-N-(пиридин-4-ил)бензамид (994 мг, 4,1 ммоль, 1 экв.) и 10% Pd/C (218 мг) помещали в EtOH (20,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов в атмосфере H2. Реакционную смесь затем фильтровали на целите, промывали EtOH, и фильтрат концентрировали при пониженном давлении с получением 3-амино-N-(пиридин-4-ил)бензамида (900 мг, 100%).
1Н ЯМР (300 МГц, d6-DMSO) δ 10,42 (s, 1Н), 8,44 (d, J=6,3 Гц, 2Н), 7,75 (d, J=6,3 Гц, 2Н), 7,16 (t, J=7,9 Гц, 1Н), 7,10-7,01 (m, 2Н), 6,76 (d, J=7,9 Гц, 1Н), 5,36 (s, 2Н).
3-Бромбензолсульфонилхлорид (0,56 мл, 3,9 ммоль, 1 экв.) и N,N-диизопропилэтиламин (1,02 мл, 5,9 ммоль, 1,5 экв.) помещали в безводный дихлорметан (20 мл). Реакционную смесь охлаждали до 0°C с помощью ледяной бани, и по каплям добавляли N,N-диэтилпропилендиамин (1,23 мл, 7,8 ммоль, 2 экв.). Реакционную смесь затем перемешивали при 0°C в течение 2 часов в инертной атмосфере аргона. Смесь промывали насыщенными водными растворами NH4Cl и затем NaCl. Водные фазы экстрагировали дихлорметаном. Органические фазы собирали, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением 3-бром-N-(3-диэтиламинопропил)бензолсульфоамида (524 мг, 38%).
1Н ЯМР (300 МГц, CDCl) δ 7,98 (s, 1Н), 7,78 (d, J=7,9 Гц, 1Н), 7,66 (d, J=8,0 Гц, 1Н), 7,37 (t, J=7,9 Гц, 1Н), 3,05 (t, J=5,4 Гц, 2Н), 2,63-2,47 (m, 6Н), 1,68 (t, J=5,4 Гц, 2Н), 1,06 (t, J=7,1 Гц, 6Н).
В соответствии с путем (А) реакционную смесь 3-бром-N-(3-диэтиламино-пропил)бензолсульфонамида (153