Новые производные салициловой кислоты, их фармацевтически приемлемая соль, композиции и способ применения
Иллюстрации
Показать всеИзобретение относится к соединениям, выбранным из указанной ниже группы, а также их фармацевтически приемлемым солям, которые обладают ингибирующей активностью в отношении STAT3 и/или STAT5. Изобретение относится также к фармацевтической композиции, включающей указанные соединения, их применению для получения лекарственного средства для ингибирования активности STAT3 и/или STAT5 или для лечения рака, где раковые клетки содержат активированный STAT3 или STAT5. Кроме того, изобретение относится к ряду других конкретных соединений подобной структуры, фармацевтической композиции, включающей указанные соединения, их применению для получения лекарственного средства для ингибирования активности STAT3 и/или STAT5 или для лечения рака, где раковые клетки содержат активированный STAT3 или STAT5. 8 н. и 12 з.п. ф-лы, 21 ил., 6 табл., 76 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США №61/651757, поданной 25 мая 2012 г., содержание которой включено в настоящую заявку во всей полноте посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым производным салициловой кислоты, композициям, содержащим указанные соединения, и способам ингибирования активности STAT3 или лечения рака, в котором задействован STAT3/5, такого как рак головного мозга, молочной железы, толстой кишки, гематологическая опухоль, рак легких, яичников и простаты, с применением указанных соединений.
УРОВЕНЬ ТЕХНИКИ
STAT3 постоянно активируется при множестве видов рака человека, включая все основные карциномы, в том числе рак молочной железы, головного мозга, толстой кишки, поджелудочной железы, яичников и плоскоклеточный рак головы и шеи (SCCHN), и меланомы, а также некоторые виды гематологических опухолей (Bowman T, et al (2000) Oncogene 19, 2474-88, и Darnell, J.E. (2005) Nat. Med. 11, 595-596). Таким образом, существует растущий интерес к разработке видов противораковой терапии, действие которых основано на ингибировании постоянно активного STAT3, в частности, в качестве стратегии борьбы с раком в случаях, когда лечащие врачи стремятся улучшить результаты, и/или когда даже обеспечение удовлетворительного стандарта лечения, включающего уход за пациентом, качество жизни и результаты, является затруднительным.
Глиобластома (ГБМ) считается самым агрессивным и летальным видом рака головного мозга и имеет медиану выживаемости после лечения примерно 15 месяцев. К сожалению, указанные скромные результаты могут быть достигнуты только в случае относительно молодых (т.е. возрастом <70) и в остальном здоровых пациентов. Пожилые пациенты с ГБМ, количество которых велико, и пациенты с плохим состоянием здоровья на момент постановки диагноза имеют значительно более короткий период выживаемости при аналогичной терапии. Кроме того, ГБМ встречается чаще у стареющего населения. Более того, в отличие от более распространенных видов рака, таких как рак легких, молочной железы и толстой кишки, ГБМ не поддается предотвращению или обнаружению на раннее стадии, когда лечение, как может ожидаться, является существенно более эффективным. Кроме того, несмотря на десятилетия интенсивных исследований, значительные улучшения общей выживаемости не были достигнуты. Таким образом, разработка терапевтических подходов для удовлетворения указанной неудовлетворенной потребности является чрезвычайно важной.
Было показано, что опухоли головного мозга содержат редкие субпопуляции опухолевых стволовых клеток головного мозга (BTSC), которые обладают такими свойствами стволовых клеток, как клоногенное самообновление, мультипотентность и онкогенность. Значительное самообновление и пролиферативная способность BTSC в сочетании с их нечувствительностью к традиционным методам радио- и химиотерапии позволяют предположить, что они являются неотъемлемой частью процессов роста и рецидива ГБМ после лечения. Таким образом, BTSC представляют собой «источник заболевания», требующий новых терапевтических подходов для эффективного устранения для улучшения результатов лечения ГБМ.
Белки STAT были изначально открыты, как латентные цитоплазматические факторы транскрипции, которые являются проводниками ответа на сигналы от цитокинов и факторов роста (Darnell, J.E., Jr. (1996) Recent Prog. Norm. Res. 51, 391-403; Darnell, J.E. (2005) Nat. Med. 11, 595-596). Семь членов семейства, STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b и STAT6, опосредуют некоторые физиологические эффекты, включая рост и дифференцировку, выживание, развитие и воспаление. STAT представляют собой белки, содержащие домен SH2. После связывания лиганда с рецепторами цитокинов или факторов роста STAT подвергается фосфорилированию по важному остатку тирозина (Tyr705 для STAT3) рецепторами факторов роста, цитоплазматическими Янус-киназами (Jaks) или киназами семейства Src. Два фосфорилированных и активированных мономера STAT димеризуются при помощи взаимных взаимодействий pTyr-домен SH2, перемещаются в ядро и связываются со специфичными ДНК-чувствительными элементами целевых генов, таким образом индуцируя транскрипцию генов (Darnell, J.E., Jr. (1996) Recent Prog. Norm. Res. 51, 391-403; Darnell, J.E. (2005) Nat. Med. 11, 595-596). В отличие от нормального сигнального пути STAT многие солидные и гематологические опухоли человека маскируют аномальную активность STAT3 (Turkson, J. Expert Opin. Ther. Targets 2004, 8, 409-422; Darnell, J.E., Jr. (1996) Recent Prog. Norm. Res. 51, 391-403; Darnell, J.E. (2005) Nat. Med. 11(6), 595-596; Bowman, T. et al. (2000) Oncogene 19(21), 2474-2488; Buettner, et al. (2002) Clin. Cancer Res. 8(4), 945-954; Yu, H. и Jove. R. (2004) Nat. Rev. Cancer 4(2), 97- 105; Haura, E.B., et al. (2005) Nat. Clin. Pract. Oncol. 2(6), 315-324).
Следует отметить, что белок STAT3 представляет собой один из семи членов семейства белков STAT, являющихся факторами транскрипции. STAT3 активируется путем фосфорилирования тирозина 705 (Y705), что инициирует образование комплекса двух фосфорилированных мономеров STAT3 (pSTAT3). Гомодимеры pSTAT3 образуются благодаря взаимным взаимодействиям домен Src гомологов 2 (SPI2) STAT3-pY705 STAT3. Гомодимеры pSTAT3:pSTAT3 перемещаются в ядро и связываются с ДНК, инициируя транскрипцию целевого гена STAT3. Ранее направленное действие в отношении STAT3 обеспечивали с применением доминантно-негативных конструкций, олигонуклеотидов или, наиболее часто, фосфопептидных агентов, которые имитируют нативную последовательность, содержащую pY705.
К сожалению, указанные ингибиторы быстро разлагаются in vivo, что ограничивает их клиническое применение. Для решения указанных проблем были разработаны ингибиторы STAT3, состоящие из небольших молекул, предназначенные для лечения раковых заболеваний, при которых задействован гиперактивированный белок STAT3. В международной заявке на патент WO 2012/018868 были выявлены ингибиторы на основе кислот, которые с высокой активностью и селективно блокируют димеризацию и активность связывания ДНК STAT3, в частности соединение 45O, также называемое BP-1-102 (иногда в настоящем описании называемое соединением 1). Соединение 45O согласно международной заявке на патент WO 2012018868 с высокой активностью подавляет разнообразные онкогенные свойства различных выращенных раковых клеток (рака молочной железы, легкого, поджелудочной железы, простаты, легкого), включая: пролиферацию клеток, безъякорный рост клеток, миграцию, инвазивность и подвижность. Оно является селективным к STAT3 и в 10 раз менее активно связывается со STAT1, на 93% гомологичным белком STAT. Оно оказывало незначительное действие на фосфорилирование Shc, Src, Jak-1/2, Erk1/2 или Akt или не оказывало его вообще, а также не влияло на нетрансформированные клетки (клетки NIH 3T3, мышиные эмбриональные фибробласты, не содержащие STAT3, или стромальные клетки тимуса мышей, кроме того, не действовало на трансформированные клетки, не содержащие активированный STAT3).
Кроме того, BP-1-102 обладало выраженным противоопухолевым действием in vivo в моделях ксенотрансплантатов рака легких или молочной железы у мышей, которое приводило к существенному уменьшению объема опухоли. Вестерн-блоты остаточных опухолей у мышей, подвергавшихся лечению, указывали на зависящее от дозы подавление pSTAT3, cMyc, циклина D1, Bc1-xL, сурвивина и ФРЭС.
Кроме того, генетические и иные молекулярные данные показывают, что устойчивое фосфорилирование STAT3 опосредовано нарушениями предшествующих Tyr киназ, а также указывают на то, что для поддержания и прогрессирования опухолей в раковых клетках требуется наличие конститутивно активного и димеризованного STAT3. Таким образом, в различных исследованиях для подтверждения правильности концепции (Turkson, J., et al. Mol. Cancer Ther. 2004, 3(3), 261-269; Turkson, J., et al. J. Biol. Chem. 2001, 276(48), 45443-45455; Siddiquee, K.; et al. Proc. Natl. Acad. Sci. U.S.A. 2007, 104, 7391-7396.; Turkson, J.; et al. Mol. Cancer Ther. 2004, 3, 1533-1542; и Turkson, J.; et al. J. Biol. Chem. 2005, 280(38), 32979-32988) было показано, что ингибирование активации STAT3 или нарушение димеризации вызывает гибель раковых клеток и регрессию опухоли. Таким образом, ингибиторы STAT3, состоящие из небольших молекул, обеспечивают средства для исследования молекулярной динамики клеточных процессов с участием STAT3 для понимания роли STAT3 в качестве сигнального медиатора и молекулярного медиатора явлений, приводящих к карциногенезу и прогрессированию злокачественных опухолей. Кроме того, так как путь STAT3 является ключевым для развития разнообразных типов раковых заболеваний человека, включая все основные типы карцином, включая карциномы молочной железы, головного мозга, толстой кишки, поджелудочной железы, яичников и плоскоклеточные карциномы головы и шеи (SCCHN) и меланомы, а также некоторые гематологические опухоли (Bowman T, et al. (2000) Oncogene 19, 2474-88, and Darnell, J.E. (2005) Nat. Med. 11, 595-596), прямое ингибирование STAT3 может обеспечивать способ прямого воздействия на молекулярные мишени для эффективной борьбы с указанными раковыми заболеваниями и в частности с агрессивными формами, такими как GBM.
В оригинальной статье Карро с соавторами (Carro et al., Nature, 463(7279): 318-325, 2010) продемонстрировали, что ген-сигнальный трансдуктор и активатор транскрипции 3 (STAT3), имеющий аномальную активность при GBM, является очень важным медиатором роста опухоли и терапевтической резистентности при GBM. При плохо поддающихся лечению раковых заболеваниях головного мозга, таких как глиомы, астроцитомы и глиобластомы, происходит конститутивная активация STAT3. Кроме того, все больше данных, полученных в последнее время с использованием разнообразных небольших молекул, косвенно ингибирующих STAT3 за счет направленного действия на предшествующие молекулы, такие как члены семейства JAK, явно указывают на то, что сигнальный путь STAT3 является важным для выживания и пролиферации клеток BTSC и GBM in vitRo и in vivo. Тем не менее, из-за направленного действия в отношении широкого диапазона мишеней существующие лекарственные средства для лечения GBM имеют ограниченную возможность использования для лечения вследствие многочисленных побочных эффектов. Таким образом, лекарственные средства, обладающие способностью более специфичной блокировки активности STAT3, могут обеспечивать эффективный способ лечения пациентов с GBM.
Сигнальный путь STAT5, так же как и сигнальный путь STAT3, временно активируется в нормальных клетках и деактивируется различными цитозольными и ядерными регуляторами, включая фосфатазы SOCS, PIAS и протеосомальная деградация. Так же как и STAT3, STAT5 стал известен из-за того, что его нарушения встречаются при раковых заболеваниях и развитии опухолей у человека, было обнаружено, что его конститутивная активация происходит при многих раковых заболеваниях, включая рак молочной железы, печени, простаты, крови, кожи, головы и шеи (Muller, J., et al. ChemBioChem 2008, 9, 723-727). В раковых клетках обычно происходит конститутивное фосфорилирование STAT5, что приводит к нарушенной экспрессии генов-мишеней STAT5 и вызывает злокачественную трансформацию. В раковых клетках, содержащих постоянно активированный STAT5, происходит сверхэкспрессия антиапоптотических белков, таких как Bc1-xL, Myc и MCL-1, что обеспечивает значительную резистентность к естественным апоптотическим сигналам и вводимым химиотерапевтическим агентам. Особенно следует отметить, что STAT5 был определен как ключевой регулятор при развитии и прогрессировании острого миелоидного (ОМЛ) и острого лимфобластного лейкоза (ОЛЛ; Gouilleux-Gruart, V., et al. Leukemia and Lymphoma 1997, 28, 83-88; Gouilleux-Gruart, V., et al. Blood 1996, 87, 1692-1697; Weber-Nordt, R. M., et al. Blood 1996, 88, 809-816). Кроме того, было показано, что ингибиторы предшествующих активаторов STAT5 (таких как JA и FLT3) обладают перспективными противораковыми свойствами (Pardanani, A., et al. Leukemia 2011, 25, 218-225; Quintas-Cardama, A., et al. Nature Reviews Drug Discovery 2011, 10, 127-140).
Следует отметить, что медицинские преимущества ингибирования STAT3/5 не ограничиваются применением к различным формам рака, описанным в настоящей заявке, в которых указанные мишени являются конститутивно активированными, и подходят для применения для лечения других состояний, в которых указанные пути играют ключевую роль, включая, но, не ограничиваясь ими, аутоиммунные нарушения (Harris, T.J.; et al Immunol. (2007) 179(7): 4313-4317), воспаление, связанное с артритом (Miyamoto. T, et al, Arthritis Research & Therapy (2012), 14(Suppl 1):P43), воспалительное заболевание кишечника (IBD) (World J GastRoenterol.(2008) 14(33): 5110-5114.), диабет (Mashili, F.; et al (2013) Diabetes 62(2), 457-465), синдром раздраженного кишечника (IBS); почечную болезнь (Weimbs, T., (2013) JAK-STAT, 2(2), 0-1) и трансплантацию органов (Debonera, F.; et al (2001) J. Surg. Res. 96(2), 289-295).
Несмотря на успехи в разработках лекарственных средств, направленных на определение ингибиторов активности белка STAT, все еще существует нехватка соединений, которые являются сильнодействующими, эффективными и селективными активаторами STAT3 и STAT5, а также являются эффективными при лечении рака и других заболеваний, связанных с дисфункцией STAT3, STAT5 или обоих указанных белков, и заболеваний, в которых задействован один из STAT3 и STAT5 или оба указанных белка. Кроме того, все еще существует потребность в оптимизации эффективности и снижении лабильности фармакокинетических свойств существующих соединений. Указанные и другие потребности удовлетворяются посредством настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с целью(ями) настоящего изобретения, реализованными и подробно описанными в настоящей заявке, в одном из аспектов настоящее изобретение относится к соединениям, подходящим для применения в качестве ингибиторов STAT3.
В другом аспекте описаны соединения и продукты способов получения или их фармацевтически приемлемые соли, гидраты, сольваты или полиморфы являющиеся модуляторами активности STAT3 и/или STAT5, способы получения указанных соединений, фармацевтические композиции, содержащие указанные соединения, и способы лечения расстройств, связанных с нарушением активности STAT3, с применением указанных соединений.
В другом аспекте настоящее изобретение относится к соединениям, которые связываются с белком STAT3 и отрицательно модулируют активность STAT3.
В другом аспекте настоящее изобретение относится к соединениям, которые связываются с белком STAT5 и отрицательно модулируют активность STAT5.
Также описаны фармацевтические композиции, содержащие терапевтически эффективное количество описанных соединений и фармацевтически приемлемого носителя.
Описаны способы лечения расстройства, связанного с нарушением активности STAT3/STAT5, предпочтительно гиперактивности или сверхэкспрессии, у млекопитающих, включающие стадию введения млекопитающему терапевтически эффективного количества описанных соединений или их фармацевтически приемлемых солей, гидратов, сольватов или полиморфов.
Также описаны способы ингибирования активности STAT3 и/или STAT5 у млекопитающих, включающие стадию введения млекопитающему терапевтически эффективного количества по меньшей мере одного из описанных соединений или их фармацевтически приемлемых солей, гидратов, сольватов или полиморфов.
Также описаны способы ингибирования активности STAT3 и/или STAT5 по меньшей мере в одной клетке, включающие стадию приведения по меньшей мере одной клетки в контакт с эффективным количеством по меньшей мере одного из описанных соединений или их фармацевтически приемлемых солей, гидратов, сольватов или полиморфов.
Также описаны способы применения по меньшей мере одного из описанных соединений или их фармацевтически приемлемых солей, гидратов, сольватов или полиморфов.
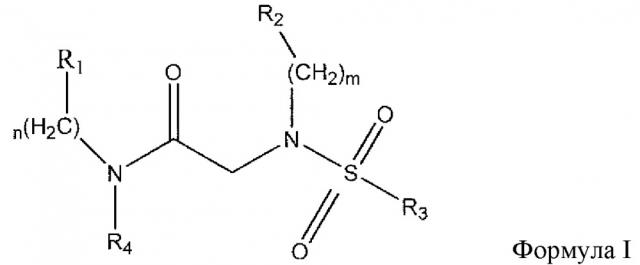
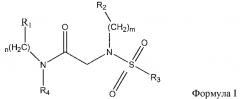
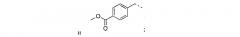
В одном из аспектов предложено соединение формулы I, как определено в настоящей заявке:
,
или его фармацевтически приемлемая соль, сольват или пролекарство, где каждый из m и n независимо представляет собой целое число от 0 до 3;
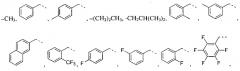
R1 выбран из A1, A2, -(A1)-(A2), -(A2)-(A3), -(A3)-(A2), -(A3)-(A4), -(A5)-(A1)-(A7), -(A5)-(A2)- (A8), -(A5)-(A3)-(A7) и -(A5)-(A6)-L-(A7); A1 представляет собой C3-6 циклоалкил, замещенный 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, C1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)R5, (C=O)OR5 и (C=O)NHR5; A2 представляет собой C3-6 циклоалкил или гетероциклоалкил, замещенный 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, С1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)R6, (C=O)OR6 и (C=O)NHR6; A3 представляет собой арил, замещенный 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, С1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)R7, (C=O)OR7 и (C=O)NHR7; A4 представляет собой арил, замещенный 1-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, С1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)R8, (C=O)OR8 и (C=O)NHR8; A5 выбран из C3-6 циклоалкила, C3-6 гетероциклоалкила и арила, замещенных 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, С1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, C1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, СО2Н, (C=O)R9, (C=O)OR9 и (C=O)NHR9; А6 выбран из С3-6 циклоалкила, С3-6 гетероциклоалкила и арила, замещенных 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, С1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, СО2Н, (C=O)R10, (C=O)OR10 и (C=O)NHR10; А7 выбран из С3-6 циклоалкила, С3-6 гетероциклоалкила и арила, замещенных 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, циано, С1- б галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, СO2Н, (C=O)R11, (C=O)OR11 и (C=O)NHR11; А8 выбран из С3-6 циклоалкила, С3-6 гетероциклоалкила и арила, замещенных 0-3 группами, выбранными из галогена, гидроксила, амино, нитро, С1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, СO2Н, (C=O)R12, (C=0)0R12 и (C=O)NHR12; L выбран из -(С=O)- и -SO2-; R2 выбран из С1-6 алкила, С2-6 алкенила, С2-6 алкинила, С1-6 галогеналкила, С2-6 галогеналкенила, С2-6 галогеналкинила, С1-6 полигалогеналкила, С2-6 полигалогеналкенила, С2-6 полигалогеналкинила; или R2 представляет собой арил, замещенный 0-5 группами, независимо выбранными из галогена, гидроксила, амино, нитро, циано, С1-6 галогеналкила, С1-6 полигалогеналкила, С1-6 алкокси, С1-6 галогеналкокси, С1-6 полигалогеналкокси, С1-6 алкилтио, С1-6 галогеналкилтио, С1-6 полигалогеналкилтио, С1-6 алкиламино, С1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси, (С1-6)-алк-(С1-6)-полигалогеналкокси, (С1-6)-алк-(С1-6)-алкилтио, (С1-6)-алк-(С1-6)-галогеналкилтио, (С1-6)-алк-(С1-6)-полигалогеналкилтио, CO2H, (C=O)OR12 и (C=O)NHR12; R3 представляет собой арил, замещенный 0-5 группами, независимо выбранными из галогена, гидроксила, амино, нитро, циано, C1-6 алкила, C1-6 галогеналкила, C1-6 полигалогеналкила, C1-6 алкокси, C1-6 галогеналкокси, C1-6 полигалогеналкокси, C1-6 алкиламино, C1-6 диалкиламино, (С1-6)-алк-(С1-6)-алкокси, (С1-6)-алк-(С1-6)-галогеналкокси и (С1-6)-алк-(С1-6)-полигалогеналкокси; каждый из R5, R6, R7, R8, R9, R10, R11 и R11 независимо выбран из водорода, C1-6 алкила, C1-6 галогеналкила и C1-6 полигалогеналкила; или фармацевтически приемлемая соль, гидрат, сольват или полиморф указанного соединения,
где R2 выбран из группы, состоящей из:
где R4 представляет собой структуру, представленную формулой:
,
где R4 представляет собой структуру, представленную формулой:
,
где R13 выбран из группы, состоящей из -OH, -COR16, -CN, -CH2PO(OH)2, -СН2Р(O)3(CH2СН3)2, -NO2, -NHR17 и 1Н-тетразола;
R16 выбран из группы, состоящей из -OH, -O-C(1-2)алкила, -OCH2OC(O)CH3, -OCH2OС(O)-трет-бутила и -NHOH,
R17 выбран из группы, состоящей из -H, -C(O)C(O)CH2CH3, -C(O)C(O)OH и -C(O)CH2-1H-тетразола,
R14 представляет собой -H, или, если R13 представляет собой -COR16, и R16 представляет собой OH, R14 представляет собой -F, -OС(O)СН3; и
R15 представляет собой Н, или, если R13 представляет собой -COR16, R16 представляет собой OH, и R14 представляет собой Н, R15 представляет собой -F, - OС(O)СН3;
R13 представляет собой -Н, если R14 представляет собой -OH, или оба из R14 и R15 представляют собой -COOH.
В другом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим фармацевтически приемлемый носитель и эффективное количество описанного соединения или его фармацевтически приемлемой соли, гидрата, сольвата или полиморфа.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая соединение, описанное в настоящей заявке, или его фармацевтически приемлемую соль, сольват или пролекарство и приемлемое вспомогательное вещество.
В другом аспекте настоящего изобретения предложен способ ингибирования активности STAT3 и/или STAT5, включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящей заявке, или его фармацевтически приемлемой соли, сольвата или пролекарства.
В другом аспекте настоящего изобретения предложен способ лечения или предотвращения рака, связанного с нарушением активности STAT3/STAT5 (предпочтительно их гиперактивности или сверхэкспрессии), включающий введение пациенту терапевтически эффективного количества соединения, описанного в настоящей заявке, или его фармацевтически приемлемой соли, сольвата или пролекарства. В альтернативном аспекте рак выбран из солидных или гематологических опухолей. В другом аспекте рак представляет собой рак, в котором задействован активированный STAT3 и/или STAT5. Такой рак может представлять собой, например, рак молочной железы, печени, простаты, крови, кожи, головы, шеи, глиобластому или острый миелоидный (ОМЛ) и острый лимфобластный лейкоз.
В другом аспекте настоящего изобретения предложено применение соединения, описанного в настоящей заявке, или его фармацевтически приемлемой соли, сольвата или пролекарства при получении лекарственных средств для ингибирования активности STAT3 и/или STAT5.
В другом аспекте настоящего изобретения предложено применение соединения, описанного в настоящей заявке, или его фармацевтически приемлемой соли, сольвата или пролекарства при получении лекарственных средств для лечения или предотвращения рака, в котором задействован активированный STAT3 и/или STAT5, такого как, рак из солидных или гематологических опухолей, рак молочной железы, рак печени, рак простаты, рак крови, рак кожи, рак головы, рак шеи, глиобластома или острый миелоидный (ОМЛ) и острый лимфобластный лейкоз.
В другом аспекте настоящего изобретения предложено применение соединения, описанного в настоящей заявке, или его фармацевтически приемлемой соли, сольвата или пролекарства для ингибирования активности STAT3 и/или STAT5.
В другом аспекте настоящего изобретения предложено применение соединения, описанного в настоящей заявке, или его фармацевтически приемлемой соли, сольвата или пролекарства для лечения или предотвращения рака, в котором задействован активированный STAT3 и/или STAT5, такого как, рак из солидных или гематологических опухолей, рак молочной железы, рак печени, рак простаты, рак крови, рак кожи, рак головы, рак шеи, глиобластома или острый миелоидный (ОМЛ) и острый лимфобластный лейкоз, связанного с нарушением активности STAT3/STAT5, такого как, рак молочной железы, простаты или головного мозга.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, описанная в настоящей заявке, для применения для ингибирования активности STAT3 и/или STAT5.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, описанная в настоящей заявке, для применения для лечения или предотвращения рака, в котором задействован активированный STAT3 и/или STAT5, такого как, рак из солидных или гематологических опухолей, рак молочной железы, рак печени, рак простаты, рак крови, рак кожи, рак головы, рак шеи, глиобластома или острый миелоидный (ОМЛ) и острый лимфобластный лейкоз.
Также описаны способы получения лекарственных средств, включающие объединение по меньшей мере одного из описанных соединений или по меньшей мере одного из описанных продуктов с фармацевтически приемлемым носителем или разбавителем. В другом аспекте настоящее изобретение относится к применению описанного соединения при получении лекарственных средств для лечения расстройства, связанного с нарушением активности STAT3/STAT5 (таким как гиперактивность или сверхэкспрессия). В другом аспекте настоящее изобретение относится к применению описанного соединения при получении лекарственных средств для лечения рака, в котором задействован активированный STAT3 и/или STAT5, такого как, рак из солидных или гематологических опухолей, рак молочной железы, рак печени, рак простаты, рак крови, рак кожи, рак головы, рак шеи, глиобластома или острый миелоидный (ОМЛ) и острый лимфобластный лейкоз.
Дополнительные преимущества настоящего изобретения частично представлены в описании ниже и частично являются очевидными из описания или могут быть изучены при реализации настоящего изобретения на практике. Преимущества настоящего изобретения реализованы и достигнуты при помощи элементов и комбинаций, указанных в прилагаемой формуле изобретения. Следует понимать, что общее описание, представленное выше, и подробное описание, представленное ниже, являются только иллюстративными и пояснительными и не ограничивают настоящее изобретение.
Настоящее изобретение может быть легче понято при помощи подробного описания изобретения, представленного ниже, и включенных в него примеров.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГ. 1А приведен график, на котором сравнивают соединение 1 и соединения 22, 31, 32 и 33 из библиотеки BTSC30M;
на ФИГ. 1В приведена таблица, в которой показаны значения IC50 соединений, исследуемых на ФИГ. 1А, в отношении BTSC, 25EF, 67EF, 73E, 84EF и 127EF;
на ФИГ. 2A показана нечувствительность различных соединений в отношении ряда киназ и структурных белков;
на ФИГ. 2B проиллюстрированы кривые ППР, на которых изображена аффинность связывания лучших соединений и белков STAT3/5;
на ФИГ. 3 проиллюстрирована древовидная диаграмма, на которой показано, что соединение 27 не ингибирует ни одну из 101 исследуемых киназ, где факт ингибирования определяют как ингибирование >35%.
на ФИГ. 4 показан вестерн-блот анализ трех соединений с лучшей активностью в отношении BTSC 147M и их сравнение с хорошо изученным ингибитором Jak2 WP1066 в концентрации 1 мкМ в отношении BTSCM 73M;
на ФИГ. 5 проиллюстрированы определенные значения IC50 контроля (стауроспорина) в отношении выбранных киназ;
на ФИГ. 6 приведена таблица, в которой показаны концентрации киназ в элюатах, измеренные путем кПЦР;
на ФИГ. 7 приведена калибровочная кривая, полученная с использованием 10 нМ Fam-pYLPQTV и разбавленных белков STAT3 и STAT1 (от 5,0 мкл до 2,4 нМ) с конечной 10% концентрацией в ДМСО;
на ФИГ. 8 проиллюстрирован скрининг соединений 22, 31, 32 и 33 в отношении различных BTSC, где для каждого соединения скрининг проводили два раза в различных концентрациях;
на ФИГ. 9 проиллюстрировано выживание клеток поджелудочной железы 10.05 пациентов, которым вводили ингибиторы STAT3;
на ФИГ. 10 проиллюстрировано действие предварительной обработки ингибитором STAT3 и последующей стимуляции цитокином IL6 в течение 15 минут на клетки пациента с Pa03C с низким пассажем;
на ФИГ. 11 проиллюстрировано действие ингибитора STAT3 31 на клеточную линию пациента с раком поджелудочной железы (Pa03C) с низким пассажем, помещенную в 96-луночный планшет с покрытием 1% очищенного агара в среду, содержащую 3% матригеля, с использованием ассоциированных с раком фибробластов и без них;
на ФИГ. 12 показано, что соединение 31 с высокой активностью снижает жизнеспособность в 12 из 15 различных опухолевых клеточных линий множественной миеломы, что определено путем исследования MTT, со значениями ED50 в диапазоне 2-6 мкМ;
на ФИГ. 13 показано окрашивание гематоксилином/эозином - окрашивание сплошных гиперклеточных участков опухоли (белый цвет) гематоксилином в клетках BT73 без использования (A) и с использованием (B) ингибитора 31;
на ФИГ. 14 проиллюстрировано действие соединения 31 на снижение экспрессии pSTAT у мышей с ортотопическим ксенотрансплантатом клеток рака мозга BT73;
на ФИГ. 15 проиллюстрировано действие соединения 31 на снижение пролиферации опухолевых клеток мозга BT73;
на ФИГ. 16 проиллюстрирован повышенный апоптоз (окрашивание TUNEL) у мышей, которым вводили соединение 31;
На ФИГ. 17 показана концентрация соединения 31 в мозге после введения различных дозировок (10 мг/кг и 25 мг/кг), определенная путем ЖХМС;
на ФИГ. 18 показана концентрация соединения 31 в мозге, определенная путем ЖХМС;
на ФИГ. 19 показана концентрация соединения 32 в мозге, определенная путем ЖХМС;
На ФИГ. 20 показана флуоресценция клеточной линии 2071 NIC после обработки соединением 31 (SH-04-54) или BP1-102; и
На ФИГ. 21 показана флуоресценция различных клеточных линий NIC после обработки соединением 31 (SH-04-54) или BP1-102.
ОПИСАНИЕ ВАРИАНТОВ РЕАЛИЗАЦИИ
Следует понимать, что, если не указано иное, соединения, композиции, изделия, системы, устройства и/или способы, раскрытые и описанные в настоящей заявке, не ограничиваются конкретными способами синтеза и конкретными реагентами, т.е. могут изменяться. Также следует понимать, что терминология, применяемая в настоящей заявке, используется с целью описания конкретных аспектов и не является ограничивающей. Хотя при тестировании или реализации на практике настоящего изобретении можно использовать любые способы и материалы, аналогичные или эквивалентные описанным в настоящей заявке, ниже описаны способы и материалы, приведенные в качестве примеров.
Все публикации, упомянутые в настоящем изобретении, включены в настоящую заявку посредством ссылки для раскрытия и описания способов и/или материалов с применением указанных публикаций. Описание публикаций, обсуждаемых в настоящей заявке, приведено только в том объеме, который они имели на момент подачи настоящей заявки. Никакую информацию, приведенную в настоящей заявке, не следует считать признанием того, что настоящее изобретение не может быть датировано задним числом на основании предшествующего изобретения. Кроме того, даты публикации, приведенные в настоящей заявке, могут отличаться от фактических дат публикации, которые могут требовать независимого подтверждения.
Номенклатура соединений, включая органические соединения, применяемая в настоящей заявке, основана на использовании тривиальных названий, рекомендаций ИЮПАК (Международный союз теоретической и прикладной химии), IUBMB (Международный союз биохимии и молекулярной биологии) или CAS (Химическая реферативная служба). В случае наличия одной или более стереохимических отличительных особенностей для обозначения стереохимического старшинства, E/Z номенклатуры и т.п. можно использовать правила Кана-Ингольда-Прелога. Если указано название соединения, специалист в данной области может легко установить его структуру при помощи системного подхода, заключающегося в применении правил номенклатуры к составным фрагментам структуры соединения, или с применением коммерчески доступного программного обеспечения, такого как CHEMDRAW™ (Cambridgesoft Corporation, U.S.A.)
Формы единственного числа «a», «an» и «the», применяемые в настоящем описании и прилагаемой формуле изобретения, включают формы множественного числа, если из контекста явно не следует иное. Таким образом, например, термины «функциональная группа», «алкил» или «остаток» включают смеси двух или более указанных функциональных групп, алкилов или остатков и т.п.
В настоящей заявке диапазоны могут быть выражены в виде указания от «примерно» одного конкретного значения и/или до «примерно» другого конкретного значения. Если указан такой диапазон, другой аспект включает от одного конкретного значения и/или до другого конкретного значения. Аналогично, следует понимать, что, если значения указаны в форме приближений при помощи антецедента «примерно», конкретное значение образует другой аспект. Также следует понимать, что оба концевых значения каждого из диапазонов являются значимыми и независимыми от другого концевого значения. Также следует понимать, что в настоящей заявке описано множество значений, и что каждое из значений также описывается в настоящей заявке в форме «примерно». Например, если описывается значение «10», также описывается «примерно 10». Также следует понимать, что включается каждое значение меж