Сорбционный материал, способ его получения и способ его применения
Иллюстрации
Показать всеГруппа изобретений относится к области синтеза сорбентов, которые, в частности, могут быть использованы в медицине. Заявленный сорбционный материал содержит пористый носитель, функциональные группы на поверхности которого ковалентно связаны с лигандом, способным к образованию прочных комплексов с бактериальными эндотоксинами. Пористый носитель представляет собой гранулы размером от 50 до 900 микрон, выполненные из полимера или сополимера. Носитель получен на основе таких мономеров, как акриловая кислота, метакриловая кислота, акриламид, метакриламид, метил акрилат, метил метакрилат, глицидил метакрилат, винил ацетат, аллиламин, натрия 2-метилпроп-2-ен-1-сульфонат, аллилглицидиловый эфир, дивинилбензол, этиленгликоль диметакрилат, триэтиленгликоль диметакрилат, N,N-бис(метакриламид). Лиганд для связывания бактериальных эндотоксинов является амфифильным органическим соединением, содержащим первичные и вторичные аминогруппы и гидрофобные заместители. Предложен способ получения нового сорбционного материала, а также его использование для очистки водного раствора белка, или водного солевого раствора, или раствора плазмы крови. Изобретение обеспечивает получение новых селективных сорбентов для очистки жидких сред от бактериальных эндотоксинов. 3 н.п. ф-лы, 2 табл., 15 пр.
Реферат
Область техники
Изобретение относится к области новых сорбционных материалов, предназначенных для удаления бактериальных эндотоксинов из водных растворов, в том числе из водных растворов белков, и органических соединений, содержащих неорганические соли.
Уровень техники
Бактериальные эндотоксины являются пирогенными веществами, уже в очень маленьких дозах сильно повышающими температуру тела теплокровных животных при попадании в организм. Если бактериальные эндотоксины напрямую попадают в кровоток, например в результате внутривенной инъекции лекарства, содержащего их в качестве примеси, то это приведет к сильному жару и лихорадке. Если подобный пирогенный эффект от попадания в кровь бактериальных эндотоксинов станет слишком сильным, лихорадка будет сопровождаться ознобом, дрожью, может перейти в шоковое состояние и привести к летальному исходу.
Хотя пирогенным эффектом обладают вещества различного строения, важнейшими и наиболее активными пирогенами являются бактериальные эндотоксины. Именно липополисахариды, фрагменты клеточной стенки грамотрицательных бактерий обладают наиболее выраженным пирогенным эффектом. Физиологической активностью обладают даже такие разбавленные растворы, как концентрации ~10-12 г/л. Липополисахариды являются поверхностно-активными веществами и в водных растворах существуют в виде агрегатов переменного состава и строения. Подобные агрегаты могут включать в себя и другие компоненты раствора, поэтому если какое-то вещество загрязняется липополисхаридами, очистить его от них очень тяжело.
На сегодняшний день применяются различные методы удаления бактериальных эндотоксинов:
(1) адсорбция с помощью активированного угля или ионообменных смол,
(2) гидролитическое расщепление бактериальных эндотоксинов с помощью кислот или щелочей,
(3) окислительное разложение бактериальных эндотоксинов с помощью водных растворов пероксида водорода, перманганата калия, гипохлорита натрия и подобных веществ,
(4) микрофильтрация с помощью мембран,
другие подобные методы.
Так или иначе, полное удаление бактериальных эндотоксинов с помощью указанных методов за одну операцию затруднительно или невозможно.
Кроме того, эти методы обладают существенными недостатками. Например, фармацевтическая субстанция, очищаемая от примесей бактериальных эндотоксинов с помощью метода (1), также сорбируется, что приводит к ее потерям, или также разрушается при использовании методов (2) и (3).
Известен ряд патентных документов, связанных с сорбционным удалением пирогенов и эндотоксинов из жидких сред, например:
DE 4113602 (A1) Highly selective endotoxin adsorber - consists of bead-like water swollen cellulose prod, contg. polyethylene-imine as the functional ligand (МПК B01D 15/00; B01J 20/22; B01J 20/28; B01J 20/32; A61M 1/36; (IPC1-7): A61M 1/36; B01D 15/00; B01J 20/26; B01J 20/28; B01J 20/30; C02F 1/28, опубл. 1992-10-29);
US 5279821 (A) Pyrogen adsorbent containing amide groups (МПК A61K 31/74; A61K 9/16; (IPC1-7): A61K 31/785; A61K 37/02; A61L 2/16; C08G 69/08; C08G 69/48, опубл. 1994-01-18);
US 5547576 (A) Pathogenic substance removing material and a blood filter containing the material (МПК A61L 2/00; A61L 2/02; A61M 1/36; B01D 39/16; B01D 67/00; (IPC1-7): B01D 63/00; B01D 69/12; B01D 71/60, опубл. 1996-08-20);
WO 9104086 (A1) FILTER MEDIA AND USE FOR PYROGEN REMOVAL (МПК B01D 15/00; B01J 20/32; (IPC1-7): B01D 15/08, опубл. 1991-04-04);
WO 0016897 (A1) MICROFILTRATION FILTER LAYER FOR SEPARATING ENDOTOXINS AND THE USE OF SAID MICROFILTRATION FILTER LAYER (МПК C07K 1/34; (IPC1-7): B01D 15/00; B01D 61/00; B01J 20/32, опубл. 2000-03-30);
US 4381239 (A) Method for reducing the pyrogen content of or removing pyrogens from substances contaminated therewith (МПК A61K 9/00; A61K 9/08; A61K 9/18; B01D 15/00; B01D 15/08; B01J 20/26; B01J 20/32; C08B 11/14; C08B 37/00; C08B 37/12; (IPC1-7): B01D 15/00, опубл. 1983-04-26);
US 6106723 (A) Method for removing pyrogens from dialysate (МПК B01D 61/00; B01D 67/00; B01D 69/14; B01J 20/28; B01J 20/32; C02F 1/44, опубл. 2000-08-22);
RU 2426557, СОРБЦИОННО-БАКТЕРИЦИДНЫЙ МАТЕРИАЛ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, СПОСОБ ФИЛЬТРОВАНИЯ ЖИДКИХ ИЛИ ГАЗООБРАЗНЫХ СРЕД, МЕДИЦИНСКИЙ СОРБЕНТ (МПК A61L 15/18, A61F 13/00, А61К 9/70, В82В 1/00, опубл. 20.08.2011) (есть РСТ-заявка WO 2011071417 (A1) BACTERICIDAL SORBENT MATERIAL AND METHOD FOR PRODUCING SAME (опубл. 2011-06-16).
После тщательного анализа всех указанных изобретений наиболее близким по технической сущности и достигаемому результату к заявляемому решению, по мнению авторов-разработчиков, признано изобретение СОРБЦИОННО-БАКТЕРИЦИДНЫЙ МАТЕРИАЛ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, СПОСОБ ФИЛЬТРОВАНИЯ ЖИДКИХ ИЛИ ГАЗООБРАЗНЫХ СРЕД, МЕДИЦИНСКИЙ СОРБЕНТ. Сорбционно-бактерицидный материал содержит нетканый полимерный волокнистый материал с закрепленными на его волокнах высокопористыми частицами гидрата оксида алюминия, при этом неорганический бактерицидный компонент сорбирован на высокопористых частицах гидрата оксида алюминия. Способ получения сорбционно-бактерицидного материала включает обработку материала раствором неорганического бактерицидного компонента и обработку нетканого полимерного волокнистого материала, на волокнах которого закреплены высокопористые частицы гидрата оксида алюминия в течение времени, не превышающего 24 ч. Способ фильтрования жидких или газообразных сред предусматривает пропускание жидкой или газообразной среды через сорбционно-бактерицидный материал. Предложенный сорбционно-бактерицидный материал на основе волокнистой матрицы и неорганических частиц и ионов обладает бактерицидной активностью и способностью к удалению бактериальных эндотоксинов. Механизм действия объясняется неселективной адсорбцией на порах волокон и образованием мостиковых координационных структур кислородсодержащих функциональных групп удаляемых органических соединений с закрепленными на волокнах сорбента ионами и частицами металлов.
Низкий объем пор и отсутствие в составе этого материала структурных фрагментов, обладающих специфическим сродством к бактериальным эндотоксинам, позволяют отнести к недостаткам этого изобретения невысокую сорбционную емкость, низкую активность и отсутствие селективности по отношению к бактериальным эндотоксинам. Таким образом, очевидно, что существует потребность в создании принципиально новых материалов, способных селективно удалять бактериальные эндотоксины из растворов органических соединений сложного состава и строения, в том числе физиологически активных белков.
Раскрытие изобретения
Технической задачей, на решение которой направлено настоящее изобретение, явилось создание нового сорбционного материала с улучшенной сорбционной активностью и селективностью по отношению к связываемым и удаляемым из раствора эндотоксинам в присутствии в этих растворах избытков органических соединений переменного строения и состава.
Другой технической задачей, стоящей перед разработчиками, была разработка нового способа получения амфифильных органических молекул, содержащих первичные и вторичные аминогруппы и гидрофобные заместители, использующиеся в качестве иммобилизованных лигандов для связывания бактериальных эндотоксинов.
Еще одной технической задачей, стоящей перед разработчиками, была разработка нового менее продолжительного и трудоемкого способа получения пористых полимерных гранул, содержащих на поверхности реакционно-способные функциональные группы.
И наконец, последней технической задачей изобретения была разработка способа фильтрования (очистки) жидких сред, включающего обеспечение контакта жидких сред с предлагаемым сорбционным материалом.
В силу этих обстоятельств были изучены и предложены селективные сорбенты, избирательно связывающие бактериальные эндотоксины. Такие сорбенты представляют из себя нерастворимые в воде пористые полимеры, на поверхности которых ковалентно иммобилизованы амфифильные органические соединения, обладающие высоким сродством к бактериальным эндотоксинам, содержащие в своем составе первичные и вторичные аминогруппы и гидрофобные заместители. Предложены методы использования таких сорбентов для снижения или полного удаления бактериальных эндотоксинов из растворов, содержащих белки и малые молекулы, неорганические соли, без существенного изменения состава таких растворов.
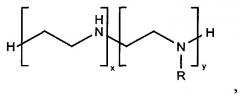
Настоящее изобретение относится к сорбенту, представляющему из себя пористый полимерный материал, состоящий из таких мономеров, как акриловая кислота, метакриловая кислота, акриламид, метакриламид, метил акрилат, метил метакрилат, глицидил метакрилат, винил ацетат, аллиламин, натрия 2-метилпроп-2-ен-1-сульфонат, аллилглицидиловый эфир, дивинилбензол, этиленгликоль диметакрилат, триэтиленгликоль диметакрилат, N,N-бис(метакриламид), и лиганда общей формулы
представляющего из себя амфифильную органическую молекулу, которая связана несколькими ковалентными связями с функциональными группами на поверхности нерастворимого в воде пористого полимерного материала. Сорбент обладает повышенной емкостью и селективностью, приемлемыми механическими свойствами, прост и дешев в изготовлении, может выдерживать стерилизацию.
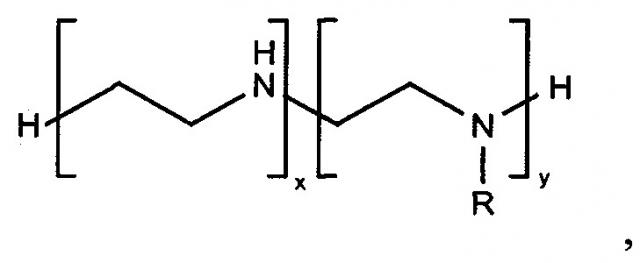
Сорбционный материал представляет из себя пористый полимерный носитель, функциональные группы на поверхности которого ковалентно связаны с лигандом в количестве от 1% до 25% по массе, способным к образованию прочных комплексов с бактериальными эндотоксинами. Пористый полимерный носитель, в котором базовый материал представляет собой гранулы размером от 50 до 900 микрон полимера или сополимера, состоящий из таких мономеров, как акриловая кислота, метакриловая кислота, акриламид, метакриламид, метил акрилат, метил метакрилат, глицидил метакрилат, винил ацетат, аллиламин, натрия 2-метилпроп-2-ен-1-сульфонат, аллилглицидиловый эфир, дивинилбензол, этиленгликоль диметакрилат, триэтиленгликоль диметакрилат, N,N-бис(метакриламид). Лиганд для связывания бактериальных эндотоксинов является амфифильным органическим соединением, содержащим первичные и вторичные аминогруппы и гидрофобные заместители, и обозначается следующей формулой
где R - алифатический неразветвленный радикал CnH2n+1, где n лежит в пределах от 1 до 18; бензил; 4-хлорбензил; 4-фенилбензил; 4-метилбензил;
соотношение х+y лежит в пределах от 1 до 4;
отношение y к х лежит в пределах от 0 до 1.
Способ получения сорбционного материала заключается в полимеризации следующих компонентов или их смесей: акриловая кислота, метакриловая кислота, акриламид, метакриламид, метил акрилат, метил метакрилат, глицидил метакрилат, винил ацетат, аллиламин, натрия 2-метилпроп-2-ен-1-сульфонат, аллилглицидиловый эфир, дивинилбензол, этиленгликоль диметакрилат, триэтиленгликоль диметакрилат, N,N-бис(метакриламид). Полимеризацию проводят в присутствии циклогексанола, толуола, поливинилового спирта, поливинилпирролидона или их смесей при температуре 70-80°C. Отдельно проводят синтез лиганда, используя один из следующих компонентов: этилендиамин, диэтилентриамин, триэтилентетрамин или тетраэтиленпентамин, которые смешивают с одним из следующих компонентов: октадецил бромид, додецил бромид, октил бромид, бутил бромид, метил йодид, бензил хлорид, 4-хлорбензил хлорид, 4-метилбензил хлорид, 4-фенилбензил хлорид. Реакцию ведут в этаноле в качестве растворителя при кипячении. Затем проводят иммобилизацию лиганда на полимерный носитель при комнатной температуре или кипячении в этаноле.
Также изобретение относится к области применения сорбента для очистки органических соединений, как белковых, так и малых молекул, в частности, физиологически активных вещества и их смесей. Конкретно, способ применения сорбционного материала заключается в очистке водного раствора белка, или водного солевого раствора, или раствора плазмы крови, согласно которому 50-100 мл загрязненного раствора помещают в сосуд, содержащий 10-40 мл сорбента, при температуре 20-37°C на время от одной минуты до трех часов, после чего раствор отделяют фильтрованием.
Примеры осуществления изобретения
Пример 1. Синтез лигандов
В круглодонную колбу объемом 2 л помещают 100 мл этилендиамина, 128 мл октадецил бромида и 1 л этанола. Реакцию ведут при кипячении в течение 24 ч. Полученное соединение (лиганд А01-С18-50) используют без выделения и очистки.
Аналогично были получены:
лиганд А01-С 12-50, исходя из 100 мл этилендиамина и 90 мл додецил бромида;
лиганд А01-С8-50, исходя из 100 мл этилендиамина и 65 мл октил бромида;
лиганд А01-С4-50, исходя из 100 мл этилендиамина и 40 мл бутил бромида;
лиганд А01-С1-50, исходя из 100 мл этилендиамина и 23 мл метил йодида;
лиганд А02-С8-50, исходя из 100 мл диэтилентриамина и 40 мл октил бромида;
лиганд А02-С8-100, исходя из 100 мл диэтилентриамина и 80 мл октил бромида;
лиганд А03-С8-50, исходя из 100 мл триэтилентетрамина и 29 мл октил бромида;
лиганд А04-С8-50, исходя из 100 мл тетраэтиленпентамина и 23 мл октил бромида;
лиганд А02-Б-25, исходя из 100 мл диэтилентриамина и 13 мл бензил хлорида;
лиганд А02-Х-25, исходя из 100 мл диэтилентриамина и 19 г 4-хлорбензил хлорида;
лиганд А02-М-25, исходя из 100 мл диэтилентриамина и 15 мл 4-метилбензил хлорида;
лиганд А03-ДФ-25, исходя из 100 мл диэтилентриамина и 23 г 4-фенилбензил хлорида.
Пример 2. Синтез микрогранул
В реактор объемом 5 л, снабженный рамной мешалкой, загружают глицидил метакрилат (102 мл), триэтиленгликоль диметакрилат (22 мл), толуол (150 мл), поливиниловый спирт (9,5 г) и дистиллированную воду (900 мл). Перемешивают при комнатной температуре со скоростью 500 об/мин в течение 15 мин. Затем вносят азобисизобутиронитрил (1,3 г). Реакцию ведут при скорости перемешивания 300 об/мин и температуре 70°C 2 ч, затем при температуре 80°C 4 ч. Содержимое выгружают из реактора на стеклянный фильтр пористостью 3, промывают водой (10 раз по 1 л), затем метанолом (3 раза по 350 мл). Высушивают на воздухе. Затем проводят рассев на виброгрохоте с выделение фракции частиц диаметром 100-500 мкм (П01).
Аналогично были получены микрогранулы:
П02, исходя из аллилглицидилового эфира (31 мл), этиленгликоль диметакрилата (70 мл), циклогексанола (100 мл), поливинилпирролидона-8000 (12 г) и азобисизобутиронитрила (1,0 г);
П03, исходя из натрия 2-метилпроп-2-ен-1-сульфоната (1,0 г), метил метакрилата (110 мл), дивинилбензола (3,0 мл, 80%), толуола (30 мл), поливинилпирролидона-8000 (9,0 г) и азобисизобутиронитрила (1,1 г);
П04, исходя из натрия 2-метилпроп-2-ен-1-сульфоната (14 г), метил метакрилата (100 мл), аллиламина (6,0 мл), дивинилбензола (6,0 мл, 80%), толуола (60 мл), поливинилпирролидона-8000 (9,0 г) и азобисизобутиронитрила (1,2 г);
П05, исходя из акриловой кислоты (20 мл), метил акрилата (50 мл), метил метакрилата (50 мл), винил ацетата (6,0 мл), N,N-бис(метакриламида) (12 г), циклогексанола (100 мл), поливинилового спирта (9,0 г) и азобисизобутиронитрила (1,3 г);
П06, исходя из метакриловой кислоты (14 мл), акриламида (7,0 мл), метакриламида (7,0 мл), метил метакрилата (80 мл), N,N-бис(метакриламида) (11 г), циклогексанола (50 мл), толуола (50 мл), поливинилового спирта (10 г) и азобисизобутиронитрила (1,2 г).
Пример 3. Синтез сорбентов М01-14
Навеску микрогранул П01 (50 г) помещают в колбу объемом 2 л, прибавляют раствор лиганда А01-С18-50 (500 мл) и этанол (500 мл). Реакцию ведут при кипячении в течение 24 ч. Затем сорбент (М01) переносят на стеклянный фильтр пористостью 3 и промывают последовательно этанолом (3 раза по 500 мл), дистиллированной водой (3 раза по 500 мл) и этанолом (3 раза по 150 мл). Хранят под слоем этанола (100 мл на 10 мл сорбента).
Аналогично были получены сорбенты:
М02, исходя из микрогранул П01 (50 г) и лиганда А01-С12-50 (500 мл);
М03, исходя из микрогранул П01 (50 г) и лиганда А01-С8-50 (500 мл);
М04, исходя из микрогранул П01 (50 г) и лиганда А01-С4-50 (500 мл);
М05, исходя из микрогранул П01 (50 г) и лиганда А01-С1-50 (500 мл);
М06, исходя из микрогранул П01 (50 г) и лиганда А02-С8-50 (500 мл);
М07, исходя из микрогранул П01 (50 г) и лиганда А02-С8-100 (500 мл);
М08, исходя из микрогранул П01 (50 г) и лиганда А03-С8-50 (500 мл);
М09, исходя из микрогранул П01 (50 г) и лиганда А04-С8-50 (500 мл);
M10, исходя из микрогранул П01 (50 г) и лиганда А02-Б-25 (500 мл);
M11, исходя из микрогранул П01 (50 г) и лиганда А02-Х-25 (500 мл);
М12, исходя из микрогранул П01 (50 г) и лиганда А02-М-25 (500 мл);
М13, исходя из микрогранул П01 (50 г) и лиганда А03-ДФ-25 (500 мл);
М14, исходя из микрогранул П02 (50 г) и лиганда А02-С8-50 (500 мл).
Пример 4. Синтез сорбентов M15-20
Навеску микрогранул П03 (50 г) помещают в колбу объемом 2 л, прибавляют раствор лиганда А02-С8-50 (300 мл) и этанол (700 мл). Реакцию ведут при комнатной температуре в течение 12 ч. Затем сорбент (M15) переносят на стеклянный фильтр пористостью 3 и промывают последовательно этанолом (3 раза по 500 мл), дистиллированной водой (3 раза по 500 мл) и этанолом (3 раза по 150 мл). Хранят под слоем этанола (100 мл на 10 мл сорбента).
Аналогично были получены сорбенты:
М16, исходя из микрогранул П03 (50 г) и лиганда А02-С8-100 (500 мл);
M17, исходя из микрогранул П03 (50 г) и лиганда А02-Б-25 (500 мл);
M18, исходя из микрогранул П04 (50 г) и лиганда А02-С8-50 (500 мл);
M19, исходя из микрогранул П05 (50 г) и лиганда А02-С8-50 (500 мл);
М20, исходя из микрогранул П06 (50 г) и лиганда А02-С8-50 (500 мл).
Пример 5. Депирогенизация водного раствора белка
Подготовка сорбента. Сорбент (50 мл) переносили на стеклянный фильтр, отделяли от этанола, промывали апирогенной водой (10 раз по 50 мл), затем 0,5 М NaOH (1 раз, 50 мл), физраствором (по 50 мл до рН<9) и апирогенной водой (1 раз, 50 мл).
Раствор бычьего сыворочного альбумина (1 мг/мл) в фосфатном буферном растворе (100 мл, 0,1 М, рН 7,0), загрязненного бактериальным эндотоксином (30 ЕЭ/мл, E. coli O113:Н10), поместили в депирогенизованную колбу объемом 250 мл. Затем в раствор внесли сорбент в количестве 40 мл. Смесь инкубировали при 37±2°C в течение 3 ч. Отбор пробы осуществляли через 1, 5, 30, 60 и 180 мин.
Определение бактериального эндотоксина осуществляли методом хромогенного ЛАЛ-теста по конечной точке. Для оценки содержания белка использовали биуретовый метод.
Пример 6. Депирогенизация водного раствора белка
Подготовку сорбента и очистку водного раствора белка проводили аналогично примеру 5, с той лишь разницей, что для очистки использовали 10 мл сорбента.
Пример 7. Депирогенизация водного раствора белка
Подготовку сорбента и очистку водного раствора белка проводили аналогично примеру 5, с той лишь разницей, что инкубацию проводили при 20±2°C.
Пример 8. Депирогенизация водного раствора белка
Подготовку сорбента проводили аналогично примеру 5. Для очистки использовали раствор цитохрома С (1 мг/мл) в трис-боратном буферном растворе (100 мл, 0,1 М, рН 8,3), загрязненного бактериальным эндотоксином (30 ЕЭ/мл, E. coli О113:Н10). Очистку проводили по аналогии с примером 5 при 37±2°C. Оценку содержания белка проводили спектрофотометрически.
Пример 9. Депирогенизация водного раствора белка
Подготовку сорбента проводили аналогично примеру 5. Для очистки использовали раствор гемоглобина (1 мг/мл) в фосфатном буферном растворе (100 мл, 0,1 М, рН 7,0), загрязненного бактериальным эндотоксином (30 ЕЭ/мл, E. coli О113:Н10). Очистку проводили по аналогии с примером 5 при 37±2°C. Оценку содержания белка проводили спектрофотометрически.
Пример 10. Депирогенизация водного раствора неорганической соли
Подготовку сорбента проводили аналогично примеру 5. Для очистки использовали физиологический раствор NaCl (0,9%), загрязненный бактериальным эндотоксином (КСЭ, 30 ЕЭ/мл, E. coli). Очистку проводили по аналогии с примером 5 при 37±2°C.
Пример 11. Депирогенизация водного раствора неорганической соли
Подготовку сорбента и очистку водного раствора неорганической соли проводили аналогично примеру 10, с той лишь разницей, что для очистки использовали 10 мл сорбента.
Пример 12. Депирогенизация водного раствора неорганической соли
Подготовку сорбента и очистку водного раствора белка проводили аналогично примеру 10, с той лишь разницей, что инкубацию проводили при 20±2°C.
Пример 13. Депирогенизация плазмы крови
Подготовку сорбента проводили аналогично примеру 5. Для очистки использовали бычью плазму крови, загрязненную бактериальным эндотоксином (5 ЕЭ/мл, E. coli O113:Н10). Очистку проводили по аналогии с примером 5 при 37±2°C.
Пример 14. Депирогенизация плазмы крови
Подготовку сорбента и очистку плазмы крови проводили аналогично примеру 13, с той лишь разницей, что для очистки использовали 10 мл сорбента.
Пример 15. Депирогенизация плазмы крови
Подготовку сорбента и очистку плазмы крови проводили аналогично примеру 13, с той лишь разницей, что инкубацию проводили при 20±2°C.
Изобретенный сорбционный материал образует как ионные, так и гидрофобные связи с молекулами бактериальных эндотоксинов, что обеспечивает синергетический эффект при их связывании и захвате, что обеспечивает высокую адсорбционную активность материала в широком спектре внешних условий (концентрация раствора, рН, ионная сила).
В заключение еще раз важно упомянуть, что удаление бактериальных эндотоксинов важно при решении двух задач:
1) лечение сепсиса и ряда других заболеваний путем фильтрования крови больного через сорбент (гемосорбция);
2) очистка фармацевтических субстанций и инъекционных растворов.
В новом предлагаемом решении сорбционный материал (сорбент) используется для решения второй задачи - очистки (фильтрования) водных растворов фармпрепаратов, в том числе белковой природы, где могут содержаться бактериальные эндотоксины. Поэтому изобретения, где сорбенты используются для лечения сепсиса, не рассматривались в качестве прямых аналогов.
Метод, который применяется для очистки фармсубстанций, - это те или иные вариации аффинной хроматографии. В данном случае предлагается к патентованию несколько упрощенная процедура очистки, связанная с погружением сорбента в сосуд с очищаемым раствором, в отличие от классической хроматографии, когда очищаемый раствор пропускают через сорбент.
Следует отметить новизну лигандов, которые иммобилизуются на носитель. В целом, амины используются для удаления эндотоксинов давно, но в предлагаемом решении используются специфические синтетические амины, имеющие все признаки новизны для решения данной задачи.
Все процессы сорбции протекают вне организма и являются классическими примерами взаимодействия адсорбат-адсорбент: суть сорбента заключается в том, что он прочно связывает (удаляет из раствора) нежелательные молекулы (бактериальные эндотоксины), при этом не способен связывать полезные молекулы (лекарственные препараты и компоненты биологических жидкостей).
Предлагаемое техническое решение получено в рамках выполнения работы по Соглашению №14.577.21.0165 между Министерством образования и науки Российской Федерации (Госзаказчик) и МГТУ им. Н.Э. Баумана.
1. Сорбционный материал, представляющий из себя пористый полимерный носитель, функциональные группы на поверхности которого ковалентно связаны с лигандом в количестве от 1% до 25% по массе, способным к образованию прочных комплексов с бактериальными эндотоксинами, при этом пористый полимерный носитель выполнен в виде гранул размером от 50 до 900 микрон из полимера или сополимера, полученных из мономеров, выбранных из ряда: акриловая кислота, метакриловая кислота, акриламид, метакриламид, метил акрилат, метил метакрилат, глицидил метакрилат, винил ацетат, аллиламин, натрия 2-метилпроп-2-ен-1-сульфонат, аллилглицидиловый эфир, дивинилбензол, этиленгликоль диметакрилат, триэтиленгликоль диметакрилат, N,N-бис(метакриламид), в качестве лиганда для связывания бактериальных эндотоксинов, материал содержит амфифильное органическое соединение, содержащее первичные и вторичные аминогруппы и гидрофобные заместители, представленное следующей формулой:
где R - алифатический неразветвленный радикал CnH2n+1,
n лежит в пределах от 1 до 18;
бензил; 4-хлорбензил; 4-фенилбензил; 4-метилбензил;
соотношение x+y лежит в пределах от 1 до 4;
отношение y к x лежит в пределах от 0 до 1.
2. Способ получения сорбционного материала, охарактеризованного в п. 1, заключающийся в полимеризации компонентов или смесей компонентов, выбранных из ряда: акриловая кислота, метакриловая кислота, акриламид, метакриламид, метил акрилат, метил метакрилат, глицидил метакрилат, винил ацетат, аллиламин, натрия 2-метилпроп-2-ен-1-сульфонат, аллилглицидиловый эфир, дивинилбензол, этиленгликоль диметакрилат, триэтиленгликоль диметакрилат, N,N-бис(метакриламид), при этом полимеризацию проводят в присутствии соединений, выбранных из циклогексанола, толуола, поливинилового спирта, поливинилпирролидона или их смесей, при температуре 70-80°C; отдельно проводят синтез лиганда, используя один из следующих компонентов: этилендиамин, диэтилентриамин, триэтилентетрамин или тетраэтиленпентамин, которые смешивают с одним из следующих компонентов: октадецил бромид, додецил бромид, октил бромид, бутил бромид, метил йодид, бензил хлорид, 4-хлорбензил хлорид, 4-метилбензил хлорид, 4-фенилбензил хлорид, реакцию ведут в этаноле в качестве растворителя при кипячении, затем проводят иммобилизацию синтезированного лиганда на полимерный носитель при комнатной температуре или кипячении в этаноле.
3. Применение сорбционного материала, охарактеризованного в п. 1, для способа очистки водного раствора белка, или водного солевого раствора, или раствора плазмы крови, согласно которому 50-100 мл загрязненного раствора помещают в сосуд, содержащий 10-40 мл сорбционного материала, при температуре 20-37°C на время от одной минуты до трех часов, после чего раствор отделяют фильтрованием.