Гибридные терпенофенолы с изоборнильным и 1-фенилэтильным или 1-фенилпропильным заместителями и их применение в качестве средства, обладающего антирадикальной, антиоксидантной и мембранопротекторной активностью
Иллюстрации
Показать всеИзобретение относится к новым гибридным терпенофенолам с изоборнильным и 1-фенилэтильным или 1-фенилпропильным заместителями формулы
,
за исключением (I-III), а также к применению гибридных терпенофенолов формулы (I-VI) в качестве средства, обладающего антирадикальной, антиоксидантной и мембранопротекторной активностью при низкой токсичности. 2 н.п. ф-лы, 5 табл., 7 пр.
Реферат
Изобретение относится к замещенным фенолам, а именно к терпенофенолам с изоборнильным и 1-фенилэтильным или 1-фенилпропильным заместителями. Соединения (I-VI) представляют интерес в качестве гибридных антиоксидантов, фармакологических субстанций, а также технических стабилизаторов полимерных материалов.
Известно, что пространственно-затрудненные фенолы являются наиболее представительным классом универсальных синтетических антиоксидантов, которые используются для решения задач как прикладного характера, так и в фундаментальных исследованиях. Благодаря способности ингибировать радикально-цепные окислительные процессы, алкилированные фенолы широко применяются в качестве стабилизаторов топлив, масел, полимерных материалов, пищевых продуктов и т.д. [Горбунов Б.Н., Гурвич Я.А., Маслова И.П. Химия и технология стабилизаторов полимерных материалов. М.: Химия. 1981. 386 с.; Мазалецкая Л.И., Шелудченко Н.И., Шишкина Л.Н., Кучин А.В., Чукичева И.Ю. Нефтехимия. 2011. 28, 78-80; Кучин А.В., Королева А.А., Федорова И.В., Шумова О.А., Чукичева И.Ю. Известия Уфимского научного центра РАН, 2012, 4, 80-93; Шалыминова Д.П., Самуилов А.Я., Хусаинов А.Д., Черезова Е.Н., Лиакумович А.Г. Вестник Казанского технологического университета. 2007. 5, 49-55; Черезова Е.Н., Шалыминова Д.П., Напалкова Н.В., Софронова О.В. Вестник Казанского технологического университета. 2011. 11, 59-63]. Известно, что фенолы с α-алкилбензильными заместителями имеют техническое и медицинское назначение. Данные соединения могут применяться для защиты полиолефинов, латексов, резин на основе натурального и синтетических каучуков [Горбунов Б.Н., Гурвич Я.А., Маслова И.П. Химия и технология стабилизаторов полимерных материалов. М.: Химия, 1981. 386 с.; Шалыминова Д.П., Самуилов А.Я., Хусаинов А.Д., Черезова Е.Н., Лиакумович А.Г. Вестник Казанского технологического университета. 2007. 5, 49-55; Черезова Е.Н., Шалыминова Д.П., Напалкова Н.В., Софронова О.В. Вестник Казанского технологического университета. 2011. 11, 59-63; Шалыминова Д.П., Черезова Е.Н., Лиакумович А.Г. ЖПХ. 2009. 82, 821-825]. Предлагается использовать изоборнилфенолы в качестве термостабилизаторов полимерных композиций [патент РФ №2458948, опубл. 20.08.2012. Бюл. №23], при переработке жидких продуктов пиролиза [патент РФ №2387631, опубл. 27.04.2010. Бюл. №12; №2375342, опубл. 10.12.2009].
Пространственно-затрудненные фенолы проявляют антибактериальную, противовоспалительную, бактерицидную, фунгицидную и ДНК-протекторную активность [Овсянникова М.Н., Вольева В.Б., Белостоцкая И.С. Фенольные соединения: фундаментальные и прикладные аспекты. Материалы докладов VIII Международного симпозиума. Москва, 2012. С. 137-140. Isomura Y., Ito Ν., Homma Η., Abe T., Kubo К. Chem. Pharm. Bull. 1983. V. 31, №9, 3168-3179; Ершов В.В., Никифоров Г.Α., Володькин А.А. Пространственно-затрудненные фенолы. М.: Химия. 1972. 328 с.; Кузурман П.А., Шарпатый В.А. Химия высоких энергий. 1999. Т. 33, №5, 347-353].
Фенолы с α-метилбензильными заместителями обладают антимикробными свойствами [Мамедова П.Ш., Садыхов К.И., Бабаев Э.Р., Мамедова З.П., Гаджиева М.А. Материалы XI Всероссийской конференции по химическим реактивам «Реактив-98». Уфа: «Реактив». 1998. С. 56].
Проведенные ранее исследования показали, что изоборнилфенолы проявляют антиоксидантную, противовоспалительную и гемореологическую активности [Cirri M., Mura P., Corvi Mora P. Int. J. Pharm. 2007. 30, 84-91; Chukicheva I.Yu., Fedorova I.V., Buravlev E.V., Lumpov A.E., Vikharev Yu.B., Anikina L.V., Grishko V.V., Kuchin A.V. Chem. Nat. Compd. 2010. 46, 478-480; Plotnikov M.B., Smol'yakova V.I., Ivanov I.S., Kuchin A.V., Chukicheva I.J., Buravlev E.V., Krasnov E.A. Pharm. Chem. J. 2011. 44, 530-533; Buravlev E.V., Chukicheva I.Y., Suponitsky K.Y., Vikharev Y.B., Grishko V.V., Kutchin A.V. Lett. Org. Chem. 2011. 8, 301-308; патенты RU №2347561. опубл. 27.02.2009 Бюл. №6; №2351321. опубл. 10.042009. Бюл. №10; №2406488, 20.12.2010; №2406487, 20.12.2010], а также обладают мембранопротекторными свойствами [Buravlev E.V., Chukicheva I.Yu., Shevchenko O.G., Suponitsky K.Yu., Kutchin A.V. Russ J. Bioorg. Chem. 2011. 37, 614-618.] Известно, что введение в структуру фенолов объемных заместителей разной природы может привести к изменению их физико-химических и биологических свойств. Перспективным с этой точки зрения является синтез гибридных фенольных антиоксидантов, содержащих в одной молекуле объемный изоборнильный и 1-фенилэтильный или 1-фенилпропильный заместители.
Известен способ получения фенолов с α-метилбензильными заместителями [Шалыминова Д.П., Самуилов А.Я., Хусаинов А.Д., Черезова Е.Н., Лиакумович А.Г. Вестник Казанского технологического университета. 2007. №5, 49-55; Шалыминова Д.П. дисс. на соискание к. техн. н. Казань. 2011, 150 с.], который включает алкилирование фенола стиролом при нагревании в присутствии катализатора пара-толуолсульфокислоты в количестве 5% масс. Алкилирование ведут при 90-130°С. За окончание реакции принимается время до прекращения изменения концентрации фенола. Недостатком данного способа является процесс обработки реакционной смеси, который включает использование большое количество промывных вод для отмывки катализатора.
Фенолы с изоборнильным и 1-фенилэтильным заместителями (I-III) синтезированы по известной методике [Шалыминова Д.П., Самуилов А.Я., Хусаинов А.Д., Черезова Е.Н., Лиакумович А.Г. Вестник Казанского технологического университета. 2007. №5, 49-55] и описаны их физико-химические свойства [Чукичева И.Ю., Сукрушева О.В., Кучин А.В. ЖОХ. 2015. Т. 85, №6, 929-932]. Свойства соединений (I-III), определяющие их применение в источниках информации не описаны.
Известен способ получения метилбензилированных фенолов с использованием гетерогенного катализатора (сульфокатионита), преимущества которого в сравнении с пара-толуолсульфокислотой заключаются в исключении стадии нейтрализации и отмывки продуктов реакции от катализатора [Шалыминова Д.П. дисс. на соискание к. техн. н. Казань. 2011, 150 с.].
Отличие метода получения фенолов с изоборнильным и 1-фенилпронильным заместителями (IV-VI) от известного заключается в использовании гетерогенных катализаторов сульфокатионитов ФИБАН К-1 или Amberlyst 15 или Amberlyst 36. Описания заявляемых соединений (IV-VI) и их свойств в источниках информации не обнаружено.
Технической задачей изобретения является получение новых гибридных антиоксидантов формулы (IV-VI) на основе изоборнилфенолов и выявление антирадикальной, антиоксидантной и мембранопротекторной активности соединений (I-VI).
Технический результат состоит в расширении арсенала средств, обладающих антирадикальной, антиоксидантной и мембранопротекторной активностью при низкой токсичности.
Заявленные соединения могут быть применимы в качестве технических антиоксидантов и стабилизаторов полимерных материалов, эпоксидных смол, органических соединений (в том числе пищевых жиров и масел), ингибиторов термополимеризации [Известия ВолгГТУ, 2010. Т. 2, №7. 134-136; патент РФ №2387631, 27.04.2010; №2375342, 10.12.2009; Кучин А.В., Королева А.А., Федорова И.В., Шумова О.Α., Чукичева И.Ю. Известия Уфимского научного центра РАН, 2012, 4, 80-93].
Также заявленные соединения могут быть применимы в качестве фармацевтических субстанций антиоксидантного, радиопротекторного, противовоспалительного, бактерицидного действия [Cirri M., Mura P., Corvi Mora P. Int. J. Pharm. 2007. 30, 84-91; Chukicheva I.Yu., Fedorova I.V., Buravlev E.V., Lumpov A.E., Vikharev Yu.B., Anikina L.V., Grishko V.V., Kuchin A.V. Chem. Nat. Compd. 2010. 46, 478-480; Мамедова П.Ш., Садыхов К.И., Бабаев Э.Р., Мамедова З.П., Гаджиева М.А. Материалы XI Всероссийской конференции по химическим реактивам «Реактив-98». Уфа: «Реактив». 1998, 56].
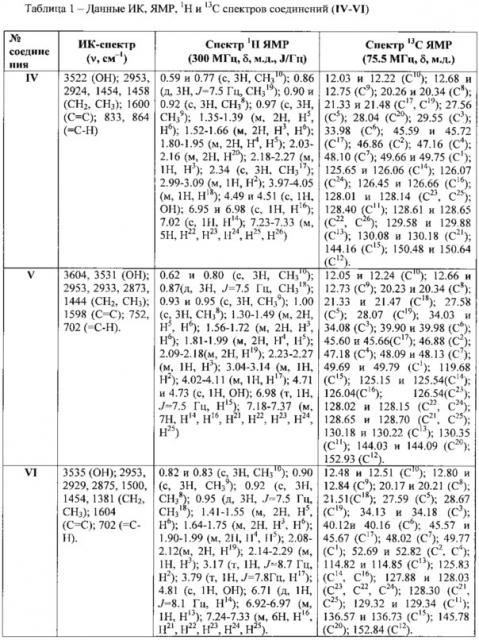
Структура полученных соединений подтверждена методами ИК и ЯМР спектроскопии. ИК спектры записывали на ИК-Фурье-спектрометре Shimadzu IR Prestige 21 в таблетках с КВr. Спектры ЯМР 1Н и 13С регистрировали на приборе «Bruker Avance II 300» (рабочая частота 300 и 75 МГц) в CDCl3. Соединения формулы I, II, IV, V и VI представляют собой масла, соединение III представляет собой мелкокристаллический порошок с т.пл. 95-98°С.
Указанные соединения хорошо растворимы в ацетоне, хлороформе, этиловом спирте, петролейном эфире, диметилсульфоксиде, гексане, не растворимы в воде.
Оценку антирадикальной активности полученных структур проводили в модельной реакции инициированного окисления этилбензола, в которой с постоянной скоростью генерируются свободные радикалы, ведущие цепи окисления.
Для тестирования антиоксидантной и мембранопротекторной активности заявляемых веществ проводили исследование гемолиза эритроцитов в условиях окислительного стресса, индуцируемого пероксидом водорода [Ко, F.N., Hsiao, G, Kuo, Y.H. Free Radic. Biol. Med. 1997, 22, 215-222; Lopez-Revuelta A., Sanchez-Gallego J.I., Hermandez-Hernandez A., Sanchez-Yague J., Llanillo M. Chem. Biol. Interact. 2006, 161, 79-91; Banerjee A., Kunwar A., Mishra В., Priyadarsini K.I. Chem. Biol. Interact. 2008, 174 (2), 134-139; Takebayashi J., Chen J., Tai A. Meth. Mol. Biol. 2010, 594, P. 287-296].
Сущность предлагаемого решения и возможность его осуществления подтверждается примерами, результатами физико-химических и биологических исследований, приведенных в таблицах 1-5.
Пример 1. 4-Метил-2-(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)-6-(1-фенилпропил)фенол (соединение IV). В двугорлую колбу, снабженную обратным холодильником и термометром, помещали рассчитанные количества 2-изоборнил-4-метилфенола, аллилбензола и ФИБАН К-1, (5-10 масс %). Реакцию проводили при температуре 100°С, соотношении фенол : аллилбензол 1:1-2, в течение 10 ч. Выход продукта составил до 66%. Бесцветный порошок с т.пл. 95-98°С., спектральные характеристики соединения (IV) приведены в таблице 1.
Пример 2. Процесс алкилирования проводят аналогично примеру 1 за исключением того, что в качестве катализатора используют Amberlyst 15(10 масс %). Выход продукта - 4-метил-2-(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)-6-(1-фенилпропил)фенол (соединение IV) составил 55%.
Пример 3. Процесс алкилирования проводят аналогично примеру 1 за исключением того, что в качестве катализатора используют Amberlyst 36 и реакцию проводят при температуре 140°С. Выход соединение (IV) составил до 50%.
Пример 4. Процесс алкилирования 2-изоборнилфенола проводят аналогично примеру 1. Выход 2-(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)-6-(1-фенилпропил)фенола (соединение V) составил до 20% и 2-(1,7,7-триметилбицикло[2.2.1]гепт-экзо-2-ил)-4-(1-фенилпропил)фенола (соединение VI) - до 45%. Светло-коричневые масла, спектральные характеристики соединений (V) и (VI) приведены в таблице 1.
Пример 5. Процесс алкилирования 2-изоборнилфенола проводят аналогично примеру 1 в присутствии Amberlyst 15. Выход продуктов: (V) 16% и (VI) 40%.
Пример 6. Процесс алкилирования 2-изоборнилфенола проводят аналогично примеру 1 в присутствии Amberlyst 36. Выход продуктов: (V) до 14% (12-14%) и (VI) до 40%.
Пример 7. Исследование антирадикальной активности заявляемых соединений.
Ингибирующую активность гибридных соединений изучали волюмометрическим методом в модельной реакции окисления этилбензола, инициированного динитрилом азаизомасляной кислоты. Кинетику поглощения кислорода в процессе окисления регистрировали с помощью высокочувствительной валюмометрической установки при 333 К и скорости инициирования Wi=5-10-8 моль/л⋅с. Этилбензол с растворенным инициатором предварительно термостатировали, после чего вводили добавку антиоксиданта и регистрировали кинетику поглощения кислорода.
Как видно из представленных в таблице 2 данных, изученные соединения являются весьма активными антиоксидантами, величина k7 которых зависит от числа, природы и расположения заместителей по отношению к ОН-группе фенола.
Пример 8. Исследование антиоксидантной и мембранопротекторной активности и токсичности заявляемых соединений.
Для исследования токсичности, антиоксидантной и мембранопротекторной активности соединений использовали суспензию эритроцитов крови лабораторных мышей в фосфатно-солевом буфере (PBS, рН 7.4). Токсичность соединений оценивали (in vitro) по их способности индуцировать гибель эритроцитов (гемолиз). Растворы соединений в ацетоне вносили в суспензию эритроцитов в конечной концентрации 10 и 100 мкМ и инкубировали при 37°С в течение 5 ч в термостатируемом шейкере Biosan ES-20 (Латвия). Контрольные образцы содержали ацетон (0.1% от общего объема инкубационной смеси). Мембранопротекторную и антиоксидантную активность определяли по степени ингибирования индуцированного гемолиза, торможения накопления вторичных продуктов окисления липидов (ПОЛ) и окисления оксигемоглобина в эритроцитах. С этой целью после внесения в суспензию эритроцитов растворов исследуемых соединений (конечная концентрация 1 и 10 мкМ) инициировали гемолиз раствором пероксида водорода (0.006%). Затем реакционную смесь инкубировали в термостатируемом шейкере при медленном перемешивании и 37°С в течение 5 ч. Каждый час из инкубационной среды отбирали аликвоту, центрифугировали 5 мин (1600 g), степень гемолиза определяли по содержанию гемоглобина в супернатанте на спектрофотометре ThermoSpectromic Genesys 20 (США) при λ 524 нм [Takebayashi J., Chen J., Tai A. Adv. Protocolsin Oxidative Stress, Meth. Mol. Biol. 2010. 594, 287-296]. Процент гемолиза рассчитывали по отношению к полному гемолизу образца [Costa R.M., Magalhaes A.S., Pereira J.A., Andrade P.B., Valentao P., Carvalho M., Silva В.M. Evaluation of free radicalscavenging and antihemolytic activities of quince (Cydonia oblonga) leaf: A comparative study with green tea (Camellia sinensis). Food Chem. Toxicol. 2009. 47, 860-865; Wang C, Qin X., Huang В., He F., Zeng C. Hemolysis of human erythrocytes induced by melamine-cyanurate complex. Biochem. Biophys. Res. Communic. 2010. 402, 773-777]. Содержание вторичных продуктов ПОЛ, реагирующих с 2-тиобрабитуровой кислотой (ТБК-АП), определяли спектрофотометрически [Asakawa Т., Matsushita S. Coloring conditions of thiobarbituric acid test for detecting lipid hydroperoxides. Lipids. 1980. 15 (3), 137-140]. Для оценки накопления продуктов окисления гемоглобина анализировали спектр поглощения гемолизата, содержание различных форм гемоглобина (oxyHb, metHb и ferrylHb) рассчитывали с учетом соответствующих коэффициентов экстинкции [Berg J.M., Kamp J.A.F., Lubin В.H., Roelofsen В., Kuypers F.A. Kinetics and site specificity of hydroperoxide-induced oxidative damage in red blood cells // Free Radie. Biol. Med. 1992. 12, No 6. 487-498]. Каждый эксперимент проводили в 4 повторностях. Статистическую обработку данных осуществляли с помощью пакета программ Microsoft Office Excel 2007. Сравнение проводили с контролем (эритроциты с добавлением растворителя) и 2-изоборнил-4-метилфенолом.
Результаты экспериментов приведены в таблицах 3-5.
Установлено, что все исследованные соединения в концентрации 10 мкМ не обладают выраженной токсичностью по отношению к эритроцитам (табл.3). В модельной клеточной системе показана высокая мембранопротекторная и антиоксидантная активность полученных соединений. Исследованные структуры не только препятствуют гибели клеток, но и эффективно ингибируют Н2О2-индуцированное окисление мембранных липидов и основного белка эритроцитов - гемоглобина (табл. 4).
Таким образом, заявленные химические соединения формулы (I-VI) обладают антирадикальной, антиоксидантной и мембранопротекторной активностью при низкой токсичности и могут быть применимы в качестве технических антиоксидантов и стабилизаторов полимерных материалов, органических соединений (в том числе пищевых жиров и масел), ингибиторов термополимеризации, а также фармацевтических субстанций антиоксидантного, противовоспалительного, бактерицидного действия.
Работа выполнена при поддержке программы «УМНИК», договор №4799ГУ1/2014.
1. Гибридные терпенофенолы с изоборнильным и 1-фенилэтильным или 1-фенилпропильным заместителями формулы
,
за исключением (I-III).
2. Применение в качестве средства, обладающего антирадикальной, антиоксидантной и мембранопротекторной активностью при низкой токсичности, гибридных терпенофенолов с изоборнильным и 1-фенилэтильным или 1-фенилпропильным заместителями формулы (I-VI):