Композиции антагонистов нейрокинина-1 для внутривенного введения
Иллюстрации
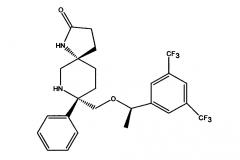
Показать всеГруппа изобретений относится к области фармацевтики, а именно к фармацевтическим композициям антагониста нейролейкина-1 для внутривенного введения, и раскрывает фармацевтическую композицию, содержащую (5S,8S)-8-[{(1R)-1-(3,5-Бис-(трифторметил)фенил)-этокси}-метил]-8-фенил-1,7-диазаспиро[4.5]декан-2-он (соединение 1) или его фармацевтически приемлемые соли, гидраты или его пролекарственные формы и фармацевтически приемлемый носитель, способ лечения тошноты и/или рвоты, в том числе острой отсроченной тошноты и/или рвоты, связанных с начальными и повторнвми курсами высокоэметогенной или умеренно эметогенной химиотерапии, в том числе способ лечения CINV, способ минимизации гемолиза при помощи указанной фармацевтической композиции. 7 н. и 27 з.п. ф-лы, 13 ил., 21 табл., 8 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтическим композициям антагониста нейрокинина-1 и их пролекарствам для внутривенного введения, получению фармацевтических композиций и их применению.
УРОВЕНЬ ТЕХНИКИ
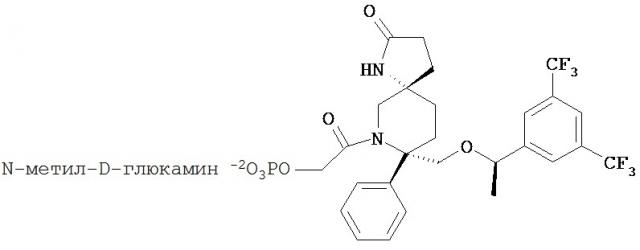
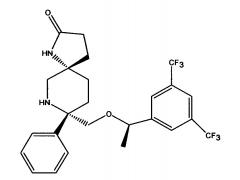
(5S,8S)-8-[{(1R)-1-(3,5-Бис-(трифторметил)фенил)-этокси}-метил]-8-фенил-1,7-диазаспиро[4.5]декан-2-он (соединение, представленное формулой I; также упоминается в настоящем изобретении как Соединение 1) и его соли были описаны в патенте США №7,049,320 (патент ’320), выданном 23 мая 2006 года. Процесс синтеза Соединения 1 подробно описывается в Примере 72а патента ’320 (см. в патенте ’320 колонка 43, со строки 55 до колонки 45, строка 20; колонка 75, со строки 55 колонки 80, строка 21; колонка 90 со строки 35 до строки 63; и колонка 98, строка 1 до колонки 99, строка 24, который включен сюда посредством ссылки. Смотри также WO 2008/11833, Примеры 1-6, которые включены сюда посредством ссылки). WO 2005/063243 раскрывает некоторые фармацевтические композиции, включающие антагонисты NK-1. Композиции, описанные в нем, требуют полианионное производное бета-циклодекстрина, содержащее примерно от одной до семи натрий сульфонатных групп, отделенных от липо-фильной полости по меньшей мере одной спейсерной бутокси группой, т.е. Captisol®. В упомянутом патенте отсутствует ссылка на внутривенные композиции, которые минимизируют гемолиз. Кроме того, различные солевые формы соединения, представленного формулой I, были описаны, например, в опубликованном патенте США 2007/0244142, который также включен посредством ссылки.
Соединение формулы I классифицируется как соединение тахикинина и является антагонистом рецепторов нейропептида нейрокинина-1 (NK-1). Соединение формулы I может быть в форме свободного основания или в форме фармацевтически приемлемой соли. Свободное основание или соль могут быть в аморфной форме, или фармацевтически приемлемой соли, используемой в настоящем изобретении, может быть в кристаллической форме или в форме кристаллогидрата или сольватной форме. В растворе и в зависимости от pH этого раствора, соединение формулы I может быть в форме смеси свободного амина/соли. Пролекарства соединения формулы I также могут быть использованы в композициях, подходящих для парентерального введения. Пролекарства, в которых либо свободный амин (либо оба амина) в соединении формулы I имеют водород, замещенный группой, выбранной из Y и его солей, где Y выбирается из -Р(O)(ОН)2, -S(O)n1R1, -С(O)(С1-6алкил)Х, -С(O)(С1-6алкил)(арил), -C(O)OR4; X выбирается из NR2R3, -Р(O)(ОН)2 или -S(O)n1R1; R1 является Н или С1-6алкила; R2 является Н или С1-6алкила; R3 является Н или С1-6алкила; R4 является Н или C1-6алкила; значение n1 равное 0-4 подходит для применения согласно настоящему изобретению. Подходящие катионы или дикатионы для ионизированной формы (форм) пролекарств включают соли металлов или катионы органических аминов, в том числе соли меглумина и подобные (N-метил-D-глюкамин). Такие пролекарства могут применяться вместе с описанными парентеральными носителями или без них в подходящей жидкой композиции для лечения пациентов, нуждающихся в таком лечении. Такие пролекарства после парентерального введения пациенту превращаются в непролекарственную форму лекарственного средства (или в его соль). Такие пролекарства могут быть в аморфной форме или в кристаллической форме и/или в форме кристаллосольватов/гидратов.
Было показано, что антагонисты рецепторов NK-1 могут быть полезными терапевтическими средствами, например, при лечении боли, воспаления, мигрени, тошноты (рвоты) и ноцицепции
Сущность изобретения
Настоящее изобретение в широком плане относится к композициям, пригодным для внутривенного введения пациенту, нуждающемся в таком лечении, где названные композиции включают соединение Формулы I и его фармацевтически приемлемые соли, гидраты, сольваты, а также носитель, выбранный из группы, состоящей из водорастворимых органических растворителей, неионных поверхностно-активных веществ, нерастворимых в воде липидов, органических липидов/полутвердых веществ и фосфолипи-дов. Растворимые в воде органические растворители могут быть выбраны из, например, полиэтиленгликоля 300, полиэтиленгликоля 400, этанола, пропиленгликоля, глицерина, N-метил-2-пирролидона, диметилацетамида и диметилсульфоксида. Неионные поверхностно-активные вещества могут быть выбраны из Кремофора EL, Кремофора RH 40, Кремофора RH 60, сукцината d-a-токоферол полиэтиленгликоля 1000, полисорбита 80, солю-тола HS 15, моноолеата сорбитана, полоксамера 407, Labrifil M-1944CS, Labrafil M-2125CS, лабразола, Gellucire 44/14, Softigen 767 и моно- и ди-эфиров жирных кислот с ПЭГ 300, 400 или 1750. Нерастворимые в воде липиды выбираются из касторового масла, кукурузного масла, хлопкового масла, оливкового масла, арахисового масла, масла мяты перечной, подсолнечного масла, кунжутного масла, соевого масла, гидрогенизированного растительного масла, гидрогенизированного соевого масла, среднеце-почечных триглицеридов из кокосового и пальмового масла. Органические жидкости и полутвердые вещества могут быть выбраны из пчелиного воска, D-α-токоферола, олеиновой кислоты и среднецепочечных моно- и диг-лицеридов. Фосфолипиды выбираются из лецитина, гидрогенизированного соевого фосфатидилхолина, дистеароилфосфатидилглицерина, L-α-димиристоилфосфатидилглицерина и L-α-димиристоилфосфатидилгли-церина и других, как описано в настоящем изобретении. Композиции изготавливаются для обеспечения достаточной растворимости и химической стабильности, которая определяется как <5-10% деградации в течение одного года (предпочтительно за два года) при конкретных условиях хранения, которые изменяются в зависимости от конкретной композиции, места хранения и т.д. Предпочтительно, композиции применяются в качестве внутривенных композиций. При необходимости или по предписанию, эти композиции могут иметь широкое назначение как парентеральные композиции, приемлемые для доставки известными специалистам в данной области техники методами, включая внутривенное (ВВ), внутримышечное (ВМ) или подкожное (ПК) введение. Пролекарства могут быть использованы в пероральной форме или в парентеральных композициях, содержащих водные/солевые системы доставки вместе или без дополнительных носителей для доставки, как изложено выше.
Настоящее изобретение описывает и заявляет, в частности, фармацевтические композиции и композиции Соединения 1 и его фармацевтически приемлемых солей для применения в целях лечения тошноты и/или рвоты. Предпочтительной формой Соединения 1, используемой для получения композиций, описываемых в настоящем изобретении, включая внутривенные композиции, является кристаллическая соль моногидрат гидрохлорид. Разработка заявляемых композиций потребовала существенного экспериментирования и усилий, как описано ниже и в Примерах, чтобы преодолеть проблему низкой растворимости лекарственного средства и, в частности, проблему гемолиза (изменение, растворение или разрушение красных кровяных телец приводит к утечке крови в мочу), предположительно вызываемого временными локальными свободными концентрациями некоторых форм Соединения 1 при его внутривенном введении экспериментальным животным в виде болюса. Гемолиз крови не происходит при введении обычных перпероральных форм Соединения 1. Гемолиз в большинстве случаев также не возникает при пероральном или очень медленном введении животным, но имел место в ходе либо медленной инфузии или и/или болюсного введения с некоторыми композициями.
Трудности, первоначально возникшие при разработке композиции Соединения 1 для внутривенного введения, заключались в том, что Соединение 1 имеет низкую растворимость при физиологических значениях pH 7,4 (<4 мкг/мл) и, следовательно, требуется повышение растворимости для достижения терапевтического уровня концентрации в плазме крови в организме и при ожидаемой дозе в 100 мг. Кроме того, было желательно увеличить концентрацию лекарственного средства и дозу в композиции, так как это будет способствовать сокращению объема инфузии, вводимой пациентам.
Для решения проблемы низкой растворимости Соединения 1 при физиологических значениях pH были проведены исследования, чтобы установить, какие системы растворителей позволят повысить растворимость Соединения 1. Captisol® (производное β-циклодекстрина, также упоминаемое в настоящем изобретении как каптизол) и композиции на основе сорастворителей, содержащих пропиленгликоль и этанол, существенно улучшили растворимость Соединения 1. Однако композиции на основе сорастворителей при внутривенном введении неожиданно вызвали гемолиз. Дальнейшие попытки уменьшить/свести к минимуму возникновение гемо-лиза, наблюдаемого при внутривенном введении композиций Соединения 1 на основе каптизола, посредством варьирования концентрации каптизола, объема, скорости введения или добавления буферов, или использования различных комбинаций этанола, пропиленгликоля и полиэтиленгликоля 400, были успешны в отдельных случаях. Например, композиция на основе Каптизола, введенная путем инфузии в течение 15-минутного периода крысам в дозах 10 мг/кг и 5 мг/кг и в объемной дозе 10 мл/кг (концентрационная доза 1 мг/мл до 0,5 мг/мл, соответственно), дала низкое число случаев гемолиза (1/5). Кроме того, болюсное введение композиции на основе Каптизола в дозе 10 мг/кг и в объемной дозе 5 мл/кг (дозовая концентрация 2 мг/мл), вызвала гемолиз у 2/5 от числа крыс. Болюсное введение Каптизола при более низкой концентрации (например, по сравнению с ин-фузионными концентрациями 1 мг/мл и 0,5 мг/мл), вероятно, может привести к еще меньшему проявлению гемолиза. Было сделано предположение, что временная локальная высокая концентрация свободного Соединения 1 в месте инфузии может быть основной причиной гемолиза.
Для того чтобы проверить вышеупомянутую гипотезу, исследования проводились на крысах путем внутривенного введения (медленное ручное болюсное введение, 1-2 минуты) мицеллярной композиции, содержащей макрогол 15-гидроксистеарат (Solutol® HS15, также упоминаемый в настоящем изобретении как солютол) (10 мг/мл лекарственного средства, 22% Solutol HS15, 20 мМ Фосфатного буфера, pH 7.0) и тестированием возникновения гемолиза в различные промежутки времени и с разными дозами (10 мг/кг, 20 мг/кг и 30 мг/кг) после введения лекарственного средства. Наблюдали, что возникновение гемолиза у крыс существенно сокращалось в период 30-60 минут после введения лекарственного средства по сравнению с 15 минутным периодом после введения. Этот результат, в комбинации с тем фактом, что Соединение 1 обладает высокой пероральной доступностью, привело к выводу, что высокая локальная концентрация свободного Соединения 1 была ответственна за временный гемолиз, который происходил в течение первых 30 минут после внутривенного введения.
Чтобы свести к минимуму/уменьшить гемолиз, связанный с Соединением 1, была применена стратегия, которая базировалась на предположении, что медленная скорость введения лекарственного средства может привести к снижению гемолиза. Это включало эксперименты по введению мицеллярных (7,5% солютола, 25 мг/кг, 5 мл/кг, 5 мг/мл) растворов Соединения 1 крысам путем 15 минутной медленной инфузии, а также болюсный метод введения. Высокий уровень возникновения гемолиза наблюдался у крыс, когда мицеллярная композиция вводилась с помощью болюсного метода (5/5), в то время как гемолиз не наблюдался при инфузии (0/10).
Таким образом, снижение концентрации солютола в мицеллярной композиции Соединения 1 с 22%, например до 7,5%, и введение композиции медленной инфузией крысам снижает возникновение гемолиза. Однако, при болюсном методе введения композиции на основе 7,5% солютола (например, низкая концентрация солютола), гемолиз наблюдался, как указано выше. Таким образом, некоторые из заявленных композиций, перечисленных в настоящем изобретении, подходят для медленной инфузии, но не для болюсного метода введения. Другие композиции, как далее описано в настоящем изобретении, подходят как для медленной инфузии, так и для болюсного введения.
Дальнейшее экспериментирование на композиции на основе солютола было проведено для оценки влияния добавления различных типов масел, процента включения масла, а также диапазона pH композиций на основе солютола на возникновение гемолиза у крыс. Считалось, что добавление масла в мицеллярный раствор для формирования микроэмульсий, т.е. загруженных маслом мицелл, должно дополнительно способствовать замедлению высвобождения Соединения 1 из гидрофобного кора и предотвращать быстрое распределение/перенос Соединения 1 в красные кровяные тельца.
Настоящее изобретение относится к парентеральным композициям, включающим, а) соединение формулы I или его фармацевтически приемлемую соль,
и b) фармацевтически приемлемый носитель.
Термин "фармацевтически приемлемый носитель" означает любой подходящий компонент, который повышает растворимость соединения формулы 1 или его фармацевтически приемлемой соли, чтобы способствовать парентеральной доставке терапевтической концентрации этого соединения или соли в целевой сайт(ы) рецептора NK-1. Носители выбираются из группы, состоящей из кремофоров, эмульсий, микроэмульсий, мицелл, отрицательно заряженных мицелл, загруженных маслом мицелл, интралипидов, ЧСА, липосом и отрицательно и положительно заряженных аминокислот и т.п., как дополнительно описано в настоящем изобретении. Фармацевтически приемлемые носители не включают в себя композиции с β-циклодекстрином. В случае липосом, эмульсий, мицелл и загруженных маслом мицелл, считается, что такие носители должны сохранять лекарственное средство внутри липофильного кора для усиления удерживания и, в то же время, экранировать лекарственное средство в коре. Композиции на основе сывороточного альбумина человека относятся к прочному связыванию ЧСА с Соединением 1 и могли бы свести к минимуму распределение свободного лекарственного средства в красных кровяных тельцах. Такие композиции могут быть сформированы совместно с солютолом, миглиолом и витамином Е. Отрицательно заряженные аминокислоты могут образовывать комплекс и нейтрализовать часть Соединения 1, что сохраняет положительный заряд и тем самым предотвращает распределение Соединения 1 в красные кровяные тельца. Положительно заряженные аминокислоты должны образовывать комплекс с отрицательно заряженной частью Соединения 1 и нейтрализовать его, и уменьшить воздействие соединения на красные кровяные тельца. Отрицательно заряженные мицеллы будут отталкивать отрицательно заряженные эритроциты и предотвращать контакт Соединения 1 с красными кровяными тельцами.
Термин "мицеллярная композиция" означает, что композиция существует в виде мицеллы и является производной или изготовлена из любого компонента, который образует или способен образовать мицеллы в фармацевтически приемлемой системе доставки, такой как вода, физиологический раствор, водный раствор глюкозы и т.п.
Термин "эмульсионная композиция" означает, что композиция существует в виде эмульсии и является производной или изготовлена из любого компонента, который образует или может образовать эмульсию, когда представлена в и/или комбинируются с фармацевтически приемлемой системой доставки, такой как вода, физиологический раствор, водный раствор сахарозы и т.п. Предпочтительные эмульсионные композиции, которые предотвращают любые гемолитические эффекты при болюсном или медленном инфузионным введении, имеют содержание масла около 10% или менее. Концентрация лекарственного средства, варьируемая от около 1 мг/мл до 30 мг/мл, с меньшим объемом и более высокой концентрацией является предпочтительной для внутривенного введения. Фармацевтические композиции могут быть приготовлены так, чтобы увеличить или повысить растворимость антагониста NK-1, а также могут быть существенно разбавленными, чтобы избежать любых возможных гемолитических последствий, однако некоторые объемы разбавления могут оказаться непригодными для введения пациентам, нуждающихся в таком лечении.
Эмульсионная композиция или мицеллярная композиция по настоящему изобретению дополнительно содержит активный фармацевтический ингредиент, выбранный из соединения формулы I или Ia и/или их фармацевтически приемлемых солей, гидратов, полиморфных или физических форм. Такие эмульсионные или мицеллярные композиции, загруженные лекарственное средством, могут дополнительно содержать эксипиенты, которые облегчают доставку и/или полезны для предотвращения или смягчения последствий таких факторов, как гемолиз. Такие дополнительные эксипиенты, могут, таким образом, включать, например, масла или другие компоненты, которые повышают или дополнительно повышают растворимость при смягчении любых потенциальных гемолитических эффектов.
Такие эмульсионные композиции или мицеллярные композиции дополнительно могут быть процессированы для создания более стабильных физических форм или растворов и могут быть дополнительно процессированы, например, для обеспечения стерилизованных парентеральных растворов.
Настоящее изобретение также относится к парентеральным композициям, содержащим соединение формулы 1 или его фармацевтически приемлемую соль в форме наночастицы. Наночастицы соединения формулы 1 или его соли могут быть затем включены в раствор для доставки такой наночастицы внутривенным путем. Наночастицы Соединения 1 и его фармацевтически приемлемой соли могут дополнительно включать фармацевтически приемлемый носитель. Считается, что медленное растворение таких наночастиц (~200 нм), может привести к меньшему гемолизу вследствие уменьшения растворимости лекарственного средства в солюбилизированной фракции.
Настоящее изобретение также относится к способу доставки в организм пациента соединения формулы I и его фармацевтически приемлемой соли, содержащему (а) объединение соединения формулы I или его фармацевтически приемлемой соли с фармацевтически приемлемым носителем для формирования композиции для внутривенного введения, (b) доставку парентеральной композиции в организм пациента, нуждающегося в таком лечении.
После испытаний и значительных усилий изобретателей разрешить вышеупомянутые проблемы, связанные с солютол-содержащими композициями, было обнаружено, что добавление как среднецепочечного, так и длинно-цепочечного масла в определенном соотношении к солютолу дает солюбилизированную, стабильную (химически и физически) микроэмульсионную композицию Соединения 1, которая при внутривенном введении экспериментальным животным показывает минимальный гемолиз. Другой объект настоящего изобретения относится к фармацевтической композиции для парентерального введения, содержащей:
а) соединение формулы I или его фармацевтически приемлемую соль
и
b) солюбилизатор, выбранный из группы, состоящей из мицеллы, загруженной маслом, или микроэмульсии.
Предпочтительный вариант осуществления изобретения включает фармацевтическую внутривенную композицию, которая включает:
а) соединение формулы I или его фармацевтически приемлемую соль
и b) эмульгатор.
Настоящее изобретение относится к фармацевтической композиции для внутривенного введения, содержащей соединение формулы 1 или его фармацевтически приемлемую соль и сывороточный альбумин человека (ЧСА).
Настоящее изобретение также относится к композиции для внутривенного введения, содержащей соединение формулы 1 или его фармацевтически приемлемую соль, где соединение или его соль находится в виде наночастицы.
Изобретение дополнительно относится к внутривенной композиции, содержащей соединение формулы 1 или его фармацевтически приемлемую соль и носитель для доставки, выбранный из кремофора.
Кроме того, изобретение относится к внутривенной композиции, содержащей соединение формулы 1 или его фармацевтически приемлемую соль и носитель для доставки, выбранный из мицеллы.
Кроме того, изобретение относится к внутривенной композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль и носитель для доставки, выбранный из липосомы.
Изобретение предпочтительно относится к внутривенной эмульсионной композиции, которая подходит как для болюсного, так и для инфузионного введения.
Предпочтительный вариант осуществления изобретения содержит внутривенную композицию, содержащую соединение формулы I или его фармацевтически приемлемую соль и по меньшей мере один эмульгатор, в котором формируется эмульсия, подлежащая микрофлюидизации для формирования капель, имеющих средний диаметр менее 500 нм, средний диаметр и/или D90 около 600 нм или менее.
Изобретение дополнительно относится к внутривенной композиции, содержащей соединение формулы 1 или его фармацевтически приемлемую соль и отрицательно или положительно заряженную аминокислоту.
Изобретение дополнительно относится к внутривенной композиции, содержащей соединение формулы 1 или его фармацевтически приемлемую соль, которые лиофилизируются.
Изобретение дополнительно относится к внутривенной композиции, содержащей соединение формулы или его фармацевтически приемлемую соль в виде порошка. Порошок растворяется или добавляется к жидкости с образованием жидкой внутривенной композиции, содержащей соединение формулы 1 или его соль, которую вводят пациенту, нуждающемуся в таком лечении. Эмульгаторы, такие как полисорбат 80 (твин 80) и т.п., могут быть добавлены к этой композиции, также как и другие неактивные ингредиенты, такие как регуляторы pH, консерванты (ЭДТА) и т.д.
В каждом из вышеперечисленных примеров осуществления, предпочтительной формой соединения формулы I или его соли, добавляемой в композицию, является форма твердого кристаллического моногидрата гидрохлорида.
В каждом из вышеперечисленных примеров осуществления, альтернативная форма соединения формулы 1 или его соли выбирается из пролекарства соединения формулы I. Такие пролекарства могут вводиться любым методом доставки, включая пероральный путь или внутривенное введение.
Такие пролекарства могут быть выбраны из соединения формулы 1а и его фармацевтически приемлемых солей:
где Z и Y независимо выбираются из группы, состоящей из Н, -РО(ОН)O-M+, -РО(O+)22М+, -PO(O-)2D2+, -[C(R1)(R2)]n-PO(OH)O-M+, -[C(R1)(R2)]n-PO(O-)22M+, -[C(R1)(R2)n-PO(O-)2D2+, -C(O)[C(R1)(R2)]m-OPO(O-)22M+, -C(O)[C(R1)(R2)]oNR1R2, -C(O)[C(R1)(R2)]pCO2-M+, -SO3-М+, -[C(R1)(R2)]qSO3-M+ и -[C(R1)(R2)]rOC(O)OR3, где R3 выбирается из группы
, , , , , , ;
при условии, что Z и Y не могут оба представлять собой Н; М+ выбирается из одновалентного катиона; D+ выбирается из двухвалентных катионов; R1 и R2 независимо выбирают из Н или С1-6алкила, n равно 1-4, m, о и p независимо выбираются из 0-4, и R выбран из C1-6алкила
В предпочтительном варианте осуществления пролекарства, Z выбирается из Н, и Y выбирается из любой одной из вышеуказанных групп для Z и Y, исключая Н. В более предпочтительном варианте выполнения настоящего изобретения такие пролекарства выбираются из:
и
Предпочтительные M+ соли выбирается из, например, солей аммония, солей щелочных металлов, таких как натрий, солей щелочноземельных металлов, таких как кальций и магний, солей органических оснований, таких как N-метил-D-глюкамин или дициклогексиламин, солей аминокислот, таких как аргинин, лизин и т.п.
Пролекарства получают при взаимодействии амина или надлежащим образом защищенного амина с активированной группой Z-X или Y-X, или любым обычным методом формирования варианта Пролекарства соединения формулы I.
Пролекарства по настоящему изобретению обладают улучшенной растворимостью по сравнению с родоначальным лекарственным средством и, таким образом, полезны и удобны для внутривенного введения.
Предпочтительным вариантом осуществления изобретения является фармацевтическая композиция, которая включает:
а) соединение формулы I
или его фармацевтически приемлемую соль;
b) макрогол 15-гидроксистеарат в количестве от 0,50% до 10,0 мас.% от всей композиции;
c) среднецепочечный триглицерид в количестве от 0,10% до 2,5 мас.% от всей композиции;
d) длинноцепочечный триглицерид в количестве от 0,10% до 1,5 мас.% от всей композиции, а также
e) по меньшей мере один буфер, где массовое отношение макрогол 15-гидроксистеарат: среднецепочечный триглицерид: длинноцепочечный триглицерид в композиции составляет около 5-100:1-5:1, и где pH композиции составляет от 6,5 до 8,0.
Приведенная выше композиция может быть в виде загруженной маслом мицеллы или микроэмульсии.
В другом варианте осуществления, изобретение обеспечивает фармацевтическую композицию, которая содержит макрогол 15-гидроксистеарат в количестве от 0,50% до 7,5 мас.% от всей композиции; среднецепочечный триглицерид в количестве от 0,15% до 1,5 мас.% от всей композиции и длинноцепочечный триглицерид в количестве от 0,10% до 1,2 мас.% от всей композиции.
В другом варианте осуществления, изобретение обеспечивает фармацевтическую композицию, которая включает макрогол 15-гидроксистеарат в количестве от 0,88% до 4,84 мас.% от всей композиции, среднецепочечный триглицерид в количестве от 0,20% до 1,20 мас.% от всей композиции, и длинноцепочечный триглицерид в количестве от 0,10% до 0,75 мас.% от всей композиции.
В другом варианте осуществления, изобретение обеспечивает фармацевтическую композицию, которая содержит:
(а)соединение формулы I
или его фармацевтически приемлемую соль;
(b) макрогол 15-гидроксистеарат в количестве около 4,4 мас.% от всей композиции;
(c) по меньшей мере один среднецепочечный триглицерид в количестве около 1,1 мас.% от всей композиции;
(d) рафинированное соевое масло в количестве около 0,66 мас.% от всей композиции, а также
(e) фосфатный буфер, в котором рН композиции составляет около 7,5.
В другом варианте осуществления, изобретение обеспечивает фармацевтическую композицию, которая содержит:
(а)соединение формулы 1
или его фармацевтически приемлемую соль;
(b) макрогол 15-гидроксистеарат в количестве около 0,88 мас.% от всей композиции;
(c) по меньшей мере один среднецепочечный триглицерид в количестве около 0,22 мас.% от всей композиции;
(d) рафинированное масло сои в количестве около 0,12 мас.% от всей композиции, а также (е) фосфатный буфер, где рН композиции составляет около 7,5.
Другим объектом настоящего изобретения является способ получения фармацевтической композиции, которая содержит:
a) нагревание (i) расплавленного макрогол 15-гидроксистеарата, (ii) среднецепочечного триглицерида, (iii) длинноцепочечного триглицерида с образованием композиции;
b) добавление воды в композицию с образованием микроэмульсионной композиции;
c) добавление в микроэмульсионную композицию соединения формулы I
или его фармацевтически приемлемой соли и
d) добавление по меньшей мере одного буфера и доведение pH от около 6,5 до 8,0, и формирование фармацевтической композиции, в которой макрогол 15-гидроксистеарат присутствует в количестве от около 0,50% до около 10,0% от общей массы фармацевтической композиции, среднецепочечный триглицерид присутствует в количестве от около 0,10% до около 2,5% от общей массы фармацевтической композиции, и длинноцепочечный триглицерид присутствует в количестве от около 0,10% до около 1,5 мас.% от общей массы фармацевтической композиции, и где массовое отношение макрогол 15-гидроксистеарат: среднецепочечный триглицерид: длинноцепочечный триглицерид в фармацевтической композиции составляет около 5-100:1-5:1.
Другим объектом настоящего изобретения является фармацевтическая композиция, которая содержит:
а) соединение формулы
или его фармацевтически приемлемую соль и
b) пегилированный гидроксистеарат в количестве от около 0,88% до около 5,0 мас.% от общей массы композиции, где пегилированный гидроксистеарат в основном свободен от полиэтиленгликоля, и где pH композиции составляет от около 6,5 до около 8.
Другим объектом настоящего изобретения является способ лечения тошноты и/или рвоты у пациентов, нуждающихся в таком лечении, который содержит инфузионное внутривенное введение пациенту эффективного количества фармацевтической композиции по настоящему изобретению и в котором гемолиз у пациента сводится к минимуму.
Другим объектом настоящего изобретения является способ минимизации гемолиза у пациентов путем внутривенного введения соединения формулы 1 или его фармацевтически приемлемой соли,
Причем способ содержит внутривенное введение с помощью инфузии пациенту эффективного количества фармацевтической композиции по настоящему изобретению.
В другом варианте осуществления настоящего изобретения перечисленные внутривенные композиции могут быть использованы в комбинации с другими лекарственными средствами против рвоты и тошноты; с противовоспалительными или стероидными агентами (например, дексаметазоном) и с химиотерапевтическими агентами. Перечисленные внутривенные композиции могут назначаться пациенту в соответствии с предписанием и режимом, прописанным врачом. Другие такие композиции включают ондан-сетрон и другие известные 5НТ3-антагонисты. Таким образом, соединение формулы 1 и его соли могут быть использованы для инфузии вместе с другими противорвотными агентами для профилактики острой и отсроченной тошноты и рвоты, связанных с начальными и повторными курсами очень высоко вызывающей рвоту химиотерапии рака, включая, например, лечение цисплатином. Соединение формулы 1 и их соли для инфузии могут быть использованы с другими противорвотными агентами для профилактики острой и отсроченной тошноты и рвоты, связанных с начальным и повторным курсом умеренно вызывающей рвоту химиотерапии рака. В дополнение к лечению цисплатином другие противоопухолевые агенты, которые вводятся в этой комбинации в дозированном режиме, включают этопозид, фторурацил, гемцитабин, винорельбин, паклитаксел, циклофосфамид, доксорубицин, доцетаксел и также могут включать темозоломид.
Лечение соединением формулы 1 следует начинать за тридцать минут до начала химиотерапии в 1-й день такой терапии. Внутривенная композиция может медленно вводиться инфузией в течение пятнадцати минут или путем болюсного введения, в зависимости от композиции.
В другом варианте осуществления настоящего изобретения, внутривенную композицию соединения формулы I и его фармацевтически приемлемой соли можно вводить отдельно или в комбинации с другими агентами для лечения и/или профилактики послеоперационной тошноты и рвоты. Такие агенты включают комбинации других противорвотных терапевтических агентов, таких как ондансетрон и других 5НТ3-антагонистов.
Краткое описание чертежей
Фиг.1. Получение микроэмульсионных композиций для внутривенного введения Соединения 1 (схематическая блок-схема).
Фиг.2. Равновесная растворимость Соединения 1 в композиции с 20% Солютола (ромбы) и в композиции с 16% Каптизола (квадраты) в зависимости от pH.
Фиг.3. Схематическое изображение способа производства эмульсионных композиций Соединения 1.
Фиг.4. Распределение частиц по размеру в необработанной композиции, BOL15SO и в обработанной композиции, включая 3 прохода при давлении 2000 фунтов на квадратный дюйм с использованием камеры взаимодействия H30Z.
Фиг.5. Распределение частиц по размерам из необработанной композиции INFWSO и обработанной композиции, включая 3 прохода при давлении 2000 пси с использованием камеры взаимодействия H30Z, и при давлении 4100 пси с использованием камеры взаимодействия H20Y.
Фиг.6. Распределение частиц по размерам из необработанной композиции BOL10WS и обработанной композиции, включая 2 и 3 прохода композиции с помощью камеры взаимодействия H30Z при давлениях 2000 и 4100 пси.
Фиг.7. Оптические микроскопические изображения композиций BOL 15SO и INFWSO в процессе микрофлюидизации.
Фиг.8. Оптические микроскопические изображения композиций BOL 10WSO в процессе микрофлюидизации.
Фиг.9. Оптические микроскопические изображения композиций INFSO в процессе микрофлюидизации.
Фиг.10. Оптические микроскопические изображения композиций BOL10SO в процессе микрофлюидизации.
Фиг.11. Кривая распределения частиц по размеру для INFWSO после стерилизации.
Фиг.12. Кривая распределения частиц по размеру для BOL 10WSO после стерилизации.
Фиг.13. Уровень Соединения 1 в крови в нг/мл при внутривенном введении в различных дозах.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В контексте настоящего изобретения для нижеследующих терминов, пока не указано иное, следует понимать следующие смысловые значения:
Термин "микроэмульсии", используемый в настоящем изобретении, относится к прозрачной, стабильной, изотропной жидкой смеси масла, воды и поверхностно-активного вещества. Этот термин также означает мицеллу, загруженную маслом.
Термин «мицелла» или «мицеллярные», используемый в настоящем изобретении, относится к коллоидным агрегатам амфифильных молекул (сурфактантов), которые возникают при или выше хорошо известной концентрации, называемой критической концентрацией мицеллообразования. Макрогол 15-гидроксистеарат (Solutol® HS15, доступный от BASF Ludvig-shafen, Германия) является конкретным примером поверхностно-активного вещества с критической концентрацией мицеллообразования в диапазоне от 0,005 до 0,02%.
Термин "гемолиз", используемый в настоящем изобретении, означает разрушение красных кровяных телец, что приводит к высвобождению гемоглобина из эритроцитов в плазму крови. Гемолиз может быть измерен методами, хорошо известными специалистам в данной области техники, например, полосками реагента Hemastix® (Bayer Corp, Elkhart, IN), которые детектируют кровь в моче. Полоски реагента Hemastix® меняют окраску от желтой до темно-зеленой, в зависимости от количества гемоглобина, найденного в моче. Шкала Hemastix® выглядит следующим образом: 0=отрицательный, 1=отсутствуют следы гемолиза, 3=следы гемолиза, 4=небольшой +, 5=умеренный++, и 6=большой+++.
Фразы "минимальный гемолиз» и «гемолиз минимизируется", используемые в настоящем изобретении, означают, что при введении экспериментальным животным композиции Соединения 1, либо гемолиз не наблюдался у экспериментальных животных или не более двух экспериментальных животных из десяти экспериментальных млекопитающих обнаруживают следовой уровень гемолиза, определенный, например, как значение три или меньше по шкале Hemastix®.
Термин "стабильный", используемый в настоящем изобретении, относится к химической и физической стабильности.
Физическая стабильность относится к мицеллам и микроэмульсиям, означая, что нет никаких существенных различий в размерах частиц / капель и что не наблюдается разделение фаз.
Химическая стабильность, как используется в настоящем изобретении, относится к сохранению активности Соединения 1 в допустимом диапазоне (более 90% заявленной активности).
Те