Среда для культуры клеток, не содержащая олигопептидов
Иллюстрации
Показать всеИзобретения касаются безбелковой среды и способа ее использования. Охарактеризована безбелковая среда для культивирования клеток СНО. Среда не содержит олигопептиды, содержит аминокислоты, витамины, органические и неорганические соли и источники углеводов и дополнена по меньшей мере 2 мг/л путресцина ⋅ 2HCl. Изобретения способствуют росту клеток, их удельной продуктивности и плотности. 2 н. и 3 з.п. ф-лы, 7 ил., 11 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к среде для культуры клеток, не содержащей олигопептидов, содержащей по меньшей мере 0,5 мг/л полиамина, и к способу культивирования клеток в упомянутой среде для культуры клеток, не содержащей олигопептидов, содержащей по меньшей мере 0,5 мг/л полиамина. Настоящее изобретение также относится к способам экспрессии по меньшей мере одного белка в среде, содержащей по меньшей мере 0,5 мг/л полиамина, и к способам продукции по меньшей мере одного вируса в среде, содержащей по меньшей мере 0,5 мг/л полиамина.
УРОВЕНЬ ТЕХНИКИ
Для культивирования клеток, в особенности эукариотических клеток, а более конкретно клеток млекопитающих, существует постоянная необходимость в использовании специальных культуральных сред, предоставляющих питательные вещества, которые требуются для эффективного роста клеток и для производства биологических продуктов, в особенности биофармацевтических препаратов, таких как, например, рекомбинантные белки, антитела, вирусы, вирусные антигены и вирусоподобные частицы. Для эффективного производства упомянутых биологических продуктов важно достичь оптимальной плотности клеток, а также повысить экспрессию самого белка для получения максимального выхода продукта.
Состав сред для культуры клеток дополняют целым рядом добавок, которые включают в себя неопределенные компоненты, такие как фетальная сыворотка теленка (FCS), несколько белков животного происхождения и/или гидролизаты белков быка, а также гидролизаты белка растительного происхождения или полученные из дрожжей.
Как правило, сыворотка или вещества, полученные из нее, такие как, например, альбумин, трансферрин или инсулин, могут содержать нежелательные агенты, которые могут загрязнять культуры клеток и полученные из нее биологические продукты. Кроме того, добавки, полученные из сыворотки человека, должны быть проверены на все известные вирусы, включая вирусы гепатита и вирус иммунодефицита человека (HIV), которые могут передаваться через сыворотку. Кроме того, бычья сыворотка и продукты, полученные из нее, несут риск заражения губчатой энцефалопатией крупного рогатого скота (BSE). Кроме того, все полученные из сыворотки продукты могут быть загрязнены неизвестными веществами. При использовании в культуре клеток сывороточных или белковых добавок, полученных от человека и из животных источников, возникают многочисленные трудности (например, изменение качества композиции из различных партий и риск заражения микоплазмой, вирусами или BSE), особенно, если клетки используются в производстве лекарств или вакцин для введения человеку.
Поэтому было предпринято множество попыток создания эффективных систем клеток-хозяев и условий культивирования, для которых не требуются сыворотка или иные соединения животного белка.
Такие бессывороточные среды были разработаны на основе белковых экстрактов, полученных из растений или дрожжей. Например, известно, что гидролизаты сои могут использоваться для процессов ферментации и могут улучшать рост многих требовательных к среде организмов, дрожжей и грибов. В документе W0 96/26266 описан продукт соевой муки, обработанный папаином, который является источником углеводов и азота, а также многих компонентов, которые могут быть использованы в культуре ткани. Franek et al. (Biotechnology Progress (2000) 16, 688-692) описали эффекты на рост и улучшение продуктивности определенных пептидных фракций гидролизатов сои и пшеницы.
В документе WO 96/15231 описана бессывороточная среда, состоящая из синтетической минимальной поддерживающей среды и экстракта дрожжей, для размножения клеток позвоночных и процесса получения вируса. Композиция среды, составленная из основной среды для культуры клеток и содержащей пептид риса и экстракт дрожжей, и их продукт ферментативной обработки, и/или растительные липиды для роста клеток животных, описана в документе WO 98/15614. Среда, содержащая очищенный гидролизат сои, для культивирования рекомбинантных клеток описана в документе WO 01/23527. В WO 00/03000 описана среда, которая содержит гидролизат сои и экстракт дрожжей, но также требует присутствия рекомбинантных форм белка животных, таких как факторы роста.
В документе ЕР-А-0 481 791 описана биохимически определенная культуральная среда для культивирования сконструированных методами генной инженерии клеток яичника китайского хомячка (СНО), которая лишена белков, липидов и углеводов, полученных из животных источников, содержащая также рекомбинантный инсулин или аналог инсулина, 1%-0,025% (вес/объем) соевого пептона, обработанного папаином, и путресцин. В документе W0 98/08934 описана бессывороточная культура эукариотических клеток, содержащая гидролизованные пептиды сои (1-1000 мг/л), 0,01-1 мг/л путресцина и разнообразные компоненты животного происхождения, включая альбумин, фетуин, различные гормоны и другие белки. В этом контексте следует отметить, что известно, что путресцин вводят в состав стандартных сред, таких как DMEM/Ham F12 в концентрации 0,08 мг/л.
Растительные гидролизаты и/или гидролизаты дрожжей, однако, являются смесями олигопептидов и других неизвестных компонентов и загрязнений неопределенного состава. Более того, качество коммерчески доступных партий гидролизатов значительно варьирует. В результате существуют значительные вариации в производстве рекомбинантных белков или вирусных продуктов (до трехкратных) в зависимости от использованных партий гидролизатов («вариации от партии к партии»). Этот недостаток влияет на пролиферацию клеток, а также экспрессию белка в каждой клетке.
Суммируя, в среды, известные в данной области техники, добавляют белки или пептидные экстракты, полученные из животных, растений или дрожжей; или рекомбинантные версии белков, таких как, например, инсулин, инсулиноподобный фактор роста или другие факторы роста.
Таким образом, существует необходимость в среде для культуры клеток, свободной от животных, растительных и грибных белков и/или олигопептидов, для решения упомянутых выше трудностей. Кроме того, в настоящее время существует потребность в повышении выхода экспрессируемых рекомбинантных белков или каких-либо иных продуктов экспрессии в получении оптимальной среды для культуры клеток для получения биологических продуктов, таких как используемые в фармацевтических препаратах или вакцинах для человека.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Объектом настоящего изобретения является среда для культуры клеток, не содержащая олигопептиды. Еще одним объектом настоящего изобретения являются способы культивирования клеток в упомянутых средах, а также способы эффективной экспрессии рекомбинантных белков и/или способы эффективной продукции вирусов.
Еще одним объектом настоящего изобретения является устранение из среды гидролизатов животного или растительного происхождения или полученных из дрожжей, и получение среды, которая не содержит каких-либо дополнительных белков или олигопептидов.
Неожиданно было обнаружено, что добавление по меньшей мере 0,5 мг/л полиамина к средам для клеточных культур дает благоприятный эффект, который не только способствует клеточному росту, но также повышает экспрессию белка и/или вируса в расчете на клетку. Упомянутый неожиданный благоприятный эффект может быть достигнут даже в среде, не содержащей олигопептидов.
Кроме того, среда, не содержащая олигопептидов, по настоящему изобретению обеспечивает согласованный рост клеток и повышение выхода желаемых продуктов, в частности белков, представляющих интерес, таких как рекомбинантные белки и/или вирусы, независимо от качества и изменений между партиями каких-либо белковых гидролизатов. Специфическое дополнение среды для клеточных культур специфической концентрацией полиаминов действует так, что повышает рост клеток, удельную продуктивность клетки, окончательную плотность клеток.
Следовательно, среды по настоящему изобретению более пригодны для экспрессии рекомбинантного белка, продукции вируса и повышения скорости роста клеток по сравнению со средами, известными в данной области. Кроме того, среда, не содержащая олигопептидов, по настоящему изобретению устраняет необходимость добавления гидролизата белка к среде для культуры клеток.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
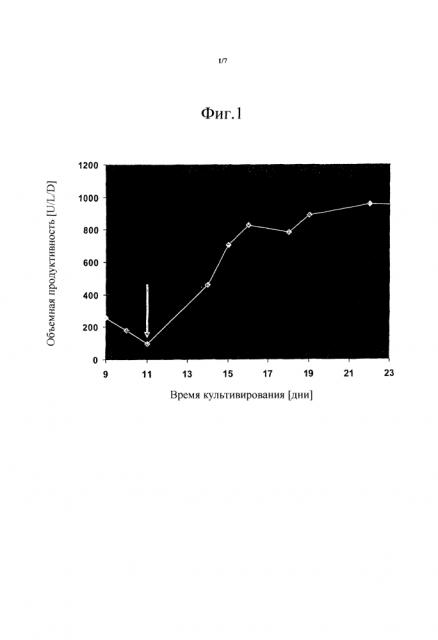
На фиг. 1 показан график, который описывает эффект добавления 2,0 мг/л путресцина⋅2НС1 на объемную продуктивность FVIII-CoA, выраженную в [единицах на литр в день], клеток GD8/6, культивируемых в среде BAV, в зависимости от времени культивирования, выраженного в [днях]. Стрелка = 11-й день: Добавление путресцина⋅2НС1 (2,0 мг/л).
На фиг. 2 показана таблица, в которой сравниваются эффекты добавления путресцина необязательно в комбинации с дополнительной добавкой Fe (II) и Cu (II) на объемную и удельную продуктивность клетки (QP, выраженную в [единицах (U) на литр в день], qp, выраженную в [миллиU на 106 клеток в день]) и на удельный темп роста μ, выраженный как удельный темп роста в день [d-1] клеток GD8/6, культивируемых в среде BAV.
На фиг. 3 показана таблица, в которой сравниваются эффекты путресцина и/или орнитина на удельный темп роста (μ абсолютный, μ относительный) и удельную продуктивность клеток (qp абсолютная, выраженная в [миллиU на 106 клеток в день], qp относительная, выраженная в %) клеток GD8/6, культивируемых в среде BAV.
На фиг. 4 показана таблица, в которой сравниваются эффекты путресцина и спермина на удельный темп роста (μ абсолютный, μ относительный) и удельную продуктивность клеток (qp абсолютная, qp относительная) клеток GD8/6, культивируемых в среде BAV.
На фиг. 5 показана таблица, в которой сравниваются эффекты путресцина и этаноламина на удельный рост (μ абсолютный, μ относительный) и удельную продуктивность (qp абсолютная, qp относительная) клеток GD8/6, культивируемых в среде BAV.
На фиг. 6 показан график, который описывает эффект добавления 3,6 мг/л путресцина⋅2НС1 на средний титр вируса MVA, выраженный в [инфицирующая доза культуры ткани (ТС1П50)/мл * 108].
-: без добавления путресцина, Putr.: с добавлением 3,6 мг/л путресцина⋅2НС1.
На фиг. 7 показан график, который описывает эффект добавления путресцина⋅2НС1 в различных концентрациях, выраженных в [мг/л], на средний титр вируса MVA, выраженный в [ТСЮ50/мл * 108].
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Одним из объектов настоящего изобретения является среда для культуры клеток, не содержащая олигопептидов и содержащая по меньшей мере 0,5 мг/л полиамина.
Если не указано иное, значения концентрации, указываемые в данном документе, относятся к форме свободного основания компонента (компонентов).
Термин «полиамин» обозначает какую-либо группу биогенных полиаминов, которые являются органическими поликатионами, производными от ароматических или катионных аминокислот. Полиамины состоят из углерода, азота и водорода и включают две или более аминогрупп. Полиамины имеют один или несколько положительных зарядов и гидрофобный скелет. Термин охватывает, например, молекулы, выбранные из группы, состоящей из кадаверина, путресцина, спермидина, спермина, агматина, орнитина и их комбинаций. В одном из вариантов осуществления настоящего изобретения культуральная среда, не содержащая олигопептидов, содержит орнитин, или путресцин, или спермин, или их комбинацию.
В еще одном варианте осуществления полиамин культуральной среды по настоящему изобретению, не содержащей олигопептидов, происходит из источника, отличного от гидролизата белка. В одном из вариантов осуществления полиамин получен синтетическим путем.
В одном из вариантов осуществления настоящего изобретения концентрация полиамина составляет по меньшей мере около 0,5 мг/л, в еще одном варианте осуществления по меньшей мере около 1 мг/л, еще в одном варианте осуществления по меньшей мере около 2 мг/л, еще в одном варианте осуществления по меньшей мере 5 мг/л и еще в одном варианте осуществления по меньшей мере 8 мг/л, а еще в одном варианте осуществления по меньшей мере 10 мг/л.
В одном из вариантов осуществления настоящего изобретения концентрация полиамина находится в диапазоне от около 0,5 мг/л до около 30 мг/л, в еще одном варианте осуществления - от около 0,5 мг/л до около 20 мг/л. В еще одном варианте осуществления - от около 1,0 мг/л до около 20 мг/л, в еще одном варианте осуществления - от около 2,0 мг/л до около 20 мг/л, в еще одном варианте осуществления - от около 2 мг/л до около 10 мг/л, в альтернативном варианте осуществления - от около 2 мг/л до около 8 мг/л, а еще в одном варианте осуществления - от около 2 мг/л до около 5 мг/л в среде.
Концентрации, указанные выше, соответствуют концентрациям чистого полиамина. Если используется производное полиамина или соединение, содержащее полиамин, концентрация группы полиамина находится в вышеупомянутых диапазонах. Например, 2 мг/л путресцина⋅2НС1 эквивалентны концентрации путресцина около 1,095 мг/л (без⋅2НС1).
Термин «среда, не содержащая олигопептидов» по настоящему изобретению относится к безбелковой среде, которая не содержит олигопептидов, таких как, например, олигопептиды, происходящие из гидролизата белка. В одном из вариантов осуществления настоящего изобретения среда не содержит олигопептидов размером двадцать или более аминокислот. В одном из вариантов осуществления настоящего изобретения среда не содержит олигопептидов размером пятнадцать или более аминокислот. В еще одном варианте осуществления настоящего изобретения среда не содержит олигопептидов размером десять или более аминокислот. В одном из вариантов осуществления среда не содержит олигопептидов размером семь или более аминокислот, в еще одном варианте осуществления олигопептиды не содержат олигопептидов размером пять или более аминокислот, в еще одном варианте осуществления олигопептиды не содержат олигопептидов размером три или более аминокислоты. В еще одном варианте осуществления настоящего изобретения среда не содержит олигопептидов размером две или более аминокислоты.
Среда по настоящему изобретению может необязательно содержать глютатион и/или по меньшей мере одну стабильную форму глютамина, такую как, например, L-аланил-L-глютамин. Термин «глютатион», как он используется в данном документе, относится к трипептиду, состоящему из аминокислот: глютамата, цистеина и глицина, включая окисленную форму глютатиона, т.е. дисульфид глютатиона, димер глютатиона, образуемый дисульфидной связью между сульфгидрильными боковыми цепями цистеина при окислении.
В одном из вариантов осуществления настоящего изобретения среда для культуры клеток, не содержащая олигопептидов, не содержит олигопептидов размером три или более аминокислот, но может необязательно содержать глютатион.
В еще одном варианте осуществления среда для культуры клеток, не содержащая олигопептидов, не содержит олигопептидов размером две или более аминокислоты, но может необязательно содержать глютатион и/или по меньшей мере одну стабильную форму глютамина.
Характерными белками и/или олигопептидами, которых избегают использовать в среде по настоящему изобретению, являются белки и/или олигопептиды, присутствующие в сыворотке и в веществах сывороточного происхождения, таких как, например, альбумин, трансферрин, инсулин или другие факторы роста, а также их рекомбинантные формы, или олигопептиды из растительных или дрожжевых гидролизатов или их нефильтрованных форм.
Культуральная среда, не содержащая олигопептидов, по настоящему изобретению может быть основана на какой-либо основной среде, такой как DMEM, Ham's F12, среда 199, McCoy или RPMI, хорошо известных специалистам в данной области. Основная среда может содержать множество ингредиентов, включая аминокислоты, витамины, органические и неорганические соли, а также источники углеводов, каждый ингредиент присутствует в количестве, которое поддерживает культивирование клеток, указанные количества хорошо известны специалистам в данной области. Среда может содержать дополнительные вещества, такие как буферные вещества, например бикарбонат натрия, антиоксиданты, стабилизаторы для противодействия механическому воздействию или ингибиторы протеаз. Если требуется, могут быть добавлены неионные детергенты, такие как сополимеры и/или смеси полиэтиленгликолей и полипропиленгликолей (например, Pluronic F68, фирма SERVA).
В одном из вариантов осуществления культуральной среды по настоящему изобретению полиамин контролирует синтез ДНК и РНК, и/или клеточную пролиферацию, и/или клеточную дифференцировку, и/или стабилизацию мембраны, и/или противоокислительную защиту ДНК.
В одном из вариантов осуществления добавление по меньшей мере 0,5 мг/л полиамина к культуральной среде, не содержащей олигопептидов, повышает экспрессию белка и/или вируса в культивируемых клетках. В еще одном варианте воплощения экспрессия белка или титр вируса в культивируемых клетках могут быть повышены по меньшей мере на 50% путем добавления по меньшей мере 0,5 мг/л полиамина к среде для культуры клеток, не содержащей олигопептидов. В еще одном варианте осуществления указанное повышение составляет по меньшей мере 60%. В еще одном варианте осуществления удельная продуктивность клеток повышается по меньшей мере в два раза при добавлении по меньшей мере 0,5 мг/л полиамина к среде для культуры клеток, не содержащей олигопептидов; в еще одном варианте осуществления удельная продуктивность клеток повышается по меньшей мере в три раза. В еще одном варианте осуществления добавление по меньшей мере 0,5 мг/л полиамина приводит к повышению экспрессии белка или титра вируса по меньшей мере до 400%; в другом варианте осуществления по меньшей мере до 500%; в другом варианте осуществления по меньшей мере до 600%; в другом вариант осуществления по меньшей мере до 700%.
В одном из вариантов осуществления удельный темп роста культивируемых клеток может быть повышен путем добавления по меньшей мере 0,5 мг/л полиамина к культуральной среде, не содержащей олигопептидов. В еще одном варианте осуществления упомянутый удельный темп роста может быть повышен на 10%. В еще одном варианте осуществления упомянутый удельный темп роста может быть повышен на 20%. В еще одном варианте осуществления упомянутый удельный темп роста может быть повышен на 50%. В другом варианте осуществления упомянутый удельный темп роста может быть повышен на 70%. В еще одном варианте осуществления упомянутый удельный темп роста может быть повышен на 80%. В еще одном варианте осуществления упомянутый удельный темп роста может быть повышен на 90%. В еще одном варианте осуществления упомянутый удельный темп роста может быть повышен на 100%.
В еще одном варианте осуществления настоящего изобретения среда имеет определенный химический состав. Термин «имеет определенный химический состав», как он используется в настоящем документе, означает, что среда не содержит каких-либо неопределенных дополнений, таких как экстракты из частей животных, органов, желез, растений или дрожжей. Соответственно, каждый компонент такой среды точно определен.
Настоящее изобретение также относится к способу культивирования клеток, включающему стадии:
(a) получения среды для культивирования клеток, не содержащей олигопептидов, по настоящему изобретению, и
(b) размножения клеток в среде с образованием культуры клеток.
Настоящее изобретение не ограничено каким-либо типом клеток. Примеры типов клеток включают в себя клетки млекопитающих, клетки насекомых, клетки птиц, бактериальные клетки и клетки дрожжей. Клетки могут, например, представлять собой стволовые клетки или рекомбинантные клетки, трансформированные вектором для экспрессии рекомбинантного гена, или клетки, трансфецированные вирусом для продуцирования вирусных продуктов. Клетки также могут быть, например, клетками, представляющими интерес, без рекомбинантной трансформации, например В-клетки, продуцирующие антитела, которые могут быть трансформированы в иммортализованное состояние, например, путем вирусной инфекции, подобной инфицированию вирусом Эпштейна-Барр. Клетки могут быть также, например, эмбриональными, например клетками куриного эмбриона, или представлять собой эмбриональные клеточные линии. Пригодными являются клетки, которые применяются для производства вирусов in vitro. Конкретные примеры подходящих клеток включают клетки BSC, клетки LLC-MK, клетки CV-1, клетки COS, клетки VERO, клетки MDBK, клетки MDCK, клетки CRFK, клетки RAF, клетки RK, клетки ТСМК-1, клетки LLCPK, клетки РК15, клетки LLC-RK, клетки MDOK, клетки ВНК-21, клетки СНО, клетки NS-1, клетки MRC-5, клетки WI-38, клетки ВНК, клетки 293, клетки RK, клетки Per.С6 и клетки куриного эмбриона.
Клетки, используемые по настоящему изобретению, могут культивироваться, например, способом, выбранным из группы, состоящей из периодического культивирования, периодического культивирования с подпиткой, перфузионного культивирования и хемостатического культивирования, которые хорошо известны в данной области.
Настоящее изобретение также относится к способу экспрессии по меньшей мере одного белка, такого как, например, гетерологический или аутологический белок или рекомбинантный белок, который включает стадии:
(a) получения культуры клеток;
(b) введения по меньшей мере одной последовательности нуклеиновой кислоты, содержащей кодирующую последовательность по меньшей мере одного белка в клетки;
(c) отбора клеток, несущих последовательность нуклеиновой кислоты; и
(d) экспрессирования белка в клетках, находящихся в среде, содержащей по меньшей мере 0,5 мг/л полиамина.
В одном из вариантов осуществления настоящего изобретения среда на стадии d) представляет собой среду, не содержащую олигопептидов, по настоящему изобретению. В еще одном варианте осуществления настоящего изобретения клетки культуры на стадии а) выращивают в культуральной среде, не содержащей олигопептидов, по настоящему изобретению. В еще одном варианте осуществления стадии a)-d) проводились в среде культуры клеток, не содержащей олигопептидов, по настоящему изобретению.
Последовательность нуклеиновой кислоты, содержащая последовательность, кодирующую по меньшей мере один белок, может представлять собой вектор. Вектор может доставляться вирусом или может представлять собой плазмиду. Последовательность нуклеиновой кислоты, кодирующая белок, может представлять собой специфический ген или быть его биологически функциональной частью. В одном из вариантов осуществления белок представляет собой по меньшей мере биологически активную часть фактора свертывания крови, такого как фактор VIII, или по меньшей мере биологически активную часть белка, участвующего в формировании красных кровяных клеток и ангиогенезе, такого как эритропоэтин, или моноклональное антитело.
В варианте осуществления последовательность нуклеиновой кислоты включает последовательность, кодирующую по меньшей мере один белок, выбранный из группы, состоящей из фактора свертывания крови VII, фактора свертывания крови VIII, фактора свертывания крови IX, vWF, ADAMTS13 и фурина.
В одном из вариантов осуществления настоящего изобретения нуклеиновая кислота также включает другие последовательности, подходящие для контролируемой экспрессии белка, такие как промоторная последовательность, энхансеры, ТАТА-боксы (боксы Хогнесса), сайты, инициирующие транскрипцию, полилинкеры, сайты рестрикции, поли-А-последовательности, последовательности процессинга белка, селекционные маркеры и им подобное, что широко известно специалистам в данной области техники.
В одном из вариантов осуществления настоящего изобретения клетки выбирают из группы, состоящей из клеток СНО, клеток 293 и клеток ВНК.
В соответствии с еще одним вариантом осуществления настоящего изобретения следующие клеточные линии могут быть трансформированы с помощью рекомбинантного вектора для экспрессии соответствующих продуктов: клетки СНО - для продукции рекомбинантных факторов свертывания крови, например фактора VII и/или фактора VIII, и/или моноклональных антител, клетки ВНК - для продукции рекомбинантного эритропоэтина, трансформированные вирусом Эпштейна-Барра, иммортализованные В-клетки человека - для продукции человеческих антител. Подходящими комбинациями клетка/белок являются, например, клетки СНО/фактор свертывания крови VIII, клетки СНО/фактор свертывания крови VII, клетки CHO/ADAMTS13, клетки СНО/фурин и клетки 293/фактор свертывания крови IX.
В еще одном варианте осуществления настоящего изобретения экспрессия по меньшей мере одного белка клетками, культивируемыми в среде по данному изобретению, повышена по сравнению с экспрессией белка клетками, не культивируемыми в среде по настоящему изобретению. В еще одном варианте осуществления указанная экспрессия повышена по меньшей мере на 10%, по еще одному варианту осуществления по меньшей мере на 50%.
Настоящее изобретение относится к способу продукции по меньшей мере одного вируса или по меньшей мере одной части вируса, включающему стадии:
a) получения культуры клеток;
b) инфицирования клеток по меньшей мере одним вирусом;
c) отбора клеток, инфицированных вирусом; и
d) размножения по меньшей мере одного вируса в клетках в среде, содержащей по меньшей мере 0,5 мг/л полиамина.
В одном из вариантов осуществления настоящего изобретения, среда на стадии d) представляет собой среду, не содержащую олигопептидов, по настоящему изобретению. В еще одном варианте осуществления настоящего изобретения клетки культуры на стадии а) выращивались в среде, не содержащей олигопептидов, по настоящему изобретению. В еще одном варианте осуществления стадии a)-d) проводятся в среде для культуры клеток, не содержащей олигопептидов, по настоящему изобретению.
Вирус, используемый в способе по настоящему изобретению, может быть любым вирусом, таким как, например, поксвирусы, например вирусами коровьей оспы или ослабленными вирусами коровьей оспы (оспенной вакцины); коронавирусами, например вирусами SARS (атипичная пневмония); ортомиксовирусами, например вирусами гриппа А или В; парамиксовирусами; ретровирусами, например лентивирусом; тогавирусами, например вирусом Росс-Ривер; флавивирусами, например западно-нильским вирусом, вирусом желтой лихорадки или вирусом FSME (т.е. клещевой вирусный энцефалит); энтеровирусами, например вирусом гепатита А; пикорнавирусами; аренавирусами; вирусами герпеса или аденовирусами. В одном из вариантов осуществления настоящего изобретения вирус представляет собой модифицированный вирус коровьей оспы (MVA). Вирус может быть размножен по настоящему изобретению для продукции соответствующей вакцины.
Вирус может быть вирусом дикого типа, ослабленным вирусом, химерным вирусом, или рекомбинантным вирусом, или их комбинацией, например, ослабленным и рекомбинантным. Кроме того, вместо истинных вирионов, используемых для инфицирования клеток вирусом, может быть использован клон инфицирующей нуклеиновой кислоты. Также могут быть использованы расщепленные вирионы.
Способ продукции вируса может быть использован для продукции иммуногенных композиций, включающих вирус, вирусный антиген или вирусоподобную частицу.
Клетки, используемые в способе продукции вируса по настоящему изобретению, могут быть выбраны из группы, включающей в себя клетки млекопитающих, клетки насекомых, клетки птиц, бактериальные клетки и клетки дрожжей. В одном из вариантов осуществления клетки, используемые в способе продукции вируса по настоящему изобретению, выбраны из группы, включающей клетки Vero (линия клеток почки африканской зеленой мартышки) и клетки куриного эмбриона.
Подходящими для продукции вируса или части вируса комбинациями клеток и вирусов являются, например, клетка Vero/ослабленный вирус коровьей оспы, клетка Vero/вирус коровьей оспы, клетка Vero/гепатит А, клетка Vero/вирус гриппа, клетка Vero/западно-нильский вирус, клетка Vero/вирус SARS, клетка Vero/вирус желтой лихорадки и клетки куриного эмбриона/вирус FSME. В одном из вариантов осуществления настоящего изобретения комбинация клетка/вирус представляет собой клетки куриного эмбриона/модифицированный вирус коровьей оспы Ankara (MVA).
Подходящие способы культивирования включают в себя периодическое культивирование, периодическое культивирование с подпиткой, перфузионное культивирование и хемостатическое культивирование.
Настоящее изобретение далее будет проиллюстрировано нижеследующими примерами, не является ограниченным ими.
ПРИМЕРЫ
Пример 1: Получение среды BAV
Среду, не содержащую олигопептидов (среда BAV), получали из основной среды DMEM/HAM's F12 (1:1), содержащей неорганические соли, аминокислоты, витамины и другие компоненты (фирма Life technologies, 32500 Powder). Также добавлены L-глютамин (600 мг/л), аскорбиновая кислота (20 мкМ), этаноламин (25 мкМ), Synperonic ® (фирма SERVA) (0,25 г/л), селенит натрия (50 нМ). Дополнительно к среде для культуры клеток были добавлены незаменимые аминокислоты: L-аспарагин⋅Н2О 20 мг/л, L-цистеин⋅НС1⋅Н20 15 мг/л, L-цистин⋅2 HCl 20 мг/л, L-пролин 35 мг/л, L-триптофан 20 мг/л.
Пример 2: Определение количества клеток
Количество клеток из суспензии клеток или иммобилизованных клеток определяли либо подсчетом с помощью счетчика клеток CASY® cell counter, как описано Scharfe et al., Biotechnologie in LaborPraxis 10: 1096-1103 (1988), или экстракцией лимонной кислотой и флуоресцентным окрашиванием ядер с последующим подсчетом с помощью NucleoCounter® (фирма Chemometec, Дания). Удельный темп роста (μ) рассчитывали по повышению плотности клеток (Xt) и/или скорости разбавления (D) стационарного состояния хемостатических культур суспензий клеток в течение определенного интервала времени (t):
μ=D+ln (Xt/X0)/t
Пример 3: Определение активности FVIII
Активность фактора VIII (FVIII) (ср. Фиг. 1-5) измеряли с помощью хромогенного анализа (фирма Chromogenic, Швеция).
Пример 4: Расчет объемной (QP) и клеточно специфической продуктивности (qp)
Объемную продуктивность (QP) рассчитывали из количества единиц активности выхода на литр объема реактора в день (U/L/d) в системе продукции.
Удельная продуктивность клетки (qp) определяется как количество продуцированного белка (U или мкг) на количество клеток в день.
Пример 5: Условия крупномасштабной культуры клеток
Клеточные культуры рекомбинантных клеток млекопитающих (например, клетки СНО, стабильно экспрессирующие фактор VIII, такие как клетки GD8/6) выращивали в суспензии в хемостатической культуре в 10-литровых биореакторах. Условия культуры: 37°С, насыщение кислородом 20% и рН 7,0-7,1 поддерживали постоянно. Культуры снабжали постоянной подпиткой средой BAV.
Пример 6: Эффект добавления полиамина на экспрессию FVIII
Клетки GD8/6 выращивали в хемостатической культуре в биореакторе объемом 10 л, как описано в Примере 5 с постоянной подачей среды BAV в течение 11 дней, что приводило к пониженной продуктивности <100U/L/d. Путем добавления путресцина⋅2НС1 (2 мг/л) объемная экспрессия FVIII повышалась на 800% (ср. Фиг. 1). Соответственно, путресцин мог быть ясно идентифицирован как движущий фактор клеточно-специфической экспрессии в клеточной линии GD8/6.
Пример 7: Эффект добавления полиамина, а также Fe (II) и Си (II) на экспрессию FVIII
Клетки GD8/6 выращивали в хемостатической культуре в биореакторе объемом 10 л, как описано в Примере 5, что приводило к средней продуктивности 271 U/L/D, с малыми удельной клеточной продуктивностью и удельным темпом клеточного роста. Путем добавления путресцина⋅2НС1 (2 мг/л) экспрессия FVIII повышалась до 870 U/L/D, главным образом благодаря повышению удельной клеточной продуктивности. Дополнительные добавки Fe (II) и Cu (II) в концентрации, которая обычно содержится в гидролизатах сои, приводили к повышению удельного темпа клеточного роста приблизительно 0,60 d-1, и может быть достигнуто повышение удельной продуктивности клеток до более чем 1700 миллиU/106 клеток/день. В таких условиях достигается объемная продуктивность более 2685 U/L/D. Дальнейшее повышение плотности клеток приводит к объемной продуктивности более 3000 U/L/D. Максимальная объемная продуктивность среды, содержащей гидролизат сои, в сравнимых условиях ферментации составляла 2000-2500 U/L/D, показывая, что химически определенная среда, содержащая только путресцин и 2 дополнительных иона металлов, превосходит какую-либо среду с гидролизатом сои с композицией, исследованной в данном процессе ранее (ср. Фиг. 2).
Пример 8: Условия культуры клеток малого объема
Эксперименты с малым объемом клеток GD8/6 в суспензионной культуре выполняли в роллерных колбах [фирмы] Techne с рабочим объемом 200 мл в периодической подпитываемой культуре при 37°С, без контроля рН и рО2. Культуры снабжали средой BAV, как это определено выше, с дополнительными добавками путресцина⋅2HCl, орнитина⋅HCl, спермина⋅4HCl или этаноламина, или их комбинациями в диапазоне 0-18 мг/л (эквивалентном 0-10 мг/л биогенного амина без⋅HCl (ср. Фиг. 3-5).
Пример 9: Эффект добавления нескольких полиаминов и комбинаций полиаминов на экспрессию FVIII
Клетки GD8/6 из культуры в среде BAV, как описано в Примере 8, центрифугировали и переносили в роллерные колбы фирмы Techne с рабочим объемом 200 мл и инкубировали при плотности клеток около 1-26 клеток/мл в определенной среде с добавлением этаноламина, путресцина, орнитина и/или спермина, как показано на Фиг. 3, 4 и 5. Орнитин, который является предшественником путресцина в [метаболическом] пути биогенных аминов, может частично заменять путресцин концентрационно-зависимым образом. Добавление орнитина в различных концентрациях к среде, содержащей путресцин⋅2HCl, приводило к дополнительному повышению удельных продуктивности FVIII и темпа роста (ср. Фиг. 3). Однако этаноламин, который не является полиамином по данному изобретению, не мог заменить путресцин в какой-либо исследованной концентрации, а повышение концентрации этаноламина в среде, содержащей путресцин, не приводило к существенному повышению объемных продуктивностей или удельных темпов роста (ср. Фиг. 5). Еще один эксперимент в сходных условиях показал, что спермин, еще один промежуточный продукт пути [метаболизма] биогенных аминов, может заместить путресцин концентрационно-зависимым образом (ср. Фиг. 4).
Пример 10: Эффект добавления полиамина на продукцию вируса MVA
Первичные культуры клеток куриного эмбриона культивировали в роллерных колбах фирмы Techne (рабочий объем 200 мл) с использованием среды, не содержащей пептидов (среда FM) без добавления и с добавлением 3,6 мг/л путресцина⋅2 HCl.
Среду FM приготавливали из основной среды M199, содержащей неорганические соли, аминокислоты, витамины и другие компоненты (фирма Life technologies, 31150 Powder). Также добавляли NaHCO3 (до 4,4 г/л), гентамицин⋅SO4 (50 мкг/л) и неомицин⋅SO4 (50 мкг/л).
Культуры клеток были инфицированы вирусом MVA и супернатанты исследовали на титр вируса анализом TCID50. Путем добавления путресцина средний титр вируса (n=16 образцов каждый) может быть повышен приблизительно на 50% (ср. Фиг. 6).
Пример 11: Эффект добавления нескольких доз полиамина на продукцию вируса MVA
Первичные культуры клеток куриного эмбриона культивировали в роллерных колбах фирмы Techne (рабочий объем 200 мл) с использованием среды, не содержащей пептидов (среда СЕМ) без добавления или с добавлением 3,6 и 9 мг/л путресцина⋅2 HCl.
Среду СЕМ готовили из основной среды DMEM/HAM's F12 (1:1), содержащей неорганические соли, аминокислоты, витамины и другие компоненты (фирма Life technologies, 32500 Powder). Также добавляли NaCO3 (2 г/л), L-глютамин (600 мг/л), аскорбиновую кислоту (20 мкМ), этаноламин (25 мкМ), Synperonic ® (фирма SERVA) (0,25 г/л), селенит натрия (50 нМ), FeSO4⋅7H2O (600 мкг/л), гентамицин⋅SO4 (50 мкг/л) и неомицин⋅SO4 (50 мкг/л). Дополнительно к среде культуры клеток добавляли незаменимые аминокислоты: L-аспарагин⋅Н2О 20 мг/л, L-цистеин⋅HCl⋅Н2О 15 мг/л, L-цистин⋅2 НС1 20 мг/л, L-пролин 35 мг/л, L-триптофан 20 мг/л.
Культуры клеток инфицировали вирусом MVA, и супернатанты исследовали на титр вируса анализом TCID50. Путем добавления путресцина 9 мг/л средний титр вируса (n=4 образцов каждый) может быть повышен приблизительно на 60% (ср. Фиг. 7).
1. Безбелковая среда для культивирования клеток СНО, не содержащая олигопептидов, содержащая аминокислоты, витамины, органические и неорганические соли и источники углеводов и дополненная по меньшей мере 2 мг/л путресцина⋅2HCl.
2. Среда, не содержащая олигопептидов по п. 1, дополнительно содержащая один или более из группы, состоящей из кадаверина, спермидина, с