Способ получения целевого антитела с модулированным галактозилированием (варианты) и способ модулирования галактозилирования целевого антитела (варианты) путем оптимизации культуральной среды
Иллюстрации
Показать всеНастоящая группа изобретений относится к биотехнологии и иммунологии. Предложены способы получения целевого антитела с модулированным галактозилированием (варианты), способы модулирования галактозилирования целевого антитела (варианты) путем оптимизации культуральной среды. Способы предусматривают повышение осмоляльности раствора для культивирования клеток животных и/или добавление аспарагина в раствор в определенный момент времени процесса культивирования клеток. Изобретения обеспечивают получение желаемой популяции антител. 5н. и 14 з.п. ф-лы, 3 ил., 8 табл., 3 пр.
Реферат
Область изобретения
Настоящее изобретение относится к способу получения целевого рекомбинатного белка с модулированным галактозилированием или способу модулирования галактозилирования целевого рекомбинатного белка, включающему повышение осмоляльности раствора для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, во время культивирования клеток животных; к способу получения целевого рекомбинатного белка с модулированным галактозилированием или способу модулирования галактозилирования целевого рекомбинатного белка, включающему добавление аспарагина в раствор для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, во время культивирования клеток животных; к способу получения целевого рекомбинатного белка с модулированным галактозилированием или способу модулирования галактозилирования целевого рекомбинатного белка, включающему повышение осмоляльности в культуре клеток животных, которые экспрессируют целевой рекомбинантный белок, и добавление к ней аспарагина во время культивирования клеток животных; и к целевому рекомбинантному белку с модулированным галактозилированием, который получен данным способом.
Предшествующий уровень техники
Антитела представляют собой белки, которые связываются с антигенами, тем самым препятствуя действию антигенов или удаляя антигены. Поскольку известно, что рынок терапевтических антител имеет значительный потенциал, проводятся интенсивные исследования по эффективной экспрессии и крупномасштабному производству антител. Одним из важных аспектов в получении антител является гомогенность популяции полученных антител. В частности, при получении моноклональных антител, профили гликоформ являются важными для неизменных и воспроизводимых моноклональных антител. Однако, много различных переменных могут влиять на профили гликозилирования получаемых моноклональных антител, и таким образом существует потребность в разработке способа, способного постоянно контролировать гликозилирование полученной популяции антител и содержание изомеров антител.
Одна из важных проблем в промышленном производстве моноклональных антител заключается в постоянном поддержании качества полученных моноклональных антител в каждой партии. Хотя существует множество качественных параметров, имеющих значение в процессе получения моноклональных антител, галактозилирование антител может представлять собой одно из наиболее важных качеств среди них. Это обусловлено тем, что галактозилирование, как известно, влияет на процесс комплементзависимой цитотоксичности (CDC), которая представляет собой один из основных механизмов действия (МОА) моноклональных антител. Галактозилирование осуществляется с использованием галактозы как структурной единицы для цепи реакций гликозилирования путем связывания ее вслед за N-ацетилглюкозаминосахаром под действием галактозилтрансферазы. Примеры способов контролирования галактозилирования могут включать способ добавления марганца или галактозы в культуральный раствор и так далее (заявка на патент США No. 2012-0276631), но все еще существует необходимость в разработке способа контролирования галактозилирования антител.
Краткое изложение сущности изобретения
Техническая задача
В этих обстоятельствах авторы настоящего изобретения приложили большие усилия в разработке способа эффективного контролирования галактозилирования рекомбинантных белков, получаемых в процессе культивирования клеток животных, которые способны продуцировать рекомбинантные белки. В результате авторы изобретения обнаружили, что галактозилирование рекомбинантных белков можно эффективно модулировать путем повышения осмоляльности раствора для культивирования клеток животных или добавления аспарагина в определенный момент времени процесса культивирования во время культивирования клеток животных. Дополнительно авторы изобретения обнаружили, что при добавлении аспарагина одновременно с повышением осмоляльности раствора для культивирования клеток животных галактозилирование можно контролировать без уменьшения содержания кислотных изомеров антител по мере повышения осмоляльности, тем самым создав настоящее изобретение.
Техническое решение
Задача настоящего изобретения заключается в предложении способа получения целевого рекомбинатного белка с модулированным галактозилированием, включающего повышение осмоляльности раствора для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, во время процесса культивирования клеток животных.
Другая задача настоящего изобретения заключается в предложении способа модулирования галактозилирования целевого рекомбинантного белка, включающего повышение осмоляльности раствора для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, во время процесса культивирования клеток животных.
Еще одна задача настоящего изобретения заключается в предложении способа получения целевого рекомбинатного белка с модулированным галактозилированием, включающего добавление аспарагина в раствор для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, во время процесса культивирования клеток животных.
Еще одна задача настоящего изобретения заключается в предложении способа модулирования галактозилирования целевого рекомбинатного белка, включающего добавление аспарагина в раствор для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, во время процесса культивирования клеток животных.
Еще одна задача настоящего изобретения заключается в предложении способа получения целевого рекомбинатного белка с модулированным галактозилированием, включающего повышение осмоляльности раствора для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, и добавление в него аспарагина во время процесса культивирования клеток животных.
Еще одна задача настоящего изобретения заключается в предложении способа модулирования галактозилирования целевого рекомбинатного белка, включающего повышение осмоляльности раствора для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, и добавление в него аспарагина во время процесса культивирования клеток животных.
Еще одна задача настоящего изобретения заключается в предложении целевого рекомбинатного белка, полученного вышеизложенным способом.
Полезные эффекты изобретения
Преимущество способа по настоящему изобретению состоит в том, что содержание галактозы целевого рекомбинатного белка можно эффективно модулировать в желаемом диапазоне. Дополнительно способ по настоящему изобретению, в котором используют как повышение осмоляльности, так и добавление аспарагина, обеспечивает эффект модулирования содержания кислотных изомеров антител (кислотных вариантов), также как и галактозы. Соответственно, способ по настоящему изобретению можно эффективно использовать для получения желаемой популяции антител.
Краткое описание графических материалов
На Фиг. 1 показана схематическая диаграмма вектора экспрессии биоаналога адалимумаба (adalimumab biosimilar).
На Фиг. 2 показан момент времени для инъецирования водного раствора хлорида натрия (NaCl) на протяжении периода культивирования с подпиткой.
На Фиг. 3 показан момент времени для добавления аспарагина на протяжении периода культивирования с подпиткой.
Наилучший вариант осуществления изобретения
Для выполнения вышеизложенных задач в одном аспекте настоящего изобретения предложен способ получения целевого рекомбинатного белка с модулированным галактозилированием, включающий повышение осмоляльности раствора для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, во время процесса культивирования клеток животных.
Более точно, вышеупомянутый способ представляет собой способ получения целевого рекомбинатного белка с модулированным галактозилированием, включающий повышение осмоляльности раствора для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, в определенные сутки культивирования во время процесса культивирования клеток животных.
В настоящем изобретении культивирование может представлять собой культивирование с подпиткой, но не ограничиваясь этим.
Термин "культивирование с подпиткой", как он использован здесь, относится к культивированию, при котором исходную клеточную культуру начинают культивировать в базовой среде или продуктивной среде и продолжают культивировать, при этом добавляя в культуру питательную среду непрерывно или прерывисто в любое время на протяжении фазы роста клеток или фазы продуцирования антител.
Термин "среда для культивирования клеток" или "культуральная среда", как он использован здесь, относится к питательному раствору для поддержания, роста, пролиферации или размножения клеток в искусственном окружении in vitro, которое представляет собой внешнее окружение многоклеточного организма или ткани. Среда для культивирования клеток может быть оптимизирована для культивирования определенных клеток, например базовая среда, приготовленная для поддержания роста клеток, или продуктивная среда, приготовленная для стимулирования выработки моноклональных антител, и концентрированная среда, приготовленная путем концентрирования питательных веществ до высокой концентрации. Питательные вещества и компоненты среды относятся к компонентам, которые составляют среду для культивирования клеток, и в настоящем изобретении их можно использовать взаимозаменяемо.
Более точно, термин "базовая культуральная среда" или "базовая среда" относится к среде, которая способна поддерживать минимальный рост клеток. Базовая среда не только обеспечивает стандартные неорганические соли, например, цинка, железа, магния, кальция и калия, но также обеспечивает микроэлементы, витамины, источники энергии, буферы и аминокислоты. Примеры базовой среды включают среду Игла, модифицированную по способу Дульбекко (DMEM), основную питательную среду Игла (ВМЕ), RPMI 1640, F-10 и F-12, но не ограничены ими.
Кроме того, более точно, термины "продуктивная среда для культивирования клеток" или "продуктивная среда" относятся к среде, которую используют с целью оптимизации экспрессии моноклональных антител в биореакторе. Состав продуктивной среды может быть таким же или отличаться от состава базовой среды, и когда он отличается, продуктивная среда может быть приготовлена путем концентрирования базовой среды или добавления определенных компонентов к базовой среде.
Термины "питательная среда" и "дополнительная культуральная среда", как они использованы здесь, могут относиться к среде, состоящей из определенного питательного вещества или множества питательных веществ, которые в обоих случаях представляют собой концентрированные компоненты базовых сред. Компоненты и концентрации питательных сред могут быть получены по-разному в зависимости от культивируемых клеток.
В описанном выше процессе культивирования фаза роста клеток относится к периоду, во время которого клетки растут быстро после инокуляции. В случае клеток яичника китайского хомячка (СНО), известно, что число клеток увеличивается наиболее активно при температуре от 35°С до 37°С и при рН от 7,0 до 7,3. В настоящем изобретении параметры культивирования во время фазы роста клеток составляли 36,5°С и рН 7,1 или рН 7,0.
Термин "инокуляция" относится к высеванию клеток в среде, которая предоставлена для культивирования клеток. В частности, среда может быть предоставлена до переноса клеток или может быть помещена в биореактор одновременно с клетками. При крупномасштабном культивировании клеток животных обычно среду предоставляют заранее и клетки переносят в биореактор после установления температуры и насыщения кислородом в предварительно определенном диапазоне.
Термин "фаза продуцирования антител" относится к периоду, во время которого используют изменения в процессе для оптимизации продукции моноклональных антител. В частности, изменения в процессе для оптимизации продукции могут включать все из следующих: понижение температуры, сдвиг в концентрации растворенного кислорода и замена среды.
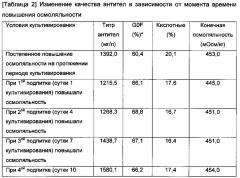
В настоящем изобретении было подтверждено, что степенью изменений в галактозилировании рекомбинантных белков, полученных в клетках животных, которые экспрессируют рекомбинантные белки, можно варьировать в зависимости от момента времени, когда повышают осмоляльность среды. То есть, когда осмоляльность постепенно повышали во время периода культивирования, различие в степени галактозилирования не было существенным по сравнению с таковым в группе, в которой осмоляльность не повышали. Напротив, когда осмоляльность повышали в определенный момент времени во время культивирования клеток, содержание G0F было значительно увеличено, тем самым подтверждая, что галактозилирование можно модулировать, и более точно, галактозилирование можно предупреждать или уменьшать.
Дополнительно в настоящем изобретении стадию повышения осмоляльности предпочтительно осуществляют во время процесса основного культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, но не ограничиваясь этим.
Термин "основное культивирование", как он использован здесь, относится к стадии культивирования, на которой происходит фактическая выработка моноклональных антител. Это конечная стадия процесса культивирования, который начинался с единственной пробирки с клетками, и по завершении основного культивирования полученные моноклональные антитела подвергают очистке. Основное культивирование можно отличить от того, что обозначают термином "посевное культивирование", которое применяют с целью постадийного увеличения объема культуры.
Стадию повышения осмоляльности можно осуществлять в определенный момент времени культивирования во время процесса основного культивирования клеток животных; в частности, в любые сутки культивирования от суток 1 до суток 10 во время основного культивирования, принимая за сутки 0 начало основного культивирования; более конкретно, в любые сутки культивирования из суток 1, суток 4, суток 7 и суток 10, принимая за сутки 0 начало основного культивирования; и более конкретно, в сутки 4 или сутки 7, принимая за сутки 0 начало основного культивирования, но не ограничиваясь этим.
Дополнительно, стадия повышения осмоляльности может быть осуществлена один раз во время процесса культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок.
Дополнительно, стадия повышения осмоляльности, хотя конкретно не ограничиваясь этим, может быть осуществлена для получения конечной осмоляльности культурального раствора в диапазоне от 460 мОсм/кг до 500 мОсм/кг, и более конкретно в диапазоне от 460 мОсм/кг до 480 мОсм/кг, но не ограничиваясь этим. Конечная осмоляльность культурального раствора относится к осмоляльности, имеющейся на момент времени окончания культивирования, но конкретно не ограничиваясь этим.
Дополнительно, стадия повышения осмоляльности может иметь целевое повышение осмоляльности культурального раствора в диапазоне от 400 мОсм/кг до 440 мОсм/кг, и более конкретно, в диапазоне от 430 мОсм/кг до 440 мОсм/кг, но не ограничиваясь этим. Целевое повышение осмоляльности в культуральном растворе относится к уровню осмоляльности, до которого она повышается к моменту времени проведения стадии повышения осмоляльности, но конкретно не ограничиваясь этим.
Дополнительно, повышение осмоляльности может быть выполнено с использованием по меньшей мере одного способа, выбранного из группы, состоящей из способа добавления хлорида натрия или хлорида калия в раствор для культивирования клеток животных и способа добавления глюкозы в культуральный раствор, и более конкретно, с использованием способа добавления хлорида натрия в культуральный раствор, но не ограничиваясь этим.
Способ добавления хлорида натрия в культуральный раствор может быть выполнен путем добавления 4 М водного раствора хлорида натрия в культуральный раствор в определенные сутки во время развития культуры с подпиткой, тем самым повышая осмоляльность до определенного уровня, но не ограничиваясь этим. Когда осмоляльность в культуральном растворе, или даже более того, осмоляльность в клетках, повышают путем добавления водного раствора хлорида натрия, это приводит к повышению активности β-галактозидазы, и таким образом галактозилирование моноклональных антител может быть ингибировано.
Термин "культуральный бульон" или "культуральная среда", как он использован здесь, относится к жидкости, содержащей культивируемые клетки, которую добавляют во встряхиваемую колбу или в биореактор. Термины "культуральный бульон" и "культуральная среда" можно использовать взаимозаменяемо. Дополнительно, культуральный раствор и культуральную среду можно различить в зависимости от наличия клеток животных.
Термин "рекомбинантный белок", как он использован здесь, может представлять собой антитело и, предпочтительно, моноклональное антитело.
Термин "моноклональное антитело", как он использован здесь, относится к антителу, которое может быть образовано клеткой с последовательностью, кодирующей антитело, и распознает специфический антиген.
Антитело по настоящему изобретению предпочтительно может включать, но не ограничиваясь ими, все терапевтические антитела, обычно применяемые в данной области техники, и в частности, это может быть адалимумаб.
Дополнительно, вышеупомянутое антитело представляет собой понятие, охватывающее как полноразмерные антитела, так и фрагменты антител, и примеры фрагментов антител включают все из Fv, Fab, Fab', F(ab')2, Fd и так далее. Fv включает как формы стабилизированных дисульфидными связями Fv (dsFv), так и одноцепочечные Fv (scFv). Fd относится к компоненту тяжелой цепи, включенному в Fab.
Клетки животных, которые могут экспрессировать целевой рекомбинантный белок, могут включать клетку нативного типа или трансфицированную, способную экспрессировать рекомбинантный белок без ограничений. Для целей настоящего изобретения клетки животных могут обладать способностью экспрессировать рекомбинантный белок, который становится субъектом для модулирования содержания галактозы, например линия клеток яичника китайского хомячка (СНО) или клеточная линия миеломы мыши (NSO), но не ограничиваясь ими.
Дополнительно, для модулирования галактозилирования моноклонального антитела могут быть включены оптимизация параметров культивирования, концентрации базовых культуральных сред и дополнительная подпитка оптимизированных культуральных сред.
То есть, способ модулирования галактозилирования моноклональных антител, определенный выше в соответствии со степенью требуемой модификации галактозилирования, можно применять после определения диапазона галактозилирования для желаемого моноклонального антитела и анализа галактозилирования моноклонального антитела, экспрессируемого клетками имеющейся клеточной линии.
В частности, примеры модификации, которые могут быть реализованы в работе биореактора для получения моноклональных антител с модулированным галактозилированием, могут включать оптимизацию параметров культивирования, таких как растворенный кислород (DO), степень кислотности (рН), температура культивирования, перемешивание и так далее. Более конкретно, в существующем способе, где культивирование осуществляют при 36,5°С, 30% растворенного кислорода и рН 7,0 во время фазы клеточного роста и при 30°С, 30% растворенного кислорода и рН 7,0 во время фазы продуцирования антител, когда культивирование проводят после изменения температуры до 28°С, растворенного кислорода до 20% и степени кислотности до рН 6,9, соответственно, было подтверждено, что модулирование галактозилирования моноклональных антител возможно.
Дополнительно, для модулирования галактозилирования базовая культуральная среда может быть сконцентрирована для использования. В частности, можно применять культуральную среду, которая не содержит компонентов, полученных из клеток животных, и базовая среда, разработанная для культивирования с подпиткой, может быть оптимизирована для модулирования галактозилирования моноклональных антител. В частности, когда среды, которые были получены путем концентрирования базовой культуральной среды, например, в 0,8 раз или 1,4 раза, использовали в основном культивировании, было возможно модулировать галактозилирование моноклональных антител.
Дополнительно, питательная среда может быть оптимизирована для модулирования галактозилирования. В настоящем изобретении галактозилирование было уменьшено путем модулирования концентрации питательной среды и оптимизации концентрации компонентов-металлов, добавленных к питательной среде.
Галактозилирование целевого рекомбинатного белка, полученного вышеизложенным способом, может быть измерено путем анализа профиля N-гликанов с использованием устройства Q-TOF (количественная время-пролетная масс-спектрометрия) или UPLC (сверхэффективная жидкостная хроматография). Анализ профиля N-гликанов обеспечивает различную информацию, включая содержание G0F, индекс галактозилирования (GI), негликозилированную тяжелую цепь (NGHC), процент афукозилирования, высокое содержание маннозы и так далее, и в настоящем изобретении в основном упоминается изменение содержания G0F.
Дополнительно, способ по настоящему изобретению может представлять собой один из способов для получения популяции антител с уменьшенным галактозилированием. То есть, он представляет собой способ, который можно применять при получении популяции антител, которые имеют более низкий уровень галактозилирования, чем проанализированное значение, полученное после анализа галактозилирования моноклональных антител, экспрессируемых клетками имеющейся клеточной линии.
Термин "популяция антител", как он использован здесь, относится к группе антител, которая включает антитела, которые могут иметь различное содержание гликанов, и для целей настоящего изобретения термин "популяция антител" относится к группе антител с модулированным галактозилированием, которая включает галактозилированные антитела в нужном соотношении.
В другом аспекте настоящего изобретения предложен способ модулирования галактозилирования целевого рекомбинатного белка, включающий повышение осмоляльности раствора для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, во время процесса культивирования клеток животных.
Способ и каждый из терминов являются такими, как объяснено выше.
В частности, способ может включать повышение осмоляльности раствора для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, в определенные сутки культивирования во время процесса культивирования клеток животных, и конкретные детали являются такими как объяснено выше.
Еще в одном аспекте настоящего изобретения предложен способ получения целевого рекомбинатного белка с модулированным галактозилированием, включающий добавление аспарагина к раствору для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, во время процесса культивирования клеток животных.
Описанные термины являются такими, как объяснено выше.
В настоящем изобретении было подтверждено, что при добавлении аспарагина в раствор для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, во время процесса культивирования клеток животных, галактозилирование целевого рекомбинатного белка можно модулировать.
В частности, аспарагин можно добавлять в форме концентрата аспарагина или культуральной среды, содержащей аспарагин.
Дополнительно, добавление аспарагина может быть выполнено множество раз во время процесса культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, в определенный момент времени процесса культивирования. В частности, добавление аспарагина может быть выполнено в сутки 4-10, принимая за сутки 0 начало основного культивирования, и в частности, добавление аспарагина может быть выполнено во все из суток 4, суток 7 и суток 10, принимая за сутки 0 начало основного культивирования, тем самым постепенно увеличивая концентрацию аспарагина в культуральном растворе.
Когда аспарагин добавляют один раз, проявляется недостаток, который заключается в том, что концентрация NH4+ в культуральном растворе быстро повышается, и в связи с этим рост клеток замедляется, и в итоге уровень экспрессии конечного белка понижается. Однако, когда аспарагин добавляют в составе разделенных доз во время подпитки согласно настоящему изобретению, имеет место преимущество в том, что желаемое количество белка может быть получено наряду с модулированием галактозилирования без вышеуказанного недостатка.
Добавление аспарагина может быть выполнено таким образом, что конечная концентрация аспарагина в растворе для культивирования клеток животных может находиться в диапазоне от 27,6 мМ до 33,6 мМ.
В частности, аспарагин может быть добавлен таким образом, что конечная концентрация аспарагина в растворе для культивирования клеток животных может составлять 33,6 мМ; например, аспарагин может быть добавлен таким образом, что конечная концентрация аспарагина в растворе для культивирования клеток животных может быть дополнительно повышена на величину от 6 мМ до 18 мМ, и более конкретно, аспарагин может быть добавлен три раза путем постепенного добавления аспарагина в концентрациях 6 мМ, 12 мМ и 18 мМ, но не ограничиваясь этим.
Когда этот способ применяют в отношении клеток животных, он вызывает выработку ионов аммония (NH4+), тем самым увеличивая концентрацию ионов аммония в клетках. Соответственно, рН сети транс-Гольджи увеличивается, и активность β-галактозилтрансферазы уменьшается, и в связи с этим галактозилирование моноклонального антитела может быть ингибировано.
Дополнительно, как описано выше, для модулирования галактозилирования моноклонального антитела могут быть включены оптимизация параметров культивирования, концентрации базовой культуральной среды и дополнительная подпитка оптимизированных культуральных сред.
То есть, способ модулирования галактозилирования моноклональных антител, определенный выше в соответствии со степенью требуемой модификации галактозилирования, можно применять после определения диапазона галактозилирования для желаемого моноклонального антитела и анализа галактозилирования моноклонального антитела, экспрессируемого клеточной линией.
В дополнительном аспекте настоящего изобретения предложен способ модулирования галактозилирования целевого рекомбинатного белка, включающий добавление аспарагина к раствору для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок во время процесса культивирования клеток животных.
Описанные способ и термины являются такими, как объяснено выше.
В дополнительном аспекте настоящего изобретения предложен способ получения целевого рекомбинатного белка с модулированным галактозилированием, включающий повышение осмоляльности раствора для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, и добавление аспарагина в культуральный раствор во время процесса культивирования клеток животных.
Описанные термины являются такими, как объяснено выше.
В настоящем изобретении было подтверждено, что при добавлении аспарагина к раствору для культивирования клеток животных, которые экспрессируют целевой рекомбинантный белок, при повышении осмоляльности культурального раствора клеток животных во время процесса культивирования клеток животных, содержание кислотных изомеров антител, которое может быть уменьшено наряду с повышением осмоляльности, увеличивалось при одновременном уменьшении галактозилирования по мере добавления аспарагина.
В вышеизложенном способе повышение осмоляльности и добавление аспарагина могут быть выполнены одновременно или последовательно. Например, осмоляльность в культуральном растворе может быть повышена путем осуществления такого способа, как добавление хлорида натрия с последующим добавлением аспарагина; или сначала может быть добавлен аспарагин, и затем осмоляльность в культуральном растворе может быть повышена путем добавления хлорида натрия или тому подобного; или добавление аспарагина и повышение осмоляльности в культуральном растворе могут быть выполнены одновременно.
В частности, повышение осмоляльности может быть выполнено путем применения способов, описанных выше.
Повышение осмоляльности может быть выполнено с получением конечной осмоляльности в культуральном растворе в диапазоне от 460 мОсм/кг до 500 мОсм/кг, и добавление аспарагина может быть выполнено с тем, чтобы довести конечную концентрацию аспарагина в культуральном растворе клеток животных до концентрации в диапазоне от 27,6 мМ до 33,6 мМ.
Дополнительно, рекомбинантный белок может представлять собой антитело, в частности моноклональное антитело, и содержание кислотных изомеров антител в популяции антител, полученных вышеизложенным способом, можно регулировать при одновременном модулировании галактозилирования целевого рекомбинантного белка с использованием способа по настоящему изобретению. То есть, галактозилирование может быть уменьшено в соответствии с повышением осмоляльности, и одновременно содержание кислотных изомеров антител, которое может быть уменьшено в соответствии с повышением осмоляльности, может быть увеличено путем добавления аспарагина.
Соответственно, вышеизложенный способ имеет преимущество, состоящее в том, что он позволяет модулировать галактозилирование в популяции целевого антитела наряду с тем, что одновременно он обладает способностью регулировать содержание кислотных изомеров антитела в популяции целевого антитела.
Кислотные изомеры антител представляют собой тип изомера антител. Изомер антитела относится к антителу, в котором часть аминокислот антитела с основной активностью модифицирована вследствие дезаминирования или окисления, и включает кислотные изомеры антител и основные изомеры антител. Примеры включают изомер антитела, в котором аспарагин среди аминокислот превращен в аспартат путем дезаминирования, и изомер антитела, в котором метионин превращен в сульфат метионина путем окисления, и так далее. Дополнительно, когда глутамат присутствует на N-конце тяжелой цепи, включен изомер антитела, в котором глутамат превращен в пироглутамат путем образования пятичленного кольца.
Анализ этих изомеров антител может быть выполнен путем хроматографии и так далее, и в настоящем изобретении анализ был выполнен путем хроматографии на катионнообменной смоле. Содержание кислотных, главных и основных изомеров антител сильно варьирует в зависимости от собственных характеристик моноклональных антител. Содержание заряженных изомеров антител (заряженных вариантов) моноклональных антител может варьировать в зависимости от условий культивирования клеточных линий, экспрессирующих моноклональные антитела (параметров культивирования, сред для производства и так далее). Соответственно, вышеизложенный способ имеет преимущество, которое заключается в том, что он позволяет регулировать желаемое содержание галактозы при одновременном доведении содержания кислотных изомеров антител до желаемого диапазона.
Подробное описание изобретения
Далее настоящее изобретение будет описано более подробно со ссылкой на следующие примеры. Однако эти примеры предназначены исключительно для иллюстративных целей и никоим образом не предназначены ограничивать объем изобретения.
Пример 1: Модулирование галактозилирования вследствие искусственного повышения осмоляльности
Существуют различные способы повышения осмоляльности культурального раствора во время развития культуры с подпиткой, например способ добавления избыточного количества глюкозы в культуральный раствор, добавления водного раствора хлорида натрия в культуральный раствор и так далее. В настоящем изобретении в качестве репрезентативного способа для повышения осмоляльности применяли способ добавления 4 М водного раствора хлорида натрия в культуральный раствор.
Объяснение способов получения и состава сред
В настоящем изобретении моноклональное антитело, в отношении которого применяли повышение осмоляльности культурального раствора или добавление аспарагина, представляло собой антитело-биоаналог адалимумаба, которое представляет терапевтический агент для лечения ревматоидного артрита и болезни Крона, разработанный Abbott. ДНК биоаналога адалимумаба была получена путем амплификации с помощью ПЦР (полимеразная цепная реакция), основанной на аминокислотных последовательностях тяжелой цепи и легкой цепи антитела адалимумаб, раскрытого в патенте США No. 6090382, и pCB-Am2.77_v5.4 (Фиг. 1) был получен с использованием промотора pGL3 CUCBin, вектора, разработанного LG Life Sciences Ltd., который затем трансфицировали в клеточную линию СНО-DXB11, что тем самым приводило к получению клеточной линии, способной экспрессировать биоаналог адалимумаба. pCUCBin, разработанный LG Life Sciences Ltd., представляет собой один из векторов, раскрытых в патенте Кореи No. 10-1038126 (Новый гибридный промотор и рекомбинантный вектор, включающий этот промотор).
Среды, применяемые в настоящем изобретении, представлены тремя различными типами сред: базовой культуральной средой, продуктивной средой (главной культуральной средой) и питательной средой (дополнительной культуральной средой).
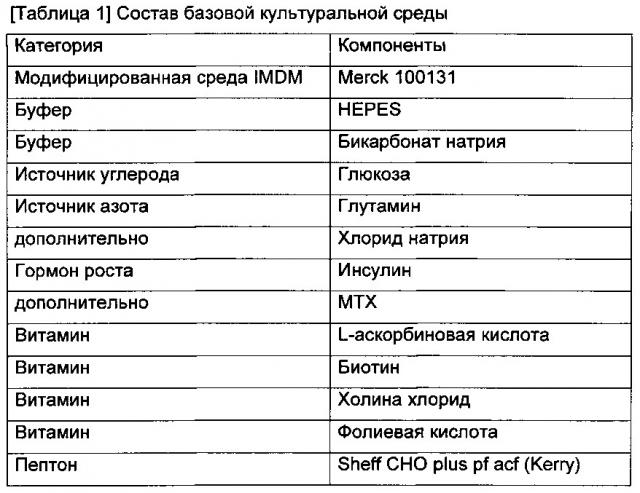
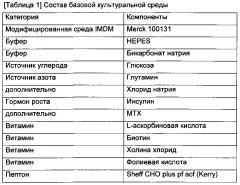
Базовая культуральная среда представляет собой среду, используемую для целей посевных культур. Продуктивная среда представляет собой среду, используемую в культуре, приготовленной для основного продуцирования антител (главная культура) после посевной культуры, и может быть получена путем концентрирования определенного(ых) компонента(ов) в базовой культуральной среде или добавления нового(ых) компонента(ов). В настоящем изобретении концентрированную в 1,4 раза базовую культуральную среду использовали в качестве продуктивной среды. Питательная среда представляет собой культуральную среду, которую добавляют с целью стимулирования клеточного роста и увеличения количества антител, экспрессируемых во время культивирования. В настоящем изобретении концентрированную в 3,3 раза базовую культуральную среду использовали в качестве питательной среды. Все среды из базовой культуральной среды, продуктивной среды и питательной среды представляют собой модифицированную среду Дульбекко, модифицированную по способу Исков (IMDM), и состав культуральных сред показан в таблице 1 ниже.
Способ получения антител, применяемый в настоящем изобретении, представляет собой процесс культивирования клеток животных с использованием биореактора, и культивирование клеток животных представляет собой процесс выращивания клеток животных в культуральной среде и обеспечения клеткам животных возможности экспрессировать антитела при определенной обработке (например понижении температуры). Способы культивирования различным образом включают периодическое культивирование, культивирование с подпиткой, непрерывное культивирование, перфузионное культивирование и так далее, и способ культивирования, используемый в настоящем изобретении для культивирования клеточной линии биоаналога адалимумаба, представляет собой культуру с подпиткой. Культура с подпиткой представляет собой способ культивирования, который протекает таким образом, что дополнительную культуральную среду добавляют в культуру по меньшей мере один раз или дважды в определенные сутки, в то же