Применение активности эндогенной днказы для понижения содержания днк
Иллюстрации
Показать всеГруппа изобретений относится к способу понижения содержания ДНК в ферментационном бульоне, полученном от культивирования клеток-хозяев, являющихся клетками нитчатых грибов. Способ включает повышение рН и/или температуры бульона, в котором культивировали грибные клетки-хозяева в течение по меньшей мере 24 ч, до рН 5,0-9,0 и температуры 30-70°С соответственно, инкубирование бульона при указанных повышенных рН и/или температуре в течение периода, достаточного для поддающегося выявлению понижения содержания ДНК грибов-хозяев в бульоне. При этом понижение содержания ДНК преимущественно не обусловлено наличием экзогенной ДНКазы в бульоне. Вариант способа дополнительно включает стадию разделения жидкой и твердой фазы для отделения бульона от клеток-хозяев, являющихся клетками нитчатых грибов. Предложен также способ понижения содержания ДНК в белковом препарате, полученном из указанных клеток-хозяев. Способ включает оценивание уровня ДНК указанных клеток-хозяев в белковом препарате, полученном из грибных клеток-хозяев, повышение рН и/или температуры белкового препарата, определение понижения количества ДНК указанных клеток-хозяев в белковом препарате после инкубирования. Изобретение позволяет эффективно снижать ДНК в ферментационном бульоне. 3 н. и 21 з.п. ф-лы, 4 ил., 2 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка заявляет приоритет по предварительной заявке на патент США № 61/537837, поданной 22 сентября 2011 г., которая включена в данный документ посредством ссылки во всей своей полноте.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Нитчатые грибы (например, Trichoderma, Aspergillus, Geosmithia, Myceliophthora, Penicillium, Fusarium, Humicola и другие) в последнее время стали популярными штаммами-хозяевами для получения белков. Ферментные препараты, вырабатываемые видами грибов, такими как Trichoderma reesei, Aspergillus niger, Aspergillus tubingensis, Aspergillus oryzae, Geosmithia emersonii, Mycellophthora thermophila, Penicillium funiculosum, Fusarium venenatum и Humicola insolens, разрабатывали как коммерческие продукты. Нитчатые грибы, такие как Trichoderma, Aspergillus, Myceliophthora, Penicillium, Fusarium и другие, также конструировали для экспрессии гетерологичных белков, например, ферментов и терапевтических белков, как правило, управляемой индуцибельными промоторами (см., например, England и соавт., патентную публикацию по PCT WO2004/035070). Многие из белков, полученных таким образом из грибов (например, T. reesei, A. niger, A. tubingensis, A. oryzae, G. emersonii, M. thermophila, P. funiculosum, F. venenatum и H. insolens), применимы в качестве пищевых или кормовых добавок (см., например, Dunn-Coleman и соавт., патентную публикацию по PCT WO2003/038035) или в других путях промышленного применения. В связи с тем, что получение белков с помощью грибов обычно осуществляется в больших масштабах, улучшение эффективности получения и переработки может иметь большое экономическое значение.
КРАТКОЕ ОПИСАНИЕ ФИГУР
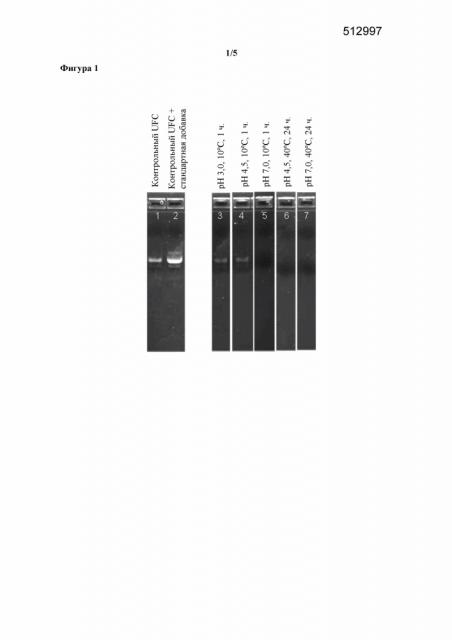
Фигура 1. Эффект повышенных pH или температуры в отношении распада ДНК, наблюдаемого в концентрате ферментативного бульона, полученном путем ультрафильтрации, в котором содержится T. reesei, экспрессирующий фитазу Buttiauxella sp.
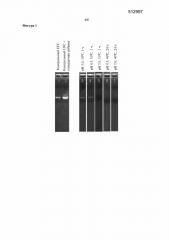
Фигура 2. Эффект времени инкубирования в отношении распада ДНК, наблюдаемого в том же, что и описанный выше, концентрате ферментативного бульона, полученном путем ультрафильтрации, в котором содержится T. reesei, экспрессирующий фитазу Buttiauxella sp.
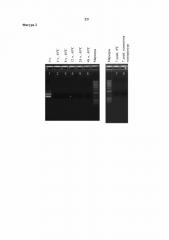
Фигура 3. Эффект повышенных температур и времени инкубирования в отношении распада ДНК, наблюдаемого в том же, что и описанный выше, концентрате ферментативного бульона, полученном путем ультрафильтрации, в котором содержится T. reesei, экспрессирующий фитазу Buttiauxella sp.
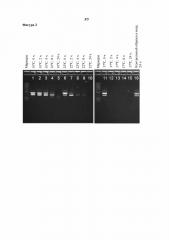
Фигуры 4A-4B. Эффекты повышенного pH в отношении распада ДНК, наблюдаемого при уровнях pH 5,2, 6,3 и 7,6, наблюдаемого в концентрате ферментативного бульона, полученном путем ультрафильтрации, в котором содержится T. reesei, экспрессирующий липазу Aspergillus tubingensis.
КРАТКОЕ ОПИСАНИЕ
Настоящее изобретение обеспечивает способы понижения содержания ДНК в бульоне, в котором культивировали клетки-хозяева, являющиеся клетками нитчатых грибов. Такие способы включают корректировку pH и/или температуры бульона, в котором культивировали клетки-хозяева, являющиеся клетками нитчатых грибов, в течение по меньшей мере 24 часов, до значений pH и/или температуры, превышающих применяемые в культивировании, и инкубирование бульона при повышенных pH и/или температуре в течение периода, достаточного для поддающегося выявлению понижения уровня ДНК нитчатых грибов-хозяев в препарате. Понижение содержания ДНК в таких способах преимущественно не обусловлено наличием экзогенной ДНКазы в бульоне. Некоторые способы дополнительно включают осуществление стадии разделения жидкой и твердой фазы для отделения бульона от клеток-хозяев, являющихся клетками нитчатых грибов, перед стадией корректировки. Некоторые способы дополнительно включают осуществление стадии ультрафильтрации, на котором макромолекулы в бульоне концентрируют перед стадией корректировки. В некоторых способах бульон имеет комнатную температуру после стадии ультрафильтрации. В некоторых способах температура бульона перед стадией корректировки составляет от 25°C до 34°C. В некоторых способах pH бульона перед стадией корректировки составляет от 4 до 5. Некоторые способы дополнительно включают культивирование клеток-хозяев, являющихся клетками нитчатых грибов, в бульоне до достижения желаемой концентрации секретируемых белков, представляющих интерес, в бульоне перед стадией корректировки. Предпочтительно стадию корректировки pH и/или температуры осуществляют перед тем, как фермент (ферменты), вырабатываемый (вырабатываемые) клеткой-хозяином, применяют для обработки намеченного субстрата или воздействия на него.
В некоторых способах pH повышают до pH 6-8 во время стадии корректировки. В некоторых способах температуру повышают до 35°C-47°C во время стадии корректировки. Некоторые способы дополнительно включают оценивание содержания ДНК в бульоне. В некоторых способах содержание ДНК можно оценить перед и после стадии инкубирования. В некоторых способах содержание ДНК снижается до невыявляемого уровня, что оценивается с помощью ПЦР и/или гель-электрофореза с окрашиванием бромистым этидием. Некоторые способы дополнительно включают предоставление возможности бульону охладиться до комнатной температуры после стадии инкубирования. Некоторые способы дополнительно включают очищение одного или нескольких белков из бульона. В некоторых способах один или несколько белков в бульоне экспрессируются рекомбинантным путем клеткой-хозяином, являющейся клеткой нитчатого гриба. В некоторых способах в клетках-хозяевах, являющихся клетками нитчатых грибов, отсутствует экзогенная ДНКаза. В некоторых способах в бульон не добавляют ДНКазу. В некоторых способах клетки-хозяева, являющиеся клетками нитчатых грибов, экспрессируют фермент целлюлазу рекомбинантным путем. В некоторых способах клетки-хозяева, являющиеся клетками нитчатых грибов, экспрессируют фитазу рекомбинантным путем. В некоторых способах клетки-хозяева, являющиеся клетками нитчатых грибов, экспрессируют липазу рекомбинантным путем.
Настоящее изобретение дополнительно обеспечивает способы понижения содержания ДНК в белковом препарате (в том числе, например, в культуральном бульоне), полученном из клеток-хозяев, являющихся клетками нитчатых грибов. Эти способы включают стадии измерения уровня ДНК грибной клетки-хозяина в белковом препарате, полученном из клеток-хозяев, являющихся клетками нитчатых грибов; корректировки pH и/или температуры белкового препарата до скорректированных pH и/или температуры; инкубирования белкового препарата при скорректированных pH и/или температуре в течение периода, достаточного для поддающегося выявлению понижения уровня ДНК клеток-хозяев, являющихся клетками нитчатых грибов, в белковом препарате и определения понижения количества ДНК клеток-хозяев, являющихся клетками нитчатых грибов, в белковом препарате. Понижение в таких способах преимущественно не обусловлено наличием экзогенной ДНКазы в белковом препарате. В некоторых способах количество ДНК снижается до невыявляемого уровня.
Настоящее изобретение дополнительно обеспечивает способы понижения содержания ДНК в бульоне, в котором культивировали клетки-хозяева, являющиеся клетками нитчатых грибов. Эти способы включают стадии повышения pH и/или температуры бульона, в котором культивировали клетки-хозяева, являющиеся клетками нитчатых грибов, в течение по меньшей мере 24 часов и в котором осуществляли стадию разделения жидкой и твердой фазы для отделения бульона от клеток-хозяев, являющихся клетками нитчатых грибов; и инкубирования бульона при повышенных pH и/или температуре в течение периода, достаточного для поддающегося выявлению понижения уровня ДНК нитчатых грибов-хозяев в бульоне. Понижение в таких способах преимущественно не обусловлено наличием экзогенной ДНКазы в бульоне.
Настоящее изобретение также обеспечивает применение активности эндогенной ДНКазы клеток-хозяев, являющихся клетками нитчатых грибов, для понижения уровня ДНК нитчатых грибов-хозяев в белковом препарате, полученном из грибной клетки-хозяина.
Настоящее изобретение дополнительно обеспечивает применение активности эндогенной ДНКазы клеток-хозяев, являющихся клетками нитчатых грибов, для понижения уровня ДНК грибов-хозяев в культуральном бульоне, в котором культивировали грибные клетки-хозяева.
В любом из вышеописанных способов или путей применения грибная клетка-хозяин может представлять собой клетку T. reesei, A. niger, A. tubingensis, A. oryzae, G. emersonii, M. thermophila, P. funiculosum, F. venenatum или H. insolens.
ОПРЕДЕЛЕНИЯ
"ДНКаза" представляет собой фермент, способный осуществлять распад ДНК, обычно путем расщепления фосфодиэфирной связи. ДНКазы включают эндонуклеазы, расщепляющие внутренние сайты, и экзонуклеазы, отщепляющие мононуклеотиды от конца молекулы ДНК. ДНКазы обычно представляют собой белки, но также могут быть небелковыми ДНКазами. ДНКазы могут обладать активностью РНКаз, а также активностью ДНКаз, или не обладать таковыми.
"Экзогенный" белок (например, экзогенная ДНКаза) относится к белку, вводимому в штамм-хозяин с помощью экспрессии рекомбинантных генов или добавляемому в экстракты штамма-хозяина из внешнего источника белка. Экзогенный белок может быть гетерологичным по отношению к штамму-хозяину (т.е. вырабатываемым естественным образом другим штаммом-хозяином) или гомологичным (т.е. вырабатываемым естественным образом данным штаммом-хозяином).
Выражение "рекомбинантный" относится к полинуклеотиду или полипептиду, который не встречается в природе в клетке-хозяине. Рекомбинантная молекула может содержать две или более встречающихся в природе последовательности, соединенные не встречающимся в природе образом.
Выражение "гетерологичный" относится к элементам, обычно не связанным друг с другом. Например, если клетка-хозяин вырабатывает гетерологичный белок, то такой белок обычно не вырабатывается в этой клетке-хозяине. Подобным образом, промотор, функционально связанный с гетерологичной кодирующей последовательностью, является промотором, функционально связанным с кодирующей последовательностью, с которой он обычно не связан функционально в клетке-хозяине дикого типа. Выражение "гомологичный" в отношении полинуклеотида (например, ДНК) или белка относится к нуклеиновой кислоте (например, ДНК) или белку, встречающимся в природе в клетке-хозяине.
"Ген" относится к сегменту ДНК, участвующему в выработке полипептида, и включает области, расположенные перед и после кодирующего сегмента (сегментов) (экзонов), а также, в некоторых генах, встроенные сегменты (интроны) между отдельными кодирующими сегментами.
Нуклеиновые кислоты включают однонитевые или двунитевые ДНК и РНК и их химически модифицированные варианты.
"Вектор" представляет собой последовательность полинуклеотида, предназначенную для введения нуклеиновых кислот в клетки одного или нескольких типов. Векторы включают клонирующие векторы, векторы экспрессии, челночные векторы, плазмиды, фаговые частицы, кассеты и т.п.
"Фитаза" представляет собой фермент, катализирующий гидролиз фитата до (1) миоинозитола и/или (2) его моно-, ди-, три-, тетра- и/или пентафосфатов и (3) неорганического фосфата. Например, фитазы включают ферменты, определяемые шифром КФ 3.1.3.8 или шифром КФ 3.1.3.26.
"Ферменты целлюлазы" или "целлюлазы" включают ферменты, оказывающие прямое воздействие на целлюлозу, и вспомогательные ферменты, способствующие прямому воздействию других ферментов на целлюлозу. Целлюлазы включают экзоглюканазы или экзоцеллобиогидролазы, и/или эндоглюканазы, и/или β-глюкозидазы бактерий или грибов. Эти три различных типа ферментов целлюлаз действуют синергически, превращая целлюлозу и ее производные в глюкозу. Ферменты целлюлазы также включают вспомогательные ферменты, в том числе представителей GH61, таких как EG4, сволленин, лузенин, CIP1 и т.п.
"Липаза" представляет собой фермент, катализирующий гидролиз или образование липидов. Например, липазы катализируют гидролиз триацилглицерина с получением диацилглицерина и карбоксилата. Липазы включают ферменты, определяемые шифром КФ 3.1.1.3.
"Выделенный" означает, что целевой образец удален из по меньшей мере одного компонента, с которым он обычно связан.
"Очищенный" означает, что целевой образец по меньшей мере на 50% (вес/вес) и в некоторых случаях по меньшей мере на 75, 90, 95 или 99% (вес/вес) свободен от макромолекулярных примесей, применяемых в его получении или очищении, но не исключает наличия наполнителей, добавляемых для облегчения применения целевого образца.
Белковый препарат содержит один или несколько желаемых белков, секретируемых нитчатым грибом-хозяином (например, T. reesei, A. niger, A. tubingensis, A. oryzae, G. emersonii, M. thermophila, P. funiculosum, F. venenatum, H. insolens и другими), в любом состоянии чистоты и может также содержать примеси, применяемые для получения или очищения желаемого белка (белков), или добавленные наполнители. Таким образом, белковый препарат может представлять собой бульон или белок (белки), очищенный (очищенные) из бульона.
Бульон или "ферментативный бульон" относится к культуральной среде, применяемой для культивирования клеток-хозяев, являющихся клетками нитчатых грибов (например, T. reesei, A. niger, A. tubingensis, A. oryzae, G. emersonii, M. thermophila, P. funiculosum, F. venenatum и H. insolens) с удалением клеток и клеточного дебриса после ферментации или без такового и с концентрированием белков и других макромолекул в бульоне с помощью ультрафильтрации или подобной методики или без такового, но не включает препарат очищенных белков, в котором желаемый белок (белки) отделен (отделены) от бульона с помощью методик, таких как осаждение и ресуспендирование белков в свежеприготовленной среде или колоночная хроматография и элюирование в свежеприготовленной среде.
Выражение "нитчатые грибы" относится ко всем нитчатым формам подотдела Eumycotina (см. Alexopoulos, C. J. (1962), INTRODUCTORY MYCOLOGY, Wiley, New York и AINSWORTH AND BISBY DICTIONARY OF THE FUNGI, 9.sup.th Ed. (2001) Kirk et al., Eds., CAB International University Press, Cambridge UK). Эти грибы характеризуются вегетативным мицелием с клеточной стенкой, состоящей из хитина, целлюлозы и других сложных полисахаридов. Нитчатые грибы по настоящему изобретению морфологически, физиологически и генетически отличаются от дрожжей. Вегетативный рост нитчатых грибов осуществляется за счет удлинения гиф, а катаболизм углерода является облигатно-аэробным.
Выражение "Trichoderma" или "Trichoderma sp." относится к любому роду грибов, ранее или в настоящее время классифицируемому как "T.", и к гибридам таких штаммов, а также к их генетически модифицированным формам (например, модифицированным с помощью мутации, или трансгена, или нокаута гена).
"Корм" означает любые естественные или искусственные продукты питания, еду или подобное или компоненты такой еды, предназначенные или подходящие для поедания, употребления, поглощения животным, отличным от человека.
"Пища" означает любые естественные или искусственные продукты питания, еду или подобное или компоненты такой еды, предназначенные или подходящие для поедания, употребления, поглощения человеком.
"Пищевая или кормовая добавка" представляет собой очищенное соединение или композицию из нескольких компонентов, предназначенные или подходящие для добавления в пищу или корм. Она может включать одно или несколько соединений, таких как витамины, минеральные вещества, ферменты и подходящие носители и/или наполнитель.
Такие выражения, как "оценивать", "измерять" или "определять", охватывают качественное или количественное выявление анализируемого вещества, в частности, эндогенной ДНК. Такое оценивание или определение может, таким образом, указывать на наличие или отсутствие анализируемого вещества или количества анализируемого вещества.
Выражение "содержащий" и однокоренные слова к нему применяют в их исчерпывающем смысле, т.е. оно эквивалентно выражению "включающий" и соответствующим однокоренным словам к нему.
Если из контекста явно не следует иное, ссылка на конкретную численную величину охватывает указанную величину и отклонение, присущее в связи с ее измерением (т.е. +/- SEM).
Если из контекста явно не следует иное, “около” указывает на допустимое отклонение, составляющее +/- 10%.
Числовые диапазоны включают числа, определяющие диапазон. Также перечислены некоторые предпочтительные поддиапазоны, но в любом случае ссылка на диапазон включает все поддиапазоны, определенные целыми числами, включенными в диапазон.
ПОДРОБНОЕ ОПИСАНИЕ
I. Общая информация
Настоящая заявка обеспечивает способ понижения содержания ДНК в белковом препарате, полученном из нитчатых грибов, без необходимости применения экзогенной ДНКазы. Настоящая заявка частично основана на наблюдении активности эндогенной ДНКазы нитчатых грибов в культуральных бульонах вместе с коммерчески ценными белками. Например, активность ДНКазы обнаруживают в культуральном бульоне, в котором содержится T. reesei, A. niger, A. tubingensis, A. oryzae, G. emersonii, M. thermophila, P. funiculosum, F. venenatum, H. insolens или другой штамм, экспрессирующий и/или вырабатывающий определенный промышленный фермент (ферменты), представляющий интерес. Хотя для практического осуществления настоящего изобретения не требуется понимание механизма, считается, что активность эндогенных ДНКаз может быть обусловлена высвобождением одной или нескольких секретируемых ДНКаз, эндогенных по отношению к нитчатому грибу (например, T. reesei, A. niger, A. tubingensis, A. oryzae, G. emersonii, M. thermophila, P. funiculosum, F. venenatum, H. insolens и т.д.), либо одной или нескольких внутриклеточных ДНКаз таких нитчатых грибов в связи с лизисом клеток.
Такую активность эндогенных ДНКаз можно применять для понижения содержания или устранения молекул ДНК из культурального бульона, в котором содержатся нитчатые грибы, например, из культурального бульона, в котором содержатся T. reesei, A. niger, A. tubingensis, A. oryzae, G. emersonii, M. thermophila, P. funiculosum, F. venenatum или H. insolens. Удаление таких молекул ДНК применимо во многих путях применения, например, в получении ферментного препарата в виде пищевой или кормовой добавки или биологически активной добавки. Регуляторные органы требуют, чтобы некоторые коммерческие ферментные препараты, в частности, применяемые в получении пищи или кормов, не содержали выявляемой ДНК хозяина или по крайней мере содержали ДНК хозяина на уровне ниже определенного предела. Хотя ДНК грибов (например, ДНК T. reesei, A. niger, A. tubingensis, A. oryzae, G. emersonii, M. thermophila, P. funiculosum, F. venenatum, H. insolens и т.д.) в культуральном бульоне можно удалить с помощью экзогенной ДНКазы, экспрессия такой ДНКазы рекомбинантным путем или ее подача в культуральный бульон подразумевает дополнительные стадии, возрастание затрат и, возможно, понижение эффективности. Способ по настоящему изобретению обеспечивает простой метод удаления генетического материала хозяина из белкового препарата без необходимости манипуляций с генами клетки-хозяина либо добавления ДНКазы (ДНКаз) в препарат.
II. Штаммы-хозяева, являющиеся штаммами нитчатых грибов
Для практического осуществления настоящего изобретения можно применять любые подходящие штаммы-хозяева, являющиеся штаммами грибов, способные к экспрессии белков гетерологичных либо эндогенных видов. Например, штаммы-хозяева, являющиеся штаммами грибов, могут представлять собой штаммы-хозяева, являющиеся штаммами видов нитчатых грибов, как, например, таковых из типа Ascomycota и подтипа Pezizomycotina. Такие организмы включают клетки нитчатых грибов, применяемые для получения коммерчески важных промышленных и фармацевтических белков, в том числе, но без ограничений, Trichoderma spp., Aspergillus spp., Fusarium spp., Penicillium spp., Chrysosporium spp., Talaromyces spp., Geosmithia spp., Myceliophthora spp. и Neurospora spp. Конкретные организмы, из которых могут быть получены подходящие штаммы-хозяева, могут включать, но без ограничений, Trichoderma reesei (ранее классифицируемый как Trichoderma longibrachiatum и Hypocrea jecorina), Aspergillus niger, Aspergillus fumigatus, Aspergillus itaconicus, Aspergillus oryzae, Aspergillus nidulans, Aspergillus terreus, Aspergillus sojae, Aspergillus japonicus, Aspergillus tubingensis, Humicola insolens, Humicola grisea, Thermomyces lanuginosus, Neurospora crassa, Penicillium funiculosum, Penicillium chrysogenum, Talaromyces (Geosmithia) emersonii, Fusarium venenatum, Fusarium graminearum, Myceliophthora thermophila и Chrysosporium lucknowense. Штаммы-хозяева, являющиеся штаммами грибов, также могут быть штаммами-хозяевами, являющимися штаммами видов нитчатых грибов, как, например, таковых из типа Basidiomycota или подтипа Mucormycotina. Такие организмы включают клетки нитчатых грибов, применяемые для получения коммерчески важных промышленных и фармацевтических белков, в том числе, но без ограничений, Agaricus spp., Phanerochaete spp., Schizophyllum spp., Rhizomucor spp. и Mucor spp. Конкретные организмы, из которых могут быть получены подходящие штаммы-хозяева, могут включать, но без ограничений, Agaricus bisporus, Phanerochaete chrysosporium, Schizophyllum commune, Rhizomucor miehei и Mucor circinelloides.
Можно ожидать, что в продуктах ферментации (например, в белковом препарате, в том числе, например, в культуральном бульоне), полученных из вышеперечисленных и других видов нитчатых грибов, будет существовать активность эндогенной ДНКазы на некотором уровне. Уровень активности ДНКазы и pH или температура, оптимальные для ДНКазы, могут варьировать между отдельными видами и среди всех видов. Тем не менее, корректировки, производимые в отношении pH, температуры и времени инкубирования, описываемые в данном документе, можно тестировать в целях определения необходимых условий для удаления ДНК в соответствии с настоящим раскрытием.
В конкретном варианте осуществления любого из способов по настоящему изобретению клетка-хозяин является клеткой T. reesei, хорошо известного нитчатого гриба. Примеры штаммов T. reesei включают № 13631 в ATCC, № 26921 в ATCC, № 56764 в ATCC, № 56765 в ATCC, № 56767 в ATCC и № 15709 в NRRL. Один пример клетки-хозяина получен из штамма RL-P37 T. reesei (описанного в Sheir-Neiss et al. (1984) Appl. Microbiol. Biotechnology 20:46-53). Другая клетка-хозяин представляет собой штамм Morph 1.1 (pyr+) T. reesei, спонтанный ревертант по pyr4 штамма RL-P37 T. reesei с делецией в четырех генах (описанного в патентной публикации по PCT WO 05/001036). Другие штаммы-хозяева, сходные с RL-P37, включают штамм RUT-C30 (№ 56765 в ATCC) и штамм QM9414 (№ 26921 в ATCC) T. reesei (longibrachiatum).
В определенных вариантах осуществления штамм-хозяин может подвергаться манипуляции с генами при помощи генной инженерии, классического мутагенеза или путем образования гибридов существующих штаммов. Генную инженерию можно применять для введения экзогенных генов или нокаута или нокдауна эндогенных генов. Мутагенез можно применять для подавления или нокаута эндогенных генов или, в некоторых клетках-хозяевах, изменения или усиления функции эндогенных генов. Примеры включают мутантов, характеризующихся сверхсинтезом, описанных, например, Bower и соавт. в патентной публикации по PCT WO2008/153903. Примеры также включают штаммы-хозяева, в которых различные нативные гены грибных клеток-хозяев были инактивированы. Инактивацию генов можно осуществлять при помощи полной или частичной делеции, при помощи инактивации вставкой или при помощи любых других способов, которые делают ген нефункциональным в отношении его предназначения (так что экспрессия функционального белка с помощью данного гена предотвращается). Примеры способов инактивации генов можно найти, например, в патентах США №№ 5246853 и 5475101 и в патентной публикации по PCT WO 92/06209. У некоторых хозяев можно инактивировать один или несколько генов, кодирующих целлюлолитические ферменты, такие как эндоглюканазы (EG) и экзоцеллобиогидролазы (CBH) (например, cbh1, cbh2, egl1 или egl2). Например, в патенте США № 5650322 раскрыты штаммы, являющиеся производными RL-P37, с делециями как в гене cbh1, так и в гене cbh2. В конкретном примере “делеция в четырех генах” cbh1, cbh2, egl1 и egl2 описана в патенте США № 5847276 и в патентной публикации по PCT WO 05/001036. В еще одном дополнительном примере определенные клетки-хозяева можно подвергать манипуляциям таким образом, что они становятся штаммами с дефицитом или отсутствием протеаз, так что риск распада белков, представляющих интерес, экспрессируемых такими штаммами, снижается или уменьшается.
Как указано, способы по настоящему изобретению, такие как методы, описанные в EP658621 или патентной публикации по PCT WO2008065200, не требуют дополнения культуры клеток-хозяев экзогенной ДНКазой. Однако, хотя этого и не требуется, но можно применять клетки-хозяева, в которых одна или несколько экзогенных ДНКаз экспрессируется рекомбинантным путем, при условии, что активность ДНКаз, используемая в способе, не является преимущественно активностью экзогенной ДНКазы (ДНКаз). В некоторых таких клетках-хозяевах экзогенная ДНКаза не экспрессируется в активной форме (например, она экспрессируется в тельцах-включениях) или экспрессируется лишь незначительно. В некоторых таких клетках-хозяевах экзогенная ДНКаза не характеризуется внеклеточной секрецией (например, не имеет сигнального пептида). Если в культуральном бульоне или другом белковом препарате находится какая-либо экзогенная ДНКаза, то вклад такой экзогенной ДНКазы в распад ДНК хозяина составляет не более 49% (например, не более 49%, не более 45%, не более 40%, не более 35%, не более 30%, не более 25%, не более 20%, не более 15%, не более 10% или не более 5%) общей активности ДНКазы. Это можно продемонстрировать, показывая, что в условиях температуры и pH, применяемых в анализе (например, pH 7,0 при температуре 40°C), время, затрачиваемое на понижение содержания эндогенной ДНК до невыявляемого уровня, повышается не более чем на 49% (например, не более чем на 49%, не более чем на 45%, не более чем на 40%, не более чем на 35%, не более чем на 30%, не более чем на 25%, не более чем на 20%, не более чем на 15%, не более чем на 10% или не более чем на 5%) и предпочтительно повышается менее чем на 25% или 10% при отсутствии экзогенной ДНКазы (ДНКаз) по сравнению с таковым в случае ее (их) присутствия. Другими словами, за распад ДНК клетки-хозяина (например, T. reesei, A. niger, A. tubingensis, A. oryzae, G. emersonii, M. thermophila, P. funiculosum, F. venenatum, H. insolens и т.д.) в культуральном бульоне или другом белковом препарате преимущественно отвечает активность эндогенной ДНКазы.
Штамм-хозяин можно применять для экспрессии и предпочтительно секреции одного или нескольких эндогенных или экзогенных ферментов или комбинации эндогенных и экзогенных ферментов. Некоторые примеры типов ферментов, которые могут характеризоваться эндогенной или экзогенной экспрессией, включают амилолитические ферменты, протеолитические ферменты, ферменты целлюлазы, ферменты оксидоредуктазы и ферменты, разрушающие клеточную стенку растений. Более конкретно, такие ферменты включают амилазы, протеазы, ксиланазы, липазы, лакказы, фенолоксидазы, оксидазы, кутиназы, целлюлазы, гемицеллюлазы, эстеразы, пероксидазы, каталазы, глюкозооксидазы, фитазы, пектиназы, глюкозидазы, изомеразы, трансферазы, галактозидазы и хитиназы.
Альтернативно или дополнительно, штамм-хозяин можно сконструировать для экспрессии и предпочтительно секреции гормонов, ферментов, факторов роста, цитокинов, антител и т.п. Некоторые примеры гормонов, которые могут экспрессироваться, включают фолликулостимулирующий гормон, лютеинизирующий гормон, кортикотропин-высвобождающий фактор, соматостатин, гонадотропный гормон, вазопрессин, окситоцин, эритропоэтин, инсулин и т.п.
Факторы роста представляют собой белки, связывающиеся с рецепторами на поверхности клетки, преимущественно обусловливающие активацию пролиферации и/или дифференцировки клеток. Некоторые примеры экспрессируемых факторов роста включают тромбоцитарный фактор роста, эпидермальный фактор роста, фактор роста нервов, факторы роста фибробластов, инсулиноподобные факторы роста, трансформирующие факторы роста и т.п.
Цитокины представляют собой особое семейство факторов роста. Секретируемые преимущественно лейкоцитами, цитокины стимулируют как гуморальный, так и клеточный иммунные ответы, а также активацию фагоцитарных клеток. Некоторые примеры экспрессируемых цитокинов включают колониестимулирующие факторы, интерлейкины (IL-1 α и β, IL-2 - IL-13) и интерфероны (α, β и γ).
Клетки-хозяева также можно сконструировать для экспрессии антител. Человеческие, гуманизированные, химерные или венированные антитела являются предпочтительными. Антитела могут быть любого класса и изотипа, т.е. G1, 2, 3 и 4 и A, M, E или D.
В определенных вариантах осуществления сегмент нуклеиновой кислоты, кодирующий экзогенный белок, клонируют в вектор экспрессии. Сегмент нуклеиновой кислоты, кодирующий экзогенный белок, можно разместить в функциональной связи с сигнальным пептидом, придающим способность к секреции, или его можно разместить в функциональной связи с промотором и в некоторых случаях с другими регуляторными последовательностями для надлежащей экспрессии. Вектор экспрессии, кодирующий полипептид, можно вводить в клетку-хозяина путем трансфекции или трансформации при помощи стандартных методик, описанных, например, в Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory Press. Нуклеиновую кислоту также можно переносить в клетки посредством вектора на основе ретровируса (см., например, Ferry et al. (1991) Proc. Natl. Acad. Sci., USA, 88: 8377-8381; и Kay et al. (1992) Human Gene Therapy 3: 641-647), вектора на основе аденовируса (см., например, Rosenfeld (1992) Cell 68: 143-155; и Herz and Gerard (1993) Proc. Natl. Acad. Sci., USA, 90:2812-2816), рецепторно-опосредованного внедрения ДНК (см., например, Wu, and Wu (1988) J. Biol. Chem. 263:14621; Wilson et al. (1992) J. Biol. Chem. 267: 963-967; и патент США № 5166320), прямой инъекции ДНК (см., например, Acsadi et al. (1991) Nature 332: 815-818 и Wolff et al. (1990) Science 247:1465-1468) или бомбардировки частицами (биобаллистического способа) (см., например, Cheng et al. (1993) Proc. Natl. Acad. Sci., USA, 90:4455-4459; Zelenin et al. (1993) FEBS Letts. 315: 29-32).
Можно применять как эписомные, так и интегрирующие векторы экспрессии. Для идентификации интегрантов, полученных с помощью интегрирующего вектора, ген, содержащий селектируемый маркер (например, устойчивости к лекарственным средствам), вводят в клетки-хозяева вместе с нуклеиновой кислотой, представляющей интерес. Примеры селектируемых маркеров включают маркеры, придающие устойчивость к определенным лекарственным средствам, таким как G418 и гигромицин. Селектируемые маркеры и нуклеиновую кислоту, представляющую интерес, можно вводить в отдельных векторах или в одном и том же векторе. Трансфицированные клетки-хозяева можно затем идентифицировать путем селекции клеток при помощи селектируемого маркера. Например, если селектируемый маркер кодирует ген, придающий устойчивость к неомицину, клетки-хозяева, в которые поместили нуклеиновую кислоту, можно идентифицировать по их росту в присутствии G418. Клетки, в которые внедрили селектируемый маркерный ген, выживут, тогда как остальные клетки погибнут.
После экспрессии полипептид можно очистить в соответствии с традиционными методами, включая аффинную очистку, осаждение при помощи сульфата аммония, ионообменную хроматографию или гель-электрофорез (см. в общем R. Scopes (1982) Protein Purification, Springer-Verlag, N.Y.; Deutscher (1990) Methods in Enzymology Vol. 182:Guide to Protein Purification, Academic Press, Inc. N.Y.). Альтернативно, полипептид после экспрессии можно подвергать минимальным манипуляциям или не подвергать таковым, так что его применяют в композиции, по существу аналогичной культуральному бульону, в котором содержатся клетки-хозяева, экспрессирующие его.
III. Культивирование клетки-хозяина, являющейся клеткой нитчатого гриба
Желаемые белки, такие как ферменты целлюлазы, кормовые ферменты или другие ферменты, могут вырабатываться клетками нитчатых грибов-хозяев (например, T. reesei, A. niger, A. tubingensis, A. oryzae, G. emersonii, M. thermophila, P. funiculosum, F. venenatum, H. insolens и т.д.) в условиях твердофазного или глубинного культивирования, в том числе с помощью способов периодического культивирования, культивирования с подпиткой и культивирования в непрерывном потоке. Культивирование с подпиткой широко применяют в связи с легкостью его контроля, получением постоянного количества продуктов и наиболее экономически выгодным применением всего оборудования.
Культивирование (иногда называемое ферментацией) можно производить в жидкой (например, в водной) среде или в твердой среде, и способ по настоящему изобретению применим к обеим. Культивирование в определенных типичных вариантах осуществления осуществляют в бульоне, содержащем водную среду с минеральными солями, органические факторы роста, материал, являющийся источником углерода или энергии, усваиваемый азот, молекулярный кислород и стартовый инокулят используемых видов грибов-хозяев. Минеральные среды в подходящем случае содержат определенное количество фосфора, магния, кальция, калия, серы и/или натрия в растворимых усваиваемых ионных и комбинированных формах, а также предпочтительно содержат следовые элементы, такие как медь, марганец, молибден, цинк, железо, бор и/или йод и другие, также в подходящей растворимой усвояемой форме. Минеральные питательные вещества могут способствовать должному росту микроорганизмов, максимизируя усвоение источника углерода и энергии клетками в ходе процесса микробной конверсии и обеспечивая достижение максимальных показателей урожая клеток.
Источником усвояемого азота может быть любое азотсодержащее соединение или соединения, способные высвобождать азот в форме, подходящей для утилизации микроорганизмом в ходе метаболизма. Хотя можно использовать разнообразные органические соединения, являющиеся источниками азота, такие как гидролизаты белков, обычно можно использовать недорогие азотсодержащие соединения, такие как аммиак, гидроксид аммония, мочевина или различные соли аммония, такие как фосфат аммония, сульфат аммония, пирофосфат аммония, хлорид аммония или различные другие соединения аммония. Газообразный аммиак сам по себе удобен для крупномасштабных операций, и его пузырьки можно пропускать через водный ферментационный раствор (ферментационную среду) в подходящем количестве. Аммиак также может содействовать регуляции pH.
Культивирование представляет собой аэробный способ, как правило, сопряженный с участием молекулярного кислорода, подаваемого в газе, содержащем молекулярный кислород, таком как воздух, воздух, обогащенный кислородом, или даже практически чистый молекулярный кислород, предоставляемого для поддержания содержимого ферментационного чана в условиях подходящего парциального давления кислорода, эффективного в содействии бурному росту видов микроорганизмов. По существу, при применении кислородсодержащего углеводородного субстрата потребность в кислороде для роста микроорганизмов снижается. Тем не менее, молекулярный кислород подают для роста, поскольку усвоение субстрата и соответствующий рост микроорганизмов отчасти представляют собой процесс окисления.
Хотя скорость аэрации может варьировать в пределах значительного диапазона, аэрацию, как правило, проводят при скорости, находящейся в диапазоне от около 0,5 до 10, предпочтительно от около 0,5 до 7 объемов (при используемом давлении и при 25°C) кислородсодержащего газа на объем жидкости в ферментере в минуту. Это количество основано на количестве воздуха с обычным содержанием кислорода, подаваемом в реактор, и в перерасчете на чистый кислород соответствующие диапазоны будут составлять от около 0,1 до 1,7 или предпочтительно от около 0,1 до 1,3 объема (при используемом давлении и при 25°C) кислорода на объем жидкости в ферментере в минуту.
Давление для ферментации также может варьировать в широком диапазоне. Значения давления обычно находятся в пределах диапазона от около 0 до 50 фунт/кв.дюйм изб., предпочтительно от около 0 до 30 фунт/кв.дюйм изб., более предпочтительно на уровне, по меньшей мере незначительно превышающем атмосферное давление, поскольку в этом случае можно достичь баланса между затратами на оборудование и эксплуатацию и растворимостью кислорода. Давление, превышающее атмосферное, является предпочтительным для повышения концентрации растворенного кислорода, что, в свою очередь, может оказать помощь в повышения темпа роста клеток. При более высоком давлении, однако, повышаются затраты на оборудование и эксплуатацию.
Температура ферментации может в некоторой степени варьировать. Например, для T. reesei температура, как правило, находится в пределах диапазона от около 20°C до около 40°C, как правило, предпочтительно в диапазоне от около 25°C до около 34°C. Предпочтительная температура ферментации для T. reesei находится в пределах диапазона от около 27°C до около 30°C.
Диапазон pH в водном растворе для микробиологической ферментации (ферментационной смеси) может, например, представлять собой диапазон от около 2,0 до около 8,0. Для нитчатых грибов pH обычно находится в диапазоне от около 2,5 до около 8,0; например, для T. reesei pH обычно находится в диапазоне от около 3,0 до около 7,0. Предпочтительный диапазон pH для T. reesei представляет собой диапазон от около 3,5 до около 5,0.
Хотя среднее время удержания ферментационной смеси в ферментере может в значительной степен