Способ лечения алкогольной кардиомиопатии
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к кардиологии, и может быть использовано для лечения алкогольной кардиомиопатии. Способ включает введение метаболитотропного кардиопротектора, в качестве которого (S)-2,6-диаминогексановой кислоты 3-метил 1,2,4-триазолил-5-тиоацетат в дозе 100 мг/кг в сутки в течение 30 дней. Использование изобретения позволяет повысить терапевтическую эффективность за счет кардиопротекторной активности и низкой токсичности (S)-2,6-диаминогексановой кислоты 3-метил 1,2,4-триазолил-5-тиоацета. 2 табл., 1 пр.
Реферат
Изобретение относится к медицине и может быть использовано в кардиологической, терапевтической и наркологической практике при комплексной терапии алкогольной кардиомиопатии (АКМП), сопровождающейся оксидативным стрессом, дискоординацией тиол-дисульфидной системы, нарушениями гистоструктуры миокарда, гибелью кардиомиоцитов и формированием сердечной недостаточности.
Актуальность разработки новых, более совершенных способов лечения алкогольной кардиомиопатии определяется тем, что круг лиц, злоупотребляющих алкоголем, остается достаточно широким и не имеет тенденций к уменьшению. Так, в странах постсоветского пространства, в том числе, и в Украине, потребление этанола превышает аналогичные показатели стран Евросоюза на 50%. Хроническая алкогольная интоксикация вызывает поражение практически всех органов и функциональных систем организма, что обусловило появление в последнее время термина «алкогольная болезнь». Показано, что смертность алкоголиков-мужчин в 4,1, а женщин в 7,7 раз выше, чем смертность среди остального населения. Средний возраст умерших, злоупотреблявших алкоголем, составляет 46 лет. Среди висцеральных проявлений алкоголизма поражения сердечно-сосудистой системы занимают одно из ведущих мест, и в 30% случаев являются непосредственной причиной смерти. В настоящее время работами многочисленных авторов установлена четкая взаимосвязь между злоупотреблением алкоголем и патологическими изменениями сердечной мышцы, детально описаны специфические морфологические изменения миокарда, которые характеризуют алкогольную кардиомиопатию как самостоятельную нозологическую единицу. Сейчас комплекс мероприятий, направленных на лечение больных с алкогольной кардиомиопатией, сводится к прекращению потребления алкоголя, проведению симптоматической и общеукрепляющей терапии. Однако при этом обнаруживается несовершенство существующих концепций лекарственной терапии структурно-функциональных нарушений миокарда на фоне хронической алкогольной интоксикации, что обусловливает актуальность поиска и разработки новых, более эффективных способов лечения этой патологии с использованием современной высокоэффективной фармакотерапии.
Известен способ лечения алкогольной кардиомиопатии путем введения крысам 2-фенил-3-карбетокси-4-диметиламинометил-5-оксибензофурана гидрохлорида (винборон) в дозе 5 мг/кг массы тела внутримышечно 2 раза в сутки в течение 14 дней (патент Украины №63731, МПК A61K 31/135 (2006.01), дата публикации 15.01.2004, бюл. №1).
Однако при таком способе лечения неудачен выбор винборона, т.к. он относится к бензофуранам, является местноанестезирующим, антиаритмическим и спазмолитическим средством и не может обладать метаболитотропными свойствами ('https://vapteke.com.ua/drugs/vinboron_borschagovskyy-cpp.php). Кроме того, разработчики предлагают курс лечения 14 дней, что недостаточно для такой патологии сердечно-сосудистой системы. Также не вполне приемлемым видится внутримышечный путь введения при 14-суточном курсе лечения, т.к. на 5-7 сутки в месте инъекции возникают инфильтраты, воспаление и т.д.
Известно использование кверцитина в лечении АКМП (Ахмад, Ель Аараж. впливу кверцетину з на показники тварин за умов нейрогенного ушкодження [Текст] / Ель Аараж Ахмад, I.А. Зупанець, О.О. Тарасенко // Укр. журн. . та лаб. медицини: науково-медичний журнал. - 2012. - Т. 7, N 3. - С. 210-214). Мы считаем неудачным выбор такой лекарственной комбинации для проведения метаболитотропной кардиопротекции, т.к кверцетин - это антиоксидант прямого типа действия, тормозящий конечные процессы оксидативного стресса, и воздействующий только на свободно-радикальные повреждения миокарда (Антиоксиданты: клинико-фармакологические аспекты / Чекман И.С., Беленичев И.Ф., Бухтиярова Н.В. и др. // Укр. мед. часопис. - 2014. - №3. - С. 1-7). Глюкозамин проявляет противовоспалительные свойства, что не позволяет заподозрить у него кардиопротективное действие в условиях АКМП.
В настоящее время применение в комплексной терапии алкогольной кардиомиопатии нашел метаболитотропный кардиопротектор милдронат, который, являясь структурным аналогом естественного метаболита, участвующего в окислительно-восстановительных процессах, оказывает стимулирующее действие на энергетические и синтетические процессы в клетке при гипоксии и токсическом поражении (Попов В.В. Новый подход к моделированию алкогольной кардиомиопатии и влияние мидроната на восстановление структурных повреждений сердечной мышцы: Автореф. дисс. к. мед. н. - Ростов-на-Дону, 1990. - 17 с.). Согласно этому исследованию, милдронат применялся по 50 мг/кг в течение 30 суток после 90 дневной алкоголизации крыс, что способствовало уменьшению степени дистрофических процессов в миокарде.
Известно исследование «Изучение влияния алкоголя и милдроната на сердечно-сосудистую деятельность в условиях высокогорья» (Захаров Г.А., Петров В.М., Горохова Г.И., Улумбекова С.А. // Вестник Российско-Кыргызского славянского университета. - 2013. - Т. 13, №6. - С. 135-138). Данные исследования показали клиническую неэффективность милдроната при АКМП.
Милдронат как метаболитотропный кардиопротектор рекомендуют использовать при алкогольной кардиомиопатии по 500 мг внутривенно 2 раза в день, затем перорально по 250 мг 4 раза в день в течение месяца (Верткин А. Коморбидный пациент. Руководство для практических врачей. - Litres, 2016. - 140 с.).
Этот способ мы считаем прототипом.
Общим существенным признаком прототипа и заявляемого способа является назначение для лечения алкогольной кардиомиопатии метаболитотропного кардиопротектора.
Однако в реальной клинической практике при назначении милдроната не всегда удается достичь адекватного клинического эффекта вследствие того, что милдронат не является препаратом строго направленного действия при алкогольной кардиомиопатии, он не в полной мере влияет на интимные механизмы повреждающего действия этилового алкоголя на миокард.
Терапия по способу-прототипу оказывает определенный метаболитотропный кардиопротективный эффект при АКМП, однако он оказывается слабее, чем при лечении по заявляемому способу.
В основу изобретения поставлена задача усовершенствования способа лечения алкогольной кардиомиопатии путем введения в схему лечения лекарственного средства, содержащего как действующее вещество (S)-2,6-диаминогексановой кислоты 3-метил-1,2,4-триазолил-5-тиоацетат, которое, влияя непосредственно на механизмы повреждающего действия алкоголя на миокард, обладает выраженным метаболитотропным кардиопротективным действием и имеет низкую токсичность, что обеспечит повышение эффективности лечения.
Поставленная задача решается тем, что в способе лечения алкогольной кардиомиопатии путем назначения метаболитотропного кардиопротектора, новым является то, что в качестве метаболитотропного кардиопротектора назначают лекарственное средство, содержащее как активное вещество - (S)-2,6-диаминогексановой кислоты 3-метил-1,2,4-триазолил-5-тиоацетат в дозе по 100 мг/кг в сутки в течение 30 дней.
Причинно-следственная связь между совокупностью заявляемых признаков и техническим результатом заключается в следующем.
Несмотря на то что алкогольная кардиомиопатия четко описана и с 1996 г. рассматривается ВОЗ в рамках дилатационной кардиомиопатии, и, согласно МКБ, выделена в отдельную нозологическую форму (I42.6), существуют определенные трудности в практической постановке данного диагноза и создании специфических схем лечения данной патологии. Эффективные схемы лечения АКМП с учетом повреждающих механизмов воздействия алкоголя на сердце на сегодняшний день не разработаны.
АКМП относится ко вторичным токсическим дилатационным кардиомиопатиям (ДКМП). По оценкам разных авторов, в 2-36% ДКМП имеет алкогольную этиологию, в этом случае ее следует рассматривать в рамках АКМП. Особенностью формирования АКМП, в отличие от других кардиомиопатий, является алкоголь-зависимое повреждение митохондрий миокарда, что делает митохондрию источником активных форм кислорода и проапоптических белков, и на фоне ухудшения энергообразования (снижение АТФ), наблюдается активация оксидативного стресса, апоптоза. Кроме того, выделяют еще несколько звеньев кардиодеструктивного действия этанола - прямое токсическое действие ацетальдегида и этанола на синтез белка, срыв сопряжения между возбуждением и сокращением, нарушение липидного обмена и формирование жировой дистрофии, дисбаланс катехоламинов и других гормонов, ионный дисбаланс, воздействие на цитоскелет, активация провирусов, изменение процессов возбуждения и проведения в сердечной мышце (Aberle N. et al. Experimental Assessment of the Role of Acetaldehyde in Alcoholic Cardiomyopathy // Biol. Proced. Online. 2003; 5:1-12). Освещенные выше механизмы, реализуя свое пагубное действие на сердце, приводят, в конечном итоге, к развитию сердечной недостаточности. Принципиально важным процессом является ремоделирование сердца. Это понятие включает в себя нарушение структуры сократительного аппарата кардиомиоцитов, их функциональную асимметрию, изменение межклеточных взаимодействий, интерстициальный фиброз, деспирализацию хода мышечных пучков и изменение формы полостей сердца (Драпкина, О. Проблема алкогольной кардиомиопатии / О. Драпкина, Я. Ашихмин, В. Ивашкин // Врач. - 2005. - №8. - С. 48-50).
Исходя из этого, на фоне базовой терапии, включающей в себя бета-адреноблокаторы, ингибиторы АПФ, блокаторы кальциевых каналов, антиагреганты, особого внимания должна заслуживать метаболитотропная терапия. Метаболитотропная терапия при АКМП, в отличие от таковой при ХСН, должна быть направлена на сохранение структурно-функциональных особенностей митохондрий миокарда, т.е. нести в себе элементы митопротекции. Комплексная метаболитотропная кардиопротекция при АКМП должна восстанавливать метаболические алкоголь-зависимые сдвиги в биохимическом континууме кардиомиоцитов так, чтобы каждый предыдущий лекарственный ингредиент создавал субстраты для действия последующего медикамента.
Кроме того, считается перспективным использование в лечении АКМП в качестве кардиопротекторов первой линии препаратов, переключающих метаболизм миокарда с использованием жирных кислот на аэробный распад глюкозы (как более эффективный путь), ингибируя митохондриальную кетоацил-СоА-тиолазу, а также нормализующих цикл Кребса, регулирующих митохондриально-цитозольные компенсаторные шунты энергии (в частности, малат-аспартатный).
И в этом отношении наш интерес вызвало производное 1,2,4-триазолил-5-тиона - (S)-2,6-диаминогексановой кислоты 3-метил-1,2,4-триазолил-5-тиоацетат (условное название Ангиолин), которое проявляет кардиопротективное действие при экспериментальном инфаркте миокарда и нейропротективное, метаболитотропное, эндотелиопротективное действие при ишемии головного мозга и хронической алкогольной интоксикации (патент Украины №106867 «Способ коррекции неврологических нарушений при хронической алкогольной интоксикации», опубл. 10.10.2014, бюл. №19; патент Украины №86668 «Лизиний 3-метил-1,2,4-триазолил-5-тиоацетат», опубл. 12.05.2009, бюл. №9), однако его действие как метаболитотропного кардиопротектора при АКМП до сегодняшнего дня не было известно и не исследовалось.
В ходе экспериментальных исследований нами были получены данные о метаболитотропном кардиопротективном действии Ангиолина при алкогольной кардиомиопатии, которое направлено на улучшение гистоструктуры миокарда, торможение оксидативного стресса и нормализацию тиол-дисульфидной системы миокарда, сохранение структурно-функциональных особенностей митохондрий миокарда (митопротекция), т.е. действии, непосредственно положительно влияющем на патогенетические механизмы развития алкогольной кардиомиопатии.
Ниже мы приводим данные, которые это подтверждают.
Пример.
В данных исследованиях экспериментальным путем была определена оптимальная доза Ангиолина при пероральном введении, которая составляет 100 мг/кг. Исходя из этого, при проведении нижеописанных экспериментов мы использовали указанную дозу.
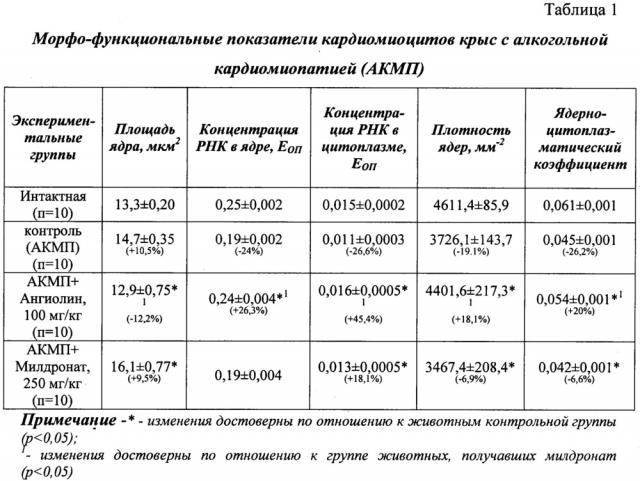
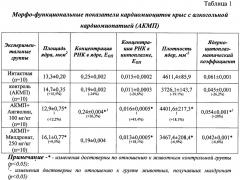
В эксперименте использовали 40 белых беспородных белых крыс-самцов массой 170-180 г, полученных из питомника Института фармакологи и токсикологии АМН Украины. Алкогольную кардиомиопатию вызывали внутрижелудочным введением с помощью металлического зонда 25% раствора этанола в дозе 6 г/кг в течение 90 суток. После прекращения введения животным алкоголя вводили внутрижелудочно в течение 30 суток Ангиолин в дозе 100 мг/кг и референт-препарат Милдронат в дозе 250 мг/кг. По окончании экспериментальной терапии животных выводили из эксперимента под тиопентал-натриевым наркозом (40 мг/кг), и у них извлекалось сердце. Верхушечную часть сердца помещали в фиксатор Карнуа на 24 часа. После стандартной процедуры обезвоживания ткани и ее пропитки хлороформом и парафином, миокард заливали в парапласт (MkCormick, США). На ротационном микроскопе Microm-325 (Microm Corp., Германия) готовили серийные гистологические срезы толщиной 5 мкм. Для изучения морфофункционального состояния миокарда и ядер эндотелиоцитов гистологические срезы депарафинировали по стандартной методике и окрашивали галоцианин-хромовыми квасцами по Эйнарсону для специфического выявления РНК. Морфометрический анализ кардиомиоцитов проводили на микроскопе Axioskop (Ziess, Germany) при помощи видеокамеры COHU - 4922 (USA) и вводили в систему цифрового анализа изображения VIDAS - 386 (Kontron Elektronic, Germany). Определяли следующие показатели: площадь ядер кардиомиоцитов (мкм2); концентрацию РНК в ядрах кардиомиоцитов в единицах оптической плотности (ЕОП); концентрацию РНК в цитоплазме кардиомиоцитов в единицах оптической плотности (ЕОП); плотность ядер кардиомиоцитов как показатель количества ядер клеток на 1 мм2 площади ткани миокарда; ядерно-цитоплазматический коэффициент как показатель суммарной площади ядер кардиомиоцитов на 1 мм2 площади ткани миокарда.
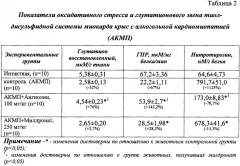
Для биохимических исследований сердце промывали охлажденным раствором 0,15 М KCl (4°С) 1:10, а затем измельчали в жидком азоте до порошкообразного состояния и перемешивали в 10-кратном объеме среды при (2°С), содержащей (в ммолях): сахарозы - 250, трис-HCl-буфера - 20, ЭДТА - 1 (рН 7,4). При температуре +4°С методом дифференциального центрифугирования на рефрижераторной центрифуге Sigma 3-30k (Германия) выделяли цитозольную фракцию. В цитозоле определяли маркер оксидативного стресса нитротирозин, а также показатели системы глутатионового звена тиол-дисульфидной системы миокарда - глутатион восстановленный и активность глутатионпероксидазы (ГПР).
Как видно из данных, представленных в таблице 1, у крыс с АКМП отмечалось достоверное снижение ядерно-цитоплазматического коэффициента на 26,2% и плотности ядер на 19,1% по сравнению с интактными животными, что отражает наличие у них патологической гипертрофии миокарда, апоптоза и гибели кардиомиоцитов. Также наблюдалось повышение площади ядер кардиомиоцитов на 10,5% с параллельным уменьшением в концентрации РНК - в ядрах на 24% и в цитоплазме кардиомиоцитов на 26,6%. Принимая во внимание важную роль РНК в процессе синтеза структурных и ферментных белков клеток, становится очевидной возможность подавления протеинсинтетической функции кардиомиоцитов в условиях алкогольной кардиомиопатии. Таким образом, морфологические изменения кардиомиоцитов у крыс с АКМП характеризуются снижением плотности ядер кардиомиоцитов, повышением их площади, снижением концентрации ядерной и цитоплазматической РНК и низким ядерно-цитоплазматическим коэффициентом по сравнению с интактными животными, т.е. характеризуются признаками патологической гипертрофии миокарда. Введение Ангиолина в дозе 100 мг/кг в течение 30 суток после 3-месячного введения этанола оказывало и кардиопротективное действие - приводило к достоверному, по сравнению с группой контроля, увеличению плотности ядер кардиомиоцитов на 18,1% (это свидетельствует о кардиопротективном действии препарата), повышению на 26,3% концентрации РНК в ядрах кардиомиоцитов и повышению на 45,4% концентрации РНК в цитоплазме кардиомиоцитов (свидетельствует о повышении трансляционных процессов в кардиомиоцитах и стимуляции протеинсинтеза). Введение Ангиолина приводило к нормализации площади кардиомиоцитов (снижение этого показателя по сравнению с контролем на 12,2%), что свидетельствовало о снижении гипертрофии миокарда. Ангиолин в дозе 100 мг/кг достоверно на 20% повышал ядерно-цитоплазматический индекс миокарда крыс с АКМП, что указывает на наличие антигипертрофического эффекта данного препарата. Курсовое введение Милдроната в дозе 250 мг/кг приводило к большему, по сравнению с группой контроля, снижению плотности ядер кардиомиоцитов (на 6,9%) и уменьшению ядерно-цитоплазматического коэффициента на 6,6% на фоне увеличения площади ядер кардиомиоцитов на 9,5%. Выявленные данные свидетельствуют о том, что Милдронат не только не оказывал влияние на признаки патологической гипертрофии миокарда при алкогольной кардиомиопатии, но и усугублял алкогольное поражение сердца. Введение Милдроната приводило к достоверному повышению РНК в цитоплазме кардиомиоцитов на 18%, не влияя на этот показатель в ядрах. По силе кардиопротективного эффекта Ангиолин достоверно превосходит референс-препарат Милдронат (250 мг/кг) по всем показателям морфо-функциональной характеристики миокарда в условиях АКМП.
Как видно из данных, представленных в таблице 2, моделирование алкогольной кардиомиопатии (АКМП) приводит к резкому всплеску свободно-радикальных реакций оксидативного стресса на фоне угнетения антиоксидантной (тиол-дисульфидной) системы. Так, в миокарде животных с АКМП наблюдали снижение уровня восстановленного глутатиона в 2 раза на фоне снижения активности глутатион-зависимого фермента ГПР в 3 раза, параллельно регистрировали значительное повышение в миокарде маркера оксидативного стресса - нитротирозина в 12 раз. Курсовое введение Ангиолина животным с АКМП приводило к торможению оксидативного стресса в миокарде, о чем свидетельствовало снижение нитротирозина на 78,1%. Параллельно в миокарде животных с АКМП, получавших Ангиолин, регистрировали повышение интермедиатов глутатионового звена тиол-дисульфидной системы - увеличение концентрации восстановленного глутатиона на 76% и повышение активности ГПР на 143,2%. Курсовое назначение животным с АКМП Милдроната не оказывало достоверного влияния на уровень восстановленного глутатиона, не оказывало выраженного влияния на повышение активности ГПР (+28,3%) и на снижение содержания нитротирозина (-14,3%) в миокарде. Ангиолин достоверно превосходит Милдронат по влиянию на такие показатели, как повышение содержания восстановленного глутатиона, активность ГПР и снижение уровня нитротирозина.
Молекулярно-биохимические механизмы развития алкогольной кардиомиопатии имеют свои особенности, поэтому препараты, которые являются достаточно эффективными при разных других видах кардиомиопатий, могут быть малоэффективными при АКМП. Метаболитотропная кардиопротективная активность Ангиолина направлена на устранение структурных и молекулярно-биохимических нарушений при алкогольном поражении миокарда, это было неочевидно для специалиста, и было выявлено в результате проведенных нами экспериментальных исследований. Такой эффект Ангиолина оказался выше в сравнении с известными препаратами, в частности, по сравнению с референс-препаратом Милдронатом. На основании вышеизложенного мы можем считать, что наш способ является новым, имеет изобретательский уровень и может быть с высокой эффективностью использован в лечении алкогольной кардиомиопатии.
Способ лечения алкогольной кардиомиопатии путем назначения метаболитотропного кардиопротектора, отличающийся тем, что в качестве метаболитотропного кардиопротектора назначают лекарственное средство, содержащее как активное вещество (S)-2,6-диаминогексановой кислоты 3-метил-1,2,4-триазолил-5-тиоацетат в дозе по 100 мг/кг в сутки в течение 30 дней.