Способ профилактики и лечения опасных нейровирусных инфекций
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к экспериментальной фармакологии, вирусологии и неврологии, и предназначено для лечения опасных нейровирусных инфекций в эксперименте. Для лечения опасных нейровирусных инфекций мышам вводят препарат Моликсан® в одноразовой дозе 20,0 мг/кг массы тела сразу после заражения и через 24, 48, 72 часа. Использование изобретения позволяет повысить эффективность борьбы с заболеваниями, вызываемыми возбудителями опасных нейровирусных инфекций. 6 табл.
Реферат
Изобретение относится к медицине, в частности к экспериментальной фармакологии, вирусологии и неврологии, и направлено на раннее этиотропное лечение вирусных инфекций центральной нервной системы и может быть использовано для лечения опасных нейровирусных инфекций.
Инфекционные заболевания продолжают оставаться одной из заметных проблем современной медицины. Особое значение имеют опасные инфекционные заболевания, а среди последних - вирусные инфекции с преимущественным поражением центральной нервной системы, к числу которых отнесены геморрагические лихорадки, энцефалиты и энцефаломиелиты и др. [Руководство по военной микробиологии / Под общ. ред. П.И. Мельниченко [и др.]. - М.: Военное издательство, 2005. - 511 с.; Руководство по организации и проведению санитарно-противоэпидемических (профилактических) и лечебно-эвакуационных мероприятий в войсках (силах) в условиях применения противником биологического оружия. - М.: Военное издательство, 2003. - 176 с.].
Вспышки этих инфекций регистрируют, прежде всего, в развивающихся странах с нестабильной социально-экономической обстановкой [Спирин А.С. Современная биология и биологическая безопасность / А.С. Спирин // Человек. - 1998. - №5. - С. 5-11; CBR Threats: A case study / K.Cuneo [et al.] // Crisis Res.J. -2005. - Vol. 1, №3. - P.50-52; VienPoint: Terrorism and dispelling the myth of a panic prone public / B. Sheppard [et al.] // J.Public Health Policy. - 2006. - Vol. 27, №3. - P. 219-245.]. Для развитых стран, включая Россию, упомянутые инфекции также не потеряли на сегодняшний день своей актуальности, о чем свидетельствуют:
- периодическая активизация на их территории природных очагов инфекций (геморрагическая лихорадка с почечным синдромом, Конго-крымская геморрагическая лихорадка, клещевой энцефалит и др.);
- периодические вспышки лихорадки Западного Нила, птичьего гриппа, Калифорнийского энцефалита, Японского энцефалита, лихорадки Сахалин, лихорадки Иссык-Куль и др. [Биотерроризм: национальная и глобальная угроза / Г.Г. Онищенко и др. // Вестн. Рос. Акад. Наук. - 2003. - Т. 73, №3. - С. 194-204].
Анализ современного состояния санитарно-эпидемиологической обстановки показывает, что в некоторых сопредельных с территорией Российской Федерацией странах сохраняется эпидемически неблагополучная ситуация по целому ряду инфекционных заболеваний. При этом наибольшую угрозу представляют особо опасные вирусные инфекции (далее - ООВИ), к числу которых следует отнести лихорадку долины Рифт (ЛДР), Венесуэльский энцефаломиелит лошадей (ВЭЛ), клещевой энцефалит (КЭ)
В настоящее время сохраняется высокая вероятность применения опасных инфекций центральной нервной системы вирусной природы в качестве потенциальных агентов биотерроризма, в том числе и против России. По мнению отечественных и зарубежных специалистов приоритет среди этих агентов будет отдаваться нетрадиционным в генетическом отношении возбудителям, против которых известные средства профилактики и лечения могут оказаться не эффективными [Биотерроризм: национальная и глобальная угроза / Г.Г. Онищенко и др. // Вестн. Рос. Акад. Наук. - 2003. - Т. 73, №3. - С. 194-204].
Известен способ противовирусной терапии с использованием иммуномодулирующих лекарственных средств на основе индукторов интерферона (патент США 4314061, МКИ C07D 413/14). Данное средство также обладает определенным профилактическим и лечебным эффектом, и его используют растворенным в воде, на мазевой основе или в других фармацевтически приемлемых носителях.
Известен способ лечения клещевого энцефалита, включающий введение в организм препарата альфа 2b интерферона человека, когда в качестве препарата альфа 2b интерферона человека используют «Реаферон-ЕС-Липинт», полученный включением рекомбинантного альфа-2b интерферона в липосомы, который вводят в организм перорально два раза в сутки за 30 мин до еды в дозе 500000 ME: (Патент на изобретение (RU №2473364 МПК А61Р 31/12, A61K 38/21)
Известен способ лечения клещевого энцефалита с использованием комплексной терапии, включающей противовирусные, дезинтоксикационные и дегидратирующие средства и дополнительно назначают введение даларгина ( Патент на изобретение RU №2167671, МПК А61Р 31/12, A61K 38/21).
Известен способ лечения клещевого энцефалита и болезни Паймера с использованием циклоферона (Стандарты оказания медицинской помощи больным клещевым энцефалитом и болезнью Паймера. Приказ Министерства Здравоохранения и Социального развития РФ №85 от 15.03.2007 года).
Целью изобретения является повышение эффективности борьбы с заболеваниями, вызываемыми возбудителями опасных нейровирусных инфекций, а также расширение арсенала средств для лечения опасных нейровирусных инфекций.
Цель достигается тем, что для лечения опасных нейровирусных инфекций назначают синтетический низкомолекулярный пептидный иммуномодулятор, причем в качестве препарата используют Моликсан® в одноразовой дозе 20,0 мг/кг массы тела сразу после заражения далее - через 24, 48, 72 часа после заражения.
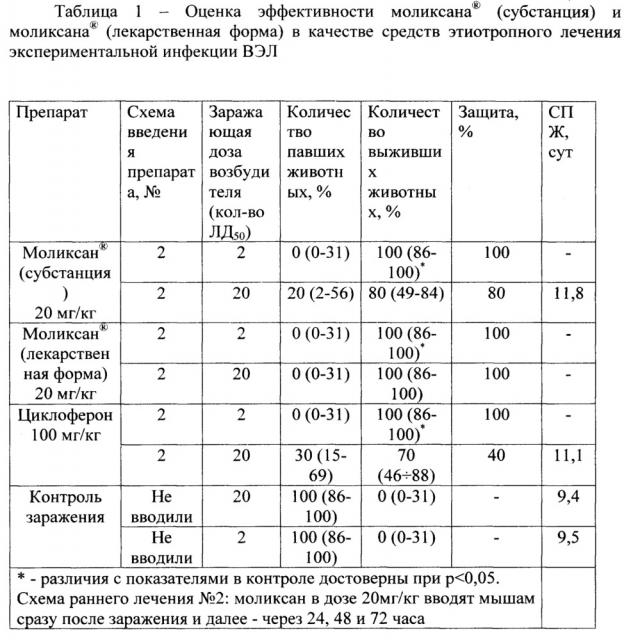
В таблице 1 представлена оценка эффективности моликсана® (субстанция) и моликсана® (лекарственная форма) в качестве средства этиотропного лечения экспериментальной инфекции вируса венесуэльского энцефалита лошадей (ВЭЛ).
В таблице 2 представлена сравнительная оценка эффективности моликсана® и циклоферона в качестве средств этиотропного лечения экспериментального клещевого энцефалита
В таблице 3 показана эффективность лекарственной формы препарата моликсан® в качестве средства этиотропного лечения экспериментальной герпесвирусной инфекции, вызванной вирусом герпеса простого (ВГП) 1 типа.
В таблице 4 осуществлена сравнительная оценка эффективности препаратов моликсан® и циклоферон, использованных в качестве средства этиотропного лечения экспериментальной герпесвирусной инфекции, вызванной ВГП 2 типа.
В таблице 5 проведена сравнительная оценка противовирусной эффективности фармакологического препарата моликсан® и циклоферона в качестве средств этиотропного лечения экспериментальной инфекции ЛДР.
В таблице 6 представлена сравнительная оценка противовирусной эффективности фармакологического препарата моликсан® и циклоферона в качестве средств этиотропного лечения экспериментальной инфекции, вызванной вирусом лихорадки Западного Нила (ЛЗН).
Способ реализуется следующим образом: для лечения опасных нейровирусных инфекций назначают синтетический низкомолекулярный пептидный иммуномодулятор, причем в качестве препарата используют моликсан® в одноразовой дозе 20,0 мг/кг массы тела сразу после заражения и далее - через 24, 48 и 72 часа после заражения.
Моликсан® представляет собой органическую соль, включающую инозин (пуриновая компонента) и глицил-цистеинил-глутамат динатрия (пептидная компонента) в соотношении 1:1. Моликсан® регулирует тиол-дисульфидный обмен гепатоцитов, индуцирует экспрессию ферментов первой и второй фаз детоксикации ксенобиотиков, подавляет репликацию ДНК и РНК вирусов, вызывающих гепатиты В и С, стимулирует продукцию интерферонов макрофагами печени, интерлейкина-2 Т-лимфоцитами. Цитопротекторная и иммуномодулирующая активности пептидной и пуриновой компонент препарата моликсан® приводят к ингибированию цитолиза гепатоцитов, разрешению воспалительного процесса при токсических и вирусных поражениях клеток печени. Пептидная и пуриновая компоненты препарата моликсан® опосредованно влияют на метаболизм, процессы пролиферации, дифференцировки и апоптоза клеток печени, способствуя восстановлению нормальной структуры печеночной ткани. Препарат обладает иммуномодулирующим, противовирусным и гепатопротекторным действием [Справочник «Видаль». Лекарственные препараты в России: Справочник. М: АстраФармСервис. - 2012. - Б-770 с.] Препарат может быть использован для профилактики и лечения химиолучевых стоматитов при химиолучевой терапии рака орофарингеальной области. (Патент на изобретение RU №2519164, МПК А61К 38/04)
Приводим конкретный пример реализации способа.
Животным, подвергнутым воздействию вирусов, вызывающих развитие особо опасной нейроинфекции, - сразу после заражения или одновременно с заражением, через 24 ч, 48 ч и 72 ч после заражения (схема - раннего этиотропного лечения) вводится синтетический низкомолекулярный гексапептид - фармакопейный препарат моликсан®. Применение изучаемого фармсредства способствовало 80-100% выживаемости экспериментальных животных при заражающей дозе вирусов равной, соответственно, 2 ЛД50-20 ЛД50. Такого рода данные свидетельствуют о достаточно высокой противовирусной активности фармакологического средства моликсан®.
В доступных иточниках информации сведений о возможности применение препарата моликсан® в качестве средства раннего этиотропного лечения нейровирусных инфекционных заболеваний нами не обнаружено.
Новая функция моликсан® а не вытекает с очевидностью из его известных свойств и состава. Активность препарата моликсан® в опытах in vivo против нескольких вирусов, вызывающих гепатиты В и С, не означает то, что препарат непременно будет обладать и активностью против вирусов обозначенных нейровирусных инфекций. Отсутствие подобной зависимости подтверждается литературными данными [Справочник Видаль, 2015].
Для доказательства соответствия заявляемого способа критерию изобретения «промышленная применимость» была проведена серия исследований.
В качестве средства этиотропного лечения (ЭЛ) инфекционных заболеваний вирусной этиологии апробированы:
- Моликсан® - лекарственная форма (раствор для внутривенного и внутримышечного введения) (Санкт-Петербург) (сер. 01012011, срок годн. до 02.2013 г.);
- циклоферон - фармакопейный препарат в инъекционной форме производства ООО «НТФФ Полисан» (Санкт-Петербург).
Исследуемый препарат вводили подкожно в объеме 0,5 мл в разовой дозе 20 мг/кг массы тела мышей по схеме:
- сразу после заражения и далее - через 24 ч, 48 ч и 72 ч после заражения.
Препарат сравнения - циклоферон вводили мышам подкожно в объеме 0,5 мл в разовой дозе 100мг/кг по такой же схеме.
Для моделирования опасных инфекционных заболеваний (ОИЗ) использованы вирулентные и вакцинные штаммы возбудителей: венесуэльского энцефаломиелита лошадей; клещевого энцефалита; герпеса простого 1 и 2 типа; лихорадки долины Рифт; лихорадки Западного Нила.
Исследования по оценке эффективности препарата моликсан® выполнены на белых неинбредных мышах-самцах массой 18-20 г.
В исследования брали животных, в обязательном порядке выдержавших карантин в течение 2 недель в клинике экспериментальных биологических моделей НИИЦ (МБЗ) ФГУ «ГосНИИИ ВМ Минобороны России».
Показатель токсичности (ЛД50) исследуемых соединений определяли по методу Кербера в модификации И.П. Ашмарина и А.А. Воробьева [И.П. Ашмарин, А.А. Воробьев Статистические методы в микробиологических методах. - Л. Гос. Изд-во мед. Лит. - 1962. - 178 с.]
Эффективность изучаемых препаратов определяли по сопоставлению величин показателей выживаемости животных в подопытных (получавших соответствующие препараты) и контрольных группах. Процент выживших животных в подопытных и контрольных группах определяли по таблицам Генеса B.C. [Генес B.C. Некоторые простые методы кибернетической обработки данных диагностических и физиологических исследований.- М.: Наука. - 1967. - 208 с.]. При этом наблюдение за инфицированными животными проводили в течение 14-21 сут, ежедневно регистрируя число живых и павших в подопытных и контрольных группах, а также среднюю продолжительность жизни (СПЖ, суток) подопытных и контрольных животных. Среднюю продолжительность жизни Т суток инфицированных животных вычисляли по формуле:
Где N - количество выживших животных, гол;
S - срок наблюдения, сут;
N1 - количество зараженных мышей в группе, гол
Статистический анализ результатов исследования произведен с помощью компьютерной программы статистической обработки данных Statistica 6.0 for Windows. Для оценки количественных показателей определяют стандартные количественные характеристики: среднее значение показателя (М), среднеквадратичное отклонение, стандартная ошибка средней величины (m). Сравнение количественных данных проводят при помощи парного и непарного теста Стьюдента с использованием t-критерия Стьюдента. Результаты представлены как М±m. Различия считают достоверными при р≤0,05.
Нами была оценена эффективность препарата моликсан®(субстанция) и моликсан® (лекарственная форма) при лечении экспериментальной инфекции, вызванной вирусом венесуэльского энцефалита лошадей (ВЭЛ). Вирус венесуэльского энцефалита лошадей - патогенный штамм Тринидад. Накопление вируссодержащего материала для последующего заражения лабораторных животных осуществляли с использованием 9-11 дневных развивающихся куриных эмбрионов - 30-50 шт. Первоначально готовили пять последовательных десятикратных разведений вируссодержащей суспензии. По 0,2 мл каждого разведения вируссодержащей суспензии вносили в аллантоисную полость развивающихся куриных эмбрионов. Место инъекции вируссодержащей суспензии покрывали расплавленным парафином. Затем развивающиеся куриные эмбрионы помещали в термостат при температуре (37±0,5)°С на 18 ч, периодически оценивая их жизнеспособность с помощью овоскопа. По истечении времени инкубации в термостате оценивали жизнеспособность развивающихся куриных эмбрионов и из «тушек» живых эмбрионов готовили 10% суспензию вируссодержащего материала с использованием физиологического раствора с добавлением антибиотиков (пенициллин из расчета 100 ЕД на 1 мл, стрептомицин - 200 ЕД на 1 мл). Полученную суспензию центрифугировали в течение 10 мин при 1,5-2,0 тыс. об./мин и температуре плюс (3±0,5)°С. Надосадочную жидкость разливали во флаконы объемом 1,0 мл и использовали для дальнейшего заражения экспериментальных животных мышей. Исходный титр вируса 107-108 ЛД50/мл
Моделирование смертельной инфекции ВЭЛ проводили на белых беспородных мышах массой 18-20 г путем их подкожного заражения вируссодержащим материалом в объеме 0,3 мл. Использовали две заражающие дозы возбудителя, вызывавшие в контроле гибель 57-100% инфицированных животных. После заражения за мышами устанавливали ежедневное наблюдение в течение 21 суток с регистрацией количества живых и павших особей, Инкубационный период моделируемой инфекции составляет в среднем 5 суток.
Заболевание характеризуется следующими признаками: мыши становятся малоподвижными, отказываются от еды и питья, шерсть у них взъерошена. В последующем развиваются и нарастают явления энцефалита (нарушение координации, появление парезов и параличей), и наступает гибель инфицированных животных. Максимальная гибель мышей отмечается, как правило, на 7-9 день после заражения.
Заражение экспериментальных животных осуществляли вирусом ВЭЛ в дозах 2 или 20 ЛД50. Численность животных в подопытных и контрольных группах - по 10 особей. Полученные результаты представлены в таблице 1.
«Оценка эффективности моликсана® (субстанция) и моликсана® (лекарственная форма) в качестве средств этиотропного лечения экспериментальной инфекции ВЭЛ»
Представленные в таблице 1 данные свидетельствуют, что наибольшим защитным эффектом обладает препарат моликсан® - уровень защиты 80 и 60% при заражении возбудителем в дозе 20 ЛД50. Этот препарат обеспечивает достаточно высокий уровень защиты при заражении наиболее высокими дозами вируса ВЭЛ. Препарат циклоферон - проявляет менее выраженную активность в отношении экспериментального ВЭЛ.
Кроме того полученные данные свидетельствуют о том, что субстанция и лекарственная форма препарата моликсан® по формируемому при их введении в организм животных лечебному эффекту в отношении экспериментальной инфекции ВЭЛ идентичны. Так, в случае применения по схеме 2 (сразу после заражения и далее через 24 ч, 48 ч и 72 ч после заражения) при исследований можно заключить, что по лечебная активность в отношении экспериментальной инфекции ВЭЛ моликсан® превышает эффект препарата сравнения циклоферона.
Нами была оценена эффективность препарата моликсан® в качестве средства раннего этиотропного лечения при экспериментальном клещевом энцефалите - вирус клещевого энцефалита (КЭ), - патогенный штамм Абсетаров. Накопление вируссодержащего материала для заражения лабораторных животных проводили на мышах-сосунках. Первоначально готовили пять последовательных десятикратных разведений вируссодержащего материала, которым служил центрифугат 10% суспензии мозга зараженных ранее мышей или регидратированный из лиофильного состояния вируссодержащий материал. По 0,02 мл каждого разведения вводили в мозг мышам-сосункам, за которыми устанавливали наблюдение в течение 24-48 ч, по окончании которого животных подвергали эвтаназии, извлекали головной мозг и депонировали его по три образца в пенициллиновые флаконы, которые хранили в морозильной камере при температуре минус (20±0,5)°С. В дальнейшем, 10% суспензию головного мозга использовали в качестве вируссодержащего материала. Исходный титр вируса 102-103 ЛД50/мл;
Моделирование смертельной инфекции КЭ проводили на белых беспородных мышах массой 18-20 г путем подкожного заражения их вируссодержащим материалом в объеме 0,3 мл. Использовали две заражающие дозы возбудителя, вызывающие в контроле гибель около 100% инфицированных животных (в зависимости от использованной заражающей дозы вируса)
После заражения за мышами устанавливают ежедневное наблюдение в течение 21 суток с регистрацией количества живых и павших особей. Инкубационный период моделируемой инфекции составляет в среднем 5 суток.
Заболевание характеризуется следующими признаками: мыши становятся малоподвижными, отказываются от еды и питья, шерсть у них взъерошена. В последующем развиваются и нарастают явления энцефалита (нарушение координации, появление парезов и параличей), и наступает гибель инфицированных животных. Максимальная гибель мышей отмечается, как правило, на 7-9 день после заражения.
Результаты исследований приведены в таблице 2. «Сравнительная оценка эффективности моликсана® и циклоферона в качестве средств раннего этиотропного лечения экспериментального клещевого энцефалита»
Как следует из представленных данных, исследуемые препараты (моликсан и циклоферон) при применении у животных, инфицированных возбудителем в дозе 2 ЛД50, проявляли практически одинаковую защитную эффективность, обеспечивая 100% выживаемость инфицированных мышей на фоне их 100% летальности в контроле. В то же время, если препараты применяли у животных, инфицированных возбудителем в дозе 20 ЛД50, то в этих условиях моликсан® оказался более эффективным, чем препарат сравнения - циклоферон. Так, если от применения последнего (циклоферона) вне зависимости от схемы введения выживаемость животных составила 50% на фоне 100% летальности в контроле, то при применении моликсана® аналогичный показатель возрастал до 100%.
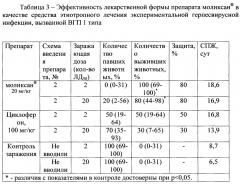
Была осуществлена оценка эффективности лекарственной формы препарата моликсан® в качестве средства раннего этиотропного лечения экспериментальной герпесвирусной инфекции, вызванной ВГП 1 типа
Для моделирования герпетической инфекции - использовали вирус герпеса простого (ВГП) 1 типа, штамм УС, исходный титр вируса 102-103 ЛД50/мл или ВГП 2 типа, штамм ВН, исходный титр вируса 102-103 ЛД50/мл.
Для внутримозгового накопления модельного вируса, а также определения инфекционной активности вируссодержащего материала использовали мышей-сосунков. Накопление ВГП-1 проводили посредством интрацеребрального заражения мышей-сосунков. Инфекционную активность вируссодержащих материалов определяли по методу Рида-Менча титрованием на мышах-сосунках. Величину LD50 применительно к каждому возбудителю определяли на белых беспородных мышах с расчетом этого критерия по методу Кербера в модификации И.П. Ашмарина и А.А.Воробьева.
Моделирование герпетической инфекции осуществляли путем внутрибрюшинного введения белым беспородным мышам суспензии вируса герпеса простого 1 и 2 типа (ВГП 1 типа или ВГП 2 типа) в объеме 0,5 мл. За 2 ч перед заражением животным в целях понижения естественной резистентности внутримышечно вводили 0,2 мл гидрокортизона. Численность опытных и контрольных групп составляла по 10 мышей в каждой.
Заболевание характеризуется следующими признаками: мыши становятся малоподвижными, отказываются от еды и питья, шерсть у них взъерошена. В последующем развиваются и нарастают явления энцефалита (нарушение координации, появление парезов и параличей), и наступает гибель инфицированных животных. Максимальная гибель мышей отмечается, как правило, на 5-7 день после заражения.
Представленные в таблице 3 данные об эффективности лекарственной формы препарата моликсан®, использованной в качестве средства раннего этиотропного лечения экспериментальной герпесвирусной инфекции, вызванной ВГП 1 типа). Они свидетельствуют о том, что лекарственная форма препарата моликсан®, тестируемая по вышеописанной схеме, проявила выраженное защитное действие в отношении экспериментальной герпесвирусной инфекции. Установлено, что при введении препарата по схеме 2 (раннего этиотропного лечения), в зависимости от заражающей дозы вируса (2 или 20 ЛД50) выживаемость инфицированных ВГП-1 животных составила 100% и 80%, соответственно. В ранее проведенных исследованиях с субстанцией препарата моликсан® были получены в отношении герпесвирусной инфекции аналогичные результаты.
Полученные результаты свидетельствуют, что оцениваемый препарат задерживает гибель инфицированных мышей, обеспечивает ее более плавную динамику в отличие от той, которая регистрировалась среди инфицированных мышей в контрольной группе. В последних случаях наблюдали резкий скачок в сторону снижения количества выживших животных, что приходилось на 6-7 сут после заражения.
Была осуществлена оценка эффективности лекарственной формы препарата моликсан® в качестве средства раннего этиотропного лечения экспериментальной герпесвирусной инфекции, вызванной ВГП 2 типа
Результаты исследований на экспериментальной модели герпетической инфекции, вызванной ВГП 2 типа.
Представленные в таблице 4 данные свидетельствуют о том, что как и на модели герпетической инфекции, вызванной ВГП 1 типа, в данных условиях оцениваемые препараты оказывают защитное действие в отношении экспериментальной герпесвирусной инфекции, вызванной ВГП 2 типа. При этом моликсан® оказался более эффективным, чем циклоферон. Так, если же препарат применяли по схеме раннего этиотропного лечения, то в этих условиях защитный эффект в зависимости от заражающей дозы вируса составил 50-80% на фоне 100% летальности в контроле. Использование циклоферона в аналогичных условиях практически показало, что его защитный эффект на 20-30% был ниже, чем от применения моликсан®.
Была проведена оценка эффективности препарата моликсан® при лечении экспериментальной вирусной инфекции, вызванной вирусом лихорадки долины Рифт (ЛДР).
Вирус лихорадки долины Рифт (ЛДР)-вирулентный штамм 8-87. Накопление вируссодержащго материала для заражения лабораторных животных осуществляли с использованием 3-5-дневных мышей сосунков в количестве 10-15 голов. Первоначально пять последовательных десятикратных разведений вирусодержащего материала. Вируссодержащий материал (по 0,02 мл каждого разведения) вводили в мозг мышам-сосункам, за которыми устанавливали наблюдение в течение 24-48 ч. Животных забивали эфиром, извлекали головной мозг и депонировали его по три образца в пенициллиновые флаконы, которые хранили в морозильной камере при температуре минус (20±0,5)°С. В дальнейшем 10% суспензию головного моза использовали в качестве вируссодержащего материала. Исходный титр вируса 105-106 ЛД50/мл
Моделирование смертельной инфекции ЛДР проводили на белых беспородных мышах массой 18-20 г путем их подкожного заражения вируссодержащим материалом в объеме 0,5 мл. Использовали две заражающие дозы возбудителя, вызывающие в контроле гибель около 100% инфицированных животных. После заражения за мышами устанавливали ежедневное наблюдение в течение 14 суток с регистрацией количества живых и павших особей. Инкубационный период моделируемой инфекции составил в среднем 3 суток.
Заболевание характеризуется следующими признаками: у мышей развивается адинамия, они отказывались от еды и питья, шерсть у них взъерошена. В последующем развивались и нарастали парезы, параличи, и наступала гибель инфицированных животных. Максимальная гибель мышей отмечалась, как правило, на 7-9 день после инфицирования
Препарат моликсан® применяли подкожно, в дозе 20 мг/кг массы тела мышей по схеме раннего этиотропного лечения после заражения вирусом ЛДР в диапазоне доз от 2 до 20 ЛД50. Численность животных в группе - по 10 особей. Полученные результаты представлены в таблице 5. Представленные в таблице 5 данные свидетельствуют, что наибольшим защитным эффектом обладает препарат моликсан® - защита на уровне 100% при заражении животных вирусом ЛДР в дозе 2,0-20 ЛД50. Моликсан® увеличивает СПЖ инфицированных животных на 3-4 суток по сравнению с аналогичным показателем в контроле заражения.
Кроме того полученные данные свидетельствуют о том, что наилучший протективный эффект в отношении ЛДР был получен при применении моликсана®. Вне зависимости от схемы применения препарат обеспечивал 100% защиту инфицированных мышей на фоне 100% летальности в контроле. Фармакологический препарат циклоферон (прототип) в данных условиях был, практически, в 1,5 раза менее эффективен, чем исследуемое средство.
Нами была оценена эффективность препарата моликсан® при лечении экспериментальной вирусной инфекции, вызванной вирусом лихорадки Западного Нила (ЛЗН).
Вирус лихорадки Западного Нила (ЛЗН) - патогенный штамм Нр-91. Накопление вируссодержащго материала для заражения лабораторных животных осуществляют с использованием 3-5-дневных мышей-сосунков в количестве 10-15 голов. Первоначально готовят пять последовательных десятикратных разведений вируссодержащего материала, которым служит центрифугат 10% суспензии мозга зараженных ранее мышей или регидратированный из лиофильного вируссодержащий материал. Вируссодержащий материал (по 0,02 мл каждого разведения) вводят в мозг мышам-сосункам, за которыми устанавливают наблюдение в течение 96-120 ч. Животных забивают эфиром, извлекают головной мозг и депонируют его по три образца в пенициллиновые флаконы, которые хранят в морозильной камере при температуре минус (50±0,5)°С. В дальнейшем 10% суспензию головного мозга используют в качестве вируссодержащего материала. Исходный титр вируса 103-104 ЛД50/мл.
Моделирование смертельной инфекции ЛЗН проводили на белых беспородных мышах массой 18-20 г путем их подкожного заражения вируссодержащим материалом в объеме 0,5 мл. Использовали две заражающие дозы возбудителя, вызывающие в контроле гибель 80-100% инфицированных животных. После заражения за инфицированными животными устанавливали ежедневное наблюдение в течение 14 суток с регистрацией количества живых и павших особей. Инкубационный период моделируемой инфекции составлял в среднем 3 суток.
Заболевание характеризуется следующими признаками: у мышей развивалась адинамия, они отказывались от еды и питья, шерсть у них взъерошена. В последующем развивались и нарастали парезы, параличи, и наступала гибель инфицированных животных. Максимальная гибель мышей отмечалась, как правило, на 6-9 день после инфицирования
Препарат моликсан® вводили подкожно, в дозе 20 мг/кг массы тела по схеме раннего этиотропного лечения после заражения вирусом ЛЗН в диапазоне доз от 2 до 20 ЛД50. Численность животных в группе - по 10 особей. Полученные результаты представлены в таблице 6.
Представленные в таблице 6 данные свидетельствуют, что наибольшим защитным эффектом обладает препарат моликсан® - защита на уровне 100% при заражении животных вирусом ЛЗН в дозе 2,0-20 ЛД50. Моликсан® увеличивает СПЖ инфицированных животных на 2-3 суток по сравнению с аналогичным показателем в контроле заражения.
Анализ данных таблицы 6 показал, что наилучший протективный эффект в отношении ЛЗН был получен при применении моликсана® Вне зависимости от схемы применения препарат обеспечивал 100% защиту инфицированных мышей на фоне 100% летальности в контроле. Фармакологический препарат циклоферон в данных условиях был практически в 1,5 раза менее эффективен, чем заявляемое средство.
Совокупность результатов проведенных исследований позволяет сделать заключение о том, что моликсан® следует рассматривать в качестве перспективного средства раннего этиотропного лечения вирусных заболеваний, в том числе вызываемых ООВИ. При этом у моликсана® выявлен универсализм действия. Он проявляет высокую эффективность при использовании в качестве средства раннего этиотропного лечения опасных нейровирусных инфекий.
Следует отметить практически одинаковый лечебный (протективный) эффект от применения препарата при его использовании на моделях различных по механизму развития ООВИ (энцефаломиелит, геморрагическая лихорадка, энцефалит, герпетическая инфекция). Надо полагать, что реализация действия препарата опосредуется его иммунотропными свойствами, а именно с его реставрационными способностями в отношении иммунокомпрометирующих состояний в процессе развития этих инфекций. Как известно, патогенез ООВИ сопряжен с иммунными дисфункциями, которые развиваются под влиянием либо самих возбудителей, либо, что наиболее часто, вследствие воздействия на структурные компоненты иммунной системы продуктов их жизнедеятельности. При этом имеет место дисбаланс в функционировании как иммунокомпетентных клеток и клеток системы неспецифической иммунологической резистентности, так и нарушение их секреторной активности, приводящее в конечном итоге к дисбалансу медиаторной составляющей иммунной системы. Вышеописанным изменениям многие исследователи придают ключевую роль в развитии и прогрессировании ООВИ, итогом которых является формирование общей иммунодепрессии. Поэтому нельзя в полной мере исключить действие препарата в отношении развития феномена иммунодепрессии. Кроме того, возможно также и то, что проникая через гематоэнцефалический барьер препарат способен непосредственно оказывать защитное действие на клетки-мишени ЦНС, подвергающиеся воздействию возбудителя. Однако данное обстоятельство справедливо применительно к энцефалитам и энцефаломиелитам, развитие которых в наибольшей степени сопряжено с поражением клеточных структур головного мозга.
СПОСОБ ЛЕЧЕНИЯ ОПАСНЫХ НЕЙРОВИРУСНЫХ ИНФЕКЦИЙ
Способ лечения опасных нейровирусных инфекций в эксперименте путем назначения фармакологического препарата мышам, отличающийся тем, что в качестве препарата для лечения используют Моликсан® в одноразовой дозе 20,0 мг/кг массы тела сразу после заражения и через 24, 48, 72 часа.