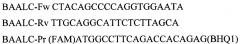Рекомбинантная плазмидная днк pal2-t-wbmag, используемая для создания днк-калибраторов при оценке эффективности терапии у пациентов с острым миелоидным лейкозом
Иллюстрации
Показать всеИзобретение относится к биотехнологии и медицине, а именно к онкогематологии. Изобретение касается рекомбинантной плазмидной ДНК. Разработана рекомбинантная плазмидная ДНК pAL2-T-WBMAG, включающая фрагменты генов WT1, BAALC, MN1, ABL1 и GUSB. Изобретение используется в качестве калибраторов при проведении ПЦР с обратной транскрипцией (ОТ-ПЦР) и детекции геноспецифических продуктов в режиме реального времени с целью сравнительной оценки экспрессии указанных генов у пациентов с острым миелоидным лейкозом (ОМЛ). Гены WT1, BAALC и MN1 выступают в качестве маркеров опухолевой прогрессии, а гены ABL1 и GUSB - в качестве нормализаторов экспрессии. Изобретение позволяет повысить точность оценки относительной экспрессии данных генов благодаря конструкции ДНК-калибраторов, совмещающих последовательности всех маркеров. Комплексный анализ генов WT1, BAALC и MN1 позволяет оценивать эффективность проводимой терапии в большинстве случаев ОМЛ, в том числе у пациентов без выявленных хромосомных аберраций. 4 ил.
Реферат
Изобретение относится к биотехнологии и медицине, а именно к онкогематологии, и касается рекомбинантной плазмидной ДНК для использования в качестве калибраторов при проведении ПЦР с обратной транскрипцией (ОТ-ПЦР) и детекцией геноспецифических продуктов в режиме реального времени с целью оценки эффективности проводимой терапии у пациентов с острым миелоидным лейкозом (ОМЛ).
Использование молекулярно-генетических методов исследования, благодаря их специфичности и чувствительности, является ключевым подходом в контроле полной излеченности пациента. Тем не менее, у половины пациентов с ОМЛ не удается идентифицировать информативный генетический маркер. Именно для этой группы пациентов внедрение альтернативных подходов контроля элиминации представляется наиболее актуальным в оценке эффективности терапии.
Гиперэкспрессия гена WT1 была обнаружена при ряде заболеваний крови опухолевой природы, в том числе и при ОМЛ. Высокая экспрессия WT1 встречается у более половины пациентов с ОМЛ и является фактором неблагоприятного прогноза заболевания и высокого риска развития рецидива [Liu-Yin, J. et al. Predictive value of minimal residual disease (MRD) monitoring by RQ-PCR in WT1 positive patients entered in the UK MRC AML-15 Trial. Blood 2008 112, 259]. Поскольку методом ОТ-ПЦР можно выявить четкие различия в уровне транскрипта WT1 в нормальных и лейкемических клетках, экспрессия WT1 является эффективным маркером в оценке минимальной остаточной болезни у пациентов при отсутствии крупных хромосомных аномалий или других мутаций, характерных для клеток опухолевого клона.
Экспрессия BAALC в зрелых клетках костного мозга и в периферической крови здоровых людей не обнаруживается. Согласно данным литературы, при ОМЛ гиперэкспрессия BAALC встречается у более 50% больных с нормальным кариотипом [Damiani D, Tiribelli М, Franzoni A et al. BAALC overexpression retains its negative prognostic role across all cytogenetic risk groups in acute myeloid leukemia patients. Am J Hematol. 2013 Oct; 88(10):848-52]. Чрезмерная экспрессия BAALC связана с низкими показателями общей выживаемости и повышенным кумулятивным риском развития рецидива заболевания в ходе терапии.
Сравнительно недавно было показано, что избыточная экспрессия MN1, независимо от вовлечения данного гена в образование химерного транскрипта, является неблагоприятным прогностическим фактором с точки зрения безрецидивной выживаемости [Heuser М, Beutel G, Krauter J, , von Neuhoff N, Schlegelberger B, Ganser A. High meningioma 1 (MN1) expression as a predictor for poor outcome in acute myeloid leukemia with normal cytogenetics. Blood. 2006; 108: 3898-3905]. Вместе с тем, было показано, что гиперэкспрессия гена MN1 является предиктором развития рецидива и коррелирует с другими показателями элиминации опухолевого клона, что косвенно указывает на возможность использования этого маркера с целью оценки ответа на противоопухолевую терапию [Carturan S et al. Variable but consistent pattern of Meningioma 1 gene (MN1) expression in different genetic subsets of acute myelogenous leukaemia and its potential use as a marker for minimal residual disease detection. Oncotarget. 2016 Sep 27].
Для перечисленных маркеров опухолевого роста подсчет абсолютных количеств копий осуществляется с использованием раздельных наборов калибраторов для анализируемого и референсного генов. Учитывая возможность неравномерной деградации плазмидной ДНК в калибраторах, существует вероятность искажения результатов исследования относительной экспрессии. Вместе с тем, при наличии вероятностных отклонений в оценке копийности плазмидной ДНК методом спетрофотометрии при создании калибраторов на основе последовательных разведений, наличие в последовательности целевого и референсного генов может повысить точность расчетов абсолютных значений относительной экспрессии генов.
Техническим результатом заявленного изобретения является создание плазмидной ДНК, содержащей три последовательности калибраторов, включающих в себя копии целевого и референсного генов, что позволяет нивелировать возникновение возможных погрешностей и оценивать эффективность проводимой терапии в большинстве случаев ОМЛ, в том числе у пациентов без выявленных хромосомных аберраций.
Указанный технический результат обеспечивается тем, что рекомбинантная плазмидная ДНК pAL2-T-WBMAG, используемая для создания ДНК-калибраторов при оценке эффективности терапии у пациентов с острым миелоидным лейкозом, содержит вставку последовательно сшитых в реакции лигирования участков кДНК генов WT1, BAALC, MN1, ABL1, GUSB, амплифицируемых в ПЦР-РВ.
Так как совокупная частота выявляемости гиперэкспрессии генов WT1, BAALC, MN1 у пациентов с ОМЛ составляет более 90%, создание унифицированной системы на основе комплексного анализа позволяет оценивать эффективность проводимой терапии практически у всех пациентов с ОМЛ. Вместе с тем, комплексная оценка нескольких опухолевых маркеров представляется целесообразной и в связи с наблюдающимся в ряде случаев изменением профиля экспрессии генов в опухолевой популяции.
Гены WT1, BAALC и MN1 выступают в качестве маркеров опухолевой прогрессии, а гены ABL1 и GUSB - в качестве нормализаторов экспрессии.
Сущность изобретения поясняется фигурами 1-4.
На фиг. 1 представлена физическая карта рекомбинантной плазмиды pAL2-T-WBMAG со следующими обозначениями: f1 origin - сайт инициации транскрипции одноцепочечного нитевидного фага f1; Т7 - ранний промотор фага Т7 для РНК-полимеразы E. coli; LacZ - ген β-галактозидазы; AmpR - ген устойчивости к антибиотику ампициллину; WT1 - последовательность участка кДНК гена WT1; BAALC - последовательность участка кДНК гена BAALC; MN1 - последовательность участка кДНК гена MN1; ABL - последовательность участка кДНК гена ABL; GUSB - последовательность участка кДНК GUSb; NotII, ClaI, EcoRI, HindIII - сайты расщепления эндонуклеазами рестрикции;
на фиг. 2 - уровни относительной экспрессии гена WT1 у здоровых доноров в костном мозге и периферической крови;
на фиг. 3 - кумулятивный риск развития рецидива в посттрансплантационном периоде на фоне гиперэкспрессии генов WT1, BAALC;
на фиг. 4 - сопоставление уровней экспрессии генов WT1, BAALC, MN1 с уровнем донорского химеризма и бластных клеток у пациента на фоне посттрансплантационного рецидива.
Рекомбинаную плазмидную ДНК pAL2-T-WBMAG, которая кодирует участки кДНК генов человека WT1, BAALC, MN1, ABL1, GUSB, получают генно-инженерным методом: путем встраивания ДНК-фрагменга, состоящего из последовательно сшитых в реакции лигирования нуклеотидных последовательностей участков кДНК генов WT1, MN1, BAALC, ABL1, GUSB, амплифицированных с использованием клинического материала пациентов и здоровых доноров, в вектор pAL2-T.
Исходным генетическим материалом для конструирования плазмиды служат следующие генно-инженерные конструкции:
- плазмидный вектор pAL2-T (Евроген, кат. номер ТА002);
- консервативный участок кДНК гена WT1, амплифицированного с кДНК, полученной в реакции обратной транскрипции из РНК, выделенной из клинического материала пациентов с ОМЛ;
- консервативный участок кДНК гена BAALC, амплифицированного с кДНК, полученной в реакции обратной транскрипции из РНК, выделенной из клинического материала пациентов с ОМЛ;
- консервативный участок кДНК гена MN1, амплифицированного с кДНК, полученной в реакции обратной транскрипции из РНК, выделенной из клинического материала пациентов с ОМЛ;
- консервативный участок кДНК гена ABL1, амплифицированного с кДНК, полученной в реакции обратной транскрипции из РНК, выделенной из клинического материала здоровых доноров;
- консервативный участок кДНК гена GUSb, амплифицированного с кДНК, полученной в реакции обратной транскрипции из РНК, выделенной из клинического материала здоровых доноров;
- синтетические олигонуклеотиды
Полученная плазмида pAL2-T-WBMAG, кодирующая участки последовательностей кДНК генов WT1, BAALC, MN1, ABL1, GUSB, имеет молекулярную массу 2,61 МДа и размер 4225 п.н. и содержит следующие элементы:
- участок плазмиды pAL2-T, размером 3009 п.н., включающий сайт инициации транскрипции одноцепочечного нитевидного фага f1, ранний промотор фага Т7 для РНК-полимеразы Е. coli, запускающий экспрессию рекомбинантного гена, ген устойчивости к ампициллину AmpR для селекции трансформированных плазмидой клеток Е. coli и лактозноый оперон, позволяющий проводить отбор трансформированных бактерий методом сине-белой селекции;
- ClaI/EcoRI фрагмент кДНК гена WT1, амплифицированного с кДНК, полученной в реакции обратной транскрипции из РНК, выделенной из клинического материала пациентов с ОМЛ;
- ClaI/EcoRI фрагмент кДНК гена BAALC, амплифицированного с кДНК, полученной в реакции обратной транскрипции из РНК, выделенной из клинического материала пациентов с ОМЛ;
- ClaI/EcoRI фрагмент кДНК гена MN1, амплифицированного с кДНК, полученной в реакции обратной транскрипции из РНК, выделенной из клинического материала пациентов с ОМЛ;
- EcoRI/HindIII фрагмент кДНК гена ABL1, амплифицированного с кДНК, полученной в реакции обратной транскрипции из РНК, выделенной из клинического материала здоровых доноров;
- EcoRI/HindIII фрагмент кДНК гена GUSb, амплифицированного с кДНК, полученной в реакции обратной транскрипции из РНК, выделенной из клинического материала здоровых доноров;
- уникальный сайт узнавания рестриктазой NotI для линеаризации плазмидной ДНК, имеющий следующие координаты - 4211.
Синтез плазмидной ДНК проводят следующим образом.
Участки кДНК, кодирующие анализируемые методом ОТ-ПЦР последовательности транскриптов, амплифицируют с помощью синтетических олигонуклеотидов, подобранных таким образом, что амплифицируемый в ОТ-ПЦР участок находится внутри клонируемого фрагмента, а на 5'-концах олигонуклеотидов находятся сайты специфического узнавания эндонуклеаз рестрикции:
ПЦР проводят в объеме 25 мкл с использованием реакционной смеси для ПЦР HF Master Mix (Dialat), содержащей высокоточную Pfu-полимеразу. Концентрация праймеров в реакционной смеси составляет 300 мМ (прямой и обратный), концентрация ионов магния 2,5 мМ, кДНК добавляют в объеме 5 мкл.
Амплифицированные последовательности подвергают электрофоретическому разделению в 1,5% агарозном геле, фрагменты ДНК, размер которых совпадает с теоретическим, вырезают из геля и очищают с помощью набора для очистки фрагментов двухцепочечной ДНК из геля Cleanup Standard (Евроген).
Полученные фрагменты амплифицируют в реакции ПЦР с помощью пар синтетических олигонуклеотидов, подбиранных таким образом, что каждый праймер одним концом комплементарен последовательности одного гена, а другим концом - гену, который будет расположен рядом с ним в генно-инженерной конструкции.
Амплификацию продуктов для клонирования осуществляют методом ПЦР. ПЦР проводят в объеме 25 мкл с использованием реакционной смеси для ПЦР HF Master Mix (Dialat), содержащей высокоточную Pfu-полимеразу. Реакционная смесь содержит праймеры в концентрации 300 мМ (прямой и обратный), ионы магния в концентрации 2,5 мМ. Очищенный из геля фрагмент ДНК добавляют в реакционную смесь в количестве 20-30 нг.
Протокол амплификации:
- первичная денатурация - 2 минуты при 98°С
- амплификационный цикл (×30)
- денатурация - 20 секунд при 98°С
- отжиг праймеров - 30 секунд при 60°С
- элонгация - 20 секунд при 72°С
- финальная элонгация - 2 минуты при 72°С.
Амплифицированные нуклеотидные последовательности подвергают электрофоретическому разделению в 1,5% агарозном геле, очищают с помощью набора для очистки фрагментов двухцепочечной ДНК из геля Cleanup Standard (Евроген) и сшивают в один фрагмент длиной 1180 п.н. с помощью набора для лигирования фрагментов ДНК NEBuilder® HiFi DNA Assembly (NEB). Для этого в одной пробирке смешивают 100 нг целевых фрагменов ДНК и 50 нг вектора pAL2-T, 10 мкл смеси NEB Master Mix и доводят дедионизованной водой до объема 20 мкл. Реакционную смесь инкубируют в течение 60 минут при 50°С и трансформируют при помощи нее химически компетентные клетки и высеивают их на агаризованную ампициллин-содержащую среду LB. Образовавшиеся через сутки колонии тестируют на предмет наличия генно-инженерной вставки с помощью метода скрининговой ПЦР с праймерами WT1_OL_F и ABL-GUSB_OL_R и секвенирования по Сенгеру с помощью универсальных плазмидных праймеров М13. Бактериальные клетки, несущие в себе вектор pAL2-T со вставкой участков кДНК генов ABL1, GUSB, WT1, MN1, BAALC, инокулируют в 0.5 л жидкой питательной среды LB, содержащей ампициллин в концентрации 100 мкг/мл, и культивируют при 37°С на шейкере в течение 8-12 часов. Затем выделяют плазмидную ДНК из массы бактериальных клеток с помощью набора для выделения плазмидной ДНК Maxiprep Purification Kit (Qiagen). Выделенную плазмидную ДНК pAL2-T-WBMAG анализируют с помощью рестрикционного анализа по сайтам NotI и HindIII, секвенируют вставки генов ABL1, GUSB, WT1, MN1, BAALC и хранят при -20°С.
Для использования в качестве ДНК-катибраторов плазмидную ДНК pAL2-T-WBMAG линеализируют по сайту узнавания рестриктазой NotI, измеряют концентрацию ДНК с помощью спектрофотометра NanoDrop, рассчитывают количество копий плазмидной ДНК по формуле:
N=(С*6.022×1023)/(L*650*1×109),
где N - количество копий ДНК в 1 мкл исходного раствора, С - концентрация плазмидной ДНК в исходном растворе (нг/мкл), L - длина плазмидной ДНК (п.н), и готовят десятичные разведения плазмидной ДНК, содержащие от 10 до 1000000 копий плазмидной ДНК в 5 микролитрах буфера.
Для амплификации участка гена BAALC используют праймеры:
Для амплификации участка гена MN1 используют олигонуклеотидные последовательности:
I
Для амплификации участка гена WT1 используют олигонуклеотидные последовательности:
Для амплификации участка гена ABL1 используют олигонуклеотидные последовательности:
Для амплификации участка гена GUSB используют олигонуклеотидные последовательности:
С использованием заявленной рекомбинантной плазмидной ДНК pAL2-T-WBMAG была проанализирована экспрессия исследуемых генов от 108 пациентов в возрасте от 2 до 60 лет (медиана - 27 лет). Период наблюдения составил в среднем 6 месяцев (от 1 до 47 месяцев). Оценка экспрессии проводилась преимущественно в посттрансплантационном периоде (19 пациентов после родственной аллогенной трансплантациии гемопоэтических стволовых клеток (аллоТГСК), 73 пациента после неродственной аллоТГСК и 16 пациентов после гаплоидентичной аллоТГСК). Помимо этого был обследован материал здоровых доноров (n=10).
Относительную экспрессию генов WT1, BAALC, и MN1 в анализируемых образцах определяли исходя из уравнений калибровочных кривых для соответствующих генов. Для этого в каждую амплификацию включали 5 последовательных убывающих десятичных разведений плазмидной ДНК известной концентрации, содержащей амплифицируемые участки анализируемых генов. Эффективность амплификации определяли как угол наклона калибровочной кривой. Для всех пар праймеров эффективность амплификации составила от 90% до 100%, коэффициент корреляции R∧2 был больше или равен 0,990.
Для оценки воспроизводимости значений порогового цикла (Ct) все анализируемые образцы с каждой парой праймеров амплифицировались в двойном повторе. В анализ включались образцы, для которых разница значений Ct между повторами была не более 0,3 цикла.
Абсолютное количество кДНК каждого гена определяли исходя из уравнения калибровочной кривой при помощи программного обеспечения iQ5 от Bio-rad. В анализ включали образцы, для которых рассчитанное относительно калибровочной кривой количество кДНК гена ABL1 превышало 10000 копий на реакцию. Уровень относительной экспрессии гена WT1,составляющий более 250 копий гена WT1 на 10000 копий гена ABL рассматривали как гиперэкспрессию маркера. Для гена BAALC под гиперэкспресией понимали выявление более 10 копий данного гена на 100 копий гена ABL, для гена MN1 - выявление более 100 копий на 100 копий гена ABL.
При оценке уровня относительной экспрессии было выявлено наличие достоверных различий в уровне экспрессии гена WT1 у здоровых доноров в костном мозге и периферической крови (фиг.2), что совпадает с результатами других исследователей [K Inoue, Н Ogawa, Т Yamagami, Т Soma, Y Tani, Т Tatekawa, Y Oji, H Tamaki, T Kyo, H Dohy, A Hiraoka, T Masaoka, T Kishimoto and H Sugiyama. Long-term follow-up of minimal residual disease in leukemia patients by monitoring WT1 (Wilms tumor gene) expression levels. Blood, 1996, 88, 2267-2278].
При анализе данных пациентов в посттрансплантационном периоде обращает на себя внимание наличие прямой корреляционной связи между уровнем экспрессии исследуемых генов и выявляемых химерных транскриптов. Для гена WT1 коэффициент корреляции (критерий Спирмена) составил 0,26 (р=0.01), а для гена BAALC - 0.27 (р=0.0001). Сопоставимые результаты были получены и при анализе корреляционной зависимости изменения количества клеток опухолевой популяции. При сопоставлении полученных данных экспрессии с результатами исследования донорского химеризма (приживления клеток донора после аллоТГСК) наблюдалась обратная зависимость, выражающаяся в обратной корреляции - коэффициент корреляции для WT1 составил -0,18 для гена WT1 (р=0.0006) и -0.21 для гена BAALC (р=0.00001).
При оценке куммулятивного риска развития рецидива после аллоТГСК были получены данные, указывающие на высокую вероятность развития рецидива заболевания на фоне гиперэкспрессии исследуемых генов (фиг.3). Нами было показано, что при наличии гиперэкспресии генов WT1 и BAALC достоверно возникает риск развития рецидива у пациентов в посттрансплантационном периоде - р=0,009 и р=0,027 соответственно.
На фиг. 4 представлены данные, указывающие на клиническую значимость оценки экспрессии гена MN1. При увеличении экспрессии данного гена также отмечалось увеличение экспрессии генов WT1 и BAALC, что сопровождалось снижением уровня донорского химеризма. Данные изменения, в свою очередь, отражали количественные значения популяции клеток опухолевого клона (количество бластных клеток).
Таким образом, изобретение позволяет повысить точность оценки относительной экспрессии данных генов благодаря конструкции ДНК-калибраторов, совмещающих последовательности всех маркеров. Комплексный анализ генов WT1, BAALC и MN1 позволяет оценивать эффективность проводимой терапии в большинстве случаев ОМЛ, в том числе у пациентов без выявленных хромосомных аберраций.
Рекомбинантная плазмидная ДНК pAL2-T-WBMAG, используемая для создания ДНК-калибраторов при оценке эффективности терапии у пациентов с острым миелоидным лейкозом, содержащая вставку последовательно сшитых в реакции лигирования участков кДНК генов WT1, BAALC, MN1, ABL1, GUSB, амплифицируемых в ПЦР-РВ,
| atgtctgaat tcgacctgca ggtcgaccat atgggagagc tcccaacgcg ttggatgcat | 60 |
| agcttgagta ttctatagtg tcacctaaat agcttggcgt aatcatggtc atagctgttt | 120 |
| cctgtgtgaa attgttatcc gctcacaatt ccacacaaca tacgagccgg aagcataaag | 180 |
| tgtaaagcct ggggtgccta atgagtgagc taactcacat taattgcgtt gcgctcactg | 240 |
| cccgctttcc agtcgggaaa cctgtcgtgc cagctgcatt aatgaatcgg ccaacgcgcg | 300 |
| gggagaggcg gtttgcgtat tgggcgctct tccgcttcct cgctcactga ctcgctgcgc | 360 |
| tcggtcgttc ggctgcggcg agcggtatca gctcactcaa aggcggtaat acggttatcc | 420 |
| acagaatcag gggataacgc aggaaagaac atgtgagcaa aaggccagca aaaggccagg | 480 |
| aaccgtaaaa aggccgcgtt gctggcgttt ttccataggc tccgcccccc tgacgagcat | 540 |
| cacaaaaatc gacgctcaag tcagaggtgg cgaaacccga caggactata aagataccag | 600 |
| gcgtttcccc ctggaagctc cctcgtgcgc tctcctgttc cgaccctgcc gcttaccgga | 660 |
| tacctgtccg cctttctccc ttcgggaagc gtggcgcttt ctcatagctc acgctgtagg | 720 |
| tatctcagtt cggtgtaggt cgttcgctcc aagctgggct gtgtgcacga accccccgtt | 780 |
| cagcccgacc gctgcgcctt atccggtaac tatcgtcttg agtccaaccc ggtaagacac | 840 |
| gacttatcgc cactggcagc agccactggt aacaggatta gcagagcgag gtatgtaggc | 900 |
| ggtgctacag agttcttgaa gtggtggcct aactacggct acactagaag aacagtattt | 960 |
| ggtatctgcg ctctgctgaa gccagttacc ttcggaaaaa gagttggtag ctcttgatcc | 1020 |
| ggcaaacaaa ccaccgctgg tagcggtggt ttttttgttt gcaagcagca gattacgcgc | 1080 |
| agaaaaaaag gatctcaaga agatcctttg atcttttcta cggggtctga cgctcagtgg | 1140 |
| aacgaaaact cacgttaagg gattttggtc atgagattat caaaaaggat cttcacctag | 1200 |
| atccttttaa attaaaaatg aagttttaaa tcaatctaaa gtatatatga gtaaacttgg | 1260 |
| tctgacagtt accaatgctt aatcagtgag gcacctatct cagcgatctg tctatttcgt | 1320 |
| tcatccatag ttgcctgact ccccgtcgtg tagataacta cgatacggga gggcttacca | 1380 |
| tctggcccca gtgctgcaat gataccgcga gacccacgct caccggctcc agatttatca | 1440 |
| gcaataaacc agccagccgg aagggccgag cgcagaagtg gtcctgcaac tttatccgcc | 1500 |
| tccatccagt ctattaattg ttgccgggaa gctagagtaa gtagttcgcc agttaatagt | 1560 |
| ttgcgcaacg ttgttgccat tgctacaggc atcgtggtgt cacgctcgtc gtttggtatg | 1620 |
| gcttcattca gctccggttc ccaacgatca aggcgagtta catgatcccc catgttgtgc | 1680 |
| aaaaaagcgg ttagctcctt cggtcctccg atcgttgtca gaagtaagtt ggccgcagtg | 1740 |
| ttatcactca tggttatggc agcactgcat aattctctta ctgtcatgcc atccgtaaga | 1800 |
| tgcttttctg tgactggtga gtactcaacc aagtcattct gagaatagtg tatgcggcga | 1860 |
| ccgagttgct cttgcccggc gtcaatacgg gataataccg cgccacatag cagaacttta | 1920 |
| aaagtgctca tcattggaaa acgttcttcg gggcgaaaac tctcaaggat cttaccgctg | 1980 |
| ttgagatcca gttcgatgta acccactcgt gcacccaact gatcttcagc atcttttact | 2040 |
| ttcaccagcg tttctgggtg agcaaaaaca ggaaggcaaa atgccgcaaa aaagggaata | 2100 |
| agggcgacac ggaaatgttg aatactcata ctcttccttt ttcaatatta ttgaagcatt | 2160 |
| tatcagggtt attgtctcat gagcggatac atatttgaat gtatttagaa aaataaacaa | 2220 |
| ataggggttc cgcgcacatt tccccgaaaa gtgccacctg atgcggtgtg aaataccgca | 2280 |
| cagatgcgta aggagaaaat accgcatcag gaaattgtaa gcgttaatat tttgttaaaa | 2340 |
| ttcgcgttaa atttttgtta aatcagctca ttttttaacc aataggccga aatcggcaaa | 2400 |
| atcccttata aatcaaaaga atagaccgag atagggttga gtgttgttcc agtttggaac | 2460 |
| aagagtccac tattaaagaa cgtggactcc aacgtcaaag ggcgaaaaac cgtctatcag | 2520 |
| ggcgatggcc cactacgtga accatcaccc taatcaagtt ttttggggtc gaggtgccgt | 2580 |
| aaagcactaa atcggaaccc taaagggagc ccccgattta gagcttgacg gggaaagccg | 2640 |
| gcgaacgtgg cgagaaagga agggaagaaa gcgaaaggag cgggcgctag ggcgctggca | 2700 |
| agtgtagcgg tcacgctgcg cgtaaccacc acacccgccg cgcttaatgc gccgctacag | 2760 |
| ggcgcgtcca ttcgccattc aggctgcgca actgttggga agggcgatcg gtgcgggcct | 2820 |
| cttcgctatt acgccagctg gcgaaagggg gatgtgctgc aaggcgatta agttgggtaa | 2880 |
| cgccagggtt ttcccagtca cgacgttgta aaacgacggc cagtgaattg taatacgact | 2940 |
| cactataggg cgaattgggc ccgacgtcgc atgctcccgg ccgccatggc ggccgcggag | 3000 |
| acatttaaaa cgacggccag tgccaatatc gattacctgc ccagctgcct cgagagccag | 3060 |
| cccgctattc gcaatcaggg ttacagcacg gtcaccttcg acgggacgcc cagctacggt | 3120 |
| cacacgccct cgcaccatgc ggcgcagttc cccaaccact cattcaagca tgaggatccc | 3180 |
| atgggccagc agggctcgct gggtgagcag cagtactcgg tggaattcaa aaatcgatac | 3240 |
| tcgggcatgc tggaagatgg actgccctcc aatggtgtgc cccgatctac agccccaggt | 3300 |
| ggaataccca acccagagaa gaagacgaac tgtgagaccc agtgcccaaa tccccagagc | 3360 |
| ctcagctcag gccctctgac ccagaaacag aatggccttc agaccacaga ggctaaaaga | 3420 |
| gatgctaaga gaatgcctgc aaaagaagtc accattaatg taacagatag catccaacag | 3480 |
| atggacagaa ggaattctaa aatcgatacc attgacctgg actcgctgat ggcagagcac | 3540 |
| agcgctgcct ggtacatgcc cgctgacaag gccctggtgg acagcgcgga cgacgacaag | 3600 |
| acgttggcgc cctgggagaa ggccaaaccc cagaacccca acagcaaaga agcccacgac | 3660 |
| ctccctgcaa acaaggcctc agcatcccag cctggcagcc acttgcagtg cctgtctgtc | 3720 |
| cactgcgaat tctaaagaat tcaggaaaac cttctcgctg gacccagtga aaatgacccc | 3780 |
| aaccttttcg ttgcactgta tgattttgtg gccagtggag ataacactct aagcataact | 3840 |
| aaaggtgaaa agctccgggt cttaggctat aatcacaatg gggaatggtg tgaagcccaa | 3900 |
| accaaaaatg gccaaggctg ggtcccaagc aactacatca cgccagtcaa cagtctggag | 3960 |
| aaacactcct ggtaccatgg gcctgtgtcc cgcaatgccg ctgagtatct taaagctttt | 4020 |
| aagcttgcag aaacgattgc agggtttcac caggatccac ctctgatgtt cactgaagag | 4080 |
| taccagaaaa gtctgctaga gcagtaccat ctgggtctgg atcaaaaacg cagaaaatac | 4140 |
| gtggttggag agctcatttg gaattttgcc gatttcatga ctgaacagtc accgacgaga | 4200 |
| gtgctcgtaa tcatggtcat agctg | 4225 |