Генетически модифицированные, не принадлежащие к человеческому роду животные и способ их использования
Иллюстрации
Показать всеНастоящее изобретение относится к генетической инженерии, в частности к генетически модифицированному иммунодефицитному грызуну, который экспрессирует полипептид M-CSF человека, полипептид IL-3 человека, полипептид GM-CSF человека, полипептид SIRPA человека и полипептид ТРО человека. Указанный грызун модифицирован таким образом, что содержит в своем геноме нуклеиновые кислоты, кодирующие человеческий M-CSF, человеческий IL-3, человеческий GM-CSF, человеческий SIRPA и человеческий ТРО, соответственно. При этом каждая из указанных нуклеиновых кислот является функционально связанной с промотором. Настоящее изобретение также раскрывает способ приживления гематопоэтической стволовой и прогениторной клетки (HSPC). Данный способ предусматривает введение HSPC генетически модифицированному иммунодефицитному грызуну согласно изобретению. Настоящее изобретение позволяет получать генетически модифицированных грызунов, демонстрирующих улучшенное приживление солидных опухолей, для использования в качестве моделей человеческой иммунной системы. 2 н. и 17 з.п. ф-лы, 17 ил., 2 пр.
Реферат
Перекрестные ссылки на родственные заявки
Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США №61/698,002, поданной 7 сентября 2012, и предварительной заявке на патент США 61/775,171, поданной 8 марта 2013, содержание каждой из которых полностью включено в настоящую заявку посредством ссылки.
Уровень техники
Целью биомедицинских исследований является улучшение понимания физиологии человека и применения этих знаний для предотвращения, лечения или исцеления болезней человека. Вследствие практических и этических барьеров проведения экспериментов на людях, многие исследования осуществляются на небольших животных моделях, например на мышах. Однако мыши не являются людьми, и знания, полученные в результате проведения экспериментов на животных, не всегда применимы к людям. В этом контексте мыши, репопулированные с помощью гемато-лимфоидной системы человека (HHLS) представляют собой удобную модель на мелком животном для исследования гематопоэза человека и иммунной фракции in vivo.
HHLS мышей получают путем пересадки гематопоэтических стволовых клеток и клеток-предшественников (прогениторных клеток) человека (HSPCs) и/или эмбриональных тканей человека мышам-реципиентам, лишенным врожденной и адаптивной ветвей иммунного ответа. Первые модели HHLS мышей были разработаны в конце 1980-х (Mosier et al., 1988, Nature 335:256-259; McCune et al., 1988, Science 241:1632-1639; Kamel-Reid и Dick, 1988, Science 242:1706-1709), и с тех пор были подвергнуты целому ряду усовершенствований (Legrand et al., 2006, Journal of Immunology 176:2053-2058; Shultz et al., 2007, Nature Reviews Immunology 7:118-130). Линии мышей, используемых в настоящее время в качестве реципиентов для приживления человеческого гематопоэтического трансплантата, имеют три общие характеристики. Во-первых, у них отсутствуют В и Т-клетки вследствие Scid мутации в гене, кодирующем PRKDC белок (Mosier et al., 1988, Nature 335:256-259; McCune et al., 1988, Science 241:1632-1639), или вследствие делеции одного из двух генов Rag (Shultz et al., 2000, Journal of immunology 164:2496-2507; Traggiai et al., 2004, Science 304:104-107). Во-вторых, делеция или мутация Il2rg гена, кодирующего общую гамма цепь (γс) рецепторов цитокинов, ликвидирует IL-15 сигнальный путь и приводит к отсутствию NK-клеток (Traggiai et al., 2004, Science 304:104-107; Ito et al. 2002, Blood 100:3175-3182). В-третьих, взаимодействие между SIRPA рецептором, экспрессированным на мышиных макрофагах, и CD47 лигандом на человеческих клетках предоставляет ингибиторный сигнал для мышиных макрофагов и обеспечивает фагоцитарную толерантность к человеческому ксенотрансплантату (Takenaka et al., 2007, Nature Immunology 8:1313-1323; Takizawa & Manz, 2007, Nature Immunology 8:1287-1289). Межвидовое взаимодействие между SIRPA, экспрессированным на мышиных клетках, и человеческим CD47 достигается при использовании генетического окружения NOD, которое содержит естественный полиморфизм в Sirpa гене (Takenaka et al., 2007, Nature Immunology 8:1313-1323; Takizawa & Manz, 2007, Nature Immunology 8:1287-1289; Legrand et al., 2011, Proc Natl Acad Sci USA 108:13224-13229), или путем ВАС-трансгенной экспрессии человеческого гена SIRPA (Strowig et al., 2011, Proc Natl Acad Sci USA 108:13218-13223). Высокие уровни приживления человеческих гематопоэтических клеток после трансплантации человеческих HSPC достигаются при использовании NOD Scid γс-/- (NOG (Ito et al. 2002, Blood 100:3175-3182) или NSG (Ishikawa et al., 2005, Blood 106:1565-1573)) или hSIRPAtg RAG2-/- γс-/- (SRG (Strowig et al., 2011, Proc Natl Acad Sci USA 108:13218-13223)) мышей в качестве реципиентов.
Хотя у этих линий-реципиентов наблюдается мультилинейное развитие человеческих гематопоэтических клеток, конечная дифференцировка, гомеостаз и/или эффекторная функция большинства человеческих типов клеток является недостаточной. Было выдвинуто предположение, что это состояние является следствием уменьшения или отсутствия перекрестной реактивности между цитокинами, секретируемыми мышиными тканями, и человеческими рецепторами, экспрессированными на гематопоэтических клетках (Manz, 2007, Immunity 26:537-541; Willinger et al., 2011, Trends in Immunology 32:321-327). С целью преодоления этого ограничения были разработаны некоторые стратегии доставки человеческих цитокинов в хозяина-мышь. Эти способы включают инъекцию рекомбинантных цитокинов (Lapidot et al., 1992, Science 255:1137-1141; van Lent et al., 2009, J. Immunol 183:7645-7655), лентивирусную доставку кДНК, кодирующей цитокин (O'Connell et al., 2010, PloS One 5(8):e12009), гидродинамическую инъекцию плазмидной ДНК (Chen et al., 2009, Proc Natl Acad Sci USA 106:21783-21788), трансгенную экспрессию кДНК (Nicolini et al., et al., 2004, Leukemia 18(2):341-347; Brehm et al., 2012, Blood 119:2778-2788; Takagi et al., 2012, Blood 119:2768-2777) или «нокин» замену генов, кодирующих цитокины (Rongvaux et al., 2011, Proc Natl Acad Sci USA 108:2378-2383; Willinger et al., 2011, Proc Natl Acad Sci USA 108:2390-2395; Rathinam et al., 2011, Blood 118:3119-3128). Последний метод имеет преимущество, заключающееся в более физиологической экспрессии человеческого гена. Кроме того, если человеческий цитокин является не полностью перекрестаореагирующим на мышином рецепторе, он может вызывать нарушение в популяциях мышиных клеток и обеспечивать дополнительное конкурентное преимущество человеческим клеткам. При использовании стратегии «нокин» замещения гена, гуманизация гена, кодирующего тромбопоэтин (Тро), приводила к лучшему сохранению функциональных человеческих гематопоэтических стволовых клеток и повышенному приживлению в костном мозге (Rongvaux et al., 2011, Proc Natl Acad Sci USA 108:2378-2383); замена генов, кодирующих интерлейкин-3 и GM-CSF (Il3 и Csf2), вызывала потерю мышиных легочных альвеолярных макрофагов (AM) и развитие функциональных человеческих AM (Willinger et al., 2011, Proc Natl Acad Sci USA 108:2390-2395); а замена Csf1 гена, кодирующего M-CSF, давала в результате повышенное количество человеческих моноцитов во многих тканях (Rathinam et al., 2011, Blood 118:3119-3128).
Гемато-лимфоидные системы человека и мыши различаются во многих аспектах (Haley, 2003, Toxicology 188:49-71; Mestas & Hughes, 2004, J Immunol 172:2731-2738). Одно из основных различий между двумя видами заключается в их лейкоцитарной формуле. Кровь человека богата миелоидными клетками, которые представляют 50-75% всех белых клеток крови (лейкоцитов). В отличие от этого в крови мыши преобладают лимфоциты и только 20-30% лейкоцитов являются клетками миелоидного ростка. Это видовое различие, функциональное и эволюционное значение которого не ясно, не воспроизводится у обыкновенных HHLS мышей, таких как NOG/NSG или SRG. Действительно, развитие миелоидных человеческих клеток, в частности, является нарушенным у этих хозяев, при этом миелоидные клетки представляют только 5-10% человеческих лейкоцитов.
Одним применением мышей с функциональными человеческими иммунными системами является создание и тестирование человеческих вакцин. Как показывает время, индукция иммунных ответов in vivo относительно неэффективна (2004, Traggiai et al., Science 304:104-107; 2002, Ito et al., Blood 100:3175-3182; 2005, Ishikawa et al., Blood 106:1565-1573; 2005, Shultz et al., J Immunol 174:6477-6489; 2006, Baenziger et al., Proc Natl Acad Sci USA 103:15951-15956). Некоторые исследования сообщали об успешных патоген-специфических иммунных ответах после инфицирования. И хотя сообщалось, что примерно у 50% мышей вырабатывался вирус-специфический IgM и IgG после заражения вирусом денге (2007, Kuruvilla et al. Virology 369:143-152), другие исследования сообщали о количестве ниже 20% мышей, продуцирующих антиген-специфический IgM и IgG после HIV и EBV инфекции (2006, Baenziger et al., Proc Natl Acad Sci USA 103:15951-15956; 2008, Yajima et al., J Infect Dis 198:673-682). После иммунизации адьювантом и антигеном переключение классов антиген-специфических иммуноглобулинов, как показывает время, также является неэффективным при наличии одной лишь фракции иммунизированных животных, демонстрирующих антиген-специфические IgG ответы (2004, Traggiai et al., Science 304:104-107; 2002, Ito et al., Blood 100:3175-3182; 2005, Ishikawa et al., Blood 106:1565-1573; 2005, Shultz et al., J Immunol 174:6477-6489; 2009, Watanabe et al., Int Immunol 21:843-858; 2010, Becker et al., PLoS ONE 5). Эти исследования включали NSG и BALB/c RAG2-/- γс-/- мышей и различные комбинации адьювант/антиген.
В данной области техники имеется потребность в гуманизированных, не принадлежащих к человеческому роду животных, способных обеспечить и поддерживать приживление человеческих гематопоэтических клеток. Настоящее изобретение направлено на эту неудовлетворенную потребность в данной области техники.
Раскрытие изобретения
В общем, данное изобретение имеет отношение к генетически модифицированным животным, не относящимся к человеческому роду, экспрессирующим, по меньшей мере, что-либо из числа человеческого M-CSF, человеческого IL-3, человеческого GM-CSF, человеческого SIRPA или человеческого ТРО, а также к способам их использования. Таким образом, в одном варианте осуществления данное изобретение представляет собой генетически модифицированное, не относящееся к человеческому роду животное, содержащее геном, содержащий, по меньшей мере, одну нуклеиновую кислоту, кодирующую, по меньшей мере, что-либо из группы, содержащей человеческий M-CSF, человеческий IL-3, человеческий GM-CSF, человеческий SIRPA и человеческий ТРО, при этом, по меньшей мере, одна нуклеиновая кислота является функционально связанной с промотором, при этом у животного экспрессируется, по меньшей мере, один полипептид, выбранный из группы, состоящей из человеческого M-CSF, человеческого IL-3, человеческого GM-CSF, человеческого SIRPA и человеческого ТРО. В другом варианте осуществления данное изобретение представляет собой генетически модифицированное, не относящееся к человеческому роду животное, содержащее геном, содержащий нуклеиновую кислоту, кодирующую человеческий M-CSF, нуклеиновую кислоту, кодирующую человеческий IL-3, нуклеиновую кислоту, кодирующую человеческий GM-CSF, нуклеиновую кислоту, кодирующую человеческий SIRPA, и нуклеиновую кислоту, кодирующую человеческий ТРО, при этом каждая из нуклеиновых кислот, кодирующая человеческий M-CSF, человеческий IL-3, человеческий GM-CSF, человеческий SIRPA и человеческий ТРО, является функционально связанной с промотором, а у животного экспресссируется человеческий M-CSF полипептид, человеческий IL-3 полипептид, человеческий GM-CSF полипептид, человеческий SIRPA полипептид и человеческий ТРО полипептид. В некоторых вариантах осуществления генетически модифицированное, не относящееся к человеческому роду животное является иммунодефицитным. В некоторых вариантах осуществления генетически модифицированное, не относящееся к человеческому роду животное не экспрессирует активирующий рекомбинацию ген 2 (Rag-2-/-). В некоторых вариантах осуществления генетически модифицированное, не относящееся к человеческому роду животное не экспрессирует гамма цепь IL2 рецептора (гамма цепь-/-). В некоторых вариантах осуществления генетически модифицированное, не относящееся к человеческому роду животное не экспрессирует Rag-2 и генетически модифицированное, не относящееся к человеческому роду животное не экспрессирует гамма цепь IL2 рецептора (Rag-2-/- гамма цепь-/-). В некоторых вариантах осуществления генетически модифицированное, не относящееся к человеческому роду животное является грызуном. В некоторых вариантах осуществления генетически модифицированное, не относящееся к человеческому роду животное является мышью. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное также содержит, по меньшей мере, одну человеческую гематопоэтическую клетку. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное также включает, по меньшей мере, одну человеческую раковую клетку. В некоторых вариантах осуществления человеческая раковая клетка является лейкемической клеткой или клеткой меланомы.
В другом варианте осуществления данное изобретение представляет собой способ приживления гематопоэтических стволовых и прогениторных клеток (HSPC) у генетически модифицированного, не относящегося к человеческому роду животного, при этом у животного экспрессируется, по меньшей мере, что-либо из группы, включающей человеческий M-CSF, человеческий IL-3, человеческий GM-CSF, человеческий SIRPA и человеческий ТРО, причем данный способ включает стадию введения, по меньшей мере, одной HSPC генетически модифицированному животному, экспрессирующему, по меньшей мере, что-либо из группы, состоящей из человеческого M-CSF, человеческого IL-3, человеческого GM-CSF, человеческого SIRPA и человеческого ТРО. В некоторых вариантах осуществления HSPC является человеческой HSPC. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное является грызуном. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное является мышью. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное является иммунодефицитным. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное не экспрессирует активирующий рекомбинацию ген 2 (Rag-2-/-). В одном варианте осуществления генетически модифицированное, иммунодефицитное, не относящееся к человеческому роду животное не экспрессирует эндогенный IL2 рецептор (гамма цепь-/-). В одном варианте осуществления генетически модифицированное, иммунодефицитное, не относящееся к человеческому роду животное не экспрессирует эндогенный Rag-2 и не экспрессирует эндогенную гамма цепь (Rag-2-/- гамма цепь-/-). В одном варианте осуществления генетически модифицированное животное содержит человеческую раковую клетку. В одном варианте осуществления человеческая раковая клетка является лейкемической клеткой или клеткой меланомы.
В другом варианте осуществления изобретением является генетически модифицированная мышь Rag-2-/- гамма цепь-/-, имеющая геном, содержащий, по меньшей мере, одну нуклеиновую кислоту, кодирующую, по меньшей мере, что-либо из группы, состоящей из человеческого M-CSF, человеческого IL-3, человеческого GM-CSF, человеческого SIRPA и человеческого ТРО, при этом, по меньшей мере, одна нуклеиновая кислота является функционально связанной, по меньшей мере, с одним промотором, причем мышь экспрессирует, по меньшей мере, один полипептид, выбранный из группы, состоящей из человеческого M-CSF, человеческого IL-3, человеческого GM-CSF, человеческого SERPA и человеческого ТРО. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное содержит геном, имеющий нуклеиновую кислоту, кодирующую человеческий M-CSF, нуклеиновую кислоту, кодирующую человеческий IL-3, нуклеиновую кислоту, кодирующую человеческий GM-CSF, нуклеиновую кислоту, кодирующую человеческий SIRPA и нуклеиновую кислоту, кодирующую человеческий ТРО, при этом каждая из нуклеиновых кислот, кодирующих человеческий M-CSF, человеческий IL-3, человеческий GM-CSF, человеческий SIRPA и человеческий ТРО, является функционально связанной с промотором, и при этом животное экспрессирует человеческий M-CSF полипептид, человеческий IL-3 полипептид, человеческий GM-CSF полипептид, человеческий SIRPA полипептид и человеческий ТРО полипептид. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное является грызуном. В одном варианте осуществления генетически модифицированное не относящееся к человеческому роду животное является мышью. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное содержит человеческую гематопоэтическую клетку. В одном варианте осуществления генетически модифицированное, не относящееся к человеческому роду животное содержит человеческую раковую клетку. В некоторых вариантах осуществления человеческая раковая клетка является лейкемической клеткой или клеткой меланомы.
Краткое описание чертежей
Следующее подробное описание предпочтительных вариантов осуществления изобретения будет более понятно после прочтения в сочетании с прилагаемыми чертежами. Для иллюстрации изобретения предпочтительные в настоящее время варианты осуществления представлены в виде чертежей. Однако следует понимать, что изобретение не ограничивается точным порядком и средствами вариантов осуществления, показанных на чертежах.
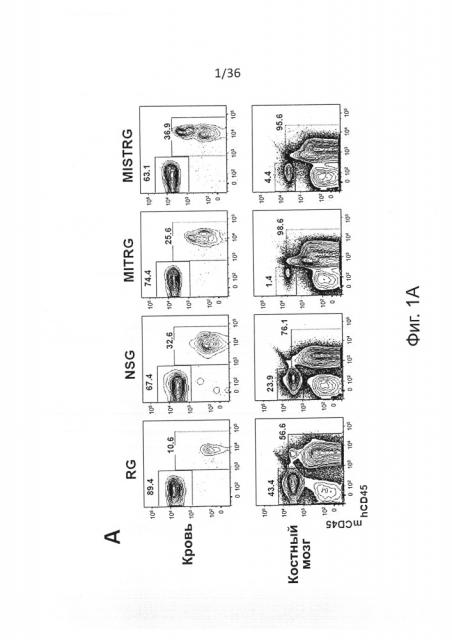
Фигура 1, включающая Фигуры 1А-1Е, показывает результаты экспериментов, демонстрирующих, что MISTRG мыши поддерживают высокие уровни приживления человеческого гематопоэтического трансплантата. Предварительно обработанным рентгеновскими лучами новорожденным мышам указанных линий было привито 100,000 (FL-)CD34+ человеческих эмбриональных клеток печени с помощью внутрипеченочной инъекции. Уровни приживления человеческого трансплантата (hCD45+ клетки) измеряли в крови через 7-9 недель, а в ВМ через 10-12 недель. (Фигура 1А) Репрезентативное исследование с помощью проточной цитометрии встречаемости мышиных и человеческих CD45+ клеток в крови и ВМ указанных реципиентных мышей. Числа рядом с областями гейтов указывают проценты от числа всех CD45+ клеток. (Фигура 1В) Представлены объединенные данные уровней приживления клеток крови (% hCD45+ клеток), полученные в 19 независимых экспериментах. В каждом эксперименте один образец FL-CD34+ клеток был отделен и введен мышам соответствующих линий. Каждый символ представляет отдельную мышь, красные планки показывают средние значения (n=56-155; ns - незначимое значение; * р<0.05 тест Тьюки (полный статистический анализ показан на Фигуре 6). Серая горизонтальная линия показывает 10% hCD45+ клеток. (Фигура 1С) Уровни приживления в ВМ репрезентативной подгруппы мышей (Фигура 6С) из панели (Фигура 6В) (n=12-16; * р<0.05 тест Тьюки; смотри также Фигуры 6D-6E). (Фигура 1D) Репрезентативное исследование с помощью проточной цитометрии приживления hCD45+ клеток в крови и ВМ через 3 месяца после внутрипеченочной инъекции 200,000 FL-CD34+ клеток необлученным новорожденным мышам MISTRG. (Фигура 1Е) Уровни приживления человеческих CD45+ клеток в крови и ВМ MISTRG мышей с пересадкой, как на Фигуре 1D (n=16). В этом случае показан ВМ всех мышей (включая мышей с hCD45+<10%).
Фигура 2, включающая Фигуры 2A-2K, показывает результаты экспериментов, демонстрирующих, что MISTRG мыши обеспечивают эффективное развитие и сохранение миелоидных клеток в лимфоидной и нелимфоидной тканях. (Фигура 2А) Процентное содержание человеческих миелоидных клеток (hCD33+) среди человеческих гематопоэтических клеток (hCD45+) в крови указанных реципиентных мышей, которым в возрасте новорожденных были пересажены FL-CD34+ клетки посредством внутрипеченочной инъекции после предварительной обработки рентгеновскими лучами. Каждый символ представляет отдельную мышь, красные планки показывают средние значения (n=20-113; статистический анализ показан на Фигуре 7А). (Фигура 2В) Композиция человеческих лейкоцитов на таких же мышах (n=20-113 мышей/группу; n=8 доноров-людей; планки погрешностей показывают стандартную ошибку среднего (ош. ср.). (Фигура 2С) Иммуногистологическое окрашивание человеческих миелоидных клеток (hCD68+) в нелимфоидных тканях указанных мышей-реципиентов. Черные планки показывают 20 мкм, и показанные изображения являются характерными, по меньшей мере, для трех проанализированных мышей на группу. (Фигура 2D и Фигура 2Е) Репрезентативное исследование с помощью проточной цитометрии (Фигура 2D) и частота встречаемости (Фигура 2Е) человеческих подгрупп моноцитов, установленных по экспрессии CD14 и CD16 среди CD45+CD33+ клеток в крови мышей-реципиентов (n=8-12 мышей/группу; планки погрешностей показывают ОШ. СР.). (Фигура 2F и Фигура 2G) Выработка цитокинов человеческими моноцитами, выделенными из ВМ MITRG реципиентов и стимулированными in vitro LPS (Фигура 2F) или R848 (Фигура 2G) (планки погрешностей показывают SD трех повторов; отражающих 3 независимых эксперимента). (Фигура 2Н) In vitro фагоцитоз GFP-экспрессирующих E.coli человеческими клетками, присутствующими в крови MITRG мышей (n=7). (Фигуры 2I, 2J, 2K) Выработка цитокинов in vivo, измеренная методом ELISA в сыворотке или с помощью ОТ-ПЦР в легких мышей, обработанных LPS (Фигура I; 90 мин, n=15-18), или инфицированных Listeria monocytogenes (Фигура 2J; день 2, n=6-15) или гриппом A/PR8 H1N1 (Фигура 2K; день 3, n=3-5). (Фигуры 2А, 2J, 2K) р-значения вычисляли с помощью однофакторного дисперсионного анализа ANOVA, а затем апостериорного теста Тьюки (* р<0.05); (Фигура 2I) р-значение вычисляли с помощью непарного критерия Стьюдента с логарифмическим (log10) преобразованием значений.
Фигура 3, включающая Фигуры 3A-3I, показывает результаты экспериментов, демонстрирующих, что MISTRG мыши эффективно обеспечивают развитие и функцию человеческих NK клеток. (Фигура 3А) Количественный ОТ-ПЦР анализ экспрессии мРНК человеческих IL-15 и IL-15Rα в печени NSG, MITRG и MISTRG мышей с пересаженными клетками (n=7-8; р-значения вычисляли с помощью однофакторного дисперсионного анализа ANOVA; *, р<0.05 апостериорный тест Тьюки). Экспрессию нормировали по отношению к мыши Hprt. (Фигура 3В) Количественный ОТ-ПЦР анализ экспрессии мРНК человеческих IL-15 и IL-15Rα в популяции человеческих клеток, очищенных из костного мозга MITRG мышей с пересаженными клетками (n=4-5, планки погрешностей указывают ОШ. СР.). Экспрессия, нормированная относительно человеческого HPRT, показана относительно hCD14+hCD16- клеток. (Фигура 3С и Фигура 3D) Репрезентативное исследование с помощью проточной цитометрии (гейтирование по hCD45+mCD45- клеткам, «канал» лимфоцитов; числа рядом с оконтуренными областями показывают проценты клеток) (Фигура 3С) и абсолютное количество или частота (Фигура 3D) человеческих NK клеток (hNKp46+hCD3-) у NSG, MITR и MISTRG мышей с пересаженными клетками (n=8-16; р-значения вычисляли с помощью однофакторного дисперсионного анализа ANOVA; *, р<0.05 апостериорный тест Тьюки). (Фигура 3Е) Абсолютное количество человеческих NK печени (hNKp46+hCD3-) и Т-клеток (hCD3+, показаны как контроль) от мышей MISTRG с пересаженными клетками, или оставленных необработанными или обработанных в течение 3 последовательных дней инкапсулированным в липосомы клодронатом для истощения фагоцитов (n=8; р-значение вычисляли с помощью непарного критерия Стьюдента; ns - незначимое значение). (Фигура 3F) Меченые LCL721.221 (HLA класс I отрицательные) и LCL721.45 (класс I положительные) клетки инъецировали i.v. в соотношении 1:1, и отношения HLA класс I положительных или отрицательных, среди меченых клеток, восстановленных спустя 12 часов в селезенке, использовали для вычисления цитотоксичности специфических NK-клеток (n=8, р-значение вычисляли с помощью непарного критерия Стьюдента). (Фигура 3G) Количественный ОТ-ПЦР анализ экспрессии мРНК человеческого IFNγ в печени NSG и MISTRG мышей через 2 дня после заражения Listeria (n=8-9, р-значение вычисляли с помощью непарного критерия Стьюдента). Экспрессию нормировали по отношению к мыши Hprt. (Фигура 3Н и Фигура 3I) Репрезентативное исследование с помощью проточной цитометрии (Фигура 3Н) и частота (Фигура 3I) IFNγ-экспрессирующих и дегранулированных (CD107a+) человеческих NK-клеток печени из неинфицированных или Listeria-инфицированных NSG и MISTRG мышей (n=4-11; р-значения вычисляли с помощью однофакторного дисперсионного анализа ANOVA). Результаты двух (Фигуры 3А, 3Е-3I), трех (Фигура 3В) или четырех (Фигуры 3С, 3D) экспериментов были объединены.
Фигура 4, включающая Фигуры 4A-4F, показывает результаты экспериментов, демонстрирующих, что человеческие миелоидные клетки в MISTRG проникают в опухоль и поддерживают рост. Клетки меланомы человека Ме290 были имплантированы в бок NSG и MISTRG мышей с пересаженными клетками или без пересадки. Некоторых мышей обработали VEGF-ингибитором Avastin™. Опухоли измеряли и извлекали для проведения исследования через 11 дней. (Фигура 4А) Инфильтрация человеческих гематопоэтических клеток в опухоль, определенная по экспрессии мРНК, кодирующей человеческие гематопоэтические (PTPRC, кодирующий CD45) и миелоидные (ITGAM, кодирующий CD11b) маркеры (n=6-7; р-значение вычисляли с помощью непарного критерия Стьюдента). (Фигура 4В и Фигура 4D) Репрезентативные иммуногистохимические изображения маркеров человеческих миелоидных клеток в опухолях от NSG, MISTRG и пациентов. (Фигура 4С) Количественная оценка плотности CD163+ клеток (n=3 образцов/группу, подсчитывали 3 слайда на образец). (Фигура 4Е и Фигура 4F) Типичные изображения (Фигура 4Е) и объем (Фигура 4F) опухолей в указанных группах мышей (n=7-24 мышей/группу), р-значения вычисляли с помощью критерия Стьюдента (Фигура 4А) или с помощью однофакторного дисперсионного анализа ANOVA (Фигуры 4С, 4Е) с последующим апостериорным тестом Тьюки (* р<0.05).
Фигура 5 показывает цитокины, вовлеченные в HSC функцию и миелоидное развитие. Схематическое изображение развития гематопоэтических стволовых клеток в миелоидные клетки и неполный перечень цитокинов, которые, как известно, регулируют этот процесс. Штриховкой указаны проценты идентичности аминокислот между человеческими и мышиными цитокинами. Процент идентичности аминокислот является самой объективной мерой консервативности белка между видами, однако, он не всегда коррелирует с функциональной межвидовой перекрестной реактивностью in vivo. Черные прямоугольники показывают цитокины, генетически гуманизированные в MISTRG. HSC - гематопоэтические стволовые клетки; МРР - мультипотентные предшественники; СМР - общий миелоидный предшественник; GMP - предшественник гранулоцита/макрофага; МЕР - предшественник мегакариоцита/эритроцита.
Фигура 6, включающая Фигуры 6А-6Е, показывает результаты статистических анализов уровней приживления у реципиентных мышей. (Фигура 6А) Статистический анализ (однофакторный дисперсионный анализ ANOVA с последующим апостериорным тестом Тьюки; ns - незначимое значение) результатов представлен на Фигуре 1А (процент hCD45+ клеток в крови мыши-реципиента). (Фигура 6В) Количество мышей-реципиентов, которые достигают уровня приживления, по меньшей мере, 10% hCD45+ клеток в крови через 7-9 недель после трансплантации. (Фигура 6С) Уровни приживления клеток крови у мышей, использованных на Фигуре 1С для анализа ВМ. (Фигура 6D) Статистический анализ, подобный анализу на Фигуре 6А, данных, представленных на Фигуре 1С (процент hCD45+ клеток в ВМ мыши-реципиента). (Фигура 6Е) Абсолютное количество hCD45+ клеток в ВМ (2 бедренных кости и 2 большеберцовых кости) мышей-реципиентов, показанных на Фигуре 1С. Уменьшенное количество клеток в ВМ MISTRG является следствием меньшего размера мышей в таком возрасте (10-12 недель после трансплантации) и является результатом первых клинических признаков анемии, описанных подробно на Фигуре 10.
Фигура 7, включающая Фигуры 7А-7Н, показывает результаты экспериментов, дающих оценку повышенному развитию человеческих миелоидных клеток у мышей MISTRG. (Фигура 7А) Статистический анализ (однофакторный дисперсионный анализ ANOVA с последующим апостериорным тестом Тьюки; ns - незначимое значение) результатов представлен на Фигуре 2А (процент hCD33+ клеток в крови мыши-реципиента). (Фигура 7В и Фигура 7С) Частота (Фигура 7В) и статистический анализ (Фигура 7С) человеческих миелоидных клеток (hCD33+) в ВМ мыши-реципиента. (Фигура 7D) Репрезентативное исследование с помощью проточной цитометриии человеческой лимфоидной и миелоидной клеточных линий в крови MISTRG. (Фигура 7Е и Фигура 7F) Репрезентативное исследование с помощью проточной цитометриии человеческих моноцитов (CD33hiSSCloCD66-) и гранулоцитов (CD33+SSChiCD66+) в ВМ (Фигура 7Е) и крови (Фигура 7F) мышей MISTRG и человека-донора. (Фигура 7G и Фигура 7Н) Абсолютное количество человеческих миелоидных клеток (hCD33+) в легких (Фигура 7G) и печени (Фигура 7Н) мышей-реципиентов (n=8-12; р-значения вычисляли с помощью однофакторного дисперсионного анализа ANOVA с последующим апостериорным тестом Тьюки, * р<0.05).
Фигура 8, включающая Фигуры 8А и 8В, показывает результаты экспериментов, демонстрирующих повышенное развитие подгрупп человеческих моноцитов у мышей MISTRG. (Фигура 8А) Репрезентативный анализ методом проточной цитометрии подгрупп человеческих моноцитов, установленных по экспрессии CD14 и CD16 среди hCD45+CD33+ клеток в ВМ, селезенке, легком и печени указанной мыши-реципиента. (Фигура 8В) Частота (планки погрешностей представляют ОШ. СР.) среди hCD33+ клеток и абсолютные количества подгрупп моноцитов в легких и печени мышей-реципиентов (n=12 мышей/группу; р-значения вычисляли с помощью однофакторного ANOVA; *, р<0.05 апостериорный тест Тьюки).
Фигура 9, включающая Фигуры 9А и 9В, показывает результаты экспериментов, демонстрирующих, что подгруппы человеческих моноцитов являются сходными у MISTRG и у людей-доноров. Расширенный иммунофенотип указанных подгрупп человеческих моноцитов в крови (Фигура 9А) и ВМ (Фигура 9В) MISTRG реципиентов и человека-донора. Показано окрашивание изотипическими контрольными антителами и специфическими антителами.
Фигура 10, включающая Фигуры 10A-10I, представляет результаты экспериментов, демонстрирующих, что человеческие миелоидные клетки нарушают фагоцитарную толерантность человек-мышь. (Фигура 10А) CFSE-меченые мышиные RBCs были пересажены указанным мышам, а частота меченых клеток была измерена в указанные моменты времени. (Фигура 10 В) MISTRG с пересаженными клетками предварительно обрабатывали или не обрабатывали клодронатом с целью истощения фагоцитов, а затем мышиные RBCs, меченые CFSE, пересаживали и контролировали, как показано на Фигуре 10А (р-значение, эффект клодроната, определенный путем повторного измерения ANOVA в течение дней 1-3). Эти результаты показывают, что пересаженные мышиные RBCs быстро устраняются in vivo фагоцитами, которые присутствуют у MISTRG, но не присутствуют у NSG. (Фигура 10С) Подсчет RBC в крови мышей без пересадки (n=9-15) или через 8-10 недель после пересадки человеческих FL-CD34+ клеток (n=11-37). р-значения показывают сравнение между мышами без пересадки и мышами с пересаженными клетками каждого генотипа (непарный t-критерий Стьюдента). (Фигура 10D) Корреляция между уровнями приживления человеческих клеток (процент hCD45+ клеток в крови) и подсчет RBC (n=13-22). (Фигура 10Е) Анализ с помощью проточной цитометрии мышиных (mTer119+) и человеческих (hCD235a+) эритроидных клеток в крови у мышей MISTRG без пересадки или с пересаженными клетками, показывающий, что почти все эритроидные клетки в крови MISTRG с пересаженными клетками являются клетками мышиного происхождения, а человеческие эритроидные клетки едва обнаружимы. (Фигура 10F) Типичные изображения и вес селезенки мышей указанных линий с пересаженными клетками (n=3-22), показывающие спленомегалию у привитых MISTRG мышей. Селезенки от мышей Balb/c использовали в качестве контроля (р-значение, однофакторный анализ ANOVA; *, р<0.05 по сравнению со всеми другими группами, апостериорный тест Тьюки). (Фигура 10G) Гистологический срез селезенки NSG и MISTRG с пересаженными клетками, окрашенный Н&Е и иллюстрирующий увеличение красной пульпы селезенки у MISTRG мышей со спленомегалией. (Фигура 10Н) Анализ с помощью проточной цитометрии мышиных эритроидных предшественников (mTer119+mCD71+), которые присутствуют почти в 80% клеток в селезенке MISTRG с пересаженными клетками. (Фигура 10I) Мазки крови MISTRG без пересадки и с пересаженными клетками иллюстрируют обогащение ретикулоцитов. Взятые в совокупности, эти результаты дают веские основания предполагать, что анемия у MISTRG происходит в результате отсутствия фагоцитарной толерантности человек-мышь, и массивный экстрамедуллярный мышиный эритропоэз не в состоянии компенсировать уничтожение mRBCs. Представлены результаты, по меньшей мере, 5 мышей, исследованных в каждой группе (Фигуры 10С, 10Е-10I), и 2 независимых экспериментов (Фигуры 10А, 10В).
Фигура 11, включающая Фигуры 11А и 11В, предоставляет результаты экспериментов, показывающих, что MISTRG мыши обеспечивают человеческий IL-15/IL-15Rα. (Фигура 11А) Количественный ОТ-ПЦР анализ экспрессии мРНК человеческих IL-15 и IL-15Rα в легких NSG, MITRG и MISTRG мышей с пересаженными клетками (n=7-8; р-значения вычисляли с помощью однофакторного дисперсионного анализа ANOVA; *, р<0.05 постериорный тест Тьюки). Экспрессия была нормирована относительно мыши Hprt. (Фигура 11В) Исследование методом проточной цитометрии экспрессии IL-15Rα на популяции человеческих клеток (hCD45+mCD45-) из крови MISTRG мышей с пересаженными клетками (n=4). Гистограммы представляют окрашивание изотипическим контролем или IL-15Rα антителом, соответственно. Объединены или представлены результаты двух экспериментов.
Фигура 12, включающая Фигуры 12А и 12В, представляет результаты экспериментов, показывающих усиленный рост человеческих NK-клеток у MISTRG мышей. (Фигура 12А и Фигура 12В) Частота (Фигура 12А) и абсолютное количество (Фигура 12 В) человеческих NK-клеток (hNKp46+hCD3-) у NSG, MITRG и MISTRG мышей с пересаженными клетками (n=8-16; р-значения вычисляли с помощью однофакторного дисперсионного анализа ANOVA; *, р<0.05 апостериорный тест Тьюки). Объединены результаты четырех экспериментов.
Фигура 13, включающая Фигуры 13A-13F, представляет результаты экспериментов, показывающих, что настоящие зрелые человеческие NK-клетки присутствуют у мышей MISTRG. (Фигура 13А) Исследование методом проточной цитометрии экспрессии CD94 и CD161 на человеческих NK-клетках крови от человека-донора и у MISTRG с пересаженными клетками (n=3). Гистограммы представляют окрашивание изотипическими контрольными Abs или CD94/CD161 Abs. (Фигура 13В) Исследование методом проточной цитометрии экспрессии KIR на человеческих NK-клетках крови от человека-донора или от MISTRG мышей с пересаженными клетками (n=3). Числа указывают частоту KIR+ клеток. (Фигура 13С и Фигура 13D) Поверхностная экспрессия CD16 на человеческих NK-клетках от NSG, MTTRG и MISTRG мышей с пересаженными клетками (n=4-8; р-значения вычисляли с помощью однофакторного дисперсионного анализа ANOVA; *, р<0.05 апостериорный тест Тьюки). (Фигура 13Е и Фигура 13F) Внутриклеточная экспрессия перфорина человеческими NK печени (hNKp46+hCD3-) и Т-клетками (hCD3+) от мышей NSG и MISTRG с пересаженными клетками (n=3; р-значения вычисляли с помощью непарного t-критерия Стьюдента). MFI - средняя интенсивность флуоресценции. Представлены или объединены результаты одного (Фигура 13А и Фигура 13В), двух (Фигура 13Е и Фигура 13F) или четырех (Фигура 13С и Фигура 13D) экспериментов.
Фигура 14 представляет результаты экспериментов, демонстрирующих эффект истощения человеческих моноцитов/макрофагов на гомеостаз человеческих NK клеток у MISTRG мышей. MISTRG мышей с пересаженными клетками оставляли необработанными или обрабатывали в течение 3 последовательных дней инкапсулированным в липосомы клодронатом с целью истощения фагоцитов. Показан проточный цитометрический анализ человеческих моноцитов/макрофагов (верхняя панель, гейтирование по hCD33+ клеткам) и NK-клеток (hNKp46+hCD3-) в печени (n=8). Представлены результаты двух экспериментов. У 1 из 8 мышей истощение клодронатом моноцитов/макрофагов было неэффективным, кроме того, у этих мышей не наблюдалось уменьшение количества NK-клеток.
Фигура 15 показывает результаты экспериментов, демонстрирующих иммуногистохимическое исследование инфильтрации человеческих миелоидных клеток в меланому. Характерное иммуногистохимическое окрашивание человеческих миелоидных клеток в опухоли из NSG, MISTRG или пациентов-людей. Представлены три субъекта на группу и 3 изображения на субъекта.
Фигура 16 показывает сравнение уровней приживления, а также развития и функции иммунных клеток у реципиентных мышей с заменой одного гена у мышей NSG, MISTRG и у людей.
Фигура 17, включающая Фигуры 17A-17D, показывает результаты экспериментов, демонстрирующих, что образцы, выделенные из пациентов с AML, CMML и MDS, могут быть приживлены мышам MISTRG. (Фигура 17А) Характеристики использованных образцов (включая тип болезни и генетическое нарушение, обнаруженное в образцах пациентов), экспериментальный протокол (способ очистки клеток, количество клеток, инъецированных одной мыши, и время после трансплантации, когда мышь исследовали) и результаты приживления (включая количество мышей с обнаружимым приживлением человеческого трансплантата, процент человеческих гематопоэтических CD45+ клеток и миелоидных CD33+ клеток, и генетическое нарушение, обнаруженное в человеческих клетках, выделенных из мышей). (Фигура 17В) Репрезентативное исследование методом проточной цитометрии зернистости (SSC) миелоидных CD33+ клеток, выделенных из мыши с трансплантированными RAEB I пациента или нормальными клетками донора, показывающее недостаточную зернистость в RAEB I образцах. (Фигура 17С) Репрезентативный fish-анализ человеческих клеток, выделенных из мышей с трансплантированным RAEB II образцом, показывающий отсутствие хромосомы 5q. (Фигура 17D) Кариотип человеческих клеток, выделенных из мышей с трансплантированным образцом CMML, который показывает делецию в хромосоме 6.
Подробное описание изобретения
В общем, изобретение имеет отношение к генетически модифицированному, не относящемуся к человеческому роду животному, экспрессирующему, по меньшей мере, что-либо из числа человеческого M-CSF, человеческого IL-3, человеческого GM-CSF,