Иммунохроматографическая тест-система для выявления патогенных штаммов helicobacter pylori
Иллюстрации
Показать всеИзобретение относится к области медицины и может быть использовано для диагностики H. pylori. Иммунохроматографическая тест-система для выявления патогенных штаммов H. pylori по белку cagA представляет собой мультимембранный композит, состоящий из нитроцеллюлозной мембраны, на поверхность которой наклеена мембрана, пропитанная конъюгатом моноклональных антител, клон НР-387 в концентрации 20 мкг⋅см-3 с наночастицами колоидного золота со средним диаметром 30 нм, мембрана для образца и адсорбирующая мембрана. На аналитическую мембрану в тестовой зоне нанесены моноклональные антитела, клон НР-1811 в концентрации 12 мкг⋅см-3, а в контрольной зоне - антивидовые антитела козы против Ig мыши в концентрации 10 мкг⋅см-3. Изобретение обеспечивает определение белка cagA H. pylori в различных биологических материалах. 1 ил., 1 табл., 3 пр.
Реферат
Изобретение относится к области иммунохроматографического анализа и может быть использовано в иммунологии и медицине для выявления Helicobacter pylori в различных биологических материалах.
Хеликобактериоз является одной из наиболее распространенных инфекций человека. Установлено, что H. pylori в 70-80% случаев является причиной развития хронического гастрита, в 50-60% - язвенной болезни двенадцатиперстной кишки и желудка, более чем у 90% пациентов вызывает развитие MALT-лимфомы желудка [Ford A.C. Epidemiology of Helicobacter pylori infection and public health implications [Text] / A.C. Ford, A.T. Axon // Helicobacter. 2010.-15 (Suppl. 1). - P. 1-6. Сарсенбаева A.C. Методы диагностики инфекции Helicobacter pylori: учеб. пособие [Текст] / A.C. Сарсенбаева // Челябинск: изд. УМК, 2005. - 35 с].
Азиатско-Тихоокеанский консенсус по раку желудка рекомендовал стратегию скрининга и лечения H. pylori-инфекции в популяциях населения с высоким риском рака желудка. В России заболеваемость MALT-лимфомой желудка у мужчин составляет 30,4, у женщин - 13,3 человек на 100000 населения (РОНЦ им. Н.Н. Блохина РАМН, 2006). Установлено, что инфицирование H. pylori является причиной как минимум 327 тыс. новых случаев рака желудка в год [Сеньчукова М.А. О роли бактерий в этиологии и патогенезе злокачественный новообразований [Текст] / М.А. Сеньчукова, А.А. Стадников // Сибирский онкологический журнал. - 2009. - №2 (32). - С. 79-85].
Все вышеперечисленное определяет целесообразность внедрения стратегии скрининга и эрадикации Н. pylori. Среди современных методов, применяемых для диагностики инфекционных заболеваний, в том числе диагностики хеликобактериозов, широкое распространение получили иммунохимические тесты.
В настоящее время на российском рынке существует ряд тест-систем, которые разработаны для обнаружения антител и антигенов H. pylori. Тест-системы, предназначенные для выявления антител к H. pylori в сыворотке крови, доступны, достаточно широко распространены, но с их помощью нельзя оценить эрадикацию микроорганизма. О положительном эффекте эрадикационной терапии при их применении можно судить лишь косвенно по снижению титров антител в сыворотке крови пациентов. Примерами таких тест-систем являются «КреативМП-H. pylori» («КреативМедприбор», Россия), «ImmunoComb» («Biogal - Galed Labs», Израиль), «Helicobacter pylori IgA/IgG ИФА - тест-система» («Biohit Oyj», Финляндия). Иммунохроматографические тест-системы для обнаружения антигенов лишены данного недостатка, позволяют получить результаты анализа за 20-25 мин. Однако они предназначены исключительно для качественного определения антигена в биологическом материале (чаще всего - в кале). Примерами таких тест-систем являются «СIТО TEST H. pylori Ag» («Фармаско», Украина), «ImmunoCard STAT HpSA» («Meridian Bioscience», Италия), «Хелико Стик» и «H. pylori тест» («Novamed», Израиль). Среди имеющихся недостатков у вышеперечисленных иммунохроматографических тест-систем следует отметить их направленность на выявление не самого микроорганизма, а фермента уреазы, который, кроме H. pylori, способен вырабатывать другие возбудители инфекционных заболеваний.
Наличие вышеуказанных недостатков у существующих иммунохроматографических тест-систем, отсутствие на рынке отечественного аналога, содержащего специфические иммунохимические компоненты российского производства, способного выявлять антигены патогенности H. pylori, обусловливают актуальность разработки иммунохроматографической тест-системы для диагностики хеликобактериоза.
Наиболее близкой к заявленной является иммунохроматографическая тест-система для детекциии антигенов Helicobacter pylori [Бызова Н.А. Разработка иммунохроматографической тест-системы для детекции антигенов Helicobacter pylori [Текст] / Н.А. Бызова [и др.] // Прикладная биохимия и микробиология. - 2015. - Т. 51, №5. - С. 520-530]. Основными специфическими иммунохимическими компонентами указанной иммунохроматографической тест-системы являются моноклональные антитела (МкАТ) к H. pylori, клон ABHPY-0404 («Arista Biologicals», США) с наночастицами коллоидного золота (НчКЗ) размером 30 нм в конъюгате и МкАТ к H. pylori, клон НР-939 (Всероссийский научный центр молекулярной диагностики и лечения), сорбированные на нитроцеллюлозной мембране в тестовой зоне.
Общим с данной тест-системой является природа маркера - НчКЗ диаметром 30 нм. Однако использование МкАТ зарубежной фирмы в конъюгате затрудняет разработку тест-системы из-за сложностей поставки импортных реагентов, а также повышает затраты на производство. Кроме этого, отсутствуют сведения о специфичности используемых для разработки тест-системы моноклональных антител - получены они к антигенам клеточной стенки либо к антигенам патогенности. Разработанная авторами для детекции антигенов H. pylori в кале иммунохроматографическая тест-система протестирована лишь со стандартными очищенными растворами коммерческих антигенов AGHPY-0100, AGHPY-0103 и AGHPY-0104 H. pylori («Arista Biologicals», США). Не определена чувствительность разработанной тест-системы при ее использовании для детекции микроорганизма непосредственно в кале пациентов, страдающих хеликобактериозом, не проведено сопоставление этих данных с результатами тестирования при использовании стандартных очищенных растворов коммерческих антигенов. Авторы протестировали разработанную тест-систему лишь с суспензией кала здорового человека, в который был добавлен один из антигенов AGHPY-0404, ранее не упомянутый в самой работе на этапах анализа чувствительности разрабатываемой тест-системы.
В связи с этим предлагается иммунохроматографическая тест-система для детекции белка патогенности cagA H. pylori, в состав которой включены специфические иммунохимические компоненты отечественного производства (МкАТ к cagA H. pylori, клоны НР-1811 и НР-387, антивидовые антитела козы против иммуноглобулинов мыши производства отечественной фирмы «Биалекса», Россия).
Целью изобретения является разработка иммунохроматографической тест-системы, пригодной для тестирования различных биологических материалов (культур микроорганизма, кала, содержимого зубодесневых карманов) на наличие белка cagA H. pylori.
Поставленная цель достигается путем создания мультимембранного композита, состоящего из нитроцеллюлозной мембраны, на поверхность которой наклеены мембрана с иммобилизованным конъюгатом моноклональных антител, клон НР-387 («Биалекса», Россия), в концентрации 20 мкг⋅см-3 с наночастицами колодного золота со средним диаметром 30 нм, и нанесены в поперечном направлении моноклональные антитела, клон HP-1811 («Биалеса», Россия) в тестовой и антивидовые антитела козы против Ig мыши («Биалекса», Россия) - в контрольной зонах мембраны для образца и адсорбирующей мембраны.
Работа по созданию иммунохроматографической тест-системы включает несколько этапов, среди которых выделяют получение конъюгата коллоидного золота с МкАТ, нанесение конъюгата на мембрану, нанесенияе МкАТ в тестовую и контрольную зоны, сборку тест-системы, а также тестирование разработанного образца с различными видами биологических материалов (музейными культурами H. pylori, калом и содержимым зубодесневых карманов лиц, имеющих в анамнезе язву желудка либо двенадцатиперстной кишки) на предмет обнаружения в нем белка cagA H. pylori.
В работе использовали моноклональные антитела к белку cagA H. pylori, клоны НР-1811 и НР-387 («Биалекса», Россия); антивидовые антитела козы против IgG мыши («Биалекса», Россия); золотохлористоводородную кислоту HAuCl4⋅3H2O («Sigma», США); дистиллированную воду (ГОСТ 6709-72); деионизированнную воду (ГОСТ 11.029.003-80); соляную кислоту (ГОСТ 3118-77); азотную кислоту (ГОСТ 4461-77); цитрат натрия 5,5-водный («Реахим», Россия); хлорид натрия («Реахим», Россия); карбонат калия («Реахим», Россия); гидрокарбонат натрия («Реахим», Россия); дигидрофосфат калия («Рап-геас», Испания); гидрофосфат натрия («Sciphos», Китай); трис(гидроксиметил)аминометан («Sigma», США); трис гидрохлорид («Panreac», Испания); полиэтиленгликоль 40000 («Sigma», США); бычий сывороточный альбумин («Диа-М», Германия); Tween-20 («AppliChem», Германия); сахарозу («Реахим», Россия).
В состав мультимембранного комплекса вошли мембраны фирмы «MDI», Индия.
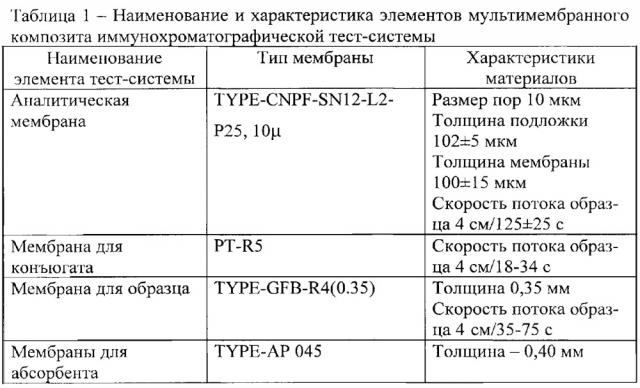
Наименование и характеристика элементов мультимембранного композита иммунохроматографической тест-системы представлены в таблице 1.
Всю лабораторную посуду, предназначенную для работы, предварительно обрабатывали «царской водкой» (смесь концентрированных кислот соляной и азотной в соотношении 3:1) в течение 5 мин с последующим промыванием посуды двукратно в дистиллированной и двукратно - в деионизированной воде, сушкой на воздухе и обработкой в сухожаровом шкафу всех флаконов (колб и др.) с закрытыми фольгой горлышками. Режим обработки в сухожаровом шкафу: 180°C, 60 мин.
Все растворы готовили на деионизированной воде. Для получения деионизированной воды применяли систему UF Arium 611 UF («Sartorius», Германия).
Для взвешивания реагентов использовали весы электронные аналитические Adventurer («OHAUS», США).
Раскрытие изобретения
Получение наночастиц коллоидного золота
НчКЗ размером 30 нм получали цитратным методом Френса [Frens G. // Nat. Phys. Sci. - 1973. - V. 241. - №105. - P. 20-22]. К 49,23 см3 деионизированной воды добавляли 0,058 см 10% раствора золотохлористоводородной кислоты HAuCl4⋅3H2O («Sigma», США), доводили до кипения и при перемешивании добавляли 0,72 см3 1% раствора 5,5-водного цитрата натрия. Смесь кипятили 20 мин, затем охлаждали и хранили при 4°C. Размеры, дисперсионные свойства, электронную плотность частиц анализировали на электронном трансмиссионном микроскопе JEM-2100 («Jeol», Япония).
Определение «золотого числа»
Для проведения реакции использовали НчКЗ с диаметром 30 нм и мышиные МкАТ к белку cagA Н. pylori, клон НР-387 с концентрацией белка 8,0 мг⋅см-3. К раствору НчКЗ добавляли 0,1 М карбонат калия до достижения рН 9,0. Разведения антител и собственно определение «золотого числа» проводили на 0,001 М Трис-HCl буфере с pH 9,0. МкАТ НР-387 с исходной концентрацией 8,0 мг⋅см-3 разводили на 0,001 М борате натрия до 200 мкг⋅см-3.
К 0,1 см3 раствора МкАТ НР-387 (с концентрацией от 100 мкг⋅см-3 до 1,5 мкг⋅см-3) добавляли 0,1 см3 раствора НчКЗ, перемешивали и инкубировали 15 мин при комнатной температуре. Затем добавляли 0,011 см3 10%-ного раствора хлорида натрия, перемешивали и через 10 мин измеряли оптическую плотность содержимого при длине волны 630 нм на спектрофотометре СПЕКС СПП-705-4 (ЗАО «Спектроскопические системы», Россия).
Концентрацию антител, используемую при синтезе конъюгатов МкА с НчКЗ, устанавливали на основании флокуляционной кривой, отражающих агрегацию конъюгатов при высокой ионной силе. Была выбрана концентрация антител, на 10-15% превосходящая точки выхода D630 на плато, как рекомендовано в [Hermanson, G.T. Bioconjugate Techniques [Text] / G.T. Hermanson // Amsterdam: Acad. Press, Elsevier. - 2008. - 900 p.], а именно 20 мкг⋅см-3.
Приготовление конъюгата НчКЗ и МкАТ НР-387
К 0,995 см3 0,025 М Трис-HCL буфера с pH 9,0±0,1 добавляли 0,005 см3 МкАТ НР-387 с концентрацией 8 мг⋅см-3, получали концентрацию антител 40 мкг⋅см-3. К 1,0 см3 МкАТ добавляли 1,0 см3 НчКЗ с pH 9,0±0,1, получали конечную концентрацию МкАТ 20 мкг⋅см-3. Конъюгат в объеме 2,0 см инкубировали 30 мин при комнатной температуре, перемешивая каждые 10 мин на вортексе («Biosan», Латвия). Для стабилизации добавляли профильтрованный 4% раствор ПЭГ 40000 до конечной концентрации 0,25%, инкубировали 15 мин. Конъюгат центрифугировали на центрифуге (Centrifuge 5415 R, «Eppendorf», Германия), используя ускорение 9000 g (13,4 тыс об⋅мин-1) в течение 30 мин при 4°C. Супернатант удаляли, осадок ресуспендировали в 2,0 см3 стабилизирующего буфера следующего состава: 0,025 М Трис-HCL буфер, содержащий 1% белковый сывороточный альбумин и 1% сахарозу, pH 8,5±0,1. Для отмывки конъюгата от несвязавшихся антител проводили повторное центрифугирование в тех же условиях. Удаляли надосадочную жидкость, полученный осадок ресуспендировали в 0,5 см3 стабилизирующего буфера с добавлением 0,05% Tween 20, pH 8,5±0,1.
Раствор конъюгата методом пропитывания наносили на мембраны для конъюгата с плотностью нанесения 30 мкл на 1 см2 и высушивали на воздухе при комнатной температуре в течение 24 ч.
Нанесение МкАТ на нитроцеллюлозную мембрану
МкАТ HP-1811 наносили в тестовую зону аналитической мембраны в концентрации 12 мг⋅см-3, антивидовые антитела козы против иммуноглобулинов мыши в концентрации 10 мг⋅см-3. Тест-системы высушивали при комнатной температуре в течение суток.
Получение иммунохроматографического композита
Склеивание тест-систем проводили последовательно: на нитроцеллюлозную мембрану наклеивали мембрану с иммобилизованным конъюгатом, мембрану для образца и мембрану для адсорбента. Затем полученный мультимембранный композит нарезали при помощи резака («Rahmenlos® Katze Geschenk Shirt», США) на отдельные полоски шириной 3,5-4,0 мм.
В результате разработан экспериментальный образец иммунохроматографической тест-системы, состав мультимембранного композита и основные компоненты которого представлены на чертеже, где 1 - мембрана для нанесения образца TYPE-GFB-R4/0,35; 2 - коньюгат НчКЗ с МкАТ НР-387, нанесенный на мембрану PT-R5; 3 - МкАТ HP-1811 в концентрации 12 мг⋅см3; 4 - антивидовые козьи AT против Ig мыши в концентрации 10 мг⋅см3; 5 - адсорбирующая мембрана TYPE-AP045; 6 - нитроцеллюлозная мембрана Т YPE-CNPE-SN12-L2-P25 10μ.
Принцип работы заявленной тест-системы, предназначенной для детекции патогенных штаммов H. pylori, заключается в следующем. При наличии целевого антигена (белка cagA H. pylori) в пробе, при нанесении ее в объеме 0,1 см3 на подложку для образца, антиген взаимодействует с конъюгатом МкАТ НР-387 с НчКЗ. В результате образуется окрашенный иммуноком-плекс «антиген-антитело», который движется под действием капиллярных сил вдоль нитроцеллюлозной мембраны, пересекает тестовую полосу и взаимодействует с иммобилизованными на указанной тестовой полосе МкАТ НР-1811, тестовая полоса окрашивается в розовый цвет. Далее несвязавшийся в тестовой полосе конъюгат продолжает движение вдоль хроматографической мембраны и взаимодействует с иммобилизованными в контрольной полосе антивидовыми козьими антителами против иммуноглобулинов мыши. В результате контрольная полоса также окрашивается в розовый цвет. Формирование контрольной полосы является внутренним контролем теста. Если анализ проведен правильно, она должна проявляться всегда, независимо от присутствия антигена в исследуемом образце.
Результаты определяются визуально в течение 20-25 мин. При положительном результате тестирования появляются две окрашенные полосы - тестовая и контрольная. При отрицательном результате появляется только одна полоса - контрольная. Если контрольная полоса не появилась, результаты теста считаются недействительными.
Разработанную тест-систему апробировали при тестировании различного биологического материала на предмет наличия белка cagA H. pylori.
На первом этапе для оценки специфичности и чувствительности анализа с помощью тест-системы исследовали культуры H. pylori, находящиеся в музейной коллекции культур кафедры микробиологии ФГБОУ ВО «Вятского государственного университета». Данные культуры были выделены из биологических материалов лиц, имеющих в анамнезе гастрит и язвенную болезнь желудка (содержимое зубодесневых карманов и биоптаты слизистой оболочки желудка). Принадлежность культур к H. pylori подтверждена бактериологическим методом, биохимическими тестами, методами молекулярной диагностики при использовании коммерческих тест-систем для постановки ПЦР («Хеликопол VA», «Хеликопол СА», «Хеликопол IA», «Хеликопол ВА» (Россия), «ДНК-технологии», Россия), методом иммунохроматографии при использовании коммерческой тест-системы («NovaMed», Израиль).
На втором этапе оценивали возможность использования тест-системы для исследования биологических материалов (кала и содержимого зубодесневых карманов), взятых от серопозитивных по отношению к H. pylori доноров.
Пример 1. Тестирование культур H. pylori
Культуру H. pylori выращивали на селективной питательной среде - колумбийском кровяном агаре с антибиотиками амфотерицином (300 мкг⋅л-1) и ванкомицином (300 мкг⋅л-1) в анаэростате при температуре 37°C в течение 3-5 суток. Проводили микробиологическую, биохимическую, молекулярно-генетическую, иммунохроматографическую идентификацию выращенной культуры H. pylori [Кудрявцева Л.В. Биологические свойства Helicobacter pylori [Текст] / Альманах клинической медицины. - 2006. - Т. XIV. - С. 39-46]. Делали смыв культуры с чашки Петри стерильным раствором хлорида натрия, центрифугировали при 2000 об⋅мин-1 в течение 10 мин для осаждения клеток и очистки смыва от остатков питательной среды, осадок ресуспендировали в буфере разгона (0,025 М K/Na ФСБ с 0,15 М NaCl и 0,05% Tween-20, pH 7,5±0,1).
В качестве отрицательного контроля использовали буфер разгона. Для первичной оценки специфичности разработанной тест-системы использовали культуру P. vulgaris. Данный микроорганизм также является этиологическим агентом заболеваний желудочно-кишечного тракта, а также присутствует в кишечнике здорового человека и многих животных.
По результатам тестирования выявлено, что тест-система обладает чувствительностью к H. pylori, о чем свидетельствует появление розовой полосы в аналитической зоне. Появление розовой полосы в контрольной зоне указывало на корректность проведенного анализа. При тестировании гетерогенной культуры P. vulgaris окрашивания аналитической зоны не наблюдалось.
Пример 2. Анализ кала на наличие антигена cagA H. pylori
На первом этапе у 20 добровольцев отбирали кровь из локтевой вены для получения сыворотки крови, которую тестировали на наличие антител к белку cagA H. pylori с помощью коммерческого набора для ДОТ-анализа «Хелико-экспресс» («ВЕКТОР-БЕСТ», Россия). По результатам исследования были выбраны 5 серопозитивых доноров, у которых на втором этапе исследования в стерильные пробирки-капельницы с 1 мл стерильного буфера (0,025 М K/Na ФСБ с 0,15 М NaCl и 0,05% Tween-20, pH 7,5±0,1) были отобраны образцы кала в количестве 250-300 мг. Анализ с использованием иммунохроматографических тест-систем проводили при комнатной температуре. На мембрану для образца наносили 0,1 см3 исследуемой пробы. В качестве контроля использовали буфер разгона.
По результатам тестирования в двух из пяти исследованных образцов обнаружен белок cagA H. pylori, о чем свидетельствовало появление розовой полосы в аналитической зоне, а окрашивание контрольной зоны подтверждало корректность проведенного анализа.
Образцы кала соответствующих добровольцев были посеяны на селективную питательную среду - колумбийский кровяной агар с антибиотиками. Выросшие культуры H. pylori протестированы микробиологическим, биохимическим, молекулярно-генетическим методами при использовании коммерческих тест-систем для постановки ПЦР («Хеликопол VA», «Хеликопол СА», «Хеликопол IA», «Хеликопол ВА» (Россия), «ДНК-технологии», Россия), методом иммунохроматографии при использовании коммерческой тест-системы («NovaMed», Израиль). Результаты исследования показали 100% сопоставимость с данными анализа, полученными при использовании разработанной имунохроматографической тест-системы.
Пример 3. Анализ содержимого зубодесневых карманов на наличие антигена cagA H. pylori
Ротовая полость является входными воротами H. pylori-инфекции. В ротовой полости инфицированных людей возбудитель обнаруживается в слюне, на слизистой оболочке, на дентальных бляшках, в зубном налете, в зубодесневых. В последних создаются микроаэрофильные условия, благоприятные для H. pylori [Угольник Т.С. Сравнительный анализ выявления Helicobacter pylori в ротовой полости с помощью тест-зонда и полимеразной цепной реакции [Текст] / Т.С. Угольник // Медицинские новости. - 2006. - Т. 1, №8. - С. 90-92. Чобанов Р.Э. Парадонтальные карманы как биотопы накопления и жизнедеятельности Helicobacter pylori [Текст] / Р.Э. Чобанов, Р.M. Мамедов // Сибирский медицинский журнал. - 2008. - №7. Булкина Н.В. Патогенетическая взаимосвязь и взаимовлияние воспалительных заболеваний пародонта с патологией сердечно-сосудистой системы и желудочно-кишечного тракта [Текст] / Н.В. Булкина // Клиническая стоматология. - 2010. - №2. - С. 12-15]. В связи с этим представляется целесообразным проверка содержимого зубодесневых карманов на предмет наличия белка cagA H. pylori с целью подтверждения эффекта полной эрадикации и предупреждения возможности реинфицирования.
Перед забором материала каждый пациент проводил дезинфекцию полости рта, трижды обрабатывая полость рта методом полоскания раствором фурацилина. Забор биологического материала из зубодесневых карманов маляров и резцов осуществлялся стерильными штифтами, представляющими собой зубочистки с ватными концами, отобранный материал ресунпендировали в 1,5 см3 буфера разгона, полученную суспензию центрифугировали при 2000 об⋅мин-1 в течение 20 мин для осаждения биологического материала, а затем полученный осадок ресуспендировали в 0,15 см3 буфера разгона.
Образцы биологического материала зубодесневых карманов соответствующих добровольцев были посеяны на селективную питательную среду - колумбийский кровяной агар с антибиотиками. Выросшие культуры H. pylori протестированы микробиологическим, биохимическим, молекулярно-генетическим методами при использовании коммерческих тест-систем для постановки ПЦР («Хеликопол VA», «Хеликопол СА», «Хеликопол IA», «Хеликопол ВА» (Россия), «ДНК-технологии», Россия), методом иммуно-хроматографии при использовании коммерческой тест-системы («NovaMed», Израиль).
По результатам исследования пяти образцов содержимого зубодесневых карманов положительная реакция выявлена всеми указанными методами в двух случаях у добровольцев, у которых положительный результат был получен при тестировании кала.
Таким образом, результаты исследования биологических материалов (образцов кала, содержимого зубодесневых карманов) показали, что только двое из пяти серопозитивных пациентов, у которых выявлено наличие патогенных штаммов H.pylori, нуждаются в назначении эрадикационной терапии, трое же имели в анамнезе хеликобактериоз и на момент обследования не являлись носителями хеликобактериоза.
Иммунохроматографическая тест-система для выявления патогенных штаммов H. pylori по белку cagA представляет собой мультимембранный композит, состоящий из нитроцеллюлозной мембраны, на поверхность которой наклеены мембрана, пропитанная иммобилизованным конъюгатом моноклональных антител, клон HP-387 в концентрации 20 мкг⋅см-3 с наночастицами коллоидного золота со средним диаметром 30 нм и нанесенными в поперечном направлении моноклональными антителами, клон HP-1811 в концентрации 12 мкг⋅см-3 в тестовой зоне и антивидовые антитела козы против Ig мыши в концентрации 10 мкг⋅см-3 в контрольной зоне, мембрана для нанесения образца и адсорбирующая мембрана.