Способ прогнозирования преждевременных родов
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к акушерству и гинекологии, и может быть использовано для прогнозирования риска преждевременных родов. Способ прогнозирования преждевременных родов у беременных с ретрохориальной гематомой (РХГ) характеризуется тем, что в срок от 11 недель до 13 недель и 6 дней анализируют уровень β-субъединицы плацентарного гормона ХГЧ и белка РАРР-А, выраженных в МоМ, при этом у беременных с РХГ объемом более 1 см3 и уровнем РАРР-А менее 0,7 МоМ риск развития преждевременных родов возрастает в 9,5 раз, а при РХГ того же объема и уровнем β-субъединицы ХГЧ менее 0,4 МоМ риск развития преждевременных родов возрастает в 5,5 раз. 4 табл., 3 пр.
Реферат
Настоящее изобретение относится к медицине, а именно к акушерству и гинекологии, и может быть использовано для прогнозирования риска преждевременных родов на основании данных скрининга 1-го триместра: свободной β-субъединицы плацентарного гормона ХГЧ и плазменного протеина РАРР-А в сроке беременности 11-13 недель 6 дней, в сочетании с наличием ретрохориальной гематомы в 1 триместре.
Проблема преждевременных родов (ПР) и их последствий является активно обсуждаемой и острой не только на территории РФ, но и других государств, так как, несмотря на весь спектр существующих на данный момент способов коррекции угрозы ПР и купирования начальных проявлений, данный вопрос продолжает иметь существенный резонанс и актуальность во всем мире (ACOG. Practice Bulletin No. 159: Management of Preterm Labor. Obstet Gynecol. 2016; 127(1):e29-38). В развитых странах процент преждевременных родов колеблется от 7 до 12% (Chang НН, Larson J, Blencowe Н, Spong CY, Simpson JL, Lawn JE. Preterm births in countries with a very high human development index-authors’ reply. Lancet 2013; 381:1356-7; Hamilton BE, Martin JA, Ventura SJ. Births: preliminary data for 2005. Natl Vital Stat Rep2006; 55:1-18.
Дети, рожденные вследствие преждевременных родов, составляют 75% перинатальной смертности, в 50% процентах имеют те или иные поражения ЦНС (Mercer В. Preterm premature rupture of the membranes. Obstet Gynecol 2003; 101:178-93; Hack M, Taylor HG, Klein N, Eiben R, Schatschneider C, Mercuri-Minich N. School-age outcomes in children with birth weights under 750 g. N EnglJ Med1994; 331:753-9).
Главной задачей ученых является поиск методов профилактики, для чего ведется поиск маркеров ПР. На данный момент выявлено множество специфических и неспецифических биохимических показателей крови, амниотической жидкости, отделяемого цервикального канала, указывающих на возможность развития ПР (Lanekoff I, Cha J, Kyle JE, Dey SK, Laskin J, Burnum-Johnson KE. Trp53 deficient mice predisposed to preterm birth display region-specific lipid alterations at the embryo implantation site. Sci Rep. 2016 Sep 13; 6:33023. doi: 10.1038/srep33023; Rzepka R, B, Rajewska A, D, Budkowska M, Kwiatkowski S, A. Diagnostic Potential of Evaluation of SDF-1α and sRAGE Levels in Threatened Premature Labor. Biomed Res Int. 2016; 2016:2719460. doi: 10.1155/2016/2719460. Epub 2016 Jul 31).
Более половины всех ПР происходит у женщин с отсутствием очевидных факторов риска, ввиду этого поиск предикторов преждевременных родов до настоящего времени является весьма актуальной задачей (Goldenberg RL, Culhane JF, Iams JD, Romero R, Epidemiology and causes of preterm birth, Lancet, 2008; 371:75-84. 3. Romero R, Espinoza J, Kusanovic JP, et al., The preterm parturition syndrome, BJOG, 2006; 113(Suppl. 3),17-42.). Так же актуально не столько изучение факторов риска преждевременных родов, сколько поиск триггеров, маркеров, прогнозирующих наступление преждевременных родов. Подобные маркеры можно обнаружить в различных средах и тканях организма человека: фетальный фибронектин и протеин-1, связывающий инсулиноподобный фактор роста, а также некоторые цитокины в цервикальном секрете.
Тем не менее представляет интерес изучение уже раннее известных биохимических маркеров, которые успешно зарекомендовали себя в акушерстве, например биохимические маркеры, свободная β-субъединица плацентарного гормона ХГЧ и плазменный протеин РАРР-А - в предикции хромосомной патологии.
Известен способ прогнозирования ПР с помощью определения в периферической крови беременных женщин после 20 недель гестации относительного содержания Т-лимфоцитов, несущих на своей поверхности структуры, реагирующие с альфа2-микроглобулином фертильности (Т-АМГФ-РОК). При уровне данных показателей менее 20% прогнозируют угрожающие преждевременные роды с точностью 94% (патент РФ №2103693, 1998 г.). Недостатком данного метода является отсутствие возможности более раннего определения вероятности ПР.
Так же известен способ прогнозирования ПР и диагностики угрозы прерывания беременности посредством определения в плазме крови содержания фибрин-мономерных комплексов. По их величине прогнозируют прерывание беременности в I, II, III триместрах (патент РФ №2123698, 1998). Недостатком метода является его не специфичность.
Известен способ прогнозирования исходов беременности, отличающийся тем, что предварительно методом двухмерного ультразвукового сканирования определяют преимущественное расположение плаценты, выполняют забор капиллярной крови, определяют процентное содержание лимфоцитов и при наличии левостороннего расположения плаценты и содержания лимфоцитов в формуле крови 20% и менее прогнозируют неблагоприятный исход беременности (патент РФ №2268466, 2006 г.). Недостатками способа являются: трудоемкость, так как необходимо одновременное применение нескольких методов клинической и лабораторной диагностики; показатель формулы крови является непостоянным, реагирующим на различные факторы, не связанные с развитием данной акушерской патологии; отсутствие регламентированных сроков определения.
Так же известен способ прогнозирования ПР при урогенитальной инфекции, основанный на увеличении экспрессии TLR2, с большой степенью вероятности приводящей к преждевременным родам за счет гиперактивации гуморальных факторов врожденного иммунитета (провоспалительных цитокинов) (патент РФ №2334233, 2006 г.). Недостатком данного способа является его специфичность относительно пациенток, имеющих урогенитальную инфекцию, не подходящая остальной группе женщин с угрозой ПР.
Известен способ прогнозирования угрожающих преждевременных родов у женщин с угрозой невынашивания ранних сроков, заключающийся в определении в периферической крови женщин с угрозой невынашивания в 6-12 недель гестации соотношения показателей относительного содержания CD25+ к IL-2+ лимфоцитам. При его значении, равном или более 1,0, прогнозируют развитие угрожающих преждевременных родов (патент РФ №2344424, 2009 г.). Недостатком данного метода является его затратность ввиду необходимости закупки лечебным учреждением специфических реактивов для выполнения данного анализа, а также отсутствие его в перечне услуг, предоставляемых по системе обязательного медицинского страхования.
Задачей заявляемого изобретения является повышение результативности прогнозирования ПР при наличии ретрохориальной гематомы на основании анализа показателей скрининга 1-го триместра в сроке 11-13 недель 6 дней: свободная β-субъединица плацентарного гормона ХГЧ и плазменный протеин РАРР-А.
Поставленная задача решается тем, что у беременных с ретрохориальной гематомой (РХГ) в срок от 11 недель до 13 недель и 6 дней анализируют уровень β-субъединицы плацентарного гормона ХГЧ и белка РАРР-А, выраженных в МоМ, при этом у беременных с РХГ объемом более 1 см3 и уровнем РАРР-А менее 0,7 МоМ риск развития преждевременных родов возрастает в 9,5 раз, а при РХГ того же объема и уровнем β-субъединицы ХГЧ менее 0,4 МоМ риск развития преждевременных родов возрастает в 5,5 раз.
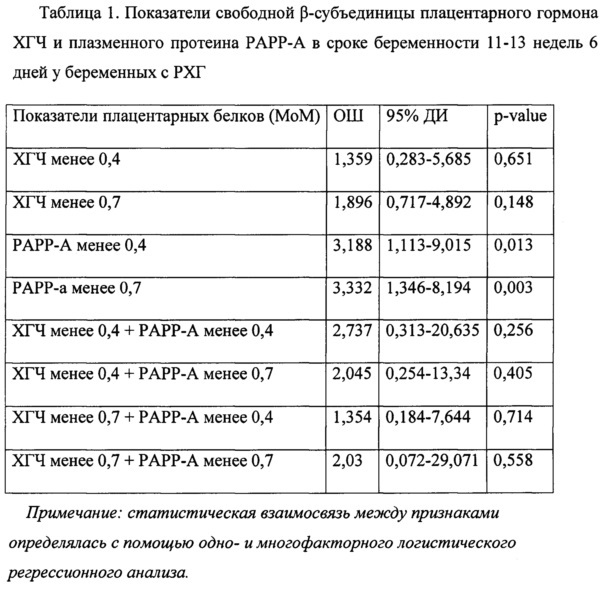
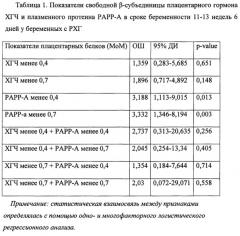
Рассмотрены различные уровни показателей биохимического скрининга: β-субъединицу плацентарного гормона ХГЧ и плацентарного белка РАРР-А у пациенток с РХГ и выявлено увеличение риска преждевременных родов при значении РАРР-А менее 0,4 МоМ (в 3,188 раз выше риск преждевременных родов) и менее 0,7 МоМ (в 3,332 раза), что отражено в таблице 1.
При этом была выявлена зависимость увеличения риска ПР, в зависимости от локализации хориона у пациенток с РХГ и снижения уровней показателей биохимического скрининга 1-го триместра: локализация хориона (передняя, задняя стенка, дно матки и область внутреннего зева - предлежание хориона), локализация ретрохориальной гематомы (корпоральная - в дне и на стенках матки и супрацервикальная - располагается в области внутреннего зева цервикального канала шейки матки), объем гематомы.
Результаты, полученные с использованием логистического регрессионного анализа, показали, что риск преждевременных родов выше при наличии ретрохориальной гематомы объемом более 5 см3 в 3 раза (ОШ 3,175; ДИ 1,522-6,618) и более 10 см3 в 2,7 раз (ОШ 2,744; ДИ 1,106-8,045) (таблица 2).
Далее была рассмотрена вероятность формирования ПР относительно совокупности признаков: ХГЧ менее 0,4 и РХГ более 1 см3, что обусловило увеличение вероятности ПР в 5,646 раз, РАРРА менее 0,7 и РХГ более 1 см3, увеличение вероятности ПР в 9,571 раз, ХГЧ менее 0,7+РХГ более 1 см3+ расположение РХГ над областью внутреннего зева, увеличение вероятности ПР в 8,5 раз, что отражено в таблице 3.
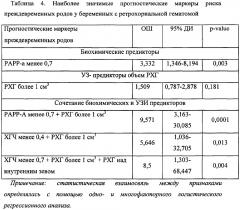
В результате данного исследования были выявлены наиболее значимые предикторы I триместра, указывающие на повышение риска преждевременных родов, этим явилось сочетание нескольких маркеров: так, значение РАРР-А менее 0,7 увеличивает риск преждевременных родов в 3,332 раза, а в сочетании с РХГ более 1 см3 - уже в 9,571 раз (таблица 4)
.
Для предикции преждевременных родов, а не коррекции их следствия, в настоящее время актуален вопрос о внедрении в клиническую практику маркеров (предикторов) преждевременных родов. Проведенный многофакторный анализ с включением биохимических маркеров (свободная β-субъединица плацентарного гормона ХГЧ и плазменный протеин РАРР-А), ультразвуковых (РХГ, в частности ее объема), а также возможных комбинаций, с целью определения факторов, связанных с риском развития преждевременных родов, показал высокую прогностическую ценность РАРР-А в МоМ, локализации хориона над внутренним зевом - так называемого предлежания хориона и объема ретрохориальной гематомы более 1 см3.
Максимальную прогностическую ценность дает сочетание биохимических и ультразвуковых маркеров. Так, при сочетании РАРР-А менее 0,7 МоМ и ретрохориальной гематомы объемом более 1 см3 шанс преждевременных родов возрастает в 9,5 раз, при сочетании ХГЧ менее 0,4 МоМ и РХГ объемом более 1 см3 - в 5,5 раз, при сочетании ХГЧ менее 0,7 МоМ+РХГ объемом более 1 см3+РХГ над внутренним зевом - в 8,5 раз. Полученные результаты позволили воспользоваться имеющимися в арсенале современного акушерства возможностями биохимического скрининга для прогноза преждевременных родов у исследуемой категории беременных с ретрохориальной гематомой. Преимуществом предлагаемого комплексного скрининга у беременных с ретрохориальной гематомой является его возможности определения в I триместре, экономическая выгодность ввиду определения специфических маркеров скрининга 1-го триместра за счет средств ОМС.
Способ осуществляется следующим образом.
В сроке беременности 10-13 недель 6 дней выполняют ультразвуковое исследование (оценка толщины воротникового пространства плода); затем, не позже чем через 7 дней после скринингового УЗИ, производят забор крови натощак в объеме 10 мл в вакуумную систему без антикоагулянта или с активатором свертывания. Цельная кровь должна быть доставлена в лабораторию не позднее 2 часов при температуре 2-8°C с последующим определением уровней плазменного протеина, связанного с беременностью (РААР-А), и свободной β-субъединицы плацентарного гормона ХГЧ. В основе теста - твердофазный хемилюминесцентный иммуноферментный анализ (сэндвич). В иммуноанализе сэндвич-типа на первой стадии на поверхность планшета сорбируется не антиген, а антитела, специфичные к исследуемому антигену (антитела подложки). После удаления не связавшихся молекул антител добавляется образец, содержащий антиген. Для детекции образовавшегося комплекса антитела подложки-антиген добавляются вторые антитела, специфичные к другому, пространственно удаленному, эпитопу антигена, конъюгированные с какой-либо меткой.
I. Сорбция антител подложки
В лунки 96-луночного планшета для проведения иммуноанализа сорбируют антитела подложки 1-2 мкг в лунку в 100 мкл фосфатно-солевого буфера (PBS). Инкубация проводится в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов. Отмывка (2-кратная) несвязавшихся молекул антигена осуществляется фосфатно-солевым буфером, содержащим 0,1% Tween-20 (PBST).
II. Блокировка
Для блокирования мест неспецифичного связывания лунки планшета заполняют PBST и инкубируют в течение 10-15 минут при комнатной температуре.
III. Инкубация с антигеном
В лунки планшета с преадсорбироваными антителами вносят по 50 мкл исследуемого раствора либо стандартных разведений антигена. Разведения антигена должны быть приготовлены на основе PBST, поскольку Tween-20 снижает неспецифичное связывание белковых молекул друг с другом и с поверхностью планшета. И исследуемый раствор, и стандартные разведения антигена вносят попарно (либо по 3 повторности), используя по две (три) лунки на каждое разведение белка. Инкубацию проводят при комнатной температуре в течение 30 мин при постоянном перемешивании. Отмывка осуществляется раствором PBST 3 раза.
IV. Инкубация с антителами, конъюгированными с ферментной меткой
В лунки планшета вносят по 100 мкл раствора специфичных антител, конъюгированных с ферментной меткой. Оптимальная концентрация конъюгированных антител, как правило, указывается производителем (обычно используют концентрацию 2-4 мкг/мл). Инкубация с антителами, содержащими ферментную метку, проводится в течение 30 минут при комнатной температуре и встряхивании на горизонтальном шейкере для планшетов. Отмывка осуществляется с помощью PBST 5-6 раз.
V. Проведение ферментативной реакции, сопровождающейся появлением окрашенного продукта
В лунки вносят по 100 мкл раствора субстрата и инкубируют в течение 10 мин при комнатной температуре и постоянном перемешивании.
VI. Остановка ферментативной реакции
Перед измерением оптической плотности проводят остановку цветной реакции с помощью 0,5 М H2SO4. В лунки с рабочим раствором ОФД после инкубации вносят по 50 мкл раствора 0,5 М серной кислоты. После этого можно сразу приступать к измерению оптической плотности.
VII. Измерение оптической плотности
Оптическая плотность раствора окрашенного продукта измеряется при λ=490 нм с использованием планшетного спектрофотометра.
Следующим шагом является оценка показателей плазменного протеина, связанного с беременностью (РААР-А) и свободной β-субъединицы плацентарного гормона ХГЧ, выраженных в МоМ.
Сущность заявляемого способа поясняется следующими примерами.
Пример 1. Пациентка К., 25 лет. Беременность первая, желанная. Из анамнеза - нарушений менструальной функции, гинекологических и экстрагенитальных заболеваний не отмечает. На учете в женской консультации состоит с 7 недель беременности, в сроке 8-9 недель появились скудные кровянистые выделения из половых путей. По данным УЗИ: беременность 8 недель, ретрохориальная гематома размером 1 см3. Пациентка госпитализирована в гинекологическое отделение Перинатального центра РО, где получала транексам по 1 т (250 мг) × 3 р/д, дюфастон 40 мг однократно, затем по 10 мг × 3 р/д, фолиевую кислоту по 4 мг в день. Выписана из стационара по истечении 7 дней. По УЗИ: беременность 9 недель. РХГ с признаками организации. По данным скрининговых УЗИ в сроке 12 недель и 20 недель патологий не выявлено. При выполнении биохимического скрининга 1-го триместра получены данные: РААР-А 0,6 МоМ, ХГЧ 0,4 МоМ.
Катамнез. В сроке 29 недель беременности появились признаки угрозы преждевременных родов. Пациентка предъявляла жалобы на тянущие схваткообразные боли внизу живота. При осмотре определялось повышение тонуса и возбудимости матки. Данные влагалищного исследования: шейка матки до 2,5 см длиной, размягчена по периферии, цервикальный канал пропускает 1 поперечный палец до внутреннего зева. По УЗИ отмечалось повышение тонуса матки. Пациентка госпитализирована в отделение патологии беременности Перинатального центра РО, где проводилась сохраняющая, токолитическая терапия, профилактика РДС плода, однако в сроке 31 недели беременности произошло преждевременное излитие околоплодных вод. Беременность закончилась преждевременными родами в сроке 31 неделя и рождением ребенка мужского пола, весом 1800 г, ростом 39 см, с оценкой 5-6 баллов по шкале Апгар. Ребенок передан неонатологу-реаниматологу, переведен в отделение реанимации. Мать выписана из стационара на 5-е сутки послеродового периода, ребенок переведен в отделение патологии недоношенных на 4-е сутки.
Пример 2. Пациентка Л., 27 лет. Беременность вторая, желанная. Из анамнеза - нарушений менструальной функции, гинекологических и экстрагенитальных заболеваний не отмечает. На учете в женской консультации состоит с 10 недель беременности, в сроке 7 недель появились умеренные, кровянистые выделения из половых путей. По данным УЗИ: беременность 7-8 недель, ретрохориальная гематома размером 5 см3. Пациентка госпитализирована в гинекологическое отделение Перинатального центра РО, где получала транексам 500 мг + 0,9% физ. р-р 200,0 мл капельно, затем транексам по 1 т (250 мг) × 3 р/д, дюфастон 40 мг однократно, затем по 10 мг × 3 р/д, фолиевую кислоту по 4 мг в день. Выписана из стационара по истечении 5 дней. По УЗИ: беременность 8-9 недель. По данным скрининговых УЗИ в сроке 12 недель и 22 недели патологий не выявлено. При выполнении биохимического скрининга 1 го триместра получены данные: РААР-А 0,5 МоМ, ХГЧ 0,6 МоМ.
Катамнез. В сроке 32 недель беременности появились признаки угрозы преждевременных родов. Пациентка предъявляла жалобы на схваткообразные боли внизу живота. При осмотре определялось повышение тонуса и возбудимости матки. Данные влагалищного исследования: шейка матки до 1,5 см длиной, мягкая, цервикальный канал пропускает 1 поперечный палец до внутреннего зева. По УЗИ отмечалось повышение тонуса матки. Пациентка госпитализирована в отделение патологии беременности Перинатального центра РО, где проводилась сохраняющая, токолитическая терапия, профилактика РДС плода, однако в сроке беременности 32 недели 4 дня произошли преждевременные роды, с самопроизвольным излитием околоплодных вод на 7 см открытия шейки матки, родился ребенок мужского пола, весом 1950 г, ростом 41 см, с оценкой 6-6 баллов по шкале Апгар. Ребенок передан неонатологу-реаниматологу, переведен в отделение реанимации. Мать выписана из стационара на 5-е сутки послеродового периода, ребенок переведен в отделение патологии недоношенных на 1-е сутки.
Пример 3. Пациентка Р., 30 лет. Беременность вторая, желанная. Из анамнеза - нарушений менструальной функции. Из гинекологических заболеваний хронический аднексит. Из экстрагенитальных заболеваний: ВСД по смешанному типу, хронический гастрит, ремиссия. На учете в женской консультации состоит с 10 недель беременности, в сроке 7 недель появились умеренные, кровянистые выделения из половых путей. По данным УЗИ: беременность 7 недель, ретрохориальная гематома размером 3 см3. Пациентка госпитализирована в гинекологическое отделение Перинатального центра РО, где получал транексам 500 мг+0,9% физ. р-р 200,0 мл капельно, затем транексам по 1 т (250 мг) × 3 р/д, дюфастон 40 мг однократно, затем по 10 мг × 3 р/д, фолиевую кислоту по 4 мг в день. Выписана из стационара по истечении 7 дней. По УЗИ: беременность 8-9 недель. РХГ с признаками организации. По данным скрининговых УЗИ в сроке 12 недель патологий не выявлено. При выполнении биохимического скрининга 1-го триместра получены данные: РААР-А 0,5 МоМ, ХГЧ 0,6 МоМ. При УЗИ в 22 недели отмечено повышение тонуса миометрия, лечение не проводилось.
Катамнез. В сроке 31-32 недели беременности появилось подтекание светлых околоплодных вод, признаки преждевременных родов. Пациентка предъявляла жалобы на схваткообразные боли внизу живота по 25-30 секунд, через 3-4 минуты. При осмотре определялось повышение тонуса и возбудимости матки. Данные влагалищного исследования: шейка матки до 1,5 см длиной, мягкая, открытие маточного зева 3 см. Через 5 часов произошли преждевременные роды, родился ребенок женского пола, весом 1950 г, ростом 40 см, с оценкой 6-6 баллов по шкале Апгар. Ребенок передан неонатологу-реаниматологу, переведен в отделение реанимации. Мать выписана из стационара на 5-е сутки послеродового периода, ребенок переведен в отделение патологии недоношенных на 1-е сутки.
Таким образом, предлагаемый способ обладает более высокой точностью, специфичностью, чем аналоги, что дает возможность с большей вероятностью прогнозировать возможность ПР, а также способ является экономически выгодным, так как определение маркеров предикции осуществляется за счет средств ОМС. Способ неинвазивен, безопасен для здоровья беременной и плода, широко доступен для современных учреждений родовспоможения.
Способ прогнозирования преждевременных родов у беременных с ретрохориальной гематомой (РХГ), характеризующийся тем, что в срок от 11 недель до 13 недель и 6 дней анализируют уровень β-субъединицы плацентарного гормона ХГЧ и белка РАРР-А, выраженных в МоМ, при этом у беременных с РХГ объемом более 1 см3 и уровнем РАРР-А менее 0,7 МоМ риск развития преждевременных родов возрастает в 9,5 раз, а при РХГ того же объема и уровнем β-субъединицы ХГЧ менее 0,4 МоМ риск развития преждевременных родов возрастает в 5,5 раз.