Системная доставка и регулируемая экспрессия паракринных генов для лечения сердечно-сосудистых и иных заболеваний
Иллюстрации
Показать всеГруппа изобретений относится к медицине и может быть использована для лечения сердечной недостаточности с застойными явлениями (CHF), диабета или предиабета in vivo у пациента, нуждающегося в этом. Для этого проводят введение индивидууму вектора, содержащего нуклеиновую кислоту, кодирующую паракринный полипептид или пептид, выбранный из группы, состоящей из кардиотонического пептида, урокортина-2 (UCn-2), урокортина-1 (UCn-1), урокортина-3 (UCn-3), мозгового натрийуретического пептида и простациклинсинтазы, где указанная нуклеиновая кислота, кодирующая паракринный полипептид или пептид, функционально связана с промотором, где вектор представляет собой аденоассоциированный вирус (AAV) и где паракринный полипептид или пептид экспрессируются в клетке. Группа изобретений обеспечивает лечение или улучшение CHF, диабета или предиабета у пациента. 2 н. и 22 з.п. ф-лы, 20 ил., 3 табл.
Реферат
Заявление в отношении права на изобретение, сделанного при исследовании, финансируемом из федерального бюджета
Изобретение было сделано при государственной поддержке за счет гранта № HL088426, выделенного Национальными институтами здоровья (NIH), DHHS. Правительство имеет определенные права на данное изобретение.
Область техники
Это изобретение имеет отношение к клеточной и молекулярной биологии и медицине. Данное изобретение предоставляет композиции и методы in vitro и ex vivo. В альтернативных вариантах осуществления изобретение предоставляет способы лечения, улучшения состояния или защиты (предохранения) индивидуума или пациента от болезни, инфекции или состояния, чувствительного к повышенному или устойчивому уровню паракринного полипептида in vivo, включая: предоставление нуклеиновой кислоты или гена, кодирующих паракринный полипептид, функционально связанных с последовательностью, регулирующей транскрипцию; или средства для экспрессии, вектора, рекомбинантного вируса или эквивалента, содержащих в себе кодирующую паракринный фактор нуклеиновую кислоту, ген, транскрипт или мРНК, при этом средство для экспрессии, вектор, рекомбинантный вирус или эквивалент может экспрессировать кодирующую паракринный фактор нуклеиновую кислоту, транскрипт или мРНК в клетке или in vivo; и введение или доставку кодирующей паракринный полипептид нуклеиновой кислоты, гена, транскрипта или мРНК, функционально связанного с последовательностью, регулирующей транскрипцию, или средства для экспрессии, вектора, рекомбинантного вируса или эквивалента нуждающемуся в этом индивидууму или пациенту и посредством этого лечение, улучшение состояния или защиты (предохранения) индивидуума или пациента от болезни, инфекции или состояния, чувствительного к повышенному уровню паракринного полипептида.
Уровень техники
Недавно было показано, что внутривенная инъекция вирусного вектора, кодирующего человеческий Фактор ГХ, содержащийся в недостаточном количестве при гемофилии В, увеличивала концентрацию Фактора IX в сыворотке субъектов с гемофилией В до такого уровня, при котором уменьшается необходимость вливания экзогенного Фактора IX. Однако 1) этот белок не подвергается регулируемой экспрессии и поэтому не обеспечивал возможность оптимальной «подгонки» уровней трансгена в сыворотке, 2) эта система не обеспечивала возможности выключения экспрессии трансгена в случае нежелательных или непредвиденных эффектов и 3) данный ген, Фактор IX, не являлся паракринным геном, не имел полезных эффектов на сердечнососудистую систему и, следовательно, не мог использоваться для лечения сердечной недостаточности.
Раскрытие изобретения
Данное изобретение предоставляет способы лечения, улучшения состояния и защиты (предохранения) индивидуума или пациента от какой-либо болезни, инфекции или состояния, чувствительного к повышенному уровню паракринного полипептида in vivo. В альтернативных вариантах осуществления изобретение предоставляет способы лечения, улучшения состояния и предотвращения болезни, инфекции или состояния, чувствительного к повышенному или устойчивому уровню паракринного пептида или полипептида in vivo включающие:
(a) (i) предоставление кодирующей паракринный полипептид нуклеиновой кислоты, или гена, функционально связанных с последовательностью, регулирующей транскрипцию; или средства для экспрессии, вектора, рекомбинантного вируса или эквивалента, содержащего кодирующую паракринный фактор нуклеиновую кислоту или ген, или экспрессирующую паракринный полипептид нуклеиновую кислоту, транскрипт или мРНК, при этом средство для экспрессии, вектор, рекомбинантный вирус, или эквивалент может экспрессировать кодирующую паракринный фактор нуклеиновую кислоту, ген, транскрипт или мРНК в клетке или in vivo; и
(ii) введение или доставку кодирующей паракринный полипептид нуклеиновой кислоты, гена, транскрипта или мРНК, функционально связанного с последовательностью, регулирующей транскрипцию, или средства для экспрессии, вектора, рекомбинантного вируса или эквивалента в клетку или индивидууму или пациенту, нуждающемуся в этом,
и посредством этого лечение, улучшение состояния или предохранение (защиту) индивидуума или пациента от болезни, инфекции или состояния, чувствительного к повышенному или устойчивому уровню паракринного полипептида;
(b) способ (а), согласно которому средство для экспрессии, вектор, рекомбинантный вирус или эквивалент представляет собой или содержит:
аденоассоциированный вирус (AAV), лентивирусный вектор или аденовирусный вектор,
AAV серотипа AAV5, AAV6, AAV8 или AAV9,
происходящий от макаки-резус AAV, или происходящий от макаки-резус AAV AAVrh.10hCLN2,
AAV капсидный мутант или AAV гибридный серотип,
органотропный AAV, или кардиотропный AAV, или кардиотропный AAVM41 мутант,
при этом необязательно AAV создается с целью увеличения эффективности нацеливания на специфический тип клеток, который является непермессивным относительно дикого типа (дт) AAV, и/или с целью улучшения эффективности инфицирования клеток только интересующего типа,
и необязательно габридный AAV перенацеливается или создается в виде гибридного серотипа с помощью одной или более модификаций, включающих: 1) транскапсидацию, 2) адсорбцию биспецифического антитела к поверхности капсида, 3) создание мозаичного капсида и/или 4) создание химерного капсида;
(c) способ (а), согласно которому кодирующая паракринный фактор нуклеиновая кислота, ген, транскрипт или мРНК является функционально связанным с регулируемой или индуцибельной последовательностью, регулирующей транскрипцию;
(d) способ (с), согласно которому регулируемая или индуцибельная последовательность, регулирующая транскрипцию, является регулируемым или индуцибельным промотором,
в котором необязательно положительный (активатор) и/или отрицательный (репрессор) модулятор транскрипции и/или трансляции является функционально связанным с кодирующей паракринный фактор нуклеиновой кислотой, геном, транскриптом или мРНК;
(e) способ согласно любому из пунктов (а)-(d), в котором введение нуклеиновой кислоты, кодирующей паракринный полипептид, гена, транскрипта или мРНК, функционально связанного с последовательностью, регулирующей транскрипцию, или средства для экспрессии, вектора, рекомбинантного вируса или эквивалента индивидууму или пациенту, нуждающемуся в этом, приводит к высвобождению паракринного белка в кровоток или системное кровообращение или к повышенной или устойчивой экспрессии паракринного белка в клетке,
при этом необязательно высвобождение или повышенная или устойчивая экспрессия паракринного белка зависит от активации индуцибельного промотора, или дерепрессии репрессора, функционально связанного с кодирующей паракринный полипептид нуклеиновой кислотой, геном, транскриптом или мРНК; или
(f) способ по любому из пунктов (а)-(е), согласно которому болезнь, инфекция или состояние, чувствительное к повышенному уровню паракринного полипептида in vivo, является нарушением сократительной функции сердца; сердечной недостаточностью с застойными явлениями (CHF); фиброзом сердца; поражением кардиомиоцитов, дисфункцией или апоптозом; легочной гипертензией; заболеванием, раком или дисфункцией сердца, кожи, печени, легких, мышц, нервов, мозга и почек; злокачественным образованием (раком) или новообразованием; или гемофилией или гемофилией В.
В альтернативных вариантах осуществления способов изобретения:
(a) кодирующая паракринный фактор нуклеиновая кислота или ген, функционально связанные с последовательностью, регулирующей транскрипцию; или средство для экспрессии, вектор, рекомбинантный вирус или эквивалент вводится или доставляется нуждающемуся в этом индивидууму или пациенту перорально, с помощью внутримышечной (IM) инъекции, внутривенной (IV) инъекции, подкожной (SC) или внутрикожной инъекции, подоболочечной инъекции, внутриартериальной (IA) инъекции, внутрикоронарной инъекции, с помощью ингаляции, с помощью биолистической системы доставки частиц или с использованием "генной пушки", пневматического пистолета или генной пушки HELIOS™ (Bio-Rad Laboratories, Hercules, CA); или
(b) кодирующая паракринный фактор нуклеиновая кислота или ген, функционально связанные с последовательностью, регулирующей транскрипцию; или средство для экспрессии, вектор, рекомбинантный вирус или эквивалент вводится или доставляется нуждающемуся в этом индивидууму или пациенту путем введения в какое-либо тканевое или жидкостное пространство в организме, которое располагается рядом или омывается (дренируется) током крови, благодаря чему кодируемый белок может секретироваться из клеток в ткань и высвобождаться в кровоток.
В альтернативных вариантах осуществления способов изобретения паракринный полипептид или пептид представляет собой или содержит кардиотонический пептид млекопитающего, фактор роста, серелаксин, релаксин-2, урокортин-2 (UCn-2), урокортин-1 (UCn-1), урокортин-3 (UCn-3), мозговой натрийуретический пептид, простациклин синтазу, гормон роста, инсулиноподобный фактор роста-1 или любую их комбинацию; или человеческий кардиотонический пептид, человеческий фактор роста, серелаксин, релаксин-2, урокортин-2, урокортин-1, урокортин-3, мозговой натрийуретический пептид, простациклинсинтазу, гормон роста, инсулиноподобный фактор роста-11 или любую их комбинацию.
В альтернативных вариантах осуществления способов изобретения паракринный полипептид представляет собой урокортин, урокортин-2, урокортин-1, урокортин-3, релаксин-2 или мозговой натрийуретический пептид, а болезнь или состояние является сердечной недостаточностью с застойными явлениями (CHF); или паракринный полипептид является простациклинсинтазой, а болезнь или состояние - легочной гипертензией, или болезнь или состояние является сердечной недостаточностью с застойными явлениями (CHF); или паракринный полипептид является простациклинсинтазой, а болезнь или состояние - легочной гипертензией.
В альтернативных вариантах осуществления способов изобретения:
(a) индивидууму, пациенту или субъекту вводится стимул или сигнал, вызывающий экспрессию нуклеиновой кислоты или гена, экспрессирующих паракринный фактор, или индуцирует или активирует промотор (например, функционально связанный с экспрессирующей паракринный фактор нуклеиновой кислотой или геном), который вызывает экспрессию экспрессирующей паракринный фактор нуклеиновой кислоты или гена;
(b) индивидууму, пациенту или субъекту вводится стимул или сигнал, вызывающий синтез активатора промотора, необязательно экспрессирующей паракринный фактор нуклеиновой кислоты или специфический промотор гена (например, функционально связанного с экспрессирующей паракринный фактор нуклеиновой кислотой, или геном);
(c) индивидууму, пациенту или субъекту вводится стимул или сигнал, вызывающий синтез природного или синтетического активатора экспрессирующей паракринный фактор нуклеиновой кислоты или гена или экспрессирующей паракринный фактор нуклеиновой кислоты или специфического промотора гена,
при этом необязательно природный активатор является эндогенным фактором транскрипции;
(d) способ (с), согласно которому синтетический активатор имеет структуру «цинкового пальца», ДНК-связывающего белка, созданного для того, чтобы специфически и селективно «включать» эндогенный или экзогенный ген-мишень, при этом необязательно эндогенная мишень является нуклеиновой кислотой, экспрессирующей паракринный фактор, или геном или активатором экспрессирующей паракринный фактор нуклеиновой кислоты или гена, или активатором промотора, функционально связанного с экспрессирующей паракринный фактор нуклеиновой кислотой или геном;
(e) любой способ из (а)-(с), согласно которому стимул или сигнал включает биологический, световой, химический или фармацевтический стимул или сигнал;
(f) индивидууму, пациенту или субъекту вводится стимул или сигнал, стимулирующий или вызывающий экспрессию посттранскрипционного активатора экспрессирующей паракринный фактор нуклеиновой кислоты или гена, или активатор промотора, функционально связанного с экспрессирующей паракринный фактор нуклеиновой кислотой или геном, или
(g) индивидууму, пациенту или субъекту вводится стимул или сигнал, который ингибирует или вызывает ингибирование транскрипционного репрессора или посттранскрипционного репрессора экспрессирующей паракринный фактор нуклеиновой кислоты или гена.
В альтернативных вариантах осуществления способов изобретения химическое или фармацевтическое вещество, вызывающее экспрессию экспрессирующей паракринный фактор нуклеиновой кислоты или гена, или вызывающее экспрессию регулируемого или индуцибельного промотора, функционально связанного с экспрессирующей паракринный фактор нуклеиновой кислотой или геном, представляет собой антибиотик для перорального приема, доксициклин или парамицин; или для индукции экспрессии экспрессирующей паракринный фактор нуклеиновой кислоты или гена, или его эквивалента, применяется tet-регулируемая система с использованием доксициклина.
В альтернативных вариантах осуществления способов изобретения экспрессирующая паракринный фактор нуклеиновая кислота или ген или средство для экспрессии, вектор, рекомбинантный вирус или эквивалент входит в состав жидкости, геля, гидрогеля, порошка или водосодержащей композиции.
В альтернативных вариантах осуществления способов изобретения экспрессирующая паракринный фактор нуклеиновая кислота или ген или средство для экспрессии, вектор, рекомбинантный вирус, или эквивалент, или пептид или полипептид урокортина-2 (UCn-2) заключается в состав везикулы, липосомы, наночастицы или нанолипидной частицы (NLP) или эквивалентов или создается с целью доставки с использованием везикулы, липосомы, наночастицы или нанолипидной частицы (NLP) или эквивалентов.
В альтернативных вариантах осуществления способов изобретения экспрессирующая паракринный фактор нуклеиновая кислота или ген или средство для экспрессии, вектор, рекомбинантный вирус или эквивалент, включается в состав, или вводится или трансфицируется в изолированную или культивируемую клетку, при этом необязательно данная клетка является клеткой млекопитающего, клеткой сердца, клеткой человека, клеткой примата, не являющегося человеком, клеткой обезьяны, клеткой мыши, клеткой крысы, клеткой морской свинки, клеткой кролика, клеткой хомяка, клеткой козы, клеткой коровы, лошади, овцы, собаки или кошки.
В альтернативных вариантах осуществления способов изобретения экспрессирующая паракринный фактор нуклеиновая кислота или ген или средство для экспрессии, вектор, рекомбинантный вирус, или эквивалент, или пептид или полипептид урокортина-2 (UCn-2) создается в виде фармацевтической или стерильной композиции.
В альтернативных вариантах осуществления способов изобретения экспрессирующая паракринный фактор нуклеиновая кислота или ген или средство для экспрессии, вектор, рекомбинантный вирус, или эквивалент, или пептид или полипептид урокортина-2 (UCn-2) входит в состав или доставляется при использовании, на или в сочетании с продуктом производства, искусственным органом или имплантатом.
В альтернативных вариантах осуществления способов изобретения экспрессирующая паракринный фактор нуклеиновая кислота или ген или средство для экспрессии, вектор, рекомбинантный вирус или эквивалент экспрессирует паракринный полипептид in vitro или ex vivo.
В альтернативных вариантах осуществления изобретение предоставляет способы лечения, улучшения состояния или защиты (предохранения) индивидуума или пациента от патологии, инфекции, болезни, расстройства или состояния, чувствительного к паракринному фактору, включающие применение способа изобретения.
В альтернативных вариантах осуществления изобретение предоставляет способы лечения, улучшения состояния при или предотвращения нарушения сократительной функции сердца; сердечной недостаточности с застойными явлениями (CHF); фиброза сердца; поражения кардиомиоцитов, дисфункции или апоптоза; легочной гипертензии; заболевания, рака или дисфункции сердца, кожи, печени, легких, мышц, нервов, мозга и почек; рака или новообразования; или гемофилии или гемофилии В, включающие применение способа изобретения.
В альтернативных вариантах осуществления изобретение предоставляет способы лечения, улучшения состояния при или предотвращения диабета или предиабета у пациента или индивидуума, включающие:
(a) осуществление способа изобретения, согласно которому паракринный полипептид или пептид содержит или состоит из урокортина-2 (UCn-2); и
(b) введение пептида или полипептида урокортина-2 (UCn-2), или нуклеиновой кислоты, гена, мРНК или транскрипта, кодирующего урокортин-2 (UCn-2), индивидууму или пациенту, нуждающемуся в этом,
при этом необязательно пептид или полипептид урокортина-2 (UCn-2) является изолированным, рекомбинантным, синтетическим и/или пептидомиметическим пептидом или полипептидом или его вариантом,
и посредством этого лечение, улучшение или предотвращение диабета или предиабета у пациента или индивидуума.
В альтернативных вариантах осуществления изобретение предоставляет способы лечения, улучшения или предотвращения ожирения у пациента или индивидуума, включающие:
(a) осуществление на практике способа изобретения, согласно которому паракринный полипептид или пептид содержит или состоит из урокортина-2 (UCn-2); и
(b) введение пептида или полипептида урокортина-2 (UCn-2) или нуклеиновой кислоты, гена, мРНК или транскрипта, кодирующего урокортин-2 (UCn-2) индивидууму или пациенту, нуждающемуся в этом,
при этом необязательно пептид или полипептид урокортина-2 (UCn-2) является изолированным, рекомбинантным, синтетическим и/или пептидомиметическим пептидом или полипептидом или его вариантом,
и посредством этого лечение, улучшение или предотвращение ожирения у пациента или индивидуума.
В альтернативных вариантах осуществления изобретение предоставляет способы подавления увеличения веса, или подавления аппетита, или стимулирования или инициирования потери веса у пациента или индивидуума, включающие:
(a) осуществление на практике способа изобретения, согласно которому паракринный полипептид или пептид содержит или состоит из урокортина-2 (UCn-2); и
(b) введение пептида или полипептида урокортина-2 (UCn-2) или нуклеиновой кислоты, гена, мРНК или транскрипта, кодирующего урокортин-2 (UCn-2), индивидууму или пациенту, нуждающемуся в этом,
при этом необязательно пептид или полипептид урокортина-2 (UCn-2) является изолированным, рекомбинантным, синтетическим и/или пептидомиметическим пептидом или полипептидом или его вариантом,
и посредством этого подавление увеличения веса, или подавление аппетита, или стимулирование или инициирование потери веса у пациента или индивидуума.
В альтернативных вариантах осуществления пептид или полипептид урокортина-2 (UCn-2) заключается в состав или создается в виде везикулы, липосомы, наночастицы или нанолипидной частицы (NLP), или заключается в состав, предназначенный для перорального введения, внутримышечной (Ш) инъекции, внутривенной (IV) инъекции, подкожной (SC) или внутрикожной инъекции, подоболочечной инъекции, внутриартериальной (IA) инъекции, внутрикоронарной инъекции, ингаляции или введения при помощи аэрозоля.
Подробности одного или более вариантов осуществления изобретения изложены в прилагаемых чертежах и описании ниже. Другие признаки, цели и преимущества изобретения станут понятны из описания и чертежей, а также пунктов формулы изобретения.
Все публикации, патенты, патентные заявки, приведенные в данном документе, во всех отношениях явным образом включены в данный документ путем отсылки.
Описание чертежей
Фигура 1 иллюстрирует типичный пример конструкции изобретения, содержащей AAV5, кодирующий IGF1, как описано в Примере 2 ниже.
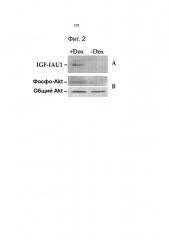
Фигура 2А и Фигура 2В иллюстрируют результаты исследований, в которых культивируемые миоциты сердца новорожденных крыс были инфицированы типичной конструкцией по изобретению - AAV5.IGFI.tet, при этом IGFI был индуцирован, экспрессирован и затем измерен, как описано в Примере 2 ниже.
Фигура 3 графически иллюстрирует регулируемую экспрессию мРНК IGFI в культивируемых миоцитах сердца новорожденных крыс после введения гена с помощью AAV5.IGFI-tet, добавления и затем удаления доксициллина, как описано в Примере 2 ниже.
Фигура 4А - микрофотографии, демонстрирующие экспрессию EGFP в односторонней передней большеберцовой мышце через 3 недели после введения гена AAV5.EGFP у крыс; и Фигура 4 В - Таблица 4, суммирующая результаты эхокардиографического измерения эффектов экспрессии IGFI в скелетных мышцах при CHF, как описано в Примере 2 ниже.
Фигура 5 представляет протокол эксперимента по переносу гена с помощью конструкции AAV5.IGFI.tet по изобретению в скелетную мышцу при CHF, как описано в Примере 2 ниже.
Фигура 6 иллюстрирует эффекты введения гена AAV5.IGFI-tet на апоптоз и фиброз сердца. Фигура 6А графически иллюстрирует результаты TUNEL-окрашивания, которые показывают, что активация экспрессии IGFI (IGF-Вкл) была связана с уменьшенным апоптозом миоцитов сердца. Фигура 6В иллюстрирует окрашенные пикросириусом красным срезы не подвергавшейся инфаркту внутрижелудочковой перегородки, полученной от крыс IGF-выкл и IGF-вкл, демонстрирующие уменьшенный фиброз сердца, при этом область фракции коллагена была уменьшена. Фигура 6С графически иллюстрирует данные, полученные от крыс IGF-выкл и IGF-вкл, как описано в Примере 2 ниже.
Фигура 7 графически иллюстрирует, что внутривенное введение типичной конструкции AAV5 давало лучшие результаты в отношении увеличения уровней в сыворотке IGFI, чем внутримышечное введение: внутривенная доставка у мышей, внутримышечная доставка у крыс, как описано в Примере 2 ниже.
Фигура 8 представляет результаты (графики и изображение), показывающие относительную эффективность внутривенной доставки конструкций по изобретению AAV5 и AAV9 с использованием числа копий и экспрессии трансгена в печени и сердце в качестве конечных точек, как описано в Примере 2 ниже.
Фигура 9 иллюстрирует типичный протокол определения и тестирования наиболее подходящего вектора для использования при желаемых или определенных показаниях при осуществлении способа изобретения, как обсуждается в Примере 2 ниже.
Фигура 10(А, В, С, D, Е и F) иллюстрируют типичные векторные конструкции изобретения, как описано в Примере 2 ниже.
Фигура 11 графически иллюстрирует результаты, показывающие, что IV и AAV8 представляют собой оптимальный вектор и способ доставки для достижения устойчивых повышенных уровней сывороточного урокортина-2 (UCn-2) при паракринном подходе, как описано в Примере 3 ниже.
Фигура 12А графически иллюстрирует зависимость от времени экспрессии мРНК UCn2 в печени после IV введения типичной конструкции AAV8.CBA.UCn2; и Фигура 12В графически иллюстрирует результаты, показывающие экспрессию UCn2 мРНК в LV через 6 недель после IV введения AAV8.CBA.UCn2, как описано в Примере 3 ниже.
Фигура 13 графически иллюстрирует результаты определения, увеличивает ли перенос гена UCn2 LV-функцию у мышей путем доставки типичной конструкции по изобретению AAV8.UCn2 с помощью внутривенного (IV) введения: на Фигуре 13А графически показано, что перенос гена UCn2 увеличивал сократительную функцию LV; Фигура 13В графически иллюстрирует, что dP/dt (скорость нарастания давления в левом желудочке) была уменьшена, указывая на увеличенную релаксацию LV, как описано в Примере 3 ниже.
Фигура 14 иллюстрирует результаты, демонстрирующие эффекты введения UCn2 на сердечную недостаточность: Фиг. 14А представляет протокол исследования; а Фигуры 14В и 14С показывают результаты воздействия введения UCn2 на сердечную недостаточность, как описано в Примере 3 ниже.
Фигура 15 представляет (Фиг. 15А - график, Фиг. 15В - иммуноблот) результат IV доставки нормальным мышам типичного AAV8.CBA.UCn2; причем полученные через четыре недели образцы LV из группы с переносом UCn2 гена показали 2-кратное увеличение экспрессии бежа SERCA2a, как описано в Примере 3 ниже.
Фигура 16 представляет результаты изменения выброса Са2+ (Са2+ transients) после введения UCn2 гена: Фиг. 16А графически иллюстрирует, что введение гена UCn2 увеличивало скорость понижения Са2+; Фиг. 16В графически иллюстрирует, что время до затухания выбросов Са2+ было укорочено в миоцитах сердца, взятых у мышей, которым ввели ген UCN2, что было осуществлено за 4 недели до этого, как описано в Примере 3 ниже.
Фигура 17 демонстрирует, что UCn2 защищает культивируемые миоциты сердца новорожденных крыс от гипоксического повреждения: Фиг. 17А иллюстрирует, что UCn2 поддерживает нормальное морфологическое состояние через 24 часа после обработки NaN3; Фиг. 17В графически иллюстрирует, что UCn2 уменьшал высвобождение LDH после обработки NaN3, как описано в Примере 3 ниже.
Фигура 18 графически иллюстрирует, что было обнаружено фосфорилирование и CREB (Фиг. 18А) и β-катенина (Фиг. 18В) в образцах LV через 4 недели после IV доставки типичной конструкции по изобретению UCn2.CBA.UCn2, как описано в Примере 3 ниже.
Фигура 19 показывает, что UCn2 оказывает влияние на регуляцию глюкозы. Мыши IV получали типичный AAV8.CBA.UCn2. Фиг. 19А иллюстрирует, что наблюдалось небольшое уменьшение уровня глюкозы в крови натощак в UCn2 группе. Фиг. 19В иллюстрирует, что перенос UCn2 гена способствует утилизации глюкозы и защищает от вызванной диетой гипергликемии, как описано в Примере 3 ниже.
Фигура 20(А, В, С, D, Е и F) иллюстрируют типичные конструкции изобретения, как описано в Примере 3 ниже.
Одинаковые условные обозначения на различных чертежах показывают одинаковые элементы.
Подробное описание изобретения
Данное изобретение предоставляет композиции и in vivo и ex vivo способы, включающие введение кодирующих паракринный фактор нуклеиновых кислот, генов, транскриптов или мРНК с целью лечения, улучшения состояния или защиты (в качестве профилактики) индивидуумов от болезней, инфекций или состояний, чувствительных к повышенным уровням паракринных факторов in vivo. В альтернативных вариантах осуществления изобретение предоставляет композиции и способы для in vivo или in situ доставки и/или in vivo экспрессии и контролируемой экспрессии какого-либо паракринного полипептида или пептида, например, кардиотонического пептида млекопитающих, серелаксина, релаксина-2, урокортина-2, урокортина-1, урокортина-3, мозгового натрийуретического пептида, простациклин синтазы, гормона роста, инсулин-подобного фактора роста 1 или любой их комбинации; или кардиотонического пептида человека, серелаксина, релаксина-2, урокортина-2, урокортина-1, урокортина-3, мозгового натрийуретического пептида, простациклинсинтазы, гормона роста, инсулиноподобного фактора роста 1 или любой их комбинации.
В альтернативных вариантах осуществления изобретение предоставляет композиции и способы доставки и контролируемой экспрессии кодирующей паракринный фактор нуклеиновой кислоты или гена или средства для экспрессии (например, вектора, рекомбинантного вируса и тому подобного), содержащего (имеющего содержащуюся в нем) кодирующую паракринный фактор нуклеиновую кислоту или ген, в результате чего паракринный белок высвобождается в кровоток или системное кровообращение, где он может оказывать благотворное действие на организм, например, сердце, в случае лечения сердечно-сосудистой болезни, или легкие или почки или другие мишени.
В альтернативных вариантах осуществления изобретение обеспечивает средства для экспрессии, векторы, рекомбинантные вирусы и тому подобное с целью экспрессии in vivo кодирующей паракринный фактор нуклеиновой кислоты или гена для осуществления способов изобретения. В альтернативных вариантах осуществления средства для экспрессии, векторы, рекомбинантные вирусы и тому подобное, экспрессирующие кодирующую паракринный фактор нуклеиновую кислоту или ген, могут быть доставлены с помощью внутримышечной (IM) инъекции, внутривенной (IV) инъекции, подкожной инъекции, с помощью ингаляции, с помощью биолистической системы доставки частиц (например, так называемой "генной пушки") и тому подобного, например, амбулаторному пациенту во время визита в клинику.
В альтернативных вариантах осуществления этот "периферический" способ доставки, например, средства для экспрессии, векторы, рекомбинантные вирусы и тому подобное, введенное IM или IV, может преодолеть возникшие проблемы в тех случаях, когда гены или нуклеиновые кислоты экспрессируются непосредственно в самом органе (например, сердце, легком или почке). Кроме того, устойчивая секреция желательного паракринного белка(ов) в кровоток или системное кровообращение «обходит» трудности и издержки введения белков путем вливания, которое может быть проблематичным для многих белков, демонстрирующих очень короткое время полужизни в организме, что суммировано в Таблице 1 ниже:
В альтернативных вариантах осуществления изобретение предоставляет способы, обеспечивающие «включение» и «выключение» экспрессии нуклеиновой кислоты, экспрессирующей паракринный фактор, или гена просто и эффективно с целью индвидуализированного лечения и с гарантией оптимальной безопасности.
В альтернативных вариантах осуществления паракринный белок или белки, экспрессированные экспрессирующей паракринный фактор нуклеиновой кислотой(ами) или геном(ами) оказывают полезные или благоприятные эффекты (например, терапевтические или профилактические) на ткань или орган, например, сердце, кровеносные сосуды, легкие, почки или другие мишени, даже в случае выделения в кровь или системное кровообращение на расстоянии (например, анатомически отдаленно) от места или мест приложения их действия.
В типичном варианте осуществления изобретения используется нуклеиновая кислота, экспрессирующая паракринный фактор, или ген, кодирующий урокортин-2, однако для осуществления способов этого изобретения могут использоваться другие нуклеиновые кислоты, экспрессирующие паракринный фактор, или гены, включая, но не ограничиваясь этим, например, для лечения сердечной недостаточности с застойными явлениями (CHF) или легочной гипертензии, урокортин-1 и урокортин-3, мозговой натрийуретический пептид (для лечения CHF), простациклинсинтазу (для лечения легочной гипертензии), гормон роста и/или инсулиноподобный фактор роста-1 или любую их комбинацию.
В альтернативных вариантах осуществления изобретение предоставляет варианты применения, и композиции и способы, с целью предоставления системы регулируемой экспрессии, обеспечивающей контролируемую экспрессию гена паракринного типа для лечения болезни сердца или легких, например, сердечной недостаточности с застойными явлениями (CHF) или легочной гипертензии.
Например, в альтернативных вариантах осуществления рекомбинантный вирус (например, долгоживущий вирус или вирусный вектор), вектор или вектор экспрессии, и тому подобное, может быть введен, например, системно в вену (например, IV) или с помощью внутримышечной (IM) инъекции, с помощью ингаляции или с помощью биолистической системы доставки частиц (например, так называемой "генной пушки"), например, амбулаторному пациенту в кабинете врача. В альтернативных вариантах осуществления спустя дни или недели (например, через четыре недели), индивидууму, пациенту или субъекту вводят (например, с помощью ингаляции, путем введения или проглатывания), химическое или фармацевтическое вещество, вызывающее экспрессию нуклеиновых кислот, экспрессирующих паракринный фактор, или генов; например, антибиотик для перорального приема (например, доксициклин или рапамицин) вводится один раз в день (или чаще или реже), который будет активировать экспрессию гена. В альтернативных вариантах осуществления после "активации" или индуцирования экспрессии (например, с помощью индуцибельного промотора) нуклеиновой кислоты или гена, паракринный белок синтезируется и высвобождается в сосудистое русло субъекта (например, в кровь), а затем вызывает благоприятные физиологические эффекты, например, терапевтические или профилактические, приносящие пользу индивидууму или пациенту (например, оказывает благотворное действие на функцию сердца, почек или легких), в зависимости от экспрессированного паракринного белка или белков. В том случае, когда врач или субъект хочет прекратить лечение, субъект просто прекращает прием активирующего химического или фармацевтического вещества, например, антибиотика.
Изобретатели использовали AAV вектор, кодирующий урокортин-2, и вводили данный вектор мыши, используя внутривенную доставку. Результаты показали: 1) 17-кратное увеличение уровней трансгена в сыворотке через 4-6 недель после внутривенной доставки вектора; 2) явно выраженные благоприятные эффекты на сократительную функцию сердца (систолическую функцию) и 3) явно выраженные благоприятные эффекты на сердечную релаксацию (диастолическую функцию).
В альтернативных вариантах осуществления варианты применения настоящего изобретения включают лечение тяжелой сердечной недостаточности со сниженной фракцией выброса; лечение легочной гипертензии; лечение сердечной недостаточности с сохраненной фракцией выброса; замену текущего лечения, которое требует госпитализации и постоянных внутривенных вливаний вазоактивных пептидов для лечения легочной гипертензии и сердечной недостаточности; и лечение других состояний, при которых контролируемая экспрессия гена паракринного типа может использоваться для обеспечения благоприятных эффектов на расстоянии в организме.
Получение и манипулирование нуклеиновыми кислотами
В альтернативных вариантах осуществления способов изобретения предоставляются изолированные, синтетические и/или рекомбинантные нуклеиновые кислоты или гены, кодирующие паракринные полипептиды. В альтернативных вариантах осуществления способов изобретения предоставляются экспрессирующие паракринный фактор нуклеиновые кислоты или гены в рекомбинантной форме в (например, сплайсированные в) носителе экспрессии с целью экспрессии in vivo, например, в векторе или рекомбинантном вирусе. В других альтернативных вариантах осуществления изобретение предоставляет, например, изолированные, синтетические и/или рекомбинантные нуклеиновые кислоты, кодирующие ингибирующие нуклеиновые кислоты (например, миРНК, микроРНК, антисмысловые, рибозимы), которые могут ингибировать экспрессию генов или мРНК (мРНК), которые ингибируют экспрессию желательного паракринного гена.
В альтернативных вариантах осуществления нуклеиновые кислоты изобретения получают, выделяют и/или манипулируют ими, например, путем клонирования и экспрессии кДНК библиотек, амплификации мРНК или геномной ДНК с помощью ПЦР и тому подобного. Нуклеиновые кислоты и гены, используемые для применения на практике этого изобретения, включая ДНК, РНК, иРНК, антисмысловую нуклеиновую кислоту, кДНК, геномную ДНК, векторы, вирусы или их гибриды, могут быть выделены из целого ряда источников, созданы методами генетической инженерии, амплифицированы и/или экспрессированы/получены рекомбинантным путем. Рекомбинантные полипептиды (например, паракринные химерные белки, используемые для осуществления изобретения), полученные из этих нуклеиновых кислот, могут быть индивидуально-изолированы или клонированы и проверены относительно желательной активности. Может использоваться любая рекомбинантная система экспрессии или система доставки генной терапии, включая например, вирусные (например, AAV конструкции или гибриды) и бактериальные, системы экспрессии с использованием клеток грибов, млекопитающих, дрожжей, насекомых или растений или средства для экспрессии.
Альтернативно, нуклеиновые кислоты, используемые для осуществления этого изобретения, могут быть синтезированы in vitro с помощью хорошо известных методов химического синтеза, как описано, например, в Adams (1983) J. Am. Chem. Soc. 105:661; Belousov (1997) Nucleic Acids Res. 25:3440-3444; Frenkel (1995) Free Radic. Biol. Med. 19:373-380; Blommers (1994) Biochemistry 33:7886-7896; Narang (1979) Meth. Enzymol. 68:90; Brown (1979) Meth. Enzymol. 68:109; Beaucage (1981) Tetra. Lett. 22:1859; патенте США №4458066.
Методы манипулирования нуклеиновыми кислотами, используемыми для осуществления этого изобретения,