Способ диагностики хронического эндометрита в среднюю стадию фазы секреции
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к акушерству и гинекологии, и предназначено для диагностики хронического эндометрита (ХЭ) в среднюю стадию фазы секреции. Путем пайпель-биопсии эндометрия с помощью атравматической аспирационной кюретки производят забор фрагмента слизистой оболочки полости матки в среднюю стадию фазы секреции. Методом количественной ОТ-ПЦР в режиме реального времени определяют уровень мРНК гена VEGFA. При уровне более 0,250 делают заключение о наличии ХЭ. Изобретение обеспечивает эффективную диагностику ХЭ по профилю экспрессии мРНК генов в эндометрии в период «окна имплантации» у женщин с трубно-перитонеальным бесплодием. 2 ил., 3 пр.
Реферат
1. Область техники
Изобретение относится к медицине, в частности к акушерству и гинекологии, и может использоваться для диагностики хронического эндометрита в период «окна имплантации», что особенно актуально для пациенток с трубно-перитонеальным бесплодием.
2. Уровень техники
В ряде исследований последних лет продемонстрировано, что морфофункциональное состояние эндометрия вносит существенный вклад в эффективность программ экстракорпорального оплодотворения (ЭКО) [1, 2, 6, 16, 18]. В структуре причин женского бесплодия частота приобретенной внутриматочной патологии составляет около 50% [9, 13, 18]. Хронический эндометрит (ХЭ) занимает первое место в структуре патологических изменений эндометрия, его распространенность у женщин с бесплодием варьирует от 2,8 до 70% [12, 18]. У пациенток с неудачными попытками ЭКО и ПЭ в анамнезе частота ХЭ по разным данным составляет от 30% до 60% [1, 16, 18].
При хроническом эндометрите нет четких диагностических критериев и яркой клинической картины. Гистологической верификацией диагноза является наличие плазматических клеток в биоптатах эндометрия в первую фазу менструального цикла. Большинство морфологов для постановки диагноза «хронический эндометрит» подчеркивают обязательное выявление в строме эндометрия даже единичных плазматических клеток, которые, по их мнению, в здоровой ткани эндометрия не содержатся [4, 7, 14, 17, 19, 20, 21]. Обнаружить плазматические клетки не всегда удается из-за таких причин, как некачественное окрашивание или ошибка медицинского работника, а также трудности визуальной идентификации клеток при простой световой микроскопии [14, 17].
Важно помнить о том, что при исследовании материала, полученного в среднесекреторную фазу менструального цикла (ЛГ+7) для оценки рецептивности эндометрия поставить гистологический диагноз хронического эндометрита зачастую очень сложно.
Следовательно, очень важно соблюдать временные промежутки взятия соскобов и биоптатов эндометрия. Для диагностики хронического эндометрита - 7-10 день менструального цикла, для оценки рецептивности эндометрия - период «окна имплантации» (ЛГ+7). Однако у пациенток, планирующих реализацию репродуктивной функции в программе ЭКО, является крайне актуальным проведение биопсии эндометрия в период «окна имплантации», что позволит одномоментно выявить наличие воспаления в эндометрии, оценить состояние рецепторного аппарата, а также служить основой для разработки тактики прегравидарной подготовки.
Учитывая повышенный интерес исследователей в последнее десятилетие к оценке «имплантационного эндометрия» у пациенток с бесплодием, актуальным является поиск возможных диагностических критериев ХЭ именно в этот короткий временной промежуток [6, 7, 8].
На данном этапе развития науки совершенствуются иммуногистохимические (ИГХ) и молекулярно-генетические критерии диагностики ХЭ. Но исследования, посвященные диагностике данного заболевания в период «окна имплантации», единичны, а результаты их противоречивы.
В патенте Михневой Е.А. и соавт. в 2004 году предложен способ диагностики ХЭ во вторую фазу менструального цикла путем выявления воспаления в ткани эндометрия на основании комплексного клинико-морфологического обследования женщин, определения показателей местного иммунитета, характерных для воспаления, иммуногистоцитохимическим методом (количество лимфоцитов, экспрессирующих маркеры естественных киллерных клеток CD56+, CD16+ и маркеры активации HLA-DR(II)+) и уточнения характера воспалительного процесса при сопоставлении показателей местного и системного иммунитета [11].
В своем исследовании Pietro С. Di и соавт. в 2013 году изучали профиль экспрессии 25 генов, кодирующих белки, которые участвуют в воспалительной реакции, пролиферации и апоптозе с использованием высокопроизводительной полимеразной цепной реакции (high throughput real time PCR) в режиме реального времени. Исследование показало, что у пациенток с хроническим эндометритом значительно изменена экспрессия генов, кодирующих провоспалительные цитокины, факторы роста и процессы апоптоза. Так, экспрессия IGFBP1, BCL2 и ВАХ была повышена, а экспрессия IL11, СС14, IGF1 и CASP8 - снижена [15].
При изучении иммуногистохимических параметров «имплантационного» эндометрия при хроническом эндометрите Манухин И.Б. и соавт. в 2014 году выявили, что при ИГХ исследовании воспалительные изменения в эндометрии характеризовались высоким уровнем VEGFA. При этом наибольшая экспрессия наблюдалась на 5-7 день менструального цикла, а наименьшая - на 19-21. Интенсивность экспрессии VEGFA в первой и второй фазах менструального цикла превышала аналогичные показатели пациенток контрольной группы [10].
Бурменская О.В. в 2014 году выделила наиболее важные молекулярно-генетические маркеры воспалительного процесса при хроническом эндометрите в фазе пролиферации. Было установлено, что экспрессии генов иммунного ответа в эндометрии зависит от фазы менструального цикла и наличия воспаления. При полном симптомокомплексе хронического эндометрита и лимфоидной инфильтрации стромы эндометрия повышена экспрессия мРНК генов IL1β, IL6, IL8, IL10, IL12A, TNF, TGFB1, Foxp3, IL2Rα, LIF, TLR9, VEGFA, TLR2. Склерозирование сосудов и фиброз стромы эндометрия сопровождаются более выраженным изменением цитокинового каскада: повышается экспрессия мРНК генов: IL1β, IL6, IL8, IL12A, TGFB1, Foxp3, IL2Rα, LIF, TLR9, VEGFA, TLR2, IL18, IFNG и TLR4 [3].
Tortorella С. и соавт. в 2014 году также выявили молекулярно-генетические маркеры хронического эндометрита в первую фазу менструального цикла: IL-6, IL1β и TNFα [22].
Гомболевская Н.А. и соавт. в 2013 году изучали особенности экспрессии мРНК генов цитокинов, толл-подобных рецепторов (TLR) и других маркеров иммунокомпетентных клеток в тканях эндометрия при хроническом эндометрите в первой фазе менструального цикла. Авторами описаны особенности экспрессионного профиля цитокинов при хроническом эндометрите, на основе которого предложен способ определения вероятности развития фиброза стромы эндометрия при хроническом эндометрите. Выраженный процесс фиброза стромы эндометрия предложено оценивать по уровню экспрессии мРНК 6 генов: интерлейкинов IL1β IL2, IL10, Foxp3, TLR9 и IL2Ra [5].
Задачей изобретения является разработка способа диагностики ХЭ по профилю экспрессии мРНК генов в эндометрии в период «окна имплантации» у женщин с трубно-перитонеальным бесплодием.
Задача решается путем взятия биоматериала из эндометрия в период средней стадии фазы секреции (день пика ЛГ+7 дней) методом пайпель-биопсии эндометрия с помощью атравматической аспирационной кюретки «Pipelle de Cornier». Используя метод количественной полимеразной цепной реакции с предварительной стадией обратной транскрипции (ОТ-ГЩР) в режиме реального времени, определяют уровень мРНК гена VEGFA. При выявлении уровня мРНК гена VEGFA >0,250 делают заключение о наличии хронического эндометрита (чувствительность 64%, специфичность 89%).
Методика исследования (или описание изобретения, или сущность изобретения)
Предложен способ диагностики хронического эндометрита в среднюю стадию фазы секреции путем определения уровня мРНК гена VEGFA в имплантационном эндометрии.
Изобретение получено на основании обследования 33 женщин с трубно-перитонеальным бесплодием (ТПБ) и двумя безуспешными попытками ЭКО в анамнезе, планирующих реализацию репродуктивной функции в программе ЭКО. Возраст пациенток не превышал 37 лет, все женщины имели овуляторный менструальный цикл и У3-критерии хронического эндометрита (повышение эхогенности эндометрия, расширение полости матки, неровный контур эндометрия, неоднородная эхоструктура эндометрия) и толщиной эндометрия в период предполагаемого «окна имплантации» не менее 8 мм.
Для выявления мРНК генов в среднюю стадию фазу секреции, ассоциированных с ХЭ всем 33 пациенткам в 1 фазу менструльного цикла были проведены ГС и диагностическое выскабливание (ДВ) эндометрия а также пайпель-биопсия в день предполагаемого «окна имплантации» следующего менструального цикла.
ГС выполняли с помощью жесткого 5-миллиметрового гистероскопа фирмы «Karl Storz» (Германия) по общепринятой методике. Для инстилляции жидкости с целью регуляции скорости потока и давления использовали аппарат HAMEUO ENDOMAT, «Karl Storz». Под гистероскопическим контролем проводили ДВ эндометрия.
В зависимости от результатов гистологического исследования соскоба эндометрия были сформированы две группы: 1 группа (основная) из 15 пациенток, у которых при гистологическом исследовании соскобов эндометрия в фазе пролиферации обнаружены плазматические клетки, 2 группа (сравнения) из 18 женщин, у которых плазматические клетки не были обнаружены.
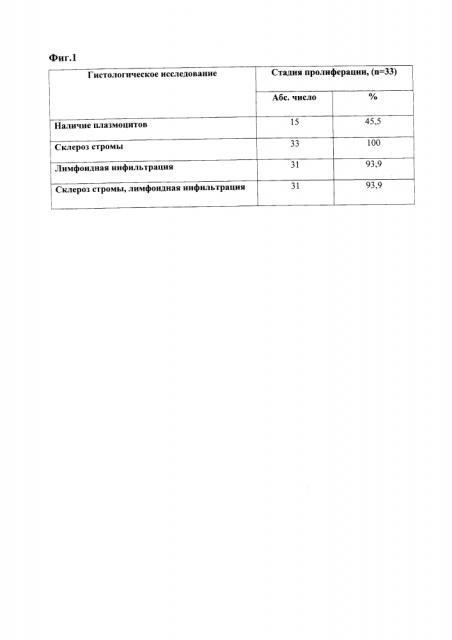
При гистологическом исследовании соскобов эндометрия плазматические клетки были обнаружены у 15 (45,5%) из 33 пациенток, склероз стромы - у всех 33 женщин, лимфоидная инфильтрация стромы - у 31 (93,9%), сочетание склероза стромы и лимфоидной инфильтрации у 31 женщины (93,9%) (фиг. 1). Таким образом, по результатам гистологического исследования в 1 фазу менструального цикла ХЭ был верифицирован по наличию плазматических клеток у каждой второй пациентки. У 18 (56,3%) женщин - плазматические клетки отсутствовали.
На следующем этапе исследования был проанализирован уровнь мРНК 39 генов в эндометрии. Для оценки диагностической значимости молекулярно-генетических маркеров в биоптатах эндометрия при ХЭ проанализирован уровнь мРНК 39 генов и проведен многофакторный регрессионный анализ, по результатам которого был выбран единственный независимый информативный маркер VEGFA, позволяющий диагностировать наличие ХЭ во вторую фазу цикла. Согласно проведенному ROC-анализу высокий уровень экспрессии мРНК VEGFA ассоциирован с наличием плазматических клеток в 1 фазе менструального цикла. Пороговым значением выбран уровень экспрессии, равный 0,250. Площадь под кривой составила 0,778 (0,612-0,943). Чувствительность и специфичность модели в области порогового значения составили 64% и 89% соответственно. Таким образом, экспрессия мРНК гена VEGFA (>0,250) в среднюю стадию фазы секреции ассоциирована с наличием ХЭ (чувствительность 64%, специфичность 89%) (фиг. 2).
Реализация изобретения
Биопсию эндометрия проводили в амбулаторных условиях в день менструального цикла ЛГ+7, который определяли с помощью мочевого теста Clear Blue («Unipath Ltd», Великобритания), основанного на определении увеличения уровня ЛГ в моче. С помощью аспирационной кюретки Pipelle de Cornier («LaboratorieC.C.D.», Франция) получали биоптат эндометрия, который был поделен на 2 части: для гистологического и молекулярно-генетического исследования. Гистологическое исследование проводилось в 1 патологоанатомическом отделении ФГБУ "НЦ АГиП им. В.И. Кулакова" Минздрава РФ в соответствии с современными стандартами.
Материалы биоптатов эндометрия для молекулярно-генетического исследования помещали в пробирки со средой для стабилизации РНК (лизирующий растовор из комплекта реагентов «Проба-НК» (ООО «НПО ДНК-Технология», Россия). В биоптатах эндометрия проанализирован уровень экспрессии мРНК гена VEGFA (общий и изоформа 189).
Оценку уровня экспрессии мРНК проводили с помощью количественной полимеразной цепной реакции с предварительной стадией обратной транскрипции (ОТ-ПЦР) в режиме реального времени («ДНК-Технология», Россия). Реакция амплификации проводилась с помощью детектирующего амплификата ДТ-96 («ДНК-Технология», Россия).
Нормировка уровня экпрессии генов выполнена с использованием метода сравнения индикаторных циклов (метод ΔΔСр) по четырем референсным генам HPRT1, ТВР, В2М, GUSB. В качестве меры центральной тенденции выбрана медиана (Me), а в качестве интервальной оценки - верхний (L) и нижний квартили (Н). На последнем этапе проводили статистический анализ полученных клинико-лабораторных данных.
Клинические примеры
Пример 1. Пациентка В., 28 лет, обратилась для проведения программы ЭКО и ПЭ с жалобами на 2 неудачные попытки ЭКО в анамнезе. По данным УЗИ эхо-признаки ХЭ. Произведено взятие биоматериала (биоптата эндометрия) в период «окна имплантации» для исследования методом количественной полимеразной цепной реакции с предварительной стадией обратной транскрипции (ОТ-ПЦР) в режиме реального времени для определения уровня мРНК гена VEGFA. При этом выявлено: уровень экспрессии мРНК гена VEGFA составил 0,330 (более 0,250). Таким образом, у пациентки В. диагносцирован хронический эндометрит.
Пример 2. Пациентка Т., 35 лет, обратилась для проведения программы ЭКО и ПЭ с жалобами на отсутствие беременности в течение 7 лет. По данным УЗИ эхо-признаки ХЭ. Произведено взятие биоматериала (биоптата эндометрия) в период окна имплантации для исследования методом количественной полимеразной цепной реакции с предварительной стадией обратной транскрипции (ОТ-ПЦР) в режиме реального времени для определения уровня мРНК гена VEGFA. При этом выявлено: уровень экспрессии мРНК гена VEGFA составил 0,290 (более 0,250). Таким образом, у пациентки В. диагносцирован хронический эндометрит.
Пример 3. Пациентка Л., 31 год, обратилась для проведения программы ЭКО и ПЭ с жалобами на первичное бесплодие в течение 5 лет. На основании анализа лабораторных исследований выявлено: по данным УЗИ обнаружены эхо-признаки неоднородного эндометрия. Произведено взятие биоматериала (биоптата эндометрия) в период окна имплантации для исследования методом количественной полимеразной цепной реакции с предварительной стадией обратной транскрипции (ОТ-ПЦР) в режиме реального времени для определения уровня мРНК гена VEGFA. При этом выявлено: уровень экспрессии мРНК гена VEGFA составил 0,150 (менее 0,250). Таким образом, у пациентки Л. диагносцированы остаточные явления хронического эндометрита, не требующие назначения прегравидарной подготовки перед проведением программы ЭКО и ПЭ.
На фиг. 1 - результаты гистологического исследования соскобов эндометрия в фазу пролиферации.
На фиг. 2 - ROC-анализ вероятности наличия плазматических клеток от уровня экспрессии мРНК VEGFA.
Источники информации
1. Бессмертная В.С., Самойлов М.В., Бабиченко И.И., Серебренникова К.Г. Морфологические и иммуногистохимические особенности эндометрия женщин с первичным и вторичным бесплодием // Архив патологии. - 2008. - Т. 70, №4.
2. Бурлев В.А., Кузьмичев Л.Н., Онищенко А.С., Ильясова Н.А., Щетинина Н.С. Функциональная активность эндометрия влияет на результаты ЭКО и перенос эмбрионов: молекулярные механизмы регуляции фертильности // Проблемы репродукции. - 2010. - №2. С. 41-52.
3. Бурменская О.В. Молекулярно-генетические маркеры иммунного ответа при воспалительных заболеваниях органов женской репродуктивной системы: Диссертация доктора биологических наук / М., 2014.
4. Газазян М.Г., Хуцишвили О.С., Иванова Т.С., Лунева И.С. Возможности улучшения диагностики эндометрита // Журн. акушерства и жен. болезней. - 2002. - Т. 51, №5, с. 38-42.
5. Гомболевская Н.А., Бурменская О.В., Демура Т.А., Марченко Л.А., Коган Е.А., Трофимов Д.Ю., Сухих Г.Т. Оценка экспрессии мРНК генов цитокинов в эндометрии при хроническом эндометрите // Акушерство и гинекология. - 2013. - Vol. 11. - Р. 35-40.
6. Дюжева Е.В., Калинина, Е.А., Кузьмичев, Л.Н., Коган, Е.А. Иммуногистохимическое исследование эндометрия в программах ВРТ. // Вестник. РУДН. Серия "Медицина". - 2009. - Vol. 6. - Р. 98-104.
7. Железнов Б.И. Структурные изменения слизистой оболочки матки и функции яичников при хроническом эндометрите // Акушерство и гинекология. - 1977. - Т. 4. С. 3-7.
8. Зароченцева Н.В., Аршакян А.К., Меньшикова Н.С., Титченко Ю.П. Хронический эндометрит: этиология, клиника, диагностика, лечение // Российский вестник акушера-гинеколога. - 2013. - №5. С. 21-27.
9. Корнеева И.Е. Роль эндометрия в неудачах реализации репродуктивной функции // Проблемы репродукции. - 2010. - №2. С. 16-20
10. Перспективы использования комплексной оценки клинико-морфологических данных в диагностике и предгравидарной подготовке пациенток с хроническим эндометритом / И.Б. Манухин, Л.В. Акуленко, Т.К. Мачарашвили, Э.О. Ибрагимова // Лечащий врач. - 2015. - №5. С. 72-76.
11. Способ диагностики хронического эндометрита и характера воспаления / Е.А. Михнина, В.Н. Эллиниди, Н.М. Калинина, Н.И. Давыдов // Пат. РФ №2236013, МПК G01N 33/53, 10.09.2004.
12. Рудакова Е.Б., Давыдов П.В., Давыдов В.В. Диагностика внутриматочной патологии при подготовке к экстракорпоральному оплодотворению // Лечащий врач. - 2015. - №1.
13. Шуршалина А.В. Роль хронического эндометрита в развитии патологии репродуктивной функции // Российский медицинский журнал. - 2007. - №4. - С. 25-27.
14. Adegboyega P.A., Pei Y., McLarty J. Relationship between eosinophils and chronic endometritis // Human pathology. - 2010. - Vol. 41. - №1. - P. 33-37.
15. Altered transcriptional regulation of cytokines, growth factors, and apoptotic proteins in the endometrium of infertile women with chronic endometritis / С. Di Pietro, E. Cicinelli, M.R. Guglielmino, M. Ragusa, M. Farina, M.A. Palumbo, A. Cianci // American journal of reproductive immunology. - 2013. - Vol. 69. - №5. -P. 509-517.
16. Cicinelli E., Matteo M., Tinelli R., Lepera A., Alfonso R., Indraccolo U. et al. Prevalence of chronic endometritis in repeated unexplained implantation failure and the IVF success rate after antibiotic therapy. Human Reprod. 2015; 30(2): 323-330.
17. Greenwood S.M., Moran J.J. Chronic endometritis: morphologic and clinical observations // Obstetrics and gynecology. - 1981. - Vol. 58. - №2. - P. 176-184.
18. Johnston-MacAnanny E.B., Hartnett J., Engmann L.L., Nulsen J.C. et al. Chronic endometritis is a frequent finding in women with recurrent implantation failure after in vitro fertilization. Fertil Steril. - 2010; 93:2: 437-441.
19. Kitaya K., Yasuo T. Immunohistochemistrical and clinicopathological characterization of chronic endometritis // American journal of reproductive immunology. - 2011. - Vol. 66. - №5. - P. 410-415.
20. Kitaya K., Yasuo T. Inter-observer and intra-observer variability in immunohistochemical detection of endometrial stromal plasmacytes in chronic endometritis // Experimental and therapeutic medicine. - 2013. - Vol. 5. - №2. - P. 485-488.
21. Matteo M., Cicinelli E., Greco P., Massenzio F., Baldini D., Falagario Т., Rosenberg P., Castellana L., Specchia G., Liso A. Abnormal pattern of lymphocyte subpopulations in the endometrium of infertile women with chronic endometritis // American journal of reproductive immunology. - 2009. - Vol. 61. - №5. - P. 322-329.
22. Tortorella C., Piazzolla G., Matteo M., Pinto V., Tinelli R., Sabba C., Fanelli M., Cicinelli E. Interleukin-6, interleukin-1 beta, and tumor necrosis factor alpha in menstrual effluents as biomarkers of chronic endometritis // Fertility and sterility. - 2014. - Vol. 101. - №1. - P. 242-247.
Способ диагностики хронического эндометрита в среднюю стадию фазы секреции, отличающийся тем, что производят забор фрагмента слизистой оболочки полости матки в среднюю стадию фазы секреции путем пайпель-биопсии эндометрия с помощью атравматической аспирационной кюретки «Pipelle de Cornier», далее используют метод количественной полимеразной цепной реакции с предварительной стадией обратной транскрипции (ОТ-ПЦР) в режиме реального времени и определяют уровень мРНК гена VEGFA, при уровне более 0,250 делают заключение о наличии хронического эндометрита.