Набор олигонуклеотидных праймеров и зондов и способ количественного определения фетальной днк в кровотоке беременной женщины на основе анализа гиперметилированных участков днк плода
Иллюстрации
Показать всеПредложенная группа изобретений относится к области медицины. Предложен способ получения ДНК-праймеров и зондов для определения присутствия и определения относительного количества фетальной ДНК в образце плазмы крови беременной женщины. Предложены способ и набор для определения наличия и концентрации фетальной ДНК в образце плазмы крови женщины. Предложенная группа изобретений обеспечивает эффективное обнаружение праймерных конструкций, соответствующих дифференциально метилированным регионам ДНК матери и плода. 3 н. и 14 з.п. ф-лы, 1 ил., 4 табл., 1 пр.
Реферат
Изобретение относится к медицине, пренатальной диагностике, молекулярно-биологическим исследованиям в области качественного и количественного определения фетальной ДНК в крови беременной женщины.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к медицине, молекулярно-биологическим исследованиям в области неинвазивной пренатальной диагностики и может быть использовано для качественного и количественного определения фетальной ДНК в крови беременной женщины.
УРОВЕНЬ ТЕХНИКИ
Молекулярный анализ ДНК плазмы женщины во время беременности привел к открытию того, что материнская плазма содержит ДНК не только матери, но и плода [1]. Это ценный источник ДНК плода, предоставляющий новые возможности для неинвазивной пренатальной диагностики.
Анализ свободно циркулирующей ДНК плода в материнской плазме является важным инструментом для пренатальной диагностики сцепленных с полом заболеваний, определения резус-принадлежности плода, определения тяжелых наследственных патологий и синдромов, вызванных изменением количества хромосом [2-4]. Многие из этих приложений сосредоточены на обнаружении наследуемых по отцовской линии последовательностей в плазме беременной женщины или на анализе эпигенетических различий ДНК плода и матери. Для всех без исключения исследований такого рода и в качестве самостоятельного клинико-диагностического инструмента необходимо определение плодной фракции фетальной ДНК в материнской плазме ДНК плода [5].
Количественное измерение ДНК плода необходимо в целях мониторинга и прогнозирования связанных с беременностью состояний, а также для минимизации ложноотрицательных результатов исследований по определению пола, резуса и анеуплоидий плода.
Существующие маркеры ДНК плода, такие как Y-хромосомные последовательности, не могут адекватно служить в качестве положительных контролей, так как они применимы только к беременностям, несущим плод мужского пола. Для разработки универсальной системы обнаружения и оценки количества ДНК плода в крови беременной матери могут быть использованы генетические вариации, различающиеся у плода (любого пола) и матери. Подходы для анализа таких вариаций требуют использования нескольких маркеров для увеличения информативности системы в целом. Такие маркеры были обнаружены при исследовании эпигенетических различий в ДНК плода и матери.
Один из таких марекров - ген белка маспина (Maspin - mammary serine protease inhibitor, ген SERPINB5) в промоторной области гиперметилирован в клетках материнской крови и гипометилирован в клетках плаценты плода. Показано, что из материнской плазмы независимо от пола плода воспроизводимо выделяется гипометилированный ген SERPINB5, который может служить в качестве универсального ДНК-маркера плода [6]. Однако данный способ сложно реализуем на практике, т.к. для обнаружения неметилированных последовательностей участков гена SERPINB5 на фоне метилированных последовательностей материнской ДНК требуется трудоемкая процедура бисульфитной конверсии. Бисульфитная конверсия образца ДНК также приводит к деградации до 96% ДНК, таким образом, значительно уменьшается эффективность использования данного маркера для обнаружения плодной ДНК в обычной клинической практике.
С целью преодоления вышеуказанных ограничений различными группами ученых был проведен ряд масштабных исследований по изучению различий метилирования между ДНК матери и плода, что привело к идентификации множества так называемых дифференциально метилированных регионов (DMR) ДНК плода и матери. В последние 10 лет различными группами ученых было достоверно выявлено более 300 DMR [7, 8].
Кроме того, были проведены многочисленные эксперименты по разработке стратегий обнаружения этих эпигенетических различий. В частности, наиболее успешно себя зарекомендовали:
- стратегия, использующая методологию метилзавизимой иммунопреципитации ДНК (MEDIP) в сочетании с количественной ПЦР в режиме реального времени для оценки количества ДНК плода и оценки количества различных хромосом, которая может быть выполнена неинвазивным способом путем анализа конкретных DMR плодной и материнской ДНК;
- методика вычленения фоновой материнской ДНК при помощи метил-чувствительных ферментов рестрикции с последующим обнаружением и анализом, в том числе и количественным при помощи ПЦР в реальном времени, генетического материала именно плода. Такой подход весьма многообещающ и перспективен, но имеет лишь одно ограничение - коммерчески доступно небольшое количество метил-чувствительных эндонуклеаз рестрикции, что существенно ограничивает количество локусов, подходящих для тестирования [9].
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Задачей предлагаемого решения является создание способа, позволяющего определить наличие и относительное количество фетальной ДНК в плазме беременной женщины, начиная с ранних сроков беременности, путем измерения соотношения дифференциально метилированных участков генома матери и плода с использованием метил-специфической реакции рестрикции, а также создание диагностического набора для осуществления предложенного способа.
Задачей предлагаемого решения также является создание диагностического набора для осуществления способа диагностики.
Технический результат состоит в частности, в обнаружении высокоспецифичных праймерных конструкций (соответствующих дифференциально метилированным регионам ДНК матери и плода) и условий проведения предварительной реакции рестрикции с целью получения способа с высокими метрологическими характеристиками для обнаружения присутствия и определения количества фетальной ДНК в образце крови беременной женщин.
Разработанный способ для определения ДНК плода в материнской плазме основан на детекции дифференциально-метилированных участков последовательности фетальной ДНК в материнском кровотоке. В отличие от способов, использующих фетальные ДНК-маркеры, которые обнаруживают Y-хромосому или используют в качестве маркеров генетические мутации, передающиеся по отцовской линии, разработанный способ применим для всех беременностей независимо от пола и генетических вариаций плода, т.к. в качестве маркеров выбраны неполиморфные участки генома.
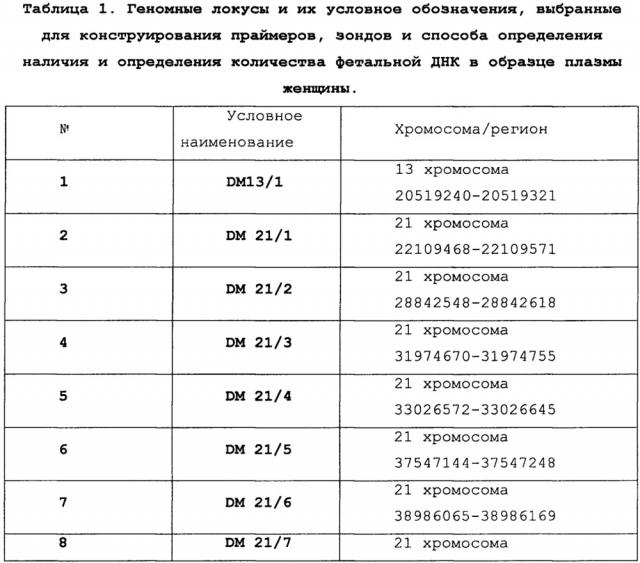
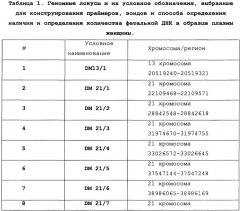
В разработанном способе используется анализ метилирования по одному из 12 специфических локусов на хромосоме 21 и по локусам на 13 и 22 хромосомах, применяется способ предварительной рестрикции высокоспецифичными ферментами с последующей ПЦР амплификацией продуктов в режиме реального времени. Фетальная ДНК в выбранных локусах на хромосомах 21 гиперметилирована по сравнению с материнской ДНК, на хромосоме 13 гиперметилирована, а на хромосоме 22 гипометилирована и фетальная, и материнская ДНК.
Используемая версия базы сиквенсов геномной ДНК человека -Genome Reference Consortium GRCh37.
Различия в метилировании выбранных локусов ДНК из клеток плаценты и из материнских клеток крови позволяет использовать чувствительные ферменты рестрикции строго к неметилированным участкам для расщепления материнской ДНК, в то же время оставляя плодные участки по данным локусам нетронутыми. Эта система более чувствительна, надежна и проста в использовании по сравнению с методикой бисульфитной конверсии, используемой для аналогичных целей. Данная методика может быть применена для обнаружения фетальной ДНК, начиная с 8-ми недель беременности.
Данный способ также включает разработанную систему внутреннего контроля, для обнаружения потенциального неполного или излишнего ферментативного расщепления, которое может привести к ложноположительным или ложноотрицательным результатам. Система внутреннего контроля состоит из набора праймеров и зондов для метилированных участков ДНК плода и матери на другой хромосоме и для участка гипометилированного локуса ДНК. В методику включены анализ метилирования локуса HYP1 на 13-й паре хромосом и анализ локуса U1 22-й хромосомы, соответственно.
Данная задача решена с помощью набора реактивов для проведения реакции рестрикции, включающей в себя эндонуклеазу рестрикции BspFNI в концентрации 10 ед./мкл и реакционный буфер.
Также задача определения количества фетальной ДНК в плазме беременной женщины решена с помощью набора олигонуклеотидных праймеров и зондов, в котором по меньшей мере 10 пар частично комплементарных олигонуклеотидных праймеров длиной по меньшей мере 16 нуклеотидов обладают специфичностью к противоположным концам последовательностей ДНК локусов, обозначенных в таблице 1, каждая из которых (последовательность) включает от 71 до 280 нуклеотидов, а праймеры-зонды, обладающие специфичностью к упомянутым локусам, имеют длину от 15 до 26 нуклеотидов.
Выбор минимальной длины ампликонов (71-280 пар нуклеотидов) обеспечивает возможность проведения анализа при сильной фрагментации фетальной ДНК.
Во всех формах упомянутых олигонуклеотидных зондов флуорофорная группа представляет собой FAM, а гаситель флуоресценции представляет собой BHQ1.
Набор дополнительно включает раствор, содержащий 67 мМ трис-HCl с рН 8,8, 16,6 мМ (NH4)2SO4, 6,7 мМ MgCl2 и 170 мкг БСА, смесь четырех основных dNTP в концентрации 0,2 мМ каждого, а также раствор термостабильной ДНК-полимеразы 5 единиц/мкл.
Задача определения относительного количества фетальной ДНК в плазме беременной женщины решается путем выделения ДНК из плазмы крови беременной женщины, затем используют вышеописанный набор для проведения реакции рестрикции, используют вышеописанный набор праймеров-зондов и праймеров, проводят начальное плавление по меньшей мере 90 сек при температуре 94-96°С, проводят полимеразную цепную реакцию с набором вышеуказанных праймеров-зондов и праймеров, включающую по меньшей мере тридцать циклов отжига, синтеза и плавления, причем плавление осуществляют 10-30 сек при температуре 94-96°С, отжиг и синтез проводят 30-60 сек при температуре 58-68°С, а детекцию осуществляют во время отжига посредством флуоресцентной спектрометрии.
В одном из вариантов осуществления начальное плавление проводят в течение по меньшей мере 100 с.
В еще одном варианте осуществления начальное плавление проводят при температуре 95°С.
В другом варианте осуществления проводят по меньшей мере тридцать пять упомянутых циклов отжига, синтеза и плавления.
В одном из вариантов осуществления проводят по меньшей мере сорок циклов плавления.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг. 1. Результаты экспериментальной проверки различных концентраций набора праймеров и зондов, по осям X и Y - значения концентрации праймеров, по оси Z - значения эффективности ПЦР, в данном примере используемая концентрация зонда - 200 нМ.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
В качестве молекулярно-генетических маркеров фетальной ДНК выбраны дифференциально метилированные регионы ДНК плода и матери, для определения присутствия в образце плазмы женщины фетальной ДНК фиксируется существенное уменьшение относительного количества копий ампликонов по маркерам DM 21/1-12 после проведения ПЦР-амплификации продуктов рестрикции с использованием рестриктазы BstFNI (по сравнению с локусом DM13/1). Для максимально информативного обнаружения наличия фетальной ДНК в образце плазмы женщины выбрано большое количество маркеров гиперметилированной плодной ДНК, что предполагает существенное снижение количеств ложноотрицательных результатов и повышение уровня чувствительности и специфичности реакции. В качестве контроля полноты рестрикции материнской ДНК в профиль исследования введен также маркер гипометилированной последовательности.
Способ определения концентрации фетальной ДНК в плазме беременной женщины включает выделение ДНК из плазмы крови, проведение реакции рестрикции с использование рестриктазы BstFNI, проведение полимеразной цепной реакции, проведение детекции продуктов полимеразной цепной реакции, определения количеств продуктов ПЦР посредством флуоресцентной спектрометрии в присутствии зондов.
Способ определения количества фетальной ДНК в плазме беременной женщины осуществляют следующим образом. Выделяют ДНК из плазмы крови беременной женщины; разделяют выделенный образец на два объема, с одним объемом проводят реакцию рестрикции с использованием рестриктазы BstFNI, затем с обоими объемами выделенного образца (до и после рестрикции) проводят полимеразную цепную реакцию, состоящую из начального плавления и ряда циклов из плавления, отжига и синтеза; проводят детекцию продуктов полимеразной цепной реакции с помощью флуоресцентной спектрометрии. Реакцию рестрикции проводят в буфере для рестрикции с 50 ед. эндонуклеазы рестрикции BstFNI в течении 120 минут. Полимеразную цепную реакцию с использованием праймеров-зондов и праймеров проводят при следующих условиях: начальное плавление проводят в течение 2 мин при температуре 95°С, далее проводят цикл от 50 до 60 раз, включающий плавление при 94°С в течение 10 с, отжиг и синтез при температуре от 60°С в течение 1 мин, во время отжига проводят детекцию с помощью флуоресцентной спектрометрии.
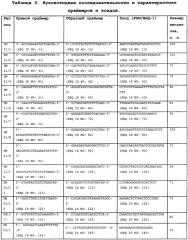
Дизайн праймеров и зондов для амплификации участков, обозначенных в таблице 1, приведен в таблице 3. В целях обеспечения специфичности амплификации по отношению к фетальной ДНК и отсутствия неспецифической реакции на материнской ДНК при дизайне праймеров и зондов руководствовались следующими принципами:
- олигонуклеотидные праймеры и зонды обладают специфичностью к противоположным концам последовательностей ДНК выбранных локусов;
- олигонуклеотидные праймеры и зонды имеют длину от 15 до 25 нуклеотидов;
- внутри амплифицируемого фрагмента, включая праймеры и зонды, необходимо наличие как минимум одного сайта рестрикции рестриктазы BstFNI;
- амплифицированный фрагмент не должен составлять более 280 п.о.;
- температура плавления праймеров и зондов должна лежать в диапазоне от 55 до 62°С.
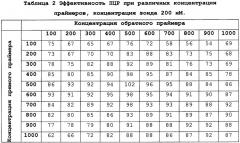
Для оценки характеристик методов флуоресцентной детекции, производили определения эффективности реакции амплификации с разными концентрациями праймеров и зондов: 50; 100; 200; 4 00; 800 нМ для праймеров и 25; 50; 100; 200; 400 нМ для зондов.
Оценка эффективности амплификации с различными комбинациями концентраций праймеров и зондов проводилась при постановке реакций амплификации на различных разведениях контрольной ДНК, в реакционную смесь вносили 105, 104, 103, 102, 10 геном-эквивалентов контролей. Использовали образцы геномных контролей ДНК клеточных линий Jurkat (производитель ООО «Сибэнзим», Россия).
Использовали исходные стоки геномной ДНК клеточных линий человека Jurkat только в известных концентрациях, а также серии их последовательных разведений.
Концентрацию ДНК измеряли на спектрофотометре NanoVue («HealthCare Biosciences АВ», Швеция).
Амплификацию проводили на термоциклерах DTlite и DTprime (ООО «ДНК-технология», Россия) в 20 мкл реакционной смеси следующего состава: 70 мМ Трис-HCl, рН 8,8, 16,6 мМ сульфат аммония, 0,01%-ный Твин-20, 2,0 мМ хлорид магния, 200 нМ каждого dNTP, 50÷800 нМ праймеров, 25÷400 нМ зондов, 1,0 единиц Taq-ДНК-полимеразы. Условия амплификации фрагментов кДНК: 94°С/5 мин - первый цикл; 94°С/10 с, 60°С/60 с - 50 циклов. Регистрируемое накопление сигнала флуоресценции свидетельствовало о том, что в образце есть ДНК, содержащая последовательности-мишени.
На фигуре 1 показан пример результатов экспериментальной проверки различных концентраций набора праймеров и зондов для региона DM21/4, по оси X - значения концентрации праймеров (форварда и реверса), по оси Y - значения эффективности ПЦР.
Пример результатов экспериментальной проверки характеристик различных концентраций праймеров и зондов приведен в таблице 2.
Аналогичные эксперименты были проведены для всех вариантов праймеров и зондов и для различных концентраций. Установлено, что оптимальной концентрацией праймеров в реакционной смеси является концентрация 400 нМ, зондов - 200 нМ, а температура отжига - 60°С.
На основе полученных значений параметров ПЦР, можно сделать вывод о том, что все наборы праймеров и зондов (таблица 3) подходят для проведения анализа и демонстрируют высокие значения эффективности и близкие к единице значения линейности R2, что позволяет использовать данные наборы олигонуклеотидов для измерения количества копий гиперметилированных участков фетальной ДНК (таблица 4).
СПИСОК ЛИТЕРАТУРЫ
1. Lo Y.M., Corbetta N., Chamberlain P.F., Rai V., Sargent I.L., Redman C.W., Wainscoat J.S. 1997. Presence of fetal DNA in maternal plasma and serum. Lancet. 350, 485-487.
2. Macher H.C., Noguerol P., Medrano-Campillo P., Garrido-Marquez M.R., Rubio-Calvo A., Carmona-Gonzalez M., Martin-Sanchez J., Perez-Simon J.A., Guerrero J.M. 2012. Standardization non-invasive fetal RHD and SRY determination into clinical routine using a new multiplex RT-PCR assay for fetal cell-free DNA in pregnant women plasma: Results in clinical benefits and cost saving. Clinica Chimica Acta. 413, 490-494.
3. Devaney S.A., Palomaki G.E., Scott J.A., Bianchi D.W. 2011. Noninvasive Fetal Sex Determination Using Cell-Free Fetal DNA. JAMA: The Journal of the American Medical Association. 306, 627-636.
4. Dennis Lo Y.M., Chiu R.W.K. 2007. Prenatal diagnosis: progress through plasma nucleic acids. Nat. Rev. Genet. 8, 71-77.
5. Struble C.A., Syngelaki A., Oliphant A., Song K., Nicolaides K.H. 2014. Fetal Fraction Estimate in Twin Pregnancies Using Directed Cell-Free DNA Analysis. Fetal Diagnosis and Therapy. 35, 199-203.
6. Bellido M.L., Radpour R., Lapaire O., Bie I.D., Hosli I., Bitzer J., Hmadcha A., Zhong X.Y., Holzgreve W. 2010. MALDI-TOF Mass Array Analysis of RASSF1A and SERPINB5 Methylation Patterns in Human Placenta and Plasma. Biology of Reproduction. 82, 745-750.
7. Sifakis S. 2012. DNA methylation in the human placenta and fetal growth (Review). Molecular Medicine Reports.
8. Chim S.S.C., Jin S., Lee T.Y.H., Lun F.M.F., Lee W.S., Chan L.Y.S., Jin Y., Yang N., Tong Y.K., Leung T.Y., Lau Т.К., Ding C., Chiu R.W.K., Lo Y.M.D. 2008. Systematic Search for Placental DNA-Methylation Markers on Chromosome 21: Toward a Maternal Plasma-Based Epigenetic Test for Fetal Trisomy 21. Clin Chem. 54, 500-511.
9. Hashimoto K., Kokubun S., Itoi E., Roach H.I. 2007. Improved quantification of DNA methylation using methylation-sensitive restriction enzymes and real-time PCR. Epigenetics. 2, 86-91.
1. Способ получения ДНК-праймеров и зондов для определения присутствия и определения относительного количества фетальной ДНК в образце плазмы крови беременной женщины, в котором используют:
(а) образец геномной ДНК клеточной линии человека Jurkat;
(б) олигонуклеотидные праймеры и зонды, которые
(i) обладают специфичностью к противоположным концам последовательностей амплифицируемого фрагмента;
(ii) имеют длину от 15 до 25 нуклеотидов;
(iii) соответствуют такому амплифицируемому фрагменту, в котором присутствует, по меньшей мере, один сайт рестрикции рестриктазы BstFNI, а его длина составляет, самое большее, 280 пар нуклеотидных оснований,
(iv) температура их плавления лежит в диапазоне от 55 до 62°C;
характеризующийся тем, что он предусматривает следующие стадии:
(1) выбирают амплифицируемый фрагмент ДНК, соответствующий дифференциально метилированным участкам фетальной ДНК и ДНК взрослого человека;
(2) синтезируют упомянутые праймеры и зонды;
(3) проводят полимеразную цепную реакцию упомянутого образца ДНК (а);
(4) отбирают пары праймеров и зонды, обеспечивающие эффективность реакции ПЦР выше 65% и линейность при изменении концентрации образца (а) выше 0,9.
2. Набор для определения присутствия и определения относительной концентрации фетальной ДНК в образце плазмы крови женщины, путем определения гиперметилированных участков в локусах, перечисленных в таблице 1 описания, содержащий для каждого из указанных локусов, по меньшей мере, одну пару из прямого и обратного праймеров, полученных в соответствии со способом по пункту 1, и, по меньшей мере, один соответствующий им зонд.
3. Набор по п. 2, характеризующийся тем, что он включает в себя эндонуклеазу рестрикции BspFNI в концентрации 10 ед./мкл и реакционный буфер.
4. Набор по п. 2, характеризующийся тем, что размер ампликона составляет целое число в диапазоне от 71 до 280 пар нуклеотидов, предпочтительно от 80 до 150.
5. Набор по п. 2, характеризующийся тем, что он включает в себя 14 комбинаций праймеров, по одной для каждого из выбранных и представленных в таблице 1 описания локусов, состоящие из трех олигонуклеотидов разного назначения - прямого, обратного праймера и зонда, представленных в таблице 3 описания и/или гомологичных им, по меньшей мере, на 95%.
6. Набор по п. 2, характеризующийся тем, что он дополнительно включает в себя синтетическую ДНК для положительных контролей.
7. Набор по п. 2, характеризующийся тем, что он дополнительно включает в себя термостабильную ДНК-полимеразу 5 ед./мкл.
8. Набор по п. 2, характеризующийся тем, что он дополнительно включает в себя водный раствор, содержащий:
приблизительно 67 мМ трис-HCl, рН 8,8 при 25°С,
приблизительно 16,6 мМ (NH4)2S04,
приблизительно 6,7 мМ MgCl2,
приблизительно 6,7 мкм ЭДТА,
приблизительно 170 мкг БСА, и
смесь четырех основных dNTP в концентрации приблизительно 0,2 мМ каждого.
9. Набор по п. 2, характеризующийся тем, что он дополнительно включает в себя воду деионизированную.
10. Способ определения наличия и концентрации фетальной ДНК в образце плазмы крови женщины, в котором используют:
(а) образец плазмы крови женщины;
(б) набор для проведения реакции рестрикции с использованием рестриктазы BstFNI;
(в) набор праймеров и зондов по пп. 2-5;
характеризующийся тем, что он предусматривает следующие стадии:
(1) выделяют ДНК из образца (а);
(2) разделяют выделенный на стадии (1) образец ДНК на два объема (I) и (II) соответственно;
(3) с объемом (I) образца ДНК, выделенного на стадии (1), проводят реакцию рестрикции с использованием набора (б);
(4) проводят параллельно реакции полимеразной цепной реакции с детекцией результатов в режиме реального времени продуктов реакции рестрикции, полученных на стадии (3), и объема (II), выделенного на стадии (1) образца ДНК;
(5) определяют количество продуктов ПЦР посредством флуоресцентной спектрометрии в присутствии зондов (в).
11. Способ по п. 10, характеризующийся тем, что в нем в качестве показателя количественного соотношения используют соотношение сигналов образцов без и после метил-специфической реакции рестрикции от зондов.
12. Способ по п. 10, характеризующийся тем, что сравнительным образцом является ДНК из клеточной линии Jurkat.
13. Способ по п. 10, характеризующийся тем, что при проведении стадии ПЦР проводят начальное плавление в течение 1-5 мин при температуре 94-96°С, 30-60 раз проводят цикл, включающий плавление при 94-96°С в течение 10÷30 секунд, отжиг и синтез при температуре 28-62°С в течение 40÷60 мин, детекцию продуктов ПЦР проводят во время стадии отжига.
14. Способ по п. 10, характеризующийся тем, что в нем проводят реакцию рестрикции с использованием рестриктазы BstFNI, с использованием 50 единиц рестриктазы в течение 120 минут при температуре 37°С.
15. Способ по п. 10, характеризующийся тем, что в нем концентрация праймеров в реакционной смеси составляет 400 нМ, зондов - 200 нМ, а температура отжига - 58÷68°С.
16. Способ по п. 10, характеризующийся тем, что в нем определение относительного количества фетальной ДНК проводят по результатам количественной ПЦР, при этом относительное количество фрагментов фетальной ДНК определяют соотношением относительного количества фрагментов ПЦР-продуктов образца ДНК до и после проведения реакции рестрикции ферментов BstFNI, при этом расчет осуществляют по методу «дельта-дельта Ct», в частности, с применением формулы:
при этом, полученный коэффициент X отражает снижение содержания материнской ДНК в смеси тотальной ДНК и может быть использован для расчета концентрации фетальной ДНК относительно ДНК женщины, в частности, по формуле:
,
где F - количество копий фетальной ДНК,
М - количество копий материнской ДНК.
17. Способ по п. 16, характеризующийся тем, что в нем по полученному отношению судят о присутствии и об относительном количестве фетальной ДНК в образце плазмы крови женщины; присутствие в образце и измерение относительно количества производят при уровне абсолютного количества фетальной ДНК не менее 100 копий.