Улучшенные синергические противодиабетические композиции
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к улучшенным синергическим композициям, эффективным в лечении диабета и/или гипергликемии. Композиция, содержащая инулин, имеющий степень полимеризации (DP) ниже примерно 25, и сульфонилмочевину и/или ее производное или их комбинацию, где композиция является синергической, когда используется для лечения или задержки начала диабета типа 2, и где композиция содержит от 5 мг до 50 г инулина и от 0,5 мг до 2000 мг сульфонилмочевины и/или ее производного или их комбинации. Способ лечения или задержки начала диабета 2 типа. Способ лечения гипергликемии, связанной с диабетом 2 типа. Способ предотвращения развития или ослабления побочного эффекта у субъекта с диабетом 2 типа, подвергнутого лечению с помощью сульфонилмочевины и/или ее производного или с помощью их комбинации, где побочный эффект возникает или обостряется в результате лечения сульфонилмочевиной и/или ее производным или их комбинацией. Способ предотвращения развития или ослабления патологического состояния у субъекта с диабетом 2 типа или гипергликемией, связанной с диабетом 2 типа. Способ лечения или задержки начала диабета 2 типа или лечения гипергликемии у субъекта с диабетом 2 типа. Вышеописанная композиция эффективна для лечения или задержки начала диабета типа 2 и действует синергетически. 6 н. и 16 з.п. ф-лы, 13 ил., 13 табл., 12 пр.
Реферат
Область техники
[0001] Настоящее изобретение относится к улучшенным синергическим композициям, эффективным в лечении диабета и/или гипергликемии. Конкретно, настоящее изобретение относится к синергическим композициям, включающим препараты инулина с определенной характерной степенью полимеризации (DP) и сульфонилмочевину и/или сульфонамид и/или их производные и/или метаболиты, используемые в лечении сахарного диабета типа 2 (T2DM).
Уровень техники
[0002] Любое обсуждение предыдущего уровня техники на протяжении спецификации не должно рассматриваться иначе как признание того, что такой предыдущий уровень техники широко известен или образует часть общих знаний в данной области.
[0003] Предыдущие исследования, описанные в PCT/AU 2011/000622, впервые продемонстрировали, что комбинация инулина и сульфонилмочевины действовала синергично, среди прочего понижая ограничение уровня глюкозы в крови (FBG) у пациентов с сахарным диабетом типа 2 (T2DM). По-видимому, синергизм ограничивается соединениями класса сульфонилмочевин в отличие от другого изучаемого в данном исследовании противодиабетического лечения.
[0004] Препараты инулина могут быть гетерогенными и могут в значительной степени варьироваться по отношению к степени полимеризации (DP). Начиная с того, что в зависимости от природного источника инулин будет иметь DP в различных интервалах (например, DP в настолько низком интервале, как от 2 до примерно 60 для различных природных источников). Инулины с DP в интервале от 2 до примерно 10 также относятся к фруктоолигосахаридам (FOS) и к олигофруктозе (OF). Экстракция и обработка инулина из природных источников будет дополнительно способствовать данной вариации DP, а также расширению интервала DP и/или стандартной ошибки интервала по отношению к более низким значениям DP. Ни одно из ранее опубликованных исследований не обеспечивает никакого указания о применяемом интервале DP для инулина и о том, как данный параметр может влиять на синергизм с сульфонилмочевиной в лечении T2DM.
[0005] Таким образом, существует необходимость получения лучшим образом определенных и улучшенных синергических композиций инулина-сульфонилмочевины с более эффективным и предсказуемым контролем уровня глюкозы в крови, и с улучшенным режимом дозирования.
[0006] Задача настоящего изобретения заключается в преодолении или улучшении, по меньшей мере, одного из недостатков предшествующего уровня техники, или в обеспечении полезной альтернативы.
Сущность изобретения
[0007] Согласно первому аспекту настоящее изобретение обеспечивает улучшенную синергическую композицию, содержащую инулин, имеющую степень полимеризации (DP) ниже примерно 25, и сульфонилмочевину и/или сульфонамид и/или их производные, и/или их метаболиты, или их комбинации, для лечения диабета.
[0008] Для применения в изобретении рассматриваются производные или метаболиты сульфонилмочевин, где такие производные/метаболиты обладают активным эффектом в отношении изменения уровня глюкозы в крови. Соответственно, любое упоминание "сульфонилмочевины" в данном документе также может включать такие производные или метаболиты.
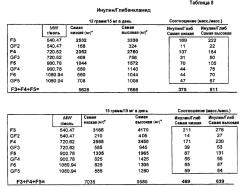
[0009] Предпочтительно, препарат инулина будет иметь DP ниже примерно 25, более предпочтительно в интервале примерно от 2 до примерно 23, более предпочтительно, примерно от 2 до примерно 10 или от 3 до 10, и еще более предпочтительны препараты инулина, имеющие значительную пропорцию DP в интервале примерно от 2 до примерно 5 или примерно от 3 до примерно 5. Особенно предпочтительными являются препараты инулина, содержащие значительную пропорцию F2-F5 (т.е. F2=2 фруктозных компонента, присоединенных посредством β 1-2 связи, F4=4 фруктозных компонента и т.д.).
Сульфонилмочевина может быть выбрана из гликлазида, глизоксепида, глибенкламида (известного также как глибурид), глипизида, глимепирида, глихидона, гликлопиримида, глиборнурида, толазамида, толбутамида, хлорпропамида, ацетогексамида, карбутамида, метагексамида, и их производных или комбинаций.
[0011] Также рассматриваются и могут применяться сульфонамиды и их производные, которые химически сходны с сульфонилмочевиной и которые оказывают эффект в отношении изменения уровня глюкозы в крови. Такие сульфонамиды включают, например, сульфонамидные антибиотики, такие как, в частности, сульфаметоксазол, сульфизомидин (также известный как сульфаизодимидин), сульфацетамид, сульфадоксин, дихлорфенамид (DCP) и дорзоламид.
[0012] Улучшенные синергические композиции по настоящему изобретению могут содержать один или несколько эксципиентов, где, по меньшей мере, один из указанных одного или нескольких эксципиентов представляет собой инулин. В некоторых воплощениях, композиции по настоящему изобретению содержат инулин в качестве единственного эксципиента.
[0013] Предпочтительно, композиции по настоящему изобретению представлены в единой лекарственной форме, такой как таблетки, капсулы и тому подобное. Такие единые лекарственные формы могут содержать примерно от 5 мг до примерно 50 граммов инулина. В одном примере единая лекарственная форма содержит примерно 5-100 мг инулина. В другом примере единая лекарственная форма содержит примерно 100-500 мг инулина. В другом примере единая дозированная форма содержит примерно 500-1000 мг инулина. В другом примере единая дозированная форма содержит примерно 1000-2000 мг инулина. В другом примере единая дозированная форма содержит примерно 2000-3000 мг инулина. В другом примере единая дозированная форма содержит примерно от 3000 до примерно 4000 мг инулина. В другом примере единая дозированная форма содержит примерно от 4000 до примерно 5000 мг инулина. В другом примере единая дозированная форма содержит примерно от 5000 мг до примерно 1 г инулина. В другом примере единая дозированная форма содержит примерно от 1 г до примерно 2 г инулина. В другом примере единая дозированная форма содержит примерно от 2 г до примерно 4 г инулина. В другом примере единая дозированная форма содержит примерно от 4 г до примерно 8 г инулина. В другом примере единая дозированная форма содержит примерно от 8 г до примерно 10 г инулина. В другом примере единая дозированная форма содержит примерно от 10 г до примерно 15 г инулина. В другом примере единая дозированная форма содержит примерно от 15 г до примерно 20 г инулина. В другом примере единая дозированная форма содержит примерно от 20 г до примерно 30 г инулина. В другом примере единая дозированная форма содержит примерно от 30 г до примерно 40 г инулина. В другом примере единая дозированная форма содержит примерно от 40 г до примерно 50 г инулина.
[0014] Инулин единой дозированной формы может быть объединен с сульфонилмочевиной и/или с сульфонамидом и/или с их производными или с их метаболитами или с их комбинациями либо в одной дозированной форме, либо в отдельных дозированных формах, где количество сульфонилмочевины и/или сульфонамида и/или их производных и/или метаболитов составляет примерно от 0,5 мг до примерно 2000 мг, или примерно от 1 мг до примерно 2 мг, или примерно от 2,5 мг до примерно 5 мг, или примерно от 5 мг до 10 мг, или примерно от 10 мг до примерно 20 мг, или примерно от 20 мг до примерно 30 мг, или примерно от 30 мг до примерно 40 мг, или примерно от 40 мг до примерно 50 мг, или примерно от 50 мг до примерно 60 мг, или примерно от 60 мг до примерно 70 мг, или примерно от 70 мг до примерно 80 мг, или примерно от 80 мг до примерно 90 мг, или примерно от 90 мг до примерно 100 мг, или примерно от 100 мг до примерно 250 мг, или примерно от 250 мг до примерно 500 мг, или примерно от 500 мг до примерно 1000 мг, или примерно от 1000 мг до примерно 1500 мг, или примерно от 1500 мг до примерно 2000 мг.
[0015] Предпочтительно, единая дозированная форма будет содержать примерно от 500 мг до примерно 2000 мг инулина и примерно от 1 мг до примерно 30 мг сульфонилмочевины и/или сульфонамида и/или их производных и/или метаболитов или их комбинации. Как правило, единая дозированная форма будет содержать 10-20 мг сульфонилмочевины и/или сульфонамид и/или их производные и/или метаболиты, или их комбинации и примерно 500 мг инулина. В конечном счете, содержание сульфонилмочевины будет зависеть от используемого типа сульфонилмочевины и/или сульфонамида и/или их производных и/или метаболитов, или их комбинаций, и количество, как правило, используемых для эффективного лечения патологического состояния пациента. Это понятно и хорошо известно практикующим врачам, лечащим диабетических пациентов.
[0016] Согласно второму аспекту в настоящем изобретении предлагается способ профилактического или терапевтического лечения диабета, включающий введение объекту, которому требуется такое лечение, композиции, содержащей инулин, имеющий DP ниже примерно 25, и сульфонилмочевину или ее производное, или сульфонамид или его производное и/или их метаболиты.
[0017] Согласно третьему аспекту, в настоящем изобретении предлагается способ лечения гипергликемии, включающий введение объекту, которому требуется такое лечение, инулина, имеющего DP ниже примерно 25, и сульфонилмочевины и/или сульфонамида и/или их производных и/или метаболитов или их комбинации в количестве и в течение времени, которых достаточно для снижения, регуляции или нормализации концентрации глюкозы в крови.
[0018] Предпочтительно, диабет представляет собой сахарный диабет типа 2 (T2DM).
[0019] Согласно четвертому аспекту, в настоящем изобретении предлагается способ предотвращения развития или ослабления побочных эффектов или патологических состояний у объекта, подвергнутого лечению сульфонилмочевиной и/или сульфонамидом и/или их производными и/или метаболитами или с помощью их комбинаций, где побочные эффекты или патологические состояния возникают или обостряются в результате лечения сульфонилмочевиной и/или сульфонамидом и/или их производными и/или их метаболитами, или с помощью их комбинаций, причем лечение включает введение объекту, которому требуется такое лечение, инулина, имеющего DP ниже примерно 25, в количестве и в течение времени, которых достаточно для предотвращения или ослабления побочных эффектов или патологических состояний.
[0020] Побочные эффекты или патологические состояния могут быть выбраны из гипогликемии, желудочно-кишечного расстройства, усталости, набора веса, плохого настроения, отсутствия желания к физической нагрузке, отрицательных изменений в насыщении и повышенного желания есть подслащенную пищу или из патологических состояний, связанных с диабетом. Такие состояния включают, в частности, заболевания сердца и кровеносных сосудов, поражения нервов, поражения почек, поражения глаз, поражения ступни, патологические состояния кожи и рта, низкую костную минеральную плотность и болезнь Альцгеймера.
[0021] Согласно пятому аспекту, в настоящем изобретении предлагается способ повышения эффективности лечения диабета сульфонилмочевиной у объекта, получающего противодиабетическую терапию в виде сульфонилмочевины, причем способ включает введение указанному объекту инулина, имеющего DP ниже примерно 25. Повышение эффективности действия сульфонилмочевины означает, что нормальная дозировка сульфонилмочевины, вводимая пациенту, может быть уменьшена.
[0022] В данном аспекте, лечение/терапия может включать применение производного сульфонилмочевины и/или сульфонамида и/или их производных и/или метаболитов или их комбинаций.
[0023] Объект/пациент согласно изобретению может представлять собой любого объекта-человека или объекта-млекопитающего, нуждающихся в таком лечении. Объекты-млекопитающие/пациенты включают, в частности, приматов, горилл, шимпанзе, виды под угрозой исчезновения, племенных животных, например, крупный рогатый скот, свиней, лошадей и домашних животных, например, собак и кошек.
[0024] Предпочтительно, инулин имеет DP в интервале примерно от 2 до примерно 23, более предпочтительно примерно от 2 до примерно 10 и еще более предпочтительно примерно от 2 до примерно 5. Особенно предпочтителен инулин, включающий F2-F5 или F3-F5.
[0025] Инулин может вводиться одновременно или последовательно в любом порядке вместе с сульфонилмочевиной и/или с сульфонамидом и/или с их производными и/или с их метаболитами или с их комбинациями. Предпочтительным путем введения является пероральный.
[0026] Удобно, если инулин вводится в виде пищевой добавки с ежедневным рационом или с напитками (например, в виде порошка или в форме гранул в мерных пакетиках саше). Инулин может вводиться в виде обогащенных или составленных пищевых форм, таких как жвачки, плитки, напитки, жевательные резинки, печенье, конфеты, мучные изделия и т.д. Однако предпочтительно, что инулин вводится в фармацевтической единой дозированной форме, такой как пилюли, таблетки, каплеты, тапсулы или капсулы для лучшего контроля дозирования и соблюдения режима терапии пациентом.
[0027] Количество вводимого инулина, как описано в любом способе данного документа, может содержать примерно от 5 мг до примерно 50 грамм инулина, или примерно от 5 мг до примерно 100 мг инулина, или примерно от 100 мг до примерно 500 мг инулина, или примерно от 500 мг до примерно 1000 мг инулина, или примерно от 1000 мг до примерно 2000 мг инулина, или примерно от 2000 мг до примерно 3000 мг инулина, или примерно от 3000 мг до примерно 4000 мг инулина, или примерно от 4000 мг до примерно 5000 мг инулина, или примерно от 5000 мг до примерно 1 г инулина, или примерно от 1 г до примерно 2 г инулина, или примерно от 2 г до примерно 4 г инулина, или примерно от 4 г до примерно 8 г инулина, или примерно от 8 г до примерно 10 г инулина, или примерно от 10 г до примерно 15 г инулина, или примерно от 15 г до примерно 20 г инулина, или примерно от 20 г до примерно 30 г инулина, или примерно от 30 г до примерно 40 г инулина, или примерно от 40 г до примерно 50 г инулина.
[0028] Количество вводимого инулина может быть объединено с сульфонилмочевиной и/или с сульфонамидом и/или с их производными или с их метаболитами или с их комбинациями либо вместе, либо в по отдельности, где количество сульфонилмочевины и/или сульфонамида и/или их производных и/или метаболитов составляет примерно от 0,5 мг до примерно 2000 мг, или примерно от 1 мг до примерно 2 мг, или примерно от 2,5 мг до примерно 5 мг, или примерно от 5 мг до 10 мг, или примерно от 10 мг до примерно 20 мг, или примерно от 20 мг до примерно 30 мг, или примерно от 30 мг до примерно 40 мг, или примерно от 40 мг до примерно 50 мг, или примерно от 50 мг до примерно 60 мг, или примерно от 60 мг до примерно 70 мг, или примерно от 70 мг до примерно 80 мг, или примерно от 80 мг до примерно 90 мг, или примерно от 90 мг до примерно 100 мг, или примерно от 100 мг до примерно 250 мг, или примерно от 250 мг до примерно 500 мг, или примерно от 500 мг до примерно 1000 мг, или примерно от 1000 мг до примерно 1500 мг, или примерно от 1500 мг до примерно 2000 мг.
[0029] Предпочтительно, вводимая форма будет содержать примерно от 500 мг до примерно 2000 мг инулина и примерно от 1 мг до примерно 30 мг сульфонилмочевины и/или сульфонамида и/или их производных и/или метаболитов или их комбинации. Как правило, вводимая форма будет включать 10-20 мг сульфонилмочевины и/или сульфонамида и/или их производных и/или их метаболитов или их комбинации и примерно 500 мг инулина. В конечном счете, содержание сульфонилмочевины будет зависеть от типа сульфонилмочевины и/или сульфонамида и/или их производных и/или метаболитов или их используемых комбинаций, и от количества, обычно используемого для эффективного лечения патологического состояния пациента. Это понятно и хорошо известно врачам, лечащим диабетических пациентов.
[0030] Пока из контекста ясно не следует иное, то на протяжении описания и формулы изобретения слова "содержит", "содержащий" и тому подобные следует рассматривать в смысле включающие в себя в отличие от исключающего или исчерпывающего смысла; иначе говоря, в смысле "содержащий в частности".
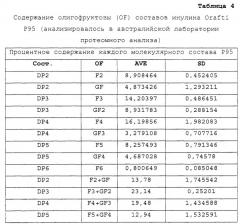
[0031] В контексте настоящего изобретения термин "инулин" используется взаимозаменяемо с терминами "олигофруктоза" и/или "фруктоолигосахарид". Следует понимать, что более сложные инулины с высокими значениями DP будут содержать различные пропорции инулинов с низкими значениями DP, которые могут обозначаться как "олигофруктоза" или "фруктоолигосахарид". Такие инулины с низким значением DP могут состоять из смеси F (m) и/или GF (n), где F представляет собой фруктозный компонент, G представляет собой глюкозный компонент и n и m составляет от 2 до примерно 10.
Краткое описание чертежей
Фигура 1: Хроматограмма стандарта инулина
Фигура 2: Хроматограмма Orafti HP инулина (стрелка указывает интервал DP примерно от 2 до 10) и соответствующий эффект данного препарата на уровень FBG пациента с T2DM.
Фигура 3: Хроматограмма Orafti GR инулина (стрелка указывает интервал DP примерно от 2 до 10) и соответствующий эффект данного препарата на уровень FBG пациента с T2DM.
Фигура 4: Хроматограмма коммерчески доступного инулина (CI) (стрелка указывает интервал DP примерно от 2 до 10) и соответствующий эффект данного препарата на уровень FBG пациента с T2DM.
Фигура 5: Хроматограмма Orafti Р95 инулина (стрелка указывает интервал DP примерно от 2 до 10) и соответствующий эффект данного препарата на уровень FBG пациента с T2DM.
Фигура 6: Сравнение эффектов различных препаратов инулина на уровень FBG пациента с T2DM.
Фигура 7: * Исходный уровень FBG, ** Повышение дозы инулина, # добавление 12 г/день инулина.
Фигура 8: * Исходный уровень FBG, ** Повышение дозы инулина, # добавление 12 г/день инулина.
Фигура 9: Профиль уровня FBG объекта в пред-диабетическом состоянии во время и после прекращения лечения с помощью инулина. (¶) коммерчески доступный инулин (CI); (§) инулин (Orafti GR), (€) отмененное лечение с использованием инулина.
Фигура 10: Длительный эффект инулина на уровень FBG у пациента с монотерапией гликлазида в комбинации с 15 гр/день инулина (CI); график демонстрирует исходное исследование лечения, как ранее представлено на фигуре 2 PCT-публикации WO 2011/146981 (левый участок, как отмечено), который дополнительно продолжался после 24 месяцев (правый участок, как отмечено).
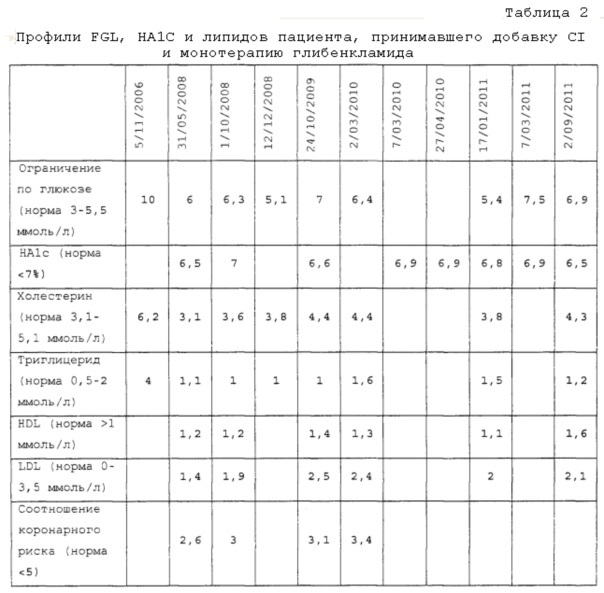
Фигура 11: Продолжительный эффект инулина на уровень FBG у пациента при лечении с использованием сульфонилмочевины, глибенкламида, монотерапии в комбинации с 15 гр/день CI; график демонстрирует продолжительное лечение свыше 61 месяца (как отмечено) и представляет собой продолжительность исследования лечения, представленного на фигуре 3 PCT-публикации WO 2011/146981.
Фигура 12: Схематическая диаграмма, демонстрирующая связь между инулином и FOS (слева) и химической структурой scFOS (справа).
Фигура 13: Схематическая диаграмма общего процесса производства для OFP.
Описание предпочтительного воплощения
[0032] Настоящее изобретение основано частично на том наблюдении, что различные препараты инулина, по-видимому, проявляют синергизм с сульфонилмочевинами до различной степени, судя по дозировке инулина, требующейся для достижения эффективного синергизма при лечении пациентов с сахарным диабетом типа 2 (T2DM). Настоящее изобретение касается оценки применяемого интервала степени полимеризации (DP) для препаратов инулина, предпочтительно пищевого класса, для достижения синергизма с сульфонилмочевинами в понижении или в нормализации уровня FBG у пациентов с T2DM.
[0033] Олигофруктоза (OF) состоит из смеси инулин фруктанов, каждый из которых содержит концевую молекулу глюкозы и последовательно связан с молекулами фруктозы. Фруктозил-глюкозная связь представляет собой Бета-(2→1), а фруктозил-фруктозные связи представляют собой Бета-(1→2). Максимальное количество связанных фруктозных компонентов (или степень полимеризации, т.е. DP) зависит от источника материала. Существует растительная, бактериальная и грибная олигофруктоза. Растительные фруктаны не превышают DP 200, где наиболее распространенный цикорий имеет верхний предел значения DP, составляющего приблизительно 60. Бактериальные фруктаны могут иметь DP до 100000. Олигофруктоза представляет собой частично гидролизованный, очищенный экстракт линейных фруктанов, полученных в виде нативного инулина, в основном из корня цикория (Cichorium intybus). При выделении из цикория, нативный инулин очищают посредством последовательной экстракции горячей водой, деминерализации, обработки активированным углем, микрофильтрации и концентрирования, например, как дополнительно описано в примерах.
[0034] В данном документе продемонстрировано, что препараты инулина, которые включают пропорцию, имеющую DP ниже примерно 25, и предпочтительно в интервале примерно от 2 до примерно 23 или примерно от 3 до примерно 23, более предпочтительно, примерно от 2 до примерно 10 или примерно от 3 до примерно 10, и еще более предпочтительно, примерно от 2 до примерно 5, конкретно F2-F5 или F3-F5, вероятно, лучше проявляют синергизм с сульфонилмочевиной для понижения или нормализации уровня FBG, чем препараты инулина с более высокими значениями DP. Инулин с целевыми и предпочтительными значениями DP и/или определенные OF и FOS могут быть получены путем ферментативной обработки инулина, экстрагированного из подходящего растительного источника или полученного из коммерческого источника, например, как дополнительно описано в примерах. Инулины с более низкими значениями DP (например, DP ниже примерно 25 и/или примерно от 2 до 23 или в более низком интервале) могут быть получены с использованием различных методов получения, хорошо известных и описанных в данной области, и, например, как дополнительно описано в примерах. Вкратце или в качестве примера, путем синтеза инулина из основных строительных элементов, начиная от сахарозы (G-F) и добавляя молекулы фруктозы с использованием фруктозил трансферазы (Bornet 1994) (1) или путем частичного ферментативного гидролиза инулина, экстрагированного из природного источника или полученного из коммерческого источника, в цепи более короткой длины (De Leenheer 1996) (2). Дополнительный метод получения инулинов с низкой DP, конкретно, FOS, представлен у Csanadi и Sisak 2008 (3). Конечный продукт затем очищают, стерилизуют и сушат на распылительной сушке с использованием методов, хорошо известных в данной области.
[0035] Препараты инулина по настоящему изобретению могут объединяться с любой из сульфонилмочевин, применяемых в настоящее время для лечения T2DM. Предыдущие исследования (PCT/AU 2011/000622) продемонстрировали, что инулин эффективно проявляет синергизм с сульфонилмочевинами, такими как гликлазид и глибенкламид в понижении или в нормализации уровня FBG у пациентов с T2DM. Настоящее исследование демонстрирует синергизм инулина с другими сульфонилмочевинами, такими как глимепирид и глипизид, дополнительно доказывая исходный постулат о том, что инулин проявляет синергизм с сульфонилмочевиной. Таким образом, на основе химической структуры и способа действия сульфонилмочевин, который может лежать в основе механизма наблюдаемого синергизма с инулином, понятно, что инулин будет проявлять синергизм с другими сульфонилмочевинами, такими как, например, глиборнурид, глизоксепид, глихидон, гликлопиримид, толазамид, толбутамид, карбутамид, метагексамид, хлорпропамид и ацетогексамид.
[0036] Количество сульфонилмочевины и/или сульфонамида и/или их производных и/или их метаболитов или их комбинаций, вводимое пациенту, может варьироваться, включая уменьшение количества, в зависимости от реакции пациента на комбинированную терапию с использованием препарата инулина. Это может достигаться с использованием любых стандартных методов, известных в данной области для мониторинга уровня FBG. Например, FBG может измеряться перед началом терапии и затем отслеживается в течение длительного срока через целевые интервалы для определения реакции пациента на комбинированную терапию с препаратом инулина. Если необходимо, то регуляция вводимого количества сульфонилмочевины и/или сульфонамида и/или их производных и/или их метаболитов или их комбинации, будет понятна практикующему врачу.
[0037] Инулин может вводиться пациенту, получающему агент сульфонилмочевины и/или агент сульфонамида и/или их производные и/или их метаболиты или комбинацию агентов, или в начале лечения агентом, или они могут вводиться периодически по необходимости регуляции/нормализации уровня глюкозы в крови, причем введение продолжается в течение срока лечения пациента с помощью сульфонилмочевины и/или сульфонамида и/или их производных и/или их метаболитов или их комбинаций. Эффект совместного введения инулина и сульфонилмочевины и/или сульфонамида и/или их производных и/или их метаболитов или их комбинаций, оказываемый на уровень глюкозы в крови, может быть не виден в течение короткого срока и, следовательно, может быть необходимым поддержание совместного введения в течение периода времени, достаточно длительного для достижения целевых эффектов, например, свыше 2-3 месяцев и предпочтительно в течение 4-6 месяцев. На основе состояния пациента, характера терапии и реакции, могут потребоваться более продолжительные периоды введения инулина до того момента, как проявится положительный эффект. Разумеется понятно, что такое совместное введение может поддерживаться настолько долго, насколько пациенту требуется лечение диабета или гипергликемии.
[0038] Композиции по настоящему изобретению дополнительно к эффективному использованию в лечении пациентов с T2DM, также могут использоваться для лечения объектов с гипергликемией, которые еще не классифицированы как диабетики (т.е. пре-диабетики), но которые, тем не менее, получают низкий уровень сульфонилмочевины, для предотвращения или для задержки появления диабета.
[0039] Композиции по настоящему изобретению могут вводиться с помощью разнообразных путей, включающих пероральный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный, внутриоболочечный, внутрибрюшинный, внутриназальный и буккальный. В зависимости от назначенного пути доставки соединения предпочтительно включают в состав либо в виде пероральных, инъецируемых или местных композиций.
[0040] Композиции для перорального введения могут принимать форму не дозированных жидких растворов или суспензий или не дозированных порошков и тому подобное. Например, в случае инулина или его природного источника композиции могут быть представлены в форме пищевой добавки, например, порошка или суспензии, которые могут быть легко добавлены к ежедневному рациону перед потреблением пищи. Они также могут принимать форму свежих, высушенных или полу-высушенных частей растений, для использования аналогичным образом.
[0041] Агенты или соединения по настоящему изобретению могут быть получены в виде отдельных композиций либо для последовательного, либо для одновременного введения или могут быть включены вместе в комбинированную композицию/единую лекарственную форму. Понятно, что отдельные композиции также могут быть включены в состав в единой лекарственной форме. Такие композиции вместе с подходящим применяемым адъювантом, носителем, разбавителем или эксципиентом могут помещаться в форму фармацевтических композиций и их единых лекарственных форм и в таких формах могут применяться в виде твердых материалов, таких как таблетки, или в виде заполненных капсул или в виде жидкостей, таких как растворы, суспензии, эмульсии, эликсиры или капсулы, заполненные этими жидкостями, для перорального применения.
[0042] Жидкие формы, подходящие для перорального введения, могут включать подходящие водные или не водные носители с буферами, суспендирующими и разбавляющими агентами, красителями, ароматизаторами и тому подобное. Твердые формы могут включать, например, любой из следующих ингредиентов или соединений сходной природы: связующий агент, такой как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза, дезинтегрирующий агент, такой как альгиновая кислота, примогель, или кукурузный крахмал; смазывающий агент, такой как стеарат магния; глидант, такой как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматизатор, такой как мята перечная, метилсалицилат или апельсиновый ароматизатор.
[0043] Для некоторых применений композиции также могут быть представлены в форме стерильных инъецируемых растворов для парентерального (включающих, в частности, внутривенное, подкожное, внутримышечное) применение. Такие фармацевтические композиции и их единые лекарственные формы могут включать ингредиенты в подходящих пропорциях вместе с дополнительными активными соединениями или элементами или без них, и такие единые лекарственные формы могут содержать любое подходящее эффективное количество активных ингредиентов соразмерно назначенному ежедневному, еженедельному, ежемесячному применению или соразмерно применению в другом интервале. Инъецируемые композиции, как правило, основаны на инъецируемом стерильном солевом растворе или фосфатно-буферном растворе или на других инъецируемых носителях, известных в данной области.
[0044] Количество каждой композиции, которое фактически вводится, будет, как правило, определяться врачом в свете сопутствующих обстоятельств, включающих патологическое состояние, которое подвергается лечению, выбранный путь введения, фактические вводимые соединения, возраст, вес и реакцию индивидуального пациента, тяжесть симптомов/патологического состояния пациента и тому подобное.
[0045] Вышеописанные компоненты для композиций перорального введения или для инъецируемых композиций являются всего лишь примерами. Композиция может быть составлена для введения. Могут использоваться методы обработки, известные в данной области, а также известные фармацевтически приемлемые носители, разбавители или эксципиенты. Для получения таких составов, композиции, описанные в данном документе, содержащие активные ингредиенты, смешивают с фармацевтически приемлемым носителем или эксципиентом, например, путем смешивания с физиологически приемлемыми носителями, эксципиентами или стабилизаторами в форме, например, лиофилизованных порошков, взвесей, водных растворов или суспензий (см., в основном Remingtonʹs Pharmaceutical Sciences, (4) и, например, ссылки (5)-(10) и примеры.
[0046] Соединения по настоящему изобретению также могут вводиться в формах с замедленным высвобождением или из систем доставки лекарственных средств с замедленным высвобождением, либо в отдельных лекарственных формах или в комбинированной лекарственной форме. Описание примерных материалов замедленного высвобождения также можно обнаружить в материалах Remingtonʹs Pharmaceutical Sciences, и например, в ссылках (5)-(10). Такое введение также может осуществляться посредством болюсного введения, или посредством имплантируемых устройств или пластырей или тому подобных.
[0047] Предпочтительно, композиции представлены в единых лекарственных формах для облегчения точного дозирования. Термин "единые лекарственные формы" относится к физически дискретным единицам, подходящим для применения в качестве единых лекарственных форм для объектов-людей и других млекопитающих (например, домашних животных или племенных животных, или для любых других животных, описанных в данном документе), причем каждая единая лекарственная содержит определенное количество активного материала, рассчитанного для получения целевого терапевтического эффекта, совместно с подходящим фармацевтическим эксципиентом, например, как описано в примерах. Типичные единые лекарственные формы включают предварительно заполненные, предварительно измеренные ампулы или шприцы с жидкими композициями или пилюли, таблетки, капсулы, каплеты, тапсулы или тому подобное в случае твердых композиций.
[0048] Единые лекарственные формы по настоящему изобретению, такие как таблетка или капсула, могут включать от 0,5 до примерно 2 г сульфонилмочевины и примерно от 5 мг до примерно 50 г инулина, или, как описано в данном документе. Однако на практике типичная лекарственная форма может включать примерно от 1 мг до примерно 2 мг сульфонилмочевины и/или сульфонамида и/или их производных и/или их метаболитов или их комбинаций, и примерно 500 мг инулина. В типичном режиме лечения это будет означать прием примерно 4 единых лекарственных форм три раза в день для достижения целевого терапевтического эффекта (например, для снижения уровня глюкозы в крови). Однако в зависимости от точной природы инулина и его способности к сжатию (в случае таблетированной единой лекарственной формы), могут использоваться, например, 2000 мг, или еще больше, на лекарственную форму, уменьшая таким образом количество лекарственных форм, которые необходимо принять с целью достижения целевого терапевтического эффекта.
[0049] В композициях по настоящему изобретению, особенно когда они присутствуют в единой лекарственной форме, инулин также может служить в качестве одного из ряда эксципиентов или может быть единственным эксципиентом в составе, действуя, таким образом, и в качестве активного агента и в качестве эксципиента.
[0050] Дополнительный дизайн и критерии включения также рассматриваются на основе способности одного или нескольких дополнительных веществ облегчать или проявлять синергизм по отношению к дозировке композиции посредством, например, высвобождения модифицирующих агентов, которые могут включать физические и/или химические модификации в отношении состава. Физические модификации могут включать, например, диспергирующие агенты, вещества, генерирующие газ, модификации или селекции размера и структуры, включающие наночастицы. Химические модификации могут включать, например, агенты, модифицирующие pH, буферы, ко-растворители, полимеры, пластификаторы. Также могут быть включены агенты, модифицирующие метаболизм, например, жиры, белки, углеводы, соли, минералы, а также вещества, которые, как известно, воздействуют на GI (гликемический индекс), конкуренты за сайты связывания с лекарственными средствами, ингибиторы ферментов, ферменты, гормоны и тому подобные.
[0051] Совместно вводимые лекарственные средства, которые исправляют или модифицируют побочные эффекты сульфонилмочевин, такие как сосудистый криз, панкреатическое истощение; также в композиции по изобретению могут быть добавлены витамины, минералы или другие питательные вещества или могут дополнительно вводиться в способах или применениях по изобретению.
[0052] Настоящее изобретение далее будет описано более подробно со ссылкой на конкретные, но частные примеры, описывающие конкретные композиции и способы их применения. Однако следует понимать, что подробное описание конкретных процедур, композиций и способов включено исключительно в иллюстративных целях настоящего изобретения. Их не следует понимать, как какое-либо ограничение описания общих черт концепции изобретения, как представлено выше.
Примеры
Пример 1
Аналитическое тестирование препаратов инулина
[0053] Анализы препаратов инулина осуществляли с помощью Австралийской лаборатории протеомного анализа (Research Park Drive, Macquarie University, Sydney, NSW, 2109, Australia), как вкратце описано ниже.
Подробное описание стандарта и образца:
[0054] Для удобства все образцы/препараты инулина получали из коммерческих источников. Стандарт инулина получали из Sigma Aldrich (PN: I2255-10G, LN: 099F71251V) и анализировали четыре различных препарата инулина, а именно, Orafti H.P, Orafti G.R, Orafti P95, все полученные из Orafti Inc., Belgium, и коммерчески доступный инулин (CI), (полученный из Just Like Sugar, Inc., Las Vegas, Nevada, USA).
Процедура анализа:
[0055] Стандартный раствор инулина и четыре препарат инулина готовили в концентрации 1 мг/мл путем растворения в горячей воде MilliQ и путем охлаждения до комнатной температуры перед применением. Раствор каждого получали свежим каждый день и анализировали при идентичных условиях. Все образцы и стандарты осуществляли в течение трех дней подряд. Анализ стандарта и каждого образца проводили в 3 отдельных процедурах согласно графику, приведенному ниже:
[0056] Образцы стандарта и инулина готовили свежими для каждого из различных дней в концентрации 1 мг/мл. Растворитель инулина (вода MilliQ) использовали в качестве пустого контроля. Прибор настраивали для прогона образцов в следующей последовательности:
[0057] Стандарт, пустой контроль, любой образец, пустой контроль, любой образец, пустой контроль, любой образец, пустой контроль, любой образец, пустой контроль, любой образец, пустой контроль, стандарт.
Прибор и способ:
[0058] Анализы стандарта и 4 образцов подвергали высокоэффективной анионообменной хроматографии на системе Dionex с импульсным амперометрическим детектирование