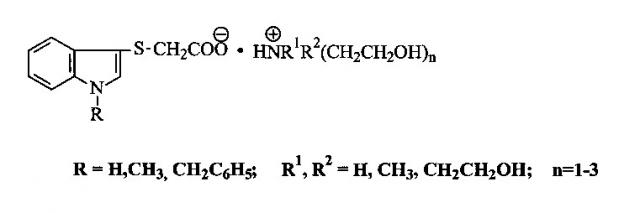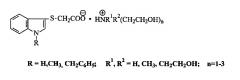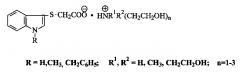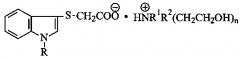Способ получения 1-r-индол-3-илсульфанилацетатов (2-гидроксиэтил)аммония
Иллюстрации
Показать всеИзобретение относится к способу получения гетероциклических соединений индольного ряда - 1-Н-, 1-метил-, 1-бензилиндол-3-илсульфанилацетатов (2-гидроксиэтил)аммония, которые обладают широким спектром действия, например, являются селективными эритропоэз- и иммуномодуляторами с минимальным потенциалом нежелательного влияния на различные системы организма, и могут быть использованы для профилактики и лечения иммуннозависимых поражений, протекающих с анемией, при онкологических и воспалительных заболеваниях, осложнений при трансплантации органов и костного мозга, защиты от кардиогенного шока и стрессов и др. Способ заключается во взаимодействии 1-R-индол-3-илсульфанилуксусных кислот с (2-гидроксиэтил)аминами - триэтаноламином, метилдиэтаноламином, диметилэтаноламином без растворителя при нагревании до 60-65°С в течение 0,5-1 часа, с промыванием полученной соли эфиром. Выход составляет 92-99%. Исходные 1-R-индол-3-илсульфанилуксусные кислоты (соединения 2) получают для этой реакции из 1-Н- или 1-метил- или 1-бензилиндола с тиомочевиной, бромом, бромистым калием, взятых в молярных соотношениях 1:2:1:1 соответственно, в водной среде при температуре 30-40°С в течение 3 часов в атмосфере инертного газа, с последующей обработкой реакционной массы водным раствором гидроксида натрия, затем водным раствором монохлоруксусной кислоты, взятых в мольных соотношениях индол, гидроксид натрия, кислота 1:(4-5):(1-1,2), нагреванием реакционной смеси при 90-100°С в течение 3 часов и при рН 9-10 с последующим подкислением соляной кислотой до рН=1 с выходом 92-95%. Чистота 98.7-99.7. Замена дефицитных и дорогих иода и йодистого калия в растворе спирта на более доступный водный раствор брома и бромида натрия, исключение из процесса токсичного гидразингидрата и токсичного растворителя (спирта) приводит к снижению себестоимости продукта и повышению экологической пожарной безопасности, поскольку реакция проводится в водной среде. 1з.п. ф-лы, 2 ил., 8 пр.
Реферат
Изобретение относится к способу получения 1-Н-, 1-метил-, 1-бензилиндол-3-ил-сульфанилацетатов (2-гидроксиэтил)аммония (соединения 1)общей формулы
Эти соединения, обладая низкой токсичностью, проявляют высокую фармакологическую активность (антиагрегантную, антиоксидантную, защитную в отношении клеточных мембран эритроцитов и тромбоцитов, противовирусную, противовоспалительную, противоаллергическую, иммуномодулирующую, противоопухолевую, антиметастатическую, протекторную при ультразвуковом и гамма-облучении) и могут использоваться при разработке передовых лекарственных средств [1-8]. Так, 1-Н-индол-3-илсульфанилацетат трис-(2-гидроксиэтил) аммония (R=Н) известен как селективный эритропоэз- и иммуномодулятор с минимальным потенциалом нежелательного влияния на различные системы организма, как антиоксидант, противовоспалительное и защитное средство
Это соединение обладает высоким избирательным Т-лимфотропным и эритропоэзстимулирующим действием наряду с отсутствием лимфотоксических свойств, селективной способностью избирательно тормозить/активировать функции Т- или В-системы иммунитета, что может быть использовано для иммуномодулирующей терапии иммуннозависимых, аллергических, онкологических и др. заболеваний [1]. Оно демонстрирует стойкий лечебный эффект (более 85% случаев) в модели иммунокомплексного гломерулонефрита у мышей (аналога волчаночного нефрита человека): повышает сниженную массу тела, снижает повышенную СОЭ и протеинурию, нормализует костно-мозговой эритропоэз и тем самым купирует анемию, стимулирует лейкопоэз, подавляет спонтанную и стимулированную продукцию провоспалительного цитокина ИЛ-1, купирует воспаление почечной и соединительной ткани при иммунокомплексном гломерулонефрите. Это соединение обладает иммунноактивными свойствами, сопоставимыми с иммунодепрессантами, используемыми в практике (циклоспорин А, азатиоприн), но, в отличие от них, не имеет нефро- и гепатотоксических свойств.
В то же время по воздействию на лимфо- и эритропоэз оно является иммуностимулятором [1-4].
Соединения 1 проявляют также противовоспалительную, антиоксидантную, антитромботическую, защитную активность. При стрессе и кардиогенном шоке они превосходят по эффективности применяемые в медицине антиоксиданты - витамин Е (токоферол) и антистрессорные, противошоковые препараты (строфантин, допамин, изадрин и др.); обладают способностью эффективно снижать содержание атерогенных липопротеидов низкой плотности [5-8]. Соединения 1 сочетают высокий терапевтический эффект с безвредностью в остром и хроническом эксперименте (LD50 в/б - 3000 мг/кг, per os - LD50 - 4460 мг/кг), не обладают аллергенным, мутагенным, цитотоксическим, тератогенным, кожно-нарывным и кожно-резорбтивным действием.
1-Бензил-индол-3-илсульфанилацетат трис(2-гидроксиэтил)аммония (R=СН2С6Н5), например, известен как нетоксичный селективный иммунодепрессант [9-11], противоопухолевое и антиметастатическое средство [12, 13]. Он обладает уникальной способностью избирательно подавлять активность В-клеток иммунитета, т.е. сдвигать баланс Т/В исключительно в сторону Т. В настоящее время не существует эффективных препаратов, способных изменять Т/В-баланс в нужном направлении.
На модели иммунокомплексного гломерулонефрита установлен клинический эффект соединения 1 (R=СН2С6Н5), не уступающий эффекту известного иммунодепрессанта азатиоприна, который вызывает серьезные побочные реакции и имеет ряд противопоказаний. В отличие от последнего, 1-бензил-индол-3-илсульфанилацетат трис(2-гидроксиэтил)аммония не токсичен, и не имеет побочного действия. Снижая в 3 раза выработку В-клетками иммуноглобулина Е - основного действующего звена в развитии аллергии, это вещество эффективно для лечения аллергических заболеваний [9-11].
Это соединение также высокоэффективно (89-99%) тормозит рост клеток опухолей мастоцитомы Р815, меланомы В16, лимфомы L1210 и гепатомы Г27 и проявляет антиметастатический эффект (уменьшает количество метастазов в легкие на 55%), сравнимый с эффектом цитостатика цисплатина, применяемого в клинической практике. Но, в отличие от цисплатина, вышеуказанное соединение не токсично [12, 13].
Другие соединения этого ряда проявляют высокую (83-99%) дозозависмую антипролиферативную активность в отношении спонтанной и стимулированной пролиферации спленоцитов и являются селективными иммунодепрессантами [12-14].
Известен способ получения 1-R-индол-3-илсульфанилацетатов (2-гидроксиэтил)аммония (1) взаимодействием в среде инертного газа R-индол-3-илсульфанилуксусных кислот (2) с (2-гидроксиэтил)аминами в спирте при нагревании до 45-50°С или при кипячении спиртового раствора в течение 1-2 часов, а затем высаживанием полученных солей этиловым эфиром с выходом до 90% [2]. При этом исходные 1-R-индол-3-илсульфанилуксусные кислоты (2) для соединений (1) синтезируют в среде инертного газа взаимодействием 1-R-индолов, тиомочевины, иода, йодистого калия и хлоруксусной кислоты при соотношении реагентов 1:2:1:1:(1-1.2) соответственно. Реакция протекает в растворе спирта (метанол, этанол, пропан-2-ол) при одновременном введении в реакцию тиомочевины и индола с последующим действием на образующийся in situ индолилизотиуроний иодид монохлоруксусной кислотой и с добавлением гидразин-гидрата в количествах от 20% до эквимольного, в присутствии щелочи при нагревании реакционной смеси до 70-75°С в течение 1,5-3 ч при рН 9-10. Выходы 1-H-индол-3-илсульфанилуксусных кислот составляют 86-90% [2, 16], а без добавления гидразин-гидрата выходы гораздо ниже - 76,8-77,8% [15].
Недостатком вышеуказанных способов получения 1-R-индол-3-илсульфанилацетатов (2-гидроксиэтил)аммония (1) является проведение процесса в спирте (чаще всего в токсичных изо-пропиловом или метиловом), что сопряжено с определенными рисками в технологическом плане для любого спирта, а также использование на стадии синтеза 1-R-индол-3-ил-сульфанилуксусных кислот (2) дефицитных и дорогих иода и йодистого калия, а также, в основном, эквимолярного количества токсичного гидразингидрата.
Задачей данного изобретения является нахождение простого и безопасного способа получения соединений 1, который позволит избежать использования токсичных растворителей в процессе получения, а также отказаться от токсичного гидразингидрата на стадии синтеза соединений 2 (1-R-индол-3-ил-сульфанилуксусных кислот).
Технический результат достигается тем, что такой рациональный синтез 1-R-индол-3-илсульфанилацетатов (2-гидроксиэтил)-аммония (1А-Г) осуществляют следующим образом: 1-R-индол-3-илсульфанилуксусные кислоты (2), где R равен 1-Н-(2 А), 1-метил- (2Б), 1-бензил (2В), как оказалось, взаимодействуют с (2-гидроксиэтил)аминами - триэтаноламином, метилдиэтаноламином, диметилэтаноламином, взятыми в мольных соотношениях 1:1, в отсутствии растворителя при нагревании до 60-65°С в течение 0,5-1,0 часа, с дальнейшим промыванием полученной соли эфиром. При этом исключается применение токсичных и пожароопасных растворителей в самом процессе синтеза, исключается стадия удаления растворителя, а выходы составляют 92-99%.
А исходные 1-R-индол-3-ил сульфанилуксусные кислоты (2) предлагается, в свою очередь, получать в водной среде при температуре 30-40°С в течение 3 ч в атмосфере инертного газа из N-H, N-алкил, N-алкиларил индолов, тиомочевины, брома, бромистого калия или бромистого натрия, взятых в молярных соотношениях 1:2:1:1 соответственно, с последующей обработкой реакционной массы водным раствором гидроксида натрия, затем водным раствором монохлоруксусныой кислоты, взятых в мольных соотношениях индол, гидроксид натрия, кислота 1:(4-5):(1-1,2), и затем выдерживают в течение 3 часов при 90-100°С, завершая реакцию подкислением соляной кислотой до рН=1. При этом выход 1-R-индол-3-ил сульфанилуксусных кислот с чистотой до 98.7-99.7% составляет 90-95%. Присутствие токсичного гидразин-гидрата при этих условиях не требуется.
Новизна предлагаемого способа заключается в том, что на обеих стадиях полностью исключается присутствие токсичного и небезопасного растворителя (спирта), а для получения индолил-сульфанилуксусных кислот реакцию проводят в воде, и вместо иода (плохо растворимого в воде, поэтому с иодом реакция в воде не идет) и йодистого калия используют бром и бромистый калий, что приводит к принципиальному изменению механизма этой реакции. Индол уже при комнатной температуре легко бромируется в положение 3, образовавшийся при этом 3-броминдол реагирует с тиомочевиной, приводя к гидробромиду изотиуроний индола, как показано на вышеприведенной схеме. Такой путь реакции способствует повышению выхода кислоты (2) (90-95%) и ее чистоты (98.7-99.7%) за счет исключения образования побочных продуктов окисления, таких как дисульфиды индола и другие, как это происходит в случае применения сильного окислителя (пара: иод-иодистый калий).
Кроме того, исключается из реакционного процесса токсичный гидразингидрат в количестве, эквимольном индолу. Повышается экологическая и пожарная безопасность за счет проведения реакций в водной среде вместо спиртовых (метанол, этанол, изо-пропанол) растворов. Также снижается себестоимость продукта за счет применения более дешевых реагентов - брома и бромидов щелочных металлов вместо дорогостоящих иода и иодида калия (стоимость брома и бромида калия в 10-20 раз ниже, чем иода и иодида калия [17]. Дальнейший процесс выделения 1-R-индол-3-илсульфанилуксусных кислот происходит путем выпадения их в виде кристаллов после очистки водной реакционной среды активированным углем, при этом для полноты выделения кристаллов водную реакционную среду выдерживают в течение 24 часов при 3-6°С.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение 1-Н-индол-3-илсульфанилуксусной кислоты (2А)
К суспензии 1.17 г (0.01 моль) индола и 1.52 г (0.02 моль) тиомочевины в 25 мл H2O в токе аргона по каплям добавляли раствор 1.6 г (0.01 моль) Br2 и 1.19 г (0.01 моль) KBr в 25 мл Н2О, не допуская повышения температуры реакционной смеси выше 40°С. Реакционную смесь перемешивали 3 часа при 30-40°С и затем медленно добавляли раствор 2.0 г (0.05 моль) NaOH в 15 мл воды и 1.13 г (0.012 моль) монохлоруксусной кислоты в 10 мл Н2О. Смесь выдерживали на водяной бане (90-100°С) в течение 3 ч. Добавляли активированный уголь (1-2 г), перемешивали 1 ч, фильтровали и подкисляли 10% HCl до рН=1, выдерживали при 3-6°С 24 часа. Выпавшую кислоту отфильтровывали и высушивали на воздухе.
Выход 1,86 г (90%). Бесцветный порошок с т.пл. 109°С (лит. 109-110°С).
Спектр ЯМР 1Н (CD3OD, ГМДС), δ, м.д.: 7.70-7.09 м (5 Н, Ind), 3.36 с (2 Н, SCH2).
Спектр ЯМР 13С (CD3OD, ГМДС), δС, м.д.: 174.44 (С=O), 138.08-104.35 (Ind), 39.94 (SCH2).
ИК-спектр (KBr), ν, см-1: 1704 (С=O), 3364 (NH), 3498 (ОН).
Найдено, %: С 58.22; Н 4.07; N 6.88. C10H9NO2S.
Вычислено, %: С 57.95; Н 4.37; N 6.75.
Содержание основного вещества в продукте по данным потенциометрического титрования (ионометр ЭА-74) составляет 98,7%
Пример 2. 1-Метилиндол-3-илсульфанилуксусная кислота. (2Б)
Получали и выделяли аналогично примеру 1 из 13.11 г (0.1 моль) 1-метилиндола, 15.22 г (0.2 моль) тиомочевины 16 г (0.1 моль) брома, 11.9 г (0.1 моль) бромистого калия и 11.34 г (0.12 моль) монохлоруксусной кислоты. Выход 20.35 г (92%). Бесцветный порошок с т.пл. 105-108°С.
Спектр ЯМР 1Н, (CD3)2CO, δ, м.д.:: 7.75-7.15 м (5 Н, Ind), 3.72 с (3 Н, N-CH3), 3.39 (2 Н, SCH2).
ИК-спектр(KBr) ν, см-1: 1700 (С=O), 3475 (ОН).
Найдено, %: С 59.78; Н 4.99; N 6.37. C11H11NO2S. Вычислено, %: С 59.71; Н 5.01; N 6.33.
Содержание основного вещества в продукте составляет 99.5%
Пример 3. Получение 1-бензилиндол-3-илсульфанилуксусной кислоты (2В)
К суспензии 2.07 г (0.01 моль) 1-бензилиндола и 1.52 г (0.02 моль) тиомочевины в 50 мл H2O в токе аргона по каплям добавляли заранее приготовленный раствор 1.6 г (0.01 моль) Br2 и 1.19 г (0.01 моль) KBr в 10 мл H2O. Реакционную смесь перемешивали 3 часа при 30-40°С. Затем прибавляли последовательно раствор 2.0 г (0.05 моль) NaOH в 10 мл H2O и 1.13 г (0.012 моль) монохлоруксусной кислоты в 10 мл H2O. Смесь выдерживали на водяной бане при 90-100°С в течение 3 ч. Добавляли активированный уголь (1 г), перемешивали 1 ч, отфильтровывали, подкисляли 10% HCl до рН=1. Выдерживали при 3-5°С 24 часа. Осадок отфильтровывали и высушивали на воздухе.
Выход 2,82 г (95%). Бесцветный порошок с т.пл. 107-109°С (лит. 107-109°С).
Спектр ЯМР 1Н (CD3OD), δ, м.д.: 7.72-7.06 м (10 Н, Bnz, bid), 5.23 с (2 Н, NCH2), 3.36 (2 Н, SCH2).
Спектр ЯМР 13C (CD3OD), δС, м.д.: 172.83 (С=O), 137.29-102.86 (Bnz, Ind), 38.55 (SCH2).
ИК-спектр, ν, см-1: 1701 (С=O), 3435 (ОН).
Найдено, %: С 68.95; Н 5.29; N 4.88. C17H15NO2S.
Вычислено, %: С 68.66; Н 5.08; N 4.71.
Содержание основного вещества в продукте по данным потенциометрического титрования (ионометр ЭА-74) составляет 99.7%.
Пример 4. Трис-(2-гидроксиэтил)аммоний 1-Н-индол-3-илсульфанилацетат(1А).
Смесь 20.72 г (0.1 моль) 1-Н-индол-3-илсульфанилуксусной кислоты (2А) и 14.92 г (0.1 моль) триэтаноламина нагревали до 60-65°С 0,5 часа. Полученный продукт промывали эфиром и вакуумировали. Выход 33.96 г (95.3%). Бесцветный порошок с т.пл. 92-93°С (лит. 90-92°С).
Спектр ЯМР 1Н (CD3OD) δ, м.д.: 7.70-7.11 (м, 5Н, Ind); 3.77 (т, 6Н, ОСН2); 3.37 (с, 2Н, SCH2); 3.19 (т, 6H, NCH2).
Спектр ЯМР 13С (CD3OD) δC, м.д.: 177.27 (С=O); 138.96-105.88 (Ind); 57.37 (ОСН2); 57.11 (SCH2); 50.91 (NCH2).
ИК ν, см-1: 1591 (С=O), шир. 2200-2800 (N+H), 3308 (ОН).
Найдено, %: С, 54.01; Н, 6.77; N, 7.80; S, 9.09. C16H24O5N2S.
Вычислено, %: С, 53.91; Н, 6.78; N, 7.86; S, 8.99.
Пример 5. Трис-(2-гидрокиэтил)аммоний 1-бензилиндол-3-илсульфанилацетат (1Б).
Смесь 2.97 г (0.01 моль) 1-бензилиндол-3-илсульфонилуксусной кислоты (2 В) и 1.49 г (0.01 моль) триэтаноламина нагревали до 60-65°С 0,5 часа. Полученный продукт промывали эфиром и вакуумировали. Выход 4.28 г (96%). Бесцветный порошок с т.пл. 93°С.
Спектр ЯМР 1Н (CD3OD) δ, м.д.: 7.98-7.23 (м, 10 Н, C8H5N, С6Н5); 5.44 (уш. с, 2Н, CH2-6H5); 4.06 (уш. с, 2Н, SO2CH2); 3.83 (т, 6Н, ОСН2); 3.32 (т, 6Н, NCH2).
Спектр ЯМР 13С (CD3OD) δС, м.д.: 166.45 (С=O); 135.52-110.15 (C8H5N, С6Н5); 63.16 (SO2CH2); 54.80 (ОСН2); 54.73 (NCH2); 49.43 (СН2-С6Н5).
ИК-спектр ν, см-1: 1607 (С=O), шир. 2200-2800 (N+H), 3300 (ОН).
Найдено (%): С, 57.90; Н, 6.11; N, 5.95. C23H30N2O5S.
Вычислено (%): С, 57.67; Н, 6.26; N, 5.85.
Пример 6. N-метил-бис-(2-гидроксиэтил)амоний 1-Н-индол-3-илсульфанилацетат (1В) получали аналогично из 2.07 г (0.01 моль) 1-Н-индол-3-илсульфанилуксусной кислоты (2А) и 1.19 г (0.01 моль) N-метилдиэтаноламина. Полученный продукт промывали эфиром и вакуумировали. Выход 3.0 г (92%). Прозрачное маслообразное вещество.
Спектр ЯМР 1Н (CD3OD) δ, м.д.: 7.72-7.10 (м, 5 Н, C8H5N); 3.76 (т, 4Н, ОСН2); 3.40 (уш. с, 2Н, SCH2); 3.10 (т, 4Н, NCH2); 2.69 (с, 3Н, N+СН3).
Спектр ЯМР 13С (CD3OD)) δC, м.д.: 177.01 (С=O); 136.99-104.56 (C8H5N); 58.01 (ОСН2); 56.18 (NCH2); 42.37 (SCH2); 40.02 (N+CH3).
ИК-спектр (KBr), ν/см-1: 3290 (ОН), шир. 2800-2200 (N+H), 1602 (С=O).
Найдено, %: С 55.30; Н 6.65; N 8.45; S 9.78. C15H22O4N2S.
Вычислено, %: С 55.19; Н 6.79; N 8.58; S 9.82.
Пример 7. N,N-диметил-(2-гидроксиэтил)аммоний 1-Н-индол-3-илсульфанилацетат (1Г) получали аналогично из 2.07 г (0.01 моль) 1-Н-индол-3-илсульфанилуксусной кислоты (2А) и 0.89 г (0.01 моль) N,N-диметилэтаноламина. Полученный продукт промывали эфиром и вакуумировали. Выход 2.95 г (99%). Прозрачное некристаллизующееся маслообразное вещество.
Спектр ЯМР 1Н (CD3OD), δ, м.д.: 7.66-7.07 (м, 5Н, C8H5N); 3.80 (т, 2Н, ОСН2); 3.39 (уш. с, 2Н, SCH2); 3.19 (т, 2Н, NCH2); 2.68 (с, 6Н, N+СН3).
Спектр ЯМР 13С (CD3OD), δ, м.д.: 178.01 (С=O); 137.81-105.51 (C8H5N); 57.21 (ОСН2); 56.87 (NCH2); 43.27 (SCH2); 40.05 (N+СН3).
ИК-спектр (KBr), ν/см-1: 3300 (ОН), шир. 2800-2200 (N+H), 1560,1616 (С=O).
Найдено (%): С 56.95; Н 6.88; N 9.40; S 10.86. C14H20O3N2S.
Вычислено (%): С 56.73; Н 6.80; N 9.45; S 10.82.
Пример 8. N-метил-бис-(2-гидроксиэтил)аммоний 1-бензилиндол-3-илсульфанилацетат. (1Д) получали аналогично из 2.97 г (0.01 моль) 1-бензилиндол-3-илсульфанилуксусной кислоты (2 В) и 1.19 г (0.01 моль) N-метилдиэтаноламина при нагревании до 60-65°С 1 час. Полученный продукт промывали эфиром и вакуумировали. Выход 3,84 г (92,3%).
Бесцветный порошок, медленно плавится при комнатной температуре.
Спектр ЯМР 1Н (CD3OD, δ, м.д.): 7.75-7.11 (м, 10 Н, C8H5N, С6Н5); 5.27 (уш. с, 2Н, СН2-С6Н5); 3.77 (т, 4Н, ОСН2); 3.42 (уш. с, 2Н, SCH2); 3.06 (т, 4Н, NCH2); 2.71 (с, 3Н, N+CH3).
Спектр ЯМР 13С (CD3OD, δ, м.д.): 176.75 (С=O); 137.75-104.98 (C8H5N, С6Н5); 58.10 (ОСН2); 56.17 (NCH2); 49.40 (СН2-С6Н5); (42.27 (SCH2); 40.56 (N+СН3).
ИК-спектр (KBr), ν/см-1: 3295 (ОН), шир. 2800-2200 (N+H), 1596 (С=O).
Найдено (%): С 63.30; Н 6.72; N 6.59; S 7.76; C22H28O4N2S.
Вычислено (%): С 63.44; Н 6.78; N 6.73; S 7.70.
ЛИТЕРАТУРА
1. О.П. Колесникова, А.Н. Мирскова, С.Н. Адамович, О.Т. Кудаева, Р.Г. Мирсков, М.Г. Воронков. Иммуно- и эритропоэзактивные свойства индол-3-илсульфанилацетата трис-(2-гидроксиэтил)-аммония, Бюл. СО РАМН. - 2010. - №30(6).- С. 12-19.
2. А.Н. Мирскова, Г.Г. Левковская, О.П. Колесникова, О.М. Перминова, Е.В. Рудакова, С.Н. Адамович. Направленный синтез и иммуноактивные свойства 2-(гидроксиэтил)- аммониевых солей 1-R-индол-3-илсульфанил(сульфонил)-алканкарбоновых кислот, Изв. АН. Сер. хим. - 2010. - №12. - С. 2181-2190.
3. А. Н. Мирскова, Р. Г. Мирсков, С.Н. Адамович, М.Г. Воронков. Индол-3-илсульфанил ацетат трис-(2-гидроксиэтил)аммония - эффективный стабилизатор клеточных мембран и антиоксидант, Докл. РАН. - 2010. - Т. 435. - №4. - С. 561-563.
4. О.П. Колесникова, О.Т. Кудаева, Т.Г. Сухенко, А.П. Лыков, Г.Г. Левковская, М.Г. Воронков, К.В. Гайдуль, В.А. Козлов. Эксперим. и клинич. фармакология, 2006, 69, 47.
5. Пат. 2086239 (1997). РФ. // Б.И. 1997. №22.
6. Пат. 2080861 (1997) РФ. // Б.И. 1997. №16.
7. Пат. 2108100 (1998) РФ // Б.И. 1998. №10.
8. Пат. 2034540 (1995) РФ. // Б.И. 1995. №9.
9. О.П. Колесникова, О.Т. Кудаева, Е. В. Ненашева, И.А. Гольдина, Е.В. Гойман, А.П. Лыков, И.В. Сафронова, В.Л. Лимонов, А.Н. Мирскова, Е.В. Рудякова, К.В. Гайдуль. Селективные иммунодепрессивные свойства нового производного индолилтиоалканкарбоновой кислоты. Бюл. СО РАМН, 2007, №2(124), 14-18. [Bull, of the Russ. Acad, of Medical Sciences Siberian Branch].
10. О.П. Колесникова, О.Т. Кудаева, Е.В. Ненашева, И.А. Гольдина, Е.В. Гойман, И.В. Сафронова, В.Л. Лимонов, А.Н. Мирскова, С.Н. Адамович, К.В. Гайдуль, В.А. Козлов. Создание иммунодепрессанта с селективным механизмом действия. Материалы респ.конференции С43 «Создание новых лекарственных препаратов» / Под. ред. Е.Д. Гольдберга, Томск: Томский ун-тет, 2007, 26-28.
11. О.П. Колесникова, О.Т. Кудаева, Е.В. Гойман, Е.В. Гойман, А.П. Лыков, Т.В. Долгих, К.В. Гайдуль, А.Н. Мирскова, Г.Г. Левковская, М.Г. Воронков, В.А. Козлов. Изучение иммунодепрессивных свойств соединения ВМ-7-02 у интактных мышей и в экспериментальной модели иммунокомплексного гломерулонефрита. В книге: «ВИЛИМ (доклинические исследования)», Новосибирск: Новосибирский полиграфкомбинат, 2008, 37-48.
12. О.П. Колесникова, О.Т. Кудаева, Т.Г. Сухенко, А.П. Лыков, Т.В. Долгих, К.В. Гайдуль, А.Н. Мирскова, Г.Г. Левковская, М.Г. Воронков, В.А. Козлов. Изучение противоопухолевых свойств новых производных арилгетероалкан-карбоновых кислот. В книге: «ВИЛИМ (доклинические исследования)» / Новосибирск: Новосибирский полиграфкомбинат, 2008, 29-36.
13. А.Н. Мирскова, Р.Г. Мирсков, С.Н. Адамович, М.Г. Воронков. 2-Гидрокси-этиламмониевые соли органилсульфанил(сульфонил)-уксусных кислот - новые фармакологически активные соединения // Химия в интересах устойч. развития. - 2011. - Т. 19. - №5. - С. 467-478.
14. Anna N. Mirskova, Sergey N. Adamovich, Rudolf G. Mirskov, Olga P. Kolesnikova, Uwe Schilde. Immunoactive ionic liquids based on 2-hydroxy-ethylamines and 1-R-indol-3-ylsulfanylaceticacids. Crystal and molecular structure of immunodepressant tris-(2-hydroxyethyl)ammonium indol-3-yl-sulfanylacetate // Open Chemistry (formerly Central European Journal of Chemistry) - 2015. - V. 13. - P. 149-155.
15. A.H. Мирскова, Г.Г. Левковская, С.А. Гусева, Ю.И. Крюкова, Г.В. Суворова, М.Г. Воронков, Ф.Ф. Мирошников. Способ получения индолил-3-тиоуксусной кислоты, Патент СССР №1473294 Б.И. 8,1998.
16. Г.Г. Левковская, Е.В. Рудакова, А.Н. Мирскова. Синтез индол-3-илсульфанил-алканкарбоновых кислот, ЖОрХ. 2002. Т. 38. №11. С. 1697-1703.
17. Aldrich Advancing Science: Handbook of Fine Chemicals 2007-2008. Published by Sigma-Aldrich Canada, 2006. P. 433, 1479, 2079, 2091.
1. Способ получения 1-R-индол-3-илсульфанилацетатов R1, R2, (2-гидроксиэтил)аммония общей формулы
взаимодействием 1-R-индол-3-илсульфанилуксусных кислот с (2-гидроксиэтил)аминами: триэтаноламином, метилдиэтаноламином, диметилэтаноламином при нагревании, отличающийся тем, реакцию проводят без растворителя при нагревании до 60-65°C в течение 0,5-1,0 часа, а целевой продукт выделяют промыванием этиловым эфиром, при этом выход составляет 92-99%, а исходные 1-R-индол-3-илсульфанилуксусные кислоты для этой реакции получают в водной среде при температуре 30-40°C в течение 3 часов в атмосфере инертного газа из N-H, N-алкил, N-алкиларил индолов, тиомочевины, брома, бромистого калия или бромистого натрия, взятых в молярных соотношениях 1:2:1:1 соответственно, с последующей обработкой реакционной массы водным раствором гидроксида натрия, затем водным раствором монохлоруксусныой кислоты, взятых в мольных соотношениях индол, гидроксид натрия, кислота 1:(4-5):(1-1,2) и выдерживании в течение 3 часов при 90-100°C, завершая подкислением соляной кислотой до pH=1.
2. Способ по п. 1, отличающийся тем, что процесс выделения 1-R-индол-3-илсульфанилуксусных кислот заканчивается после истечения 24 часов, и выделяют их в виде кристаллов после очистки водной реакционной среды активированным углем.