Форзициазида сульфат и его производные, способ его получения и его применение
Иллюстрации
Показать всеИзобретение относится к форзициазида сульфату и его производным, представленным следующей формулой, где R представляет собой Na+, K+ или NH+, и способу их получения, а также к противовирусному лекарственному средству на их основе и его применению. 4 н. и 6 з.п. ф-лы, 9 табл., 2 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицинской химии, и в частности, к производным форзициазида сульфата, и к способам их получения, а также к фармакологическим эффектам таких производных с точки зрения резистентности вирусов.
Предшествующий уровень техники
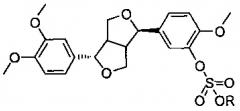
Форзициазид, агликоновая часть форзицина, также известный как филлигенин, является главным активным компонентом Forsythia suspense (Форзиции свисающей) из рода Forsythia (Форзиция) семейства Oleaceae (Маслиновые), и имеет структуру, как представлено ниже. Современные фармакологические исследования показали, что форзициазид обладает антивирусным, антиоксидантным эффектом, снижает липиды крови, является акцептором свободных радикалов, обладает антибактериальным, противоопухолевым, противовоспалительным эффектом, и тому подобное.
Форзициазид имеет нестабильные молекулы, которые подвержены окислению и легко изменяют конфигурацию в кислой среде. Исследования, имитирующие метаболизм форзицина кишечными бактериями крысы, показали, что форзицин легко метаболизируется кишечной флорой с образованием нового метаболита.
Исследования метаболизма лекарств с фенольной структурой установили, что лекарства со структурой фенольного гидроксилата легко метаболизируются сульфатазами in vivo с образованием фенол-сульфатных производных, и обладают хорошей активностью. Например, производные даидзеин сульфата, производные эдаравон сульфата, производные генистеин сульфата, производные ресвератол сульфата, и тому подобные. Таким образом, мы получили сульфатные производные филлигенина, и провели химический синтез и фармакологические исследования.
Раскрытие изобретения
Техническая проблема, решаемая настоящим изобретением, заключается в получении производных форзициазида сульфата посредством способа химического синтеза. Настоящее изобретение обеспечивает производные форзициазида сульфата. Кроме того, настоящее изобретение также обеспечивает способ получения производных форзициазида сульфата, и пригодно для производства в промышленном масштабе.
Во-первых, настоящее изобретение обеспечивает форзициазида сульфат и его производные, представленные следующей формулой:
где R является Н, Na+, K+, NH4+, тетраметиламмонием, тетраэтиламмонием, метиламино, диметиламино, триметиламино, триэтиламино, диэтиламино, этиламино, этаноламино, диэтаноламино, пиперидилом, пиперазинилом или пиразинилом.
Во-вторых, настоящее изобретение обеспечивает фармацевтическую композицию, включающую производные форзициазида сульфата по настоящему изобретению и фармацевтически приемлемые вспомогательные вещества.
При этом фармацевтически приемлемые вспомогательные вещества означают нетоксичные твердые, полутвердые или жидкие наполнители, разбавители, носители, регуляторы рН, регуляторы ионной силы, агент медленного высвобождения или контролируемого высвобождения, материал оболочки или другие фармакологические вспомогательные вещества. Используемый носитель может быть приспособлен к соответствующему способу применения лекарства; можно применять вспомогательные вещества, хорошо известные специалистам в данной области техники для получения инъекций, лиофилизированного порошка (для инъекций), спреев, пероральных растворов, пероральных суспензий, таблеток, капсул, кишечнорастворимых таблеток, пилюль, порошков, гранул, составов пролонгированного высвобождения или отсроченного высвобождения, и тому подобного. Производные форзициазида сульфата по первому аспекту настоящего изобретения являются предпочтительными, и вводятся путем инъекции или через пищеварительный тракт; таким образом, фармацевтическая композиция по настоящему изобретению предпочтительно является составами для инъекций или составами, вводимыми через пищеварительный тракт; т.е. вспомогательные материалы, пригодные для получения инъекций или составов, вводимых через пищеварительный тракт, являются особо предпочтительными, где «введение через пищеварительный тракт» означает подход к введению лекарственных препаратов через пищеварительный тракт пациента, включая пероральное введение, внутрижелудочное введение, введение посредством клизмы, и тому подобное, предпочтительно пероральное введение; например, вспомогательные вещества, хорошо известные специалистам в данной области техники, можно применять для получения пероральных растворов, пероральных суспензий, таблеток, капсул, кишечнорастворимых таблеток, пилюль, порошков, гранул, составов пролонгированного высвобождения или отсроченного высвобождения и тому подобного; где составы для инъекций являются главным образом инъекционными формами и порошками для инъекций.
В-третьих, настоящее изобретение обеспечивает способ получения форзициазида сульфата и его производных, включающий следующие последовательно выполняемые этапы:
(1) растворение форзициазида в органическом растворителе для получения раствора форзициазида;
(2) вначале добавление сульфатирующего агента в раствор форзициазида и тщательное перемешивание; затем проведение реакции этерификации для получения жидкой смеси продукта;
(3) добавление основания для установки значения рН жидкой смеси до 8-10;
(4) разделение и очистка жидкой смеси для получения готового продукта;
где органический растворитель на этапе (1) выбран из пиридина, N,N-диметилформамида, N,N-диметилацетамида или дихлорметана;
где сульфатирующий агент добавляют в раствор форзициазида при 0-5°С.
В частности, сульфатирующий агент добавляют в раствор форзициазида при 0°С, и перемешивают до однородного состояния.
В частности, сульфатирующий агент выбирают из хлорсульфоновой кислоты, комплекса серы триоксида-триэтиламина, комплекса серы триоксида-пиридина, или комплекса серы триоксида-триметиламина, и предпочтительно, хлорсульфоновой кислоты.
В частности, молярное отношение форзициазида в растворе форзициазида к сульфатирующему агенту составляет 1:1-10, и предпочтительно 1:2.
При этом температура реакции этерификации на этапе (2) составляет 0-110°С.
В частности, температура реакции этерификации, выполняемой с форзициазидом и хлорсульфоновой кислотой, составляет 0-10°С, и предпочтительно 10°С; температура реакции этерификации, проводимой с форзициазидом и комплексом серы триоксид-триэтиламин, комплексом серы триоксид-пиридин или комплексом серы триоксид-триметиламин, составляет 100-110°С.
В частности, после выполнения реакции этерификации с форзициазидом и комплексом серы триоксид-триэтиламин, комплексом серы триоксид-пиридин или комплексом серы триоксид-триметиламин, способ дополнительно включает охлаждение смеси реакции этерификации, и добавление основания для доведения рН смеси до 8-10.
В частности, смесь реакции этерификации охлаждают до комнатной температуры (10-30°С), при этом значение рН на этапе (3) предпочтительно составляет 10; основание выбрано из органического основания или неорганического основания.
В частности, неорганическое основание выбрано из раствора натрия карбоната, калия карбоната, натрия бикарбоната, калия бикарбоната, натрия гидроксида, калия гидроксида, или водного раствора аммиака, и предпочтительно раствора натрия гидроксида, калия гидроксида или водного раствора аммиака; органическое основание выбрано из тетраметиламмония, тетраэтиламмония, метиламина, диметиламина, триметиламина, триэтиламина, диэтиламина, этиламина, этаноламина, диэтаноламина, пиперидина, пиперазина или пиразина.
При этом жидкую смесь продукта разделяют с применением колоночной хроматографии на силикагеле на этапе (4).
В частности, в качестве силикагеля выбирают силикагель GF254.
В другом аспекте настоящее изобретение обеспечивает применение форзициазида сульфата и его производных для изготовления противовирусных лекарственных средств.
При этом противовирусные лекарственные средства выбраны из лекарств против вируса гриппа, лекарств против вируса парагриппа, лекарств против респираторно-синцитиального вируса, лекарств против вируса простого герпеса I типа, и лекарств против вируса Коксаки А16.
В другом аспекте настоящее изобретение обеспечивает противовирусное лекарственное средство, содержащее форзициазида сульфат или производные форзициазида сульфата.
Преимущества настоящего изобретения являются следующими: способ получения производных форзициазида сульфата по настоящему изобретению является легко контролируемым, выход продукта является высоким, и способ пригоден для производства в промышленном масштабе; производные форзициазида сульфата по настоящему изобретению обладают значительным противовирусным эффектом, и ингибирующая эффективность по отношению к вирусам достигает более 80%; результаты антивирусных тестов in vivo показывают, что производные форзициазида сульфата обладают относительно высокими ингибирующими эффектами в отношении вируса гриппа и вируса парагриппа, кроме того, при вызванной этими вирусами мышиной пневмонии позволяют значительно уменьшить легочный индекс и титр гемагглютинации, а также обеспечить существенное улучшение легочной гистопатологии.
Краткое описание чертежей
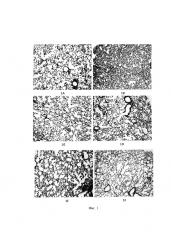
Фиг. 1 является изображением, полученным при микроскопии среза легочной ткани, полученной на мышиной модели пневмонии, вызванной вирусом гриппа; и
фиг. 2 является изображением, полученным при микроскопии среза легочной ткани, полученной на мышиной модели пневмонии, вызванной вирусом парагриппа.
Осуществление изобретения
Настоящее изобретение далее описано посредством следующих вариантов осуществления. Однако эти варианты осуществления приведены только с целью иллюстрации, и не должны рассматриваться как ограничивающие объем настоящего изобретения. Кроме того, все реагенты и сырьевые материалы в вариантах осуществления могут быть коммерческими; если это не упомянуто, может быть приведена ссылка на руководство по органическому синтезу, указания по применению лекарственных средств и соответствующие инструкции производителей на оборудование и реагенты, и тому подобное.
Вариант осуществления 1
1. Форзициазид (4 г, 10,75 ммоль) добавляли в 180 мл безводного пиридина, и перемешивали до растворения, для получения раствора форзициазида.
2. На ледяной бане дихлорметановый раствор хлорсульфоновой кислоты (1,4 мл, примерно 21,5 ммоль) добавляли по каплям в раствор форзициазида, при перемешивании, и скорость капельного добавления составила 1 каплю (примерно 50 мкл на каплю) в 2 секунды, т.е. молярное отношение форзициазида к хлорсульфоновой кислоте в настоящем варианте осуществления составило 1:2.
3. После завершения капельного добавления в условиях перемешивания температуру поднимали и поддерживали при 10°С, и проводили реакцию этерификации;
4. В условиях сохранения температуры 10°С реакцию этерификации завершали, при проведении реакции в течение 1 часа, добавляли метаноловый раствор (5 мл) натрия гидроксида для доведения значения рН до 10, реакционную смесь затем выпаривали при сниженном давлении для удаления растворителя, затем образец загружали на хроматографическую колонку, загруженную силикагелем GF254, проводили элюцию жидкой смесью хлороформа и метанола, где объемное отношение хлороформа и метанола составило 9:1. Форзициазида натрия сульфат (соединение 1) получали посредством колоночной хроматографии на силикагеле.
Форзициазида натрия сульфат (3 г) является белым твердым веществом, растворимым в воде и этаноле. После нанесения на пластину для ТСХ (с раствором для хроматографии хлороформ/метанол 10:1, и Rf 0,4) он показал пурпурно-красную окраску при распылении 10% реагента H2SO4-этанола. На спектре тандемной масс-спектрометрии с электрораспылительной ионизацией m/z[M-Na]- равно 451, молекулярная масса 474.
1Н-ЯМР (600 МГц, d6-ДМСО) соединения 1 является следующим: δ (имп./мин): 7.4 (1H, d, J=8.4 Гц, Н-), 6.9 (5Н, m, Ar-Н), 4.8 (1Н, d, J=4.8 Гц, Н-6), 4.38 (Н, d, J=6.6 Гц, Н-8), 4.10 (1H, d, J=9.0 Гц, Н-2), 3.75 (12Н, d, J=8.4 Гц, Н-8,4, О-СН3), 3.11 (1H, t, J=8.1 Гц, Н-5), 2.85 (1Н, d, J=7.2 Гц, Н-1);
13С-ЯМР (150 МГц, d6-ДМСО) соединения 1 является следующим: δ (имп./мин): 150.99 (С-3''), 148.97 (С-3'), 148.10 (С-4''), 142.51 (С-4'), 137.20 (С-1''), 131.73 (С-1'), 121.33 (С-5'), 118.09 (С-6'), 118.06 (С-6''), 112.09 (С-5''), 110.94 (С-2'), 110.00 (С-2''), 87.22 (С-2), 81.76 (С-6), 70.87 (С-8), 69.44 (С-4), 56.23 (С-ОСН3), 55.99 (С-ОСН3), 54.54 (С-ОСН3), 53.37 (С-1), 49.78 (С-5) имп./мин.
В соответствии с данными тандемной масс-спектрометрии с электрораспылительной ионизацией, 1Н-ЯМР и 13С-ЯМР, определено, что молекулярной формулой соединения 1 является: C21H23O9SNa, а структурной формулой является:
Вариант осуществления 2
1. Форзициазид (4 г, 10,75 ммоль) добавляли в 180 мл безводного пиридина, и перемешивали до растворения, для получения раствора форзициазида.
2. На ледяной бане дихлорметановый раствор хлорсульфоновой кислоты (1,4 мл, примерно 21,5 ммоль) добавляли по каплям в раствор форзициазида, при перемешивании, и скорость капельного добавления составила 1 каплю (примерно 50 мкл на каплю) в 2 секунды, т.е. молярное отношение форзициазида к хлорсульфоновой кислоте в настоящем варианте осуществления составило 1:2.
3. После завершения капельного добавления в условиях перемешивания температуру поднимали и поддерживали при 10°С, и проводили реакцию этерификации.
4. В условиях сохранения температуры 10°С реакцию этерификации завершали, при проведении реакции в течение 1 часа, добавляли метаноловый раствор (5 мл) калия гидроксида для доведения значения рН до 10, реакционную смесь затем выпаривали при сниженном давлении для удаления растворителя, затем образец загружали на хроматографическую колонку, загруженную силикагелем GF254, проводили элюцию жидкой смесью хлороформа и метанола, где объемное отношение хлороформа и метанола составило 9:1. Форзициазида калия сульфат (соединение 2) получали посредством колоночной хроматографии на силикагеле.
Форзициазида калия сульфат (3 г) является белым твердым веществом, растворимым в воде и этаноле. После нанесения на пластину для ТСХ (с раствором для хроматографии хлороформ/метанол 10:1, и Rf 0,4) он показал пурпурно-красную окраску при распылении 10% реагента H2SO4-этанола. На спектре тандемной масс-спектрометрии с электрораспылительной ионизацией m/z[M-K]- равно 451, молекулярная масса 490.
1Н-ЯМР (600 МГц, d6-ДМСО) соединения 2 является следующим: δ (имп./мин): 7.4 (1Н, d, J=8.4 Гц, Н-), 6.9 (5Н, m, Ar-Н), 4.8 (1Н, d, J=4.8 Гц, Н-6), 4.38 (Н, d, J=6.6 Гц, Н-8), 4.10 (1Н, d, J=9.0 Гц, Н-2), 3.75 (12Н, d, J=8.4 Гц, Н-8,4, O-СН3), 3.10 (1H, t, J=8.1 Гц, Н-5), 2.84 (1Н, d, J=7.2 Гц, H-1);
13С-ЯМР (125 МГц, d6-ДМСО) соединения 2 является следующим: δ (имп./мин): 150.99 (С-3''), 148.97 (С-3'), 148.10 (С-4''), 142.51 (С-4'), 137.20 (С-1''), 131.73 (С-1'), 121.33 (С-5'), 118.09 (С-6'), 118.06 (С-6''), 112.09 (С-5''), 110.95 (С-2'), 110.00 (С-2''), 87.23 (С-2), 81.76 (С-6), 70.87 (С-8), 69.44 (С-4), 56.21 (С-ОСН3), 55.99 (С-ОСН3), 54.52 (С-ОСН3), 53.37 (С-1), 49.78 (С-5) имп./мин.
В соответствии с данными тандемной масс-спектрометрии с электрораспылительной ионизацией, 1Н-ЯМР и 13С-ЯМР, определено, что молекулярной формулой соединения 2 является: C21H23O9SK, а структурной формулой является:
Вариант осуществления 3
1. Форзициазид (4 г, 10,75 ммоль) добавляли в 180 мл безводного пиридина, и перемешивали до растворения, для получения раствора форзициазида.
2. На ледяной бане дихлорметановый раствор хлорсульфоновой кислоты (1,4 мл, примерно 21,5 ммоль) добавляли по каплям в раствор форзициазида, при перемешивании, и скорость капельного добавления составила 1 каплю (примерно 50 мкл на каплю) в 2 секунды, т.е. молярное отношение форзициазида к хлорсульфоновой кислоте в настоящем варианте осуществления составило 1:2.
3. После завершения капельного добавления в условиях перемешивания температуру поднимали и поддерживали при 10°С, и проводили реакцию этерификации;
4. В условиях сохранения температуры 10°С реакцию этерификации завершали, при проведении реакции в течение 1 часа, добавляли раствор аммиака (5 мл) для доведения значения рН до 8, реакционную смесь затем выпаривали при сниженном давлении для удаления растворителя, затем образец загружали на хроматографическую колонку, загруженную силикагелем GF254, проводили элюцию жидкой смесью хлороформа и метанола, где объемное отношение хлороформа и метанола составило 9:1. Форзициазида аммония сульфат (соединение 3) получали посредством колоночной хроматографии на силикагеле.
Форзициазида аммония сульфат (3 г) является белым твердым веществом, растворимым в воде и этаноле. После нанесения на пластину для ТСХ (с раствором для хроматографии хлороформ/метанол 10:1, и Rf 0,4) он показал пурпурно-красную окраску при распылении 10% реагента H2SO4-этанола. На спектре тандемной масс-спектрометрии с электрораспылительной ионизацией m/z[M-NH4]- равно 451, молекулярная масса 469.
1Н-ЯМР (600 МГц, d6-ДМСО) соединения 3 является следующим: δ (имп./мин): 7.4 (1Н, d, J=8.4 Гц, Н-), 6.9 (5Н, m, Ar-H), 4.8 (1H, d, J=4.8 Гц, H-6), 4.38 (H, d, J=6.6 Гц, H-8), 4.10 (1H, d, J=9.0 Гц, H-2), 3.75 (12H, d, J=8.4 Гц, H-8,4, O-СН3), 3.12 (1H, t, J=8.1 Гц, Н-5), 2.86 (1Н, d, J=7.2 Гц, Н-1);
13С-ЯМР (125 МГц, d6-ДМСО) соединения 3 является следующим: δ (имп./мин): 150.99 (С-3''), 148.97 (С-3'), 148.10 (С-4''), 142.51 (С-4'), 137.20 (С-1''), 131.73 (С-1''), 121.32 (С-5'), 118.09 (С-6'), 118.06 (С-6''), 112.09 (С-5''), 110.94 (С-2'), 110.00 (С-2''), 87.22 (С-2), 81.76 (С-6), 70.87 (С-8), 69.44 (С-4), 56.21 (С-ОСН3), 55.99 (С-ОСН3), 54.52 (С-ОСН3), 53.37 (С-1), 49.78 (С-5) имп./мин.
В соответствии с данными тандемной масс-спектрометрии с электрораспылительной ионизацией, 1Н-ЯМР и 13С-ЯМР, определено, что молекулярной формулой соединения 3 является: C21H27NO9S; а структурной формулой является:
Вариант осуществления 4
1. Форзициазид (4 г, 10,75 ммоль) добавляли в 180 мл безводного N,N-диметилформамида, и перемешивали до растворения, для получения раствора форзициазида.
2. На ледяной бане дихлорметановый раствор, содержащий соединение серы триоксида-триэтиламина (3,89 г мл, примерно 21,5 ммоль) добавляли по каплям в раствор форзициазида, при перемешивании, и скорость капельного добавления составила 1 каплю (примерно 50 мкл на каплю) в 2 секунды, т.е. молярное отношение форзициазида к соединению серы триоксида-триэтиламина в настоящем варианте осуществления составило 1:2.
3. После завершения капельного добавления в условиях перемешивания температуру поднимали и поддерживали при 110°С, и проводили реакцию этерификации;
4. В условиях сохранения температуры 110°С реакцию этерификации завершали, при проведении реакции в течение 1 часа, температуру снижали до комнатной температуры, добавляли раствор аммиака (5 мл) для доведения значения рН до 8, реакционную смесь затем выпаривали при сниженном давлении для удаления растворителя, затем образец загружали на хроматографическую колонку, загруженную силикагелем GF254, проводили элюцию жидкой смесью хлороформа и метанола, где объемное отношение хлороформа и метанола составило 9:1. Форзициазида аммония сульфат (соединение 3) получали посредством колоночной хроматографии на силикагеле.
Форзициазида аммония сульфат (3 г) является белым твердым веществом, растворимым в воде и этаноле. После нанесения на пластину для ТСХ (с раствором для хроматографии хлороформ/метанол 10:1, и Rf 0,4) он показал пурпурно-красную окраску при распылении 10% реагента H2SO4-этанола. На спектре тандемной масс-спектрометрии с электрораспылительной ионизацией m/z[M-NH4]- равно 451, молекулярная масса 469.
1Н-ЯМР (600 МГц, d6-ДМСО) соединения 3 является следующим: δ (имп./мин): 7.4 (1H, d, J=8.4 Гц, Н-), 6.9 (5Н, m, Ar-Н), 4.8 (1Н, d, J=4.8 Гц, Н-6), 4.38 (Н, d, J=6.6 Гц, Н-8), 4.10 (1Н, d, J=9.0 Гц, Н-2), 3.75 (12Н, d, J=8.4 Гц, Н-8,4, O-СН3), 3.12 (1H, t, J=8.1 Гц, Н-5), 2.86 (1Н, d, J=7.2 Гц, H-1);
13С-ЯМР (125 МГц, d6-ДМСО) соединения 3 является следующим: δ (имп./мин): 150.99 (С-3''), 148.97 (С-3'), 148.10 (С-4''), 142.51 (С-4'), 137.20 (С-1''), 131.73 (С-1''), 121.32 (С-5'), 118.09 (С-6'), 118.06 (С-6''), 112.09 (С-5''), 110.94 (С-2'), 110.00 (С-2''), 87.22 (С-2), 81.76 (С-6), 70.87 (С-8), 69.44 (С-4), 56.21 (С-ОСН3), 55.99 (С-ОСН3), 54.52 (С-ОСН3), 53.37 (С-1), 49.78 (С-5) имп./мин.
В соответствии с данными тандемной масс-спектрометрии с электрораспылительной ионизацией, 1Н-ЯМР и 13С-ЯМР, определено, что молекулярной формулой соединения 3 является: C21H27NO9S; а структурной формулой является:
Вариант осуществления 5
1. Форзициазид (4 г, 10,75 ммоль) добавляли в 180 мл безводного N,N-диметилформамида, и перемешивали до растворения, для получения раствора форзициазида.
2. На ледяной бане дихлорметановый раствор, содержащий соединение серы триоксида-пиридина (3,68 г, примерно 21,5 ммоль) добавляли по каплям в раствор форзициазида, при перемешивании, и скорость капельного добавления составила 1 каплю (примерно 50 мкл на каплю) в 2 секунды, т.е. молярное отношение форзициазида к соединению серы триоксида-пиридина в настоящем варианте осуществления составило 1:2.
3. После завершения капельного добавления в условиях перемешивания температуру поднимали и поддерживали при 110°С, и проводили реакцию этерификации;
4. В условиях сохранения температуры 110°С реакцию этерификации завершали, при проведении реакции в течение 1 часа, температуру снижали до комнатной температуры, добавляли метанольный раствор калия гидроксида (5 мл) для доведения значения рН до 8, реакционную смесь затем выпаривали при сниженном давлении для удаления растворителя, затем образец загружали на хроматографическую колонку, загруженную силикагелем GF254, проводили элюцию жидкой смесью хлороформа и метанола, где объемное отношение хлороформа и метанола составило 9:1. Форзициазида калия сульфат (соединение 2) получали посредством колоночной хроматографии на силикагеле.
Форзициазида калия сульфат (3 г) является белым твердым веществом, растворимым в воде и этаноле. После нанесения на пластину для ТСХ (с раствором для хроматографии хлороформ/метанол 10:1, и Rf 0,4) он показал пурпурно-красную окраску при распылении 10% реагента H2SO4-этанола. На спектре тандемной масс-спектрометрии с электрораспылительной ионизацией m/z[M-K]- равно 451, молекулярная масса 490.
1Н-ЯМР (600 МГц, d6-ДМСО) соединения 2 является следующим: δ (имп./мин): 7.4 (1Н, d, J=8.4 Гц, Н-), 6.9 (5Н, m, Ar-Н), 4.8 (1Н, d, J=4.8 Гц, Н-6), 4.38 (Н, d, J=6.6 Гц, Н-8), 4.10 (1H, d, J=9.0 Гц, Н-2), 3.75 (12Н, d, J=8.4 Гц, Н-8,4, O-СН3), 3.10 (1Н, t, J=8.1 Гц, Н-5), 2.84 (1Н, d, J=7.2 Гц, Н-1);
13С-ЯМР (125 МГц, d6-ДМСО) соединения 2 является следующим: δ (имп./мин): 150.99 (С-3''), 148.97 (С-3'), 148.10 (С-4''), 142.51 (С-4'), 137.20 (С-1''), 131.73 (С-1'), 121.33 (С-5'), 118.09 (С-6'), 118.06 (С-6''), 112.09 (С-5''), 110.95 (С-2'), 110.00 (С-2''), 87.23 (С-2), 81.76 (С-6), 70.87 (С-8), 69.44 (С-4), 56.21 (С-ОСН3), 55.99 (С-ОСН3), 54.52 (С-ОСН3), 53.37 (С-1), 49.78 (С-5) имп./мин.
В соответствии с данными тандемной масс-спектрометрии с электрораспылительной ионизацией, 1Н-ЯМР и 13С-ЯМР, определено, что молекулярной формулой соединения 2 является: C21H23O9SK, а структурной формулой является:
Вариант осуществления 6
1. Форзициазид (4 г, 10,75 ммоль) добавляли в 180 мл безводного N,N-диметилформамида, и перемешивали до растворения, для получения раствора форзициазида.
2. На ледяной бане дихлорметановый раствор, содержащий соединение серы триоксида-триметиламина (2,99 г, примерно 21,5 ммоль) добавляли по каплям в раствор форзициазида, при перемешивании, и скорость капельного добавления составила 1 каплю (примерно 50 мкл на каплю) в 2 секунды, т.е. молярное отношение форзициазида к соединению серы триоксида-триметиламина в настоящем варианте осуществления составило 1:2.
3. После завершения капельного добавления в условиях перемешивания температуру поднимали и поддерживали при 100°С, и проводили реакцию этерификации;
4. В условиях сохранения температуры 100°С реакцию этерификации завершали, при проведении реакции в течение 1 часа, температуру снижали до комнатной температуры, добавляли метанольный раствор калия гидроксида (5 мл) для доведения значения рН до 8, реакционную смесь затем выпаривали при сниженном давлении для удаления растворителя, затем образец загружали на хроматографическую колонку, загруженную силикагелем GF254, проводили элюцию жидкой смесью хлороформа и метанола, где объемное отношение хлороформа и метанола составило 9:1. Форзициазида калия сульфат (соединение 2) получали посредством колоночной хроматографии на силикагеле.
Форзициазида калия сульфат (3 г) является белым твердым веществом, растворимым в воде и этаноле. После нанесения на пластину для ТСХ (с раствором для хроматографии хлороформ/метанол 10:1, и Rf 0,4) он показал пурпурно-красную окраску при распылении 10% реагента H2SO4-этанола. На спектре тандемной масс-спектрометрии с электрораспылительной ионизацией m/z[M-K]- равно 451, молекулярная масса 490.
1Н-ЯМР (600 МГц, d6-ДМСО) соединения 2 является следующим: δ (имп./мин): 7.4 (1H, d, J=8.4 Гц, Н-), 6.9 (5Н, m, Ar-Н), 4.8 (1H, d, J=4.8 Гц, Н-6), 4.38 (Н, d, J=6.6 Гц, Н-8), 4.10 (1Н, d, J=9.0 Гц, Н-2), 3.75 (12Н, d, J=8.4 Гц, Н-8,4, O-СН3), 3.10 (1Н, t, J=8.1 Гц, Н-5), 2.84 (1H, d, J=7.2 Гц, Н-1);
13С-ЯМР (125 МГц, d6-ДМСО) соединения 2 является следующим: δ (имп./мин): 150.99 (С-3''), 148.97 (С-3'), 148.10 (С-4''), 142.51 (С-4'), 137.20 (С-1''), 131.73 (С-1'), 121.33 (С-5'), 118.09 (С-6'), 118.06 (С-6''), 112.09 (С-5''), 110.95 (С-2'), 110.00 (С-2''), 87.23 (С-2), 81.76 (С-6), 70.87 (С-8), 69.44 (С-4), 56.21 (С-ОСН3), 55.99 (С-ОСН3), 54.52 (С-ОСН3), 53.37 (С-1), 49.78 (С-5) имп./мин.
В соответствии с данными тандемной масс-спектрометрии с электрораспылительной ионизацией, 1Н-ЯМР и 13С-ЯМР, определено, что молекулярной формулой соединения 2 является: C21H23O9SK, а структурной формулой является:
Пример анализа 1. Анализ противовирусной активности производных форзициазида сульфата
1. Антивирусный тест in vitro
1.1. Материалы анализа
(1) Лекарственные средства
1) Производные форзициазида сульфата: форзициазида натрия сульфат, форзициазида калия сульфат и форзициазида аммония сульфат, которые являются белым порошком и производятся Dalian Fusheng Natural Medicinal Development Co. Ltd.; их анализировали, соответственно, двумя детекторами для высокоэффективной жидкостной хроматографии, т.е. ультрафиолетовым детектором и испарительным нефелометрическим детектором, посредством способа нормализации площади; чистота составила 99,9%, 99,5% и 99,2%, соответственно.
2) Рибавирин для инъекций, который является бесцветной прозрачной жидкостью, производимой Henan Runhong Pharmaceutical Co., ltd., номер серии продукта: 1206261, номер национальной медицинской регистрации: Н19993553; его концентрация составила 100 мг/мл; и он использовался в качестве положительного контроля в настоящем анализе.
3) Осельтамивир фосфат, производимый Национальным институтом контроля фармацевтических и биологических продуктов. Номер серии продукта: 101096-200901. Осельтамивир фосфат использовали в качестве положительного контроля в настоящем анализе, где каждая доза для инъекции составила 100 мг.
Все вышеупомянутые лекарства растворяли в очищенной воде, фильтровали, стерилизовали, паковали и хранили при 4°С для последующего применения; все они являются лекарствами, исследуемыми в настоящем анализе.
(2) Клеточный штамм
Клеточный штамм клеток Vero (клетки почки африканских зеленых мартышек) хранился в Колледже основных медицинских наук Цзилиньского университета.
(3) Вирусные штаммы
1) Вирус гриппа, полученный из Института вирусологии Китайской Академии профилактической медицины.
2) Вирус парагриппа, полученный из Института вирусологии Китайской Академии профилактической медицины.
3) Респираторно-синцитиальный вирус (RSV), полученный из Института вирусологии Китайской Академии профилактической медицины.
4) Вирус Коксаки, штамм В3 (CVB3), полученный из Америки и хранящийся в учебно-исследовательском отделе.
5) Вирус Коксаки, штамм А16 (СохА16), полученный в дар из Национального госпиталя Сендая из Японии, и хранящийся в учебно-исследовательском отделе.
6) Энтеровирус, штамм EV71, полученный в дар из Национального госпиталя Сендая из Японии, и хранящийся в учебно-исследовательском отделе.
7) Аденовирус (AdV), полученный из педиатрической лаборатории Научного центра здоровья имени Нормана Бетьюна Цзилиньского университета.
8) Вирус простого герпеса I типа (HSV-1), полученный из Национального института контроля фармацевтических и биологических продуктов.
(4) Основное оборудование и реагенты:
| Кабинет биологической безопасности | ВНС-1300 IIA/В3, AIRTECH |
| CO2 инкубатор | МСО-18AIC, SANYO |
| Инвертированный микроскоп | CKX41, OLYMPUS |
| Электронные аналитические весы | AR1140/С, DHAUS |
| Среда для культивирования | DMEM, HyClone |
| Эмбриональная телячья сыворотка | HyClone |
| Трипсин | Gibco |
| МТТ | Sigma |
| ДМСО | Tianjin Beilian Fine Chemicals Development Co., Ltd. |
1.2. Способ анализа
(1) Приготовление клеток
Клетки Vero подвергали субкультивированию в течение 1-2 суток, и готовили пластины, где граница раздела была чистой; при стереоскопическом восприятии и сильном увеличении обрабатывали трипсином; при наличии иглоподобных ячеек на поверхности клеток пищеварительный сок полностью адсорбировался, несколько миллилитров культурального бульона брали для диспергирования клеток, которые затем подсчитывали и разбавляли средой для культивирования (DMEM, содержащей 10% эмбриональной телячьей сыворотки) до примерно 5×107/л, и инокулировали в 96-луночном планшете для культивирования, пока клетки не формировали монослой.
(2) Определение токсичности лекарственного средства
Анализ цитотоксичности: лекарства разбавляли в соответствии с концентрациями, указанными в таблице 1, для определения цитотоксичности.
Вышеупомянутые лекарства, разбавленные раствором для хранения (DMEM с 2% эмбриональной телячьей сывороткой) до различных концентраций, добавляли по каплям к монослою клеток Vero, в каждую ячейку по 0,2 мл, по 6 ячеек для каждой концентрации, и дополнительно обеспечивали 6 ячеек для нормального контроля (группа нормального контроля без добавления дополнительных лекарств) и 6 ячеек для холостого контроля (культуральной среды); планшет помещали в инкубатор с 5% СО2 при 37°С для культивирования, наблюдая цитопатический эффект с инвертированным микроскопом каждый день, и регистрируя. Спустя 72 часа добавляли 20 мкл (5 мг/мл) раствора МТТ в каждую ячейку, и продолжали инкубацию в течение 4 часов, удаляли аспирацией культуральную среду из каждой ячейки, добавляли 100 мкл ДМСО в каждую ячейку, и встряхивали в течение 5 минут, измеряли значение ОП при 492 нм для расчета доли выживших клеток. С помощью статистического программного обеспечения SPSS 18.0 подвергали число долю выживших клеток регрессионному анализу методом пробит для расчета максимальной нетоксичной концентрации (ТС0) и полумаксимальной токсичной концентрации (ТС50) лекарства на клетках Vero.
(3) Определение TCID50 (дозы заражения 50% культуры ткани) для разных вирусов.
Разные вирусы разбавляли с 10-кратным декрементом для получения различных разведений 10-1, 10-2, 10-3, 10-4, 10-5 и 10-6, и последовательно инокулировали ими монослой клеток Vero в 96-луночном планшете для культивирования, по 100 мкл в каждую ячейку, по 6 ячеек на каждое разведение, и при этом обеспечивалась контрольная группа нормальных клеток. Их инкубировали в инкубаторе с 5% СО2 в течение 2 часов, жидкость с вирусами удаляли, затем добавляли 100 мкл раствора для поддержки клеток в каждую ячейку, и культивировали в 5% СО2 при 37°С. Результаты цитопатического воздействия наблюдали под микроскопом с 3-го дня, результаты определяли на 7-8 день и регистрировали, при этом брали наивысшее разведение в виде конечной точки, где в 50% клеток из ячейки наблюдалось положительной поражение, и рассчитывали титр вируса с применением методом Карбера.
Формула:
TCID50: доза инфицирования 50% гистиоцитов
ХМ: логарифм наивысшей концентрации разведения вируса
d: логарифм коэффициента разбавления (множитель)
Σpi: сумма процентов поражения для каждого разведения
(4) Влияние лекарства на индуцированную вирусом цитотоксичность
Брали планшет для культивирования с монослоем клеток, удаляли аспирацией культуральную среду, клетки инокулировали количеством вируса, соответствующим 100TCID50, и помещали в инкубатор с 5% СО2 при 37°С на 2 часа, добавляли различные жидкости со специфическими концентрациями (около максимальной нетоксичной концентрации), готовили по 6 ячеек для культуры для каждой концентрации, по 200 мкл на ячейку. Рибавирин для инъекций и осельтамивир фосфат использовали в качестве положительной контрольной группы лекарств, использовали нормальную контрольную группу (без добавления вируса и лекарства) и вирусную контрольную группу (с добавлением вируса, но без лекарства), наблюдали влияние лекарства на вирус-индуцированный цитопатический эффект. Спустя 72 часа измеряли значение ОП при длине волны 492 нм с применением МТТ колориметрического метода для расчета уровня противовирусной эффективности (ER%) лекарства. С помощью статистического программного обеспечения SPSS 18.0 рассчитывали статистическую разницу антивирусной эффективности различных лекарств с применением метода ANOVA.
ER%=(среднее значение ОП в группе с применением лекарства - среднее значение ОП в группе контроля вируса)/(среднее значение ОП в группе контроля клеток - среднее значение ОП в группе контроля вируса)×100%
1.3. Результаты анализа
(1) TCID50 различных вирусов
Вирус гриппа:
Вирус парагриппа:
CVB3:
HSV-1:
AdV:
RSV:
СохА16:
EV71:
(2) Определение лекарственной токсичности.
(1) Определение цитотоксичности лекарств
Максимальная нетоксичная концентрация (ТС0), полумаксимальная токсичная концентрация (ТС50) лекарства на клетках Vero, и концентрации, использованные для антивирусного анализа, показаны в таблице 2.
(2) Результаты защитных эффектов лекарств в отношении вирус-индуцированной цитотоксичности и результаты одностороннего дисперсионного анализа ANOVA показаны в таблице 3.
Как показано в результатах в таблице 3, уровни эффективности форзициазида сульфата: форзициазида натрия сульфата, форзициазида калия сульфата и форзициазида аммония сульфата в ингибировании вируса гриппа, вируса парагриппа, вируса Коксаки (СохА16) были выше 90%, и при сравнении с группой вирусного контроля разница была статистически достоверной; уровни ингибирования респираторного синцитиального вируса RSV и вируса простого герпеса I типа (HSV-I) были выше 80%, уровни эффективности были выше 80%, и по сравнению с группой контроля вирусов различия были статистически значимыми; и терапевтические эффекты трех производных форзициазида сульфата в отношении вышеупомянутых вирусов превосходили эффекты рибавирина и осельтамивира фосфата. 2. Антивирусный анализ in vivo.
2.1. Экспериментальные материалы
1) Экспериментальные животные
Куньминские мыши были получены из Научного центра здоровья имени Нормана Бетьюна Цзилиньского университет