Липосома, фармацевтическая композиция и лекарственное средство для лечения местных радиационных поражений кожи, применение липосом и способ для лечения местных радиационных поражений кожи
Иллюстрации
Показать всеГруппа изобретений относится к фармацевтике, в частности, к средствам для лечения местных радиационных поражений кожи липосомами, содержащими альфа-фетопротеин человека. Для этого применяют фармацевтическую композицию, содержащую указанные липосомы. Дополнительно липосомы могут содержать гранулоцитарный колониестимулирующий фактор человека. Лекарственное средство для лечения местных радиационных поражений кожи, содержащее фармацевтическую композицию, может применяться подкожно или трансдермально. Группа изобретений обеспечивает способ лечения и/или профилактики местных радиационных поражений кожи. 5 н. и 7 з.п. ф-лы, 12 ил., 8 табл., 6 пр.
Реферат
Область техники
Изобретение относится к биотехнологии и фармацевтике, в частности к липосомам, фармацевтической композиции и лекарственному средству для лечения местных радиационных поражений кожи, а также к способу лечения и/или профилактики местных радиационных поражений кожи. Указанные липосомы могут содержать альфа-фетопротеин человека и, в дополнение к нему, гранулоцитарный колониестимулирующий фактор человека.
Предшествующий уровень техники
Радиационный дерматит является наиболее распространенным побочным эффектом радиационной терапии и обследований, производимых с применением радиоактивных изотопов (Козлова А.В. Возможные последствия повреждений органов и тканей при лучевой терапии злокачественных опухолей, Мед. Радиология, 1977, Вып. 12, с. 71-75), что делает необходимым разработку мероприятий по снижению повреждающего действия ионизирующей радиации на нормальные клетки и ткани. Случаи радиационных поражений кожи вероятны при авариях на атомных энергетических установках, среди персонала, работающего с радиоизотопами и связанного с утилизацией ядерных боеприпасов, а также в результате террористических актов с использованием так называемых "грязных бомб" (Goffman Т.Е. Nuclear terrorism and the problem of burns, Am J Emerg Med, 2011, v. 29(2), p. 224-228; Романович И.К. и др. Авария на АЭС «Фукусима-1»: организация профилактических мероприятий, направленных на сохранение здоровья населения Российской Федерации. Под ред. акад. РАМН Г.Г. Онищенко, СПб.: НИИРГ им. проф. П.В. Рамзаева, 2012, 336 с.; Радиационные поражения человека, Ильин Л.А., Кочетков О.А., Савкин М.Н. и др., М.: ИздАТ, 2002, 607 с.).
Выраженность лучевых поражений кожи определяется дозой, мощностью дозы облучения, видом и характеристиками ионизирующего излучения (Wilson C.W. Comparsion of the skin and depilatory reactions produced in the legs of mice by 2000 r of 200 kV and 2 MeV X-rays, Brit. J. Radiol., 1957, v. 115, p. 661-670). При радиационных авариях и инцидентах электромагнитные ионизирующие излучения могут дистанционно оказывать поражающее действие на людей даже на значительном расстоянии от источника облучения. Особенностью действия ионизирующих излучений электромагнитной природы, в отличие от α- и β-излучений, является их высокая проникающая способность и, как следствие, поражающее действие на все слои кожи.
Кроме того, ионизирующие излучения электромагнитной природы получили широкое применение в онкологической практике. В зависимости от используемого вида излучения различают электронную терапию, бета-терапию, нейтронную, протонную, пи-мезонную терапию, рентгенотерапию и гамма-терапию. Разрабатываются все новые современные установки для точной формы лучевой терапии, такие как Гамма-Нож, Кибер-Нож (CyberKnife). В настоящее время в мире установлено около 250 установок Кибер-Нож. Они используется в стереотаксической радиохирургии (СРХ) для лечения, удаления опухолей и других патологий мозга и позвоночника, лечения метастазов, лечения рака и опухолей паренхиматозных органов (рака предстательной железы (рака простаты), рака легких (не мелкоклеточного), рака печени, рака почек, рака поджелудочной железы. При использовании Гамма-Ножа и Кибер-Ножа применяют разовые дозы 2-4 Гр, а суммарные дозы составляет до 60-80 Гр (Малая медицинская энциклопедия, 1991-96). Повреждающему действию радиации при этом подвергаются все слои кожи. Так при гамма-терапии злокачественных опухолей внутренних органов, в частности, опухолей легких, мочевого пузыря, женских половых органов и других, лучевые повреждения кожи развиваются у 25-30% пациентов (Африканова Л.А. Острая лучевая травма кожи, М.: Медицина, 1975, с. 8-41).
Реакции кожи на облучение подразделяют на ранние и поздние. Поздние местные лучевые повреждения развиваются через 3-6 месяцев и позже после лучевого воздействия. Характеризуются образованием поздней лучевой язвы в зоне лучевого фиброза, которая не имеет четких границ. Морфологическими признаками зоны, где образуется поздняя лучевая язва, являются: хроническое неспецифическое воспаление, склероз и облитерация кровеносных и лимфатических сосудов, периваскулярная инфильтрация, демиелинизация нервных стволов, распространенный фиброз соединительной ткани.
В генезе поздних радиационных поражений кожи, развивающихся через месяцы-годы после облучения, помимо повреждения стволовых клеток базального слоя эпидермиса, существенную роль играет поражение эндотелия сосудов кожи. На пораженных участках наблюдается прогрессирующая облитерация капилляров, развитие атрофической аваскулярной неэластичной дермы, неспособной питать лежащий поверх нее эпидермис, что в свою очередь приводит к его атрофии, изъязвлению и некрозу.
В процессе развития лучевого поражения кожи выделяют две фазы: фазу деструкции, когда формируется очаг острого радиационного поражения, и фазу репарации, когда в очаге поражения идут процессы, направленные на ликвидацию этого очага.
Радиочувствительность клеточных элементов уменьшается в следующей последовательности: волосяные луковицы, эпидермис, сальные железы, подкожная соединительная ткань, эндотелий кровеносных сосудов (Devik F. Histological and cytological changes produces by alpha-particles in the skin of mice, Acta Radiol., 1961, v. 35, p. 150-164).
Таким образом, критическими структурами кожи при облучении являются стволовые клетки базального слоя эпидермиса и эпителия вокруг придатков кожи.
Особенностью лучевых поражений кожи является глубокое подавление всех регенеративных и репаративных процессов, поэтому лучевые язвы характеризуются торпидным длительным течением, а их лечение представляет трудноразрешимую задачу (Стрелин Г.С. Регенерационные процессы в развитии и ликвидации лучевого повреждения, М.: Медицина, 1978. 207 с.; Сосоновский А.Е. Лучевые дерматиты, Минск: Беларусь, 1974, 143 с.).
Деление формирования лучевой язвы на деструктивную и репаративную фазы носит условный характер. И в той, и в другой фазе явления деструкции и репарации неотделимы друг от друга, однако имеет место явное преобладание направленности тех или иных процессов в зависимости от фазы. Репаративная фаза клинически определяется как завершение стадии влажной эксквамации формированием струпа. В это время регистрируется эпителизация ожоговой раны. В процессе эпителизации принимают участие не только пролиферирующий эпидермис, но и эпителий придатков кожи (Африканова Л.А. Острая лучевая травма кожи, М.: Медицина, 1975, с. 8-41).
Имеются данные, что при заживлении ран в восстановлении эпителия участвуют клетки эпидермиса, а для восстановления популяции дермальных фибробластов привлекаются как местные мезенхимальные клетки дермы, так и стволовые клетки костного мозга (Fathke С, Wilson L, Hutter J, Kapoor V, Smith A, Hocking A, Isik F. Contribution of bone marrow-derived cells to skin: collagen deposition and wound repair, Stem Cells, 2004, 22(5):812-22).
Пролиферирующий эпидермис проявляет потенцию к росту пластом. Однако прочность связи его с подлежащими тканями и возможность его дальнейшего существования зависят от характера соединительной ткани на дне дефекта кожи. Пролиферирующий эпидермис прочно удерживается на соединительной ткани слоя дермы, на кожной жировой клетчатке и на молодой соединительной ткани, формирующейся за счет преобразования этого слоя. На месте ожоговой раны формируется рубец. Однако молодая соединительная ткань, формирующаяся за счет преобразования рыхлой соединительной ткани на границе с фасциями подлежащих мышц, не может обеспечить жизнеспособность пролиферирующего эпидермиса. В этом случае репарация приобретает неблагоприятное течение с возникновением трофических язв (Африканова Л.А. Острая лучевая травма кожи, М.: Медицина, 1975, с. 8-41).
Поражения кожи, вызванные воздействием ионизирующего излучения, относятся к разряду тяжелых и инвалидизирующих заболеваний и вносят существенный вклад в течение и исход лучевой болезни (Африканова Л.А. Острая лучевая травма кожи, М.: Медицина, 1975, с. 8-41; Ильин Л.А., Кочетков О.А., Савкин М.Н. и др. Радиационные поражения человека, М.: ИздАТ, 2002, 607 с.). Степень выраженности радиационного поражения кожи в зависимости от условий облучения может варьировать от легкой воспалительной реакции (ожог I степени) до полного поражения кожи и нижележащих тканей (ожог IV степени).
Как и простые термические повреждения участков кожи, лучевые ожоги по глубине делятся на четыре степени:
I степень характеризуется повреждением самого поверхностного слоя кожи (эпидермиса), состоящего из эпителиальных клеток. При этом появляется покраснение кожи, небольшая припухлость, сопровождающаяся болезненностью. Через два - три дня эти явления самостоятельно проходят, и после ожога не остается никаких следов, исключая незначительный зуд и шелушение кожи;
II степень отличается образованием пузырей с желтоватой жидкостью на фоне покраснения кожи. Пузыри могут образовываться сразу после ожога или спустя некоторое время. Если пузыри лопаются, то обнажается ярко-красная эрозия. Заживление при этой степени происходит обычно к 10-12 дню без образования рубцов;
III степень ожогов характеризуется большей глубиной поражения с омертвением тканей (некроз) и образованием ожогового струпа. Струп представляет собой сухую корку от светло-коричневого до почти черного цвета; при ошпаривании же струп бывает мягким, влажным, белесовато-серого цвета. Выделяют IIIA степень, при которой сохраняются эпителиальные элементы кожи, являющиеся исходным материалом для самостоятельного заживления раны, и IIIБ степень, при которой все слои кожи полностью погибают и образовавшаяся ожоговая рана заживает посредством рубцевания;
IV степень ожогов сопровождается обугливанием кожи и поражением глубжележащих тканей - подкожной жировой клетчатки, мышц и костей.
В соответствии с принятой в настоящее время концепцией, специальному лечению подлежат случаи с местными лучевыми поражениями II и выше степени тяжести (Инструкция по диагностике, медицинской сортировке и лечению острых радиационных поражений: Утв. Минздравом СССР 30.09.1977. Под ред. В.И. Пахомова, М.: Воениздат, 1980, 40 с.).
При лечении лучевых ожогов комплекс терапевтических процедур включает в себя системное введение препаратов для уменьшения воспалительной реакции (глюкокортикоиды), обезболивающих средства, препаратов антипротеолитического действия и антибиотиков. Местное лечение направлено на предотвращение инфицирования пораженных поверхностей. В более поздние сроки при активации регенерационных процессов применяются лекарственные средства, содержащие стимуляторы регенерации и адаптогены.
Одним из стратегических направлений лечения ожоговых ран является хирургический. Основными недостатками аутодермопластики являются: дополнительная кожная рана в месте забора лоскута и невозможность применения этой технологии при обширных поражениях (Valencia I.C., Falabella AF, Eaglstein WH. Skin grafting, Dermatol Clin., 2000, 18(3), p. 521-32; Qaryoute S. et al. Usage of autograft and allograft skin in treatment of burns in children, Burns, 2001, 27 (6), p. 599-602). Важное место в этой области исследований отводится использованию клеточных технологий (Котенко К.В., Смирнов С.В. и др. Современные методы клеточной терапии при лечении ожогов, Хирургия, 2003, вып. 12, с. 58-62).
Для лечения глубоких ожогов, хронических язв и обширных повреждений постоянно разрабатываются новые покрытия, заменяющие кожу: трансплантаты из культивированных аутокератиноцитов (Teepe R.G, Kreis R.W., Koebrugge E.J. et all. The use of cultured autologous epidermis in the treatment of extensive burn wounds, J Trauma., 1990, v. 30(3), p. 269-275; Terskikh V.V., Vasiliev A.V. Cultivation and transplantation of epidermal keratinocytes, Int Rev Cytol, 1999, v. 188, p. 41-72) и аллогенных кератиноцитов (De Luca M., Albanese E., Bondanza S. et al. Multicentre experience in the treatment of burns with autologous and allogenic cultured epithelium, fresh or preserved in a frozen state, Burns, 1989, v. 15(5), p. 303-309; Oshima H., Inoue H., Matsuzaki K. et all. Permanent restoration of human skin treated with cultured epithelium grafting - wound healing by stem cell based tissue engineering, Hum Cell, 2002, v. 15(3), p. 118-128), эквиваленты кожи (Dvorankova В., Holikova Z., Vacik J. et all. Reconstruction of epidermis by grafting of keratinocytes cultured on polymer support-clinical study, Int J Dermatol., 2003, v. 42(3), p. 219-223; Ehrlich H.P. Understanding experimental biology of skin equivalent: from laboratory to clinical use in patients with bums and chronic wounds, Am J Surg., 2004, v. 187(5A), p. 29-33), которые включают не только культивированные кератиноциты, но и дермальный эквивалент, состоящий из коллагена, гликозамин-гликанов и др.).
Применения трансплантатов из культивированных аутокератиноцитов имеет ряд недостатков: использование аутокератиноцитов не дает возможности создать банк клеток; сроки, необходимые для изготовления достаточного по площади трансплантата, велики и составляют 3-4 недели (Navsaria НА, Myers SR, Leigh IM, McKay IA. Culturing skin in vitro for wound therapy, Trends Biotechnol., 1995, Mar; 13(3):91-100; Туманов В.П., Алексеев А.А., Будкевич Л.И. Десятилетний опыт использования культивированных клеток кожи человека для лечения термических ожогов. Архив патологии, 1999, №4. с. 14-21); длительные сроки получения трансплантатов увеличивают риск развития инфекционных осложнений ожоговой болезни и удлиняют время пребывания пациентов в стационаре; аутокератиноциты практически не приживаются при трансплантации на гранулирующие ожоговые раны (De Luca М., Albanese Е., Bondanza S. et al. Multicentre experience in the treatment of burns with autologous and allogenic cultured epithelium, fresh or preserved in a frozen state. Burns, 1989, v. 15(5), p. 303-309; Туманов В.П., Алексеев А.А., Будкевич Л.И. Десятилетний опыт использования культивированных клеток кожи человека для лечения термических ожогов. Архив патологии, 1999, №4. с. 14-21); высока стоимость специальных ростовых сред и биологически активных стимуляторов роста кератиноцитов.
В последние несколько лет начаты исследования по возможностям применения мезенхимальных стволовых клеток костного мозга. Поскольку такой клеточный материал аутологичен (в отличие от аллофибробластов), легко культивируется и дифференцируется (в отличие от кератиноцитов), то этот метод в будущем может стать хорошей альтернативой прочим клеточным методам лечения кожных поражений (Шумаков В.И., Расулов М.Ф., Крашенинников М.Е. и др. Сравнительная оценка эффективности применения аллогенных эмбриональных фибробластов и мезенхимальных стволовых клеток костного мозга для терапии глубоких ожоговых ран. Вестник трансплантологии и искусственных органов, 2002, Вып. 4, с. 7-11; Ai G., Su Y., Yan G. et all. The experimental study of bone marrow mesenchymal stem cells on the repair of skin wound combined with local radiation injury. Zhonghua Yi Xue Za Zhi., 2002, v. 82(23), p. 1632-1636; Badiavas E.V. The potential of bone marrow cells to orchestrate homeostasis and healing in skin. Blood Cells Mol Dis., 2004, v. 32(1), p. 21-23).
Определенные успехи достигнуты на пути использования в лечении лучевых поражений цитокинов (Кетлинский С.А., Симбирцев А.С., Воробьев А.А. Эндогенные иммуномодуляторы. СПб: Гиппократ, 1992, 256 с.; Рождественский Л.М. Радиобиологические аспекты применения интерлейкина-1 бета как средства скорой помощи при остром радиационном воздействии. Труды Междунар. симпозиума "Проблемы биохимии, радиационной и космической биологии", 1997, Дубна, т. 2, с. 15-22), в частности при использовании колониестимулирующих факторов (КСФ) - гранулоцитарного (Г-КСФ) и гранулоцитарно-макрофагального (ГМ-КСФ) (Легеза В.И., Селезнев А.Б., Загарова Н.И., Кондаков А.Ю. Экспериментальное исследование лечебно-профилактического применения интерлейкина-1β при сочетанных радиационных поражениях. Медико-биологические и социально-психологические проблемы безопасности в чрезвычайных ситуациях, 2010, №4 (2), с. 41-45; Dainiak N., Waselenko J.K., Armitage J.O. et al. The Hematologist and Radiation Casualties. Hematology, 2003, v. 1). К настоящему времени разработан целый ряд препаратов такого рода, к числу которых относятся, прежде всего, интерлейкины и колониестимулирующие факторы: беталейкин, гранулоцитарный колониестимулирующий фактор (нейпоген, филграстим, пегфилграстим, лейкостим), гранулоцитарно-макрофагальный колониестимулирующий фактор (молграмостим, сарграмостим, лейкомакс), тромбопоэтин и другие. Именно это направление и, в частности, изучение возможности комплексного применения различных цитокинов с целью стимуляции восстановления костномозгового кроветворения, является наиболее перспективным подходом к существенному повышению эффективности терапии острых радиационных поражений мирного и военного времени.
Перспективными являются исследования, направленные на использование антиоксидантов с целью снижения деструкции после лучевого воздействия за счет инактивации окислительных радикалов, возникающих преимущественно при взаимодействии ионизирующего излучения с водой пораженной ткани (Kouvaris J.R., Kouloulias V.E., Vlahos L.J. Amifostine: the first selective-target and broad-spectrum radioprotector. Oncologist, 2007, 12:738-747; Montana G.S., Anscher M.S., Mansbach C.M 2nd, Daly N., Delannes M., Carke-Pearson D, Gaydica E.F. Topical application of WR-2721 to prevent radiation-induced proctosigmoiditis. A phase I/II trial. Cancer, 1992; 69: 2826-2830; Kumar S, Juresic E, Barton M, Shafiq J. Management of skin toxicity during radiation therapy: a review of the evidence. J Med Imaging Radiat Oncol., 2010 Jun; 54(3):264-79; Greenberger J.S., Clump D., Kagan V., Bayir H., Lazo J.S., Wipf P., Li S., Gao X., Epperly M.W. Strategies for discovery of small molecule radiation protectors and radiation mitigators. Front Oncol., 2012 Jan., 13; 1:59).
Наиболее близким аналогом настоящего изобретения является решение, описанное в Евразийском патенте №010058. В указанном патенте, в частности, описан пептид, соответствующий активному центру альфа-фетопротеина человека. Также указано, что указанный пептид может применяться для снижения цитотоксических эффектов после химио- и лучевой терапии.
Несмотря на большой опыт по изучению способов консервативного лечения лучевых поражений, проблема создания средств экстренной профилактики и лечения лучевых ожогов остается крайне актуальной.
Краткое описание настоящего изобретения
Целью настоящего изобретения является разработка нового эффективного средства для экстренной профилактики и лечения местных радиационных поражений кожи.
Указанная цель была достигнута путем установления того факта, что альфа-фетопротеин человека (АФП) увеличивает жизнеспособность облученных клеток и снижает напряженность апоптотических процессов. Далее было показано, что использование липосомального препарата, содержащего рекомбинантный альфа-фетопротеин человека (рчАФП), липосомального препарата, содержащего, в дополнение к рчАФП, рекомбинантный гранулоцитарный колониестимулирующий фактор человека (рчГКСФ), а также липосомального препарата, состоящего из «пустых» липосом ускоряет процессы репарации и эпителизации ожоговой раны и в целом укорачивает время заживления лучевого ожога.
Первый аспект настоящего изобретения предоставляет липосомы, содержащие альфа-фетопротеин человека, для лечения местных радиационных поражений кожи.
Еще один аспект настоящего изобретения предоставляет указанную выше липосому, в которой указанным альфа-фетопротеином человека является рекомбинантный альфа-фетопротеин человека.
Еще один аспект настоящего изобретения предоставляет указанную выше липосому, в которой указанная липосома содержит от 0,1 мг/мл до 1,0 мг/мл альфа-фетопротеина человека.
Следующий аспект настоящего изобретения предоставляет указанную выше липосому, в которой указанная липосома дополнительно содержит гранулоцитарный колониестимулирующий фактор человека.
Еще один аспект настоящего изобретения предоставляет указанную выше липосому, в которой указанным гранулоцитарным колониестимулирующим фактором человека является рекомбинантный гранулоцитарный колониестимулирующий фактор человека.
Еще один аспект настоящего изобретения предоставляет указанную выше липосому, в которой указанная липосома содержит от 0,004 мг/мл до 0,06 мг/мл гранулоцитарного колониестимулирующего фактора человека.
Следующий аспект настоящего изобретения указывает на возможность применения указанных выше липосом для лечения местных радиационных поражений кожи.
Еще один аспект настоящего изобретения указывает на возможность применения так называемых «пустых» липосом, то есть липосом, не содержащих каких-либо активных веществ, для лечения местных радиационных поражений кожи.
Следующий аспект настоящего изобретения предоставляет фармацевтическую композицию для лечения местных радиационных поражений кожи, содержащую эффективное количество указанных выше липосом.
Следующий аспект настоящего изобретения предоставляет лекарственное средство для лечения местных радиационных поражений кожи, содержащее указанную выше фармацевтическую композицию.
Еще один аспект настоящего изобретения предоставляет указанное выше лекарственное средство, которое является средством трансдермального действия.
Еще один аспект настоящего изобретения предоставляет указанное выше лекарственное средство в виде пластины, пластыря, пленки, крема, раствора, эмульсии, мази или спрея.
Следующий аспект настоящего изобретения предоставляет способ лечения и/или профилактики местных радиационных поражений кожи, включающий стадию нанесения указанной выше фармацевтической композиции на пораженный или подвергающийся поражению участок кожи.
Краткое описание чертежей
На Фиг. 1 показано влияние рчАФП на жизнеспособность NIH3T3 клеток после облучения. NIH3T3 клетки облучали и инкубировали с добавлением рчАФП. Подсчет клеток осуществляли через 72 часа после фиксации и окрашивания. Для анализа использовали данные, полученные в 3-х независимых полях зрения. График демонстрирует результат одного из трех независимых экспериментов. Данные представлены в виде среднего значения ± среднеквадратичное отклонение.
На Фиг. 2 показано влияние рчАФП на напряженность апоптотического процесса в культуре облученных NIH3T3 клеток. NIH3T3 клетки облучали и инкубировали с добавлением рчАФП. Подсчет клеток осуществляли через 72 часа после фиксации и окрашивания красителем DAPI. Для анализа использовали данные, полученные в 3-х независимых полях зрения. График демонстрирует результат одного из трех независимых экспериментов. Данные представлены в виде среднего значения ± среднеквадратичное отклонение.
На Фиг. 3 показан способ фиксации кожной складки на спине животного при проведении экспериментов по облучению.
На Фиг. 4 показана схема эксперимента по оценке эффективности липосомального препарата при подкожном и трансдермальном введении. А2 - сроки введения препарата А2 (липосомальный белковый препарат); A0 - сроки введения препарата A0 (комплекс антиоксидантов).
На Фиг. 5 показана клиническая картина лучевого ожога: А - стадия сухого радиоэпидермита (эритема, отек); Б - стадия влажного радиоэпидермита; В - стадия струпа; Г - стадия после отпадения последней корочки (струпа); Д - в конце периода восстановления эпителия.
На Фиг. 6 приведены показатели клинической картины течения радиационного поражения кожи в экспериментах по сравнительной оценке эффективности трансдермального и подкожного способа введения исследуемых препаратов.
На Фиг. 7 приведены схемы эксперимента по оценке эффективности препарата при лечении и профилактике лучевых поражений кожи с использованием мышей в моделях «Профилактика», «Лечение», «Профилактика + Лечение».
На Фиг. 8 показаны результаты различных схем применения липосомального белкового препарата (рчАФП, рчГКСФ) на течение лучевого ожога кожи IIIA степени у мышей по клиническим показателям.
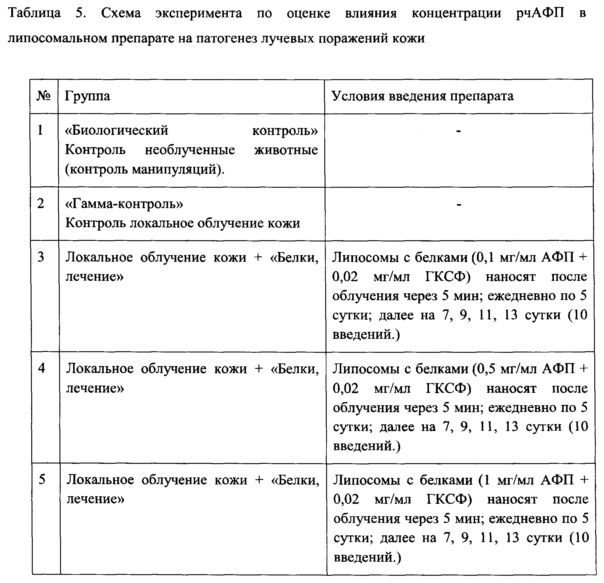
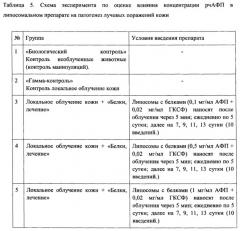
На Фиг. 9 приведена схема эксперимента по оценке эффективности липосомального препарата с разной концентрацией рчАФП при лечении лучевых поражений кожи.
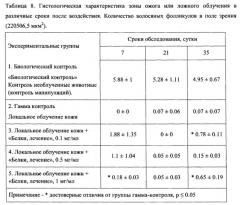
На Фиг. 10 показаны результаты оценки влияния концентрации рчАФП в липосомальном препарате на течение лучевого ожога кожи IIIA степени у мышей по клиническим показателям. Примечание: * - достоверные отличия от группы облученного контроля, р≤0,05.
На Фиг. 11 показаны зависимости длительностей различных стадий лучевого ожога кожи IIIA степени у мышей от концентрации рчАФП в липосомальном препарате: А - длительность скрытого периода; Б - длительность стадии сухого эпидермита; В - длительность стадии влажного эпидермита; Г - длительность деструктивного периода.
На Фиг. 12 показаны данные по длительности периодов течения лучевого поражения кожи после использования исследуемого липосомального препарата с активными веществами и «пустых» липосом.
Подробное описание настоящего изобретения
Авторы настоящего изобретения установили, что альфа-фетопротеин человека АФП увеличивает жизнеспособность облученных клеток и снижает напряженность апоптотических процессов в клетках. Затем авторы настоящего изобретения в ходе длительных и тщательных исследований установили, что использование липосомального препарата, содержащего рекомбинантный альфа-фетопротеин человека (рчАФП), липосомального препарата, содержащего, в дополнение к рчАФП рекомбинантный гранулоцитарный колониестимулирующий фактор человека (рчГКСФ), а также липосомального препарата, состоящего из «пустых» липосом, ускоряет процесс заживления лучевого ожога, репарации и эпителизации ожоговой раны. Таким образом, было выполнено настоящее изобретение.
В настоящем изобретении термин "липосома" означает сферическую везикулу, имеющую один или несколько липидных бислоев. Липосомы образуются в смесях фосфолипидов с водой. Внутри липосом может содержаться вода или раствор, в котором проводилось их получение. Также внутри липосом могут находиться активные вещества, в частности различные биологически активные белки.
В настоящее время разработан целый ряд способов приготовления различных типов липосом и протеолипосом, а также их стандартизации по размерам, структуре, гомогенности, стабильности и другим характеристикам. Однослойные липосомы можно получать различными методами, например из суспензии многослойных липосом, если обработать их ультразвуком. Диаметр однослойных липосом, полученных этим методом, составляет 25-30 нм. Разработаны и другие методы получения однослойных липосом, в том числе диаметром до 400 нм и более.
Липосомы, искусственные фосфолипидные везикулы, являются универсальным контейнером для доставки лекарственных препаратов непосредственно в клетку. Они защищают включенное соединение от разрушающего действия ферментов плазмы, снижают токсичность инкапсулируемых веществ и пролонгируют их действие в организме. Методы получения существенным образом влияют на свойства липосом. От технологии приготовления зависит размер везикул, степень окисления липидов (ПОЛ), входящих в состав оболочки (липосомы с высоким соединением продуктов ПОЛ могут быть токсичными для организма), их внутренний объем, стабильность при хранении и др. свойства.
Существуют разные способы получения липосом и выбор метода, как правило, зависит от задач, поставленных при разработке той или иной липосомальной формы. Наиболее просто получаются мультиламеллярные липосомы, так как липиды, используемые для получения липосом, самопроизвольно образуют при гидратировании подобные бислойные структуры (V.P. Torchilin and V. Weissig, Liposomes A Practical Approach, Second Edition, Oxford University Press, 2003).
Близким к инкапсулированию методом иммобилизации можно считать включение водных растворов целевых белков в липосомы, представляющие собой сферические или ламеллярные системы двойных липидных бислоев. Впервые данный способ был применен для иммобилизации ферментов Дж. Вайсманом и Дж. Сессом в 1970 г. Для получения липосом из растворов липида (чаще всего лецитина) упаривают органический растворитель. Оставшуюся тонкую пленку липидов диспергируют в водном растворе, содержащем белок. В процессе диспергирования происходит самосборка бислойных липидных структур липосомы, содержащих включенный раствор целевого белка.
Липосомальные препараты согласно настоящему изобретению готовили на специализированной установке ЛЭМП (электромагнитный смеситель-диспергатор) из раствора рчАФП, раствора рчГ-КСФ и раствора фосфолипидов Lipoid S80 в пропиленгликоле с добавлением, в случае необходимости, консервантов.
Данная установка позволяет получать липосомальные системы с заданными показателями размеров дисперсной фазы (медианный размер от 5 мкм до 50 нм) и высокой однородностью получаемой эмульсии. Препараты, полученные для профилактики и лечения радиационных ожогов кожи, характеризовались содержанием липидной фазы 1,0-1,4%, рН 7,3-7,5. Медианный размер препаратов составлял для различных партий от 130 до 100 нм.
В настоящем изобретении термин "альфа-фетопротеин человека" (чАФП) означает гликопротеин с молекулярным весом 69000 Да, состоящий из одной полипептидной цепи, включающей ~600 аминокислот и содержащей около 4% углеводов (Tomasi ТВ. Structure and function of alpha-fetoprotein. Annual review of medicine, 1977, v. 28, p. 453-65.), который образуется при развитии эмбриона и плода. По структуре и физико-химическим свойствам АФП очень близок главному белку сыворотки крови взрослых - сывороточному альбумину (СА). Функция СА - транспортная, перенос низкомолекулярных веществ в ткани. АФП как бы заменяет СА у эмбриона, его часто называют эмбриональным СА, и его функция, скорее всего, тоже транспортная. АФП обладает исключительно высоким сродством к полиненасыщенным жирным кислотам (ПНЖК), веществам, необходимым для построения клеточных мембран и особого класса биологически активных веществ - простагландинов. Наиболее вероятная функция АФП - избирательное связывание ПНЖК в плаценте и перенос их из крови матери в кровь и клетки эмбриона.
АФП человека согласно настоящему изобретению может быть натуральным сывороточным эмбриональным АФП, получаемым из абортивного материала или пуповинной сыворотки (RU 2170586, RU 2100031, RU 2010113136). АФП человека согласно настоящему изобретению предпочтительно является рекомбинантным чАФП (рчАФП) (US 2011/0077208, ЕА 011606 В1).
Последовательность аминокислот АФП человека, последовательность нуклеотидов гена, кодирующего АПФ человека, а также свойства указанного белка описаны, например, в базе данных Uniprot: http://www.uniprot.org/uniprot/P02771.
В настоящем изобретении термин "гранулоцитарный колониестимулирующий фактор человека" (ГКСФ), также известный как колониестимулирующий фактор 3 (КСФ 3), это колониестимулирующий фактор, стимулирующий в культуре клеток формирование колоний гранулоцитов (Metcalf, D. Hematopoietic regulators: Redundancy or subtlety? Blood, 1993, v. 82, p. 3515-23). Гранулоцитарный колониестимулирующий фактор является главным гемопоэтическим фактором роста, регулирующим гранулоцитопоэз. ГКСФ стимулирует пролиферацию и дифференцировку поздних клеток-предшественников в нейтрофилы. Под действием цитокинов Г-КСФ и колониестимулирующий фактор макрофагов (М-КСФ) происходит образование нейтрофилов и моноцитов, соответственно, из колониеобразующих единиц гранулоцитов-макрофагов (КОЕ-ГМ). Оба эти фактора в дальнейшем, как и другие цитокины, стимулируют дифференцировку моноцитов в макрофаги.
ГКСФ человека согласно настоящему изобретению предпочтительно является рекомбинантным чГКСФ (рчГКСФ) (RU 2326169, RU 2278870, RU 2207373, RU 2201962, RU 2157846, US 2010/0227818).
Последовательность аминокислот ГКСФ человека, последовательность нуклеотидов гена, кодирующего ГКСФ человека, а также свойства указанного белка описаны, например, в базе данных Uniprot: http://www.uniprot.org/uniprot/P09919.
Рекомбинантные белки, обладающие активностью зрелого АФП человека или зрелого ГКСФ человека, представляют собой белки с аминокислотной последовательностью, соответствующей природным белкам, или с модифицированной аминокислотной последовательностью, имеющей делеции, добавления, вставки или замены одного или нескольких аминокислотных остатков, что приводит к образованию соответствующих модифицированных белков, последовательность которых по крайней мере на 80% соответствует аминокислотным последовательностям зрелых природных белков, с сохранением у указанных продуктов с модифицированной структурой функциональной биологической активности зрелого АФП человека или зрелого ГКСФ человека, соответственно.
Способы получения рекомбинантных белков, в частности рчАФП и рчГКСФ согласно настоящему изобретению, хорошо известны специалистам в данной области техники. Указанные способы включают, например, экспрессию рекомбинантных плазмид, содержащих гены, кодирующие целевые белки, в подходящих клетках-продуцентах указанных целевых белков. В указанных способах клетки-продуценты целевых белков выращивают в питательной среде и выделяют полученные целевые белки из, например, культуральной жидкости или телец включения.
Методы получения плазмидной ДНК, расщепления и лигирования ДНК, трансформации, подбора олигонуклеотидов в качестве праймеров и подобные методы могут быть стандартными методами, хорошо известными специалисту в данной области техники. Эти методы описаны, например, в Sambrook, J., Fritsch, E.F., and Maniatis, Т. "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989).
Липосомы согласно настоящему изобретению содержат от 0,1 мг/мл до 1,0 мг/мл альфа-фетопротеина человека (АФП). Указанный альфа-фетопротеин человека предпочтительно является рекомбинантным альфа-фетопротеином человека (рчАФП).
Также липосомы согласно настоящему изобретению могут дополнительно содержать от 0,004 мг/мл до 0,06 мг/мл гранулоцитарного колониестимулирующего фактора человека. Указанный гранулоцитарный колониестимулирующий фактор человека является рекомбинантным гранулоцитарным колониестимулирующим фактором человека (рчГКСФ).
Фармацевтическая композиция для лечения местных радиационных поражений кожи согласно настоящему изобретению содержит эффективное количество липосом согласно настоящему изобретению, описанных выше. Термин "эффективное количество" означает количество, способное уменьшить тяжесть и/или сократить время восстановления пораженного участка кожи. Указанная фармацевтическая композиция может дополнительно содержать фармацевтически приемлемые добавки, наполнители и носители, известные специалисту в данной области техники.
Лекарственное средство для лечения местных радиационных поражений кожи, согласно настоящему изобретению, содержит фармацевтическую композицию, описанную выше. Указанное лекарственное средство может предназначено для трансдермального или подкожного введения. Трансдермальное введение является предпочтительным, поскольку трансдермальное введение препарата является не инвазивным способом введения, по сравнению с подкожным. Трансдермальное введения снижает вероятность инфекционных осложнений и исключает дополнительную травматизацию вблизи ожоговой раны.
Для преодоления барьерных свойств кожи и усиления трансдермальной доставки лекарственных средств дополнительно могут применяться различные приемы, заключающиеся например, в использовании в составе лекарственного средства дополнительных химических веществ, усилителей транспорта, и увеличения его проницаемости для лекарственных средств. В качестве таких химических «усилителей» используется широкий спектр веществ, включающий многоатомные спирты, жирные кислоты и их эфиры, поверхностно-активные вещества, терпены (патент США №6444234). Трансдермальная доставка лекарственных средств в инкапсулированном виде, в частности внутри липосом, как это сделано в настоящем изобретении, является одним из таких приемов.
Лекарственные средства согласно настоящему изобретению могут быть в форме пластины, пластыря, пленки, крема, пасты, раствора, эмульсии, мази или спрея. Предпочтительным является использование лекарственных средств согласно настоящему изобретению в виде крема, пасты, раствора, эмульсии, мази или спрея.
Способ лечения и/или профилактики местных радиационных поражений кожи согласно настоящему изобретению включает стадию нанесения фармацевтической композиции согласно настоящему изобретению на пораженный или подвергающийся поражению участок кожи. В случае лечения пораженного участка в соответствии с указанным способом кожи фармацевтическую композицию согласно настоящему изобретению наносят на пораженный участок кожи ежедневно один или несколько раз в зависимости от тяжести поражения. Схема лечения подбирается соответствующим практикующим врачом в соответствии с методами, хорошо известными специалистам в данной области. В случае профилактики подвергающегося возможному поражению участка кожи в соответствии с указанным способом согласно настоящему изобретению фармацевтическую композицию наносят на участок кожи ежедневно один или несколько раз в зависимости от возможного уровня облучения и предполагаемой тяжести поражения. Схема профилактической обработки также подбирается соответствующим практикующим врачом в соответствии с методами, хорошо известными специалистам в данной области.
Примеры
Последующие примеры приведены исключительно в иллюстративных целях для разъяснения сущности настоящего изобретения и никоим образом не ограничивают рамки настоящего изобретения.
Пример 1. Усиление устойчивости фибробластов к действию ионизирующего облучения в присутствии рчАФП
Влияние рчАФП