Лиофилизированные лекарственные наносуспензии
Иллюстрации
Показать всеНастоящее изобретение относится к лиофилизированной (также называемой лиофильно высушенной) лекарственной наносуспензии, содержащей 4-[[4-[[4-(2-цианоэтенил)-2,6-диметилфенил]амино]-2-пиримидинил]амино]бензонитрил, или его стереоизомерную форму, или его фармацевтически приемлемую соль и стерический стабилизатор, представляющий собой твердое вещество при комнатной температуре и поливинилпирролидон. Композиция лиофилизированной лекарственной наносуспензии по настоящему изобретению обладает приемлемой стабильностью гранулометрического состава при хранении, в том числе при длительном хранении. 5 н. и 20 з.п. ф-лы, 6 ил., 7 табл., 2 пр.
Реферат
Настоящее изобретение относится к лиофилизированным (также называемым лиофильно высушенными) лекарственным наносуспензиям. Композиция лиофилизированной лекарственной наносуспензии по настоящему изобретению обладает приемлемой стабильностью гранулометрического состава при хранении, в том числе при длительном хранении. Стабильность гранулометрического состава при длительном хранении включает стабильность в течение периода 2 недели, в частности, периода один месяц, более конкретно, периода два месяца, и еще более конкретно, периода три месяца или периода шесть месяцев, или периода от по меньшей мере шести месяцев до двух лет. Стабильность гранулометрического состава при длительном хранении является важным свойством, поскольку она представляет собой неотъемлемую часть каждой процедуры разработки состава.
Наночастицы или наносуспензии известны из предшествующего уровня техники и были описаны, например, в EP-A-0499299.
Состав лекарственной наносуспензии, который является составом-предшественником для состава лиофилизированной лекарственной наносуспензии по настоящему изобретению, представляет собой жидкий состав, где лекарственное средство суспендировано в форме наночастиц. Жидкая или дисперсионная среда представляет собой предпочтительно водную среду, такую как вода.
Состав-предшественник лекарственной наносуспензии обычно содержит стерический стабилизатор, предпочтительно, поверхностно-активное вещество (например, полимерное поверхностно-активное вещество) или полимер. Стерический стабилизатор адсорбируется или прикрепляется на поверхности лекарственных наночастиц и обеспечивает широкий и плотный стерический барьер, препятствующий силам ван-дер-ваальсового притяжения, и, следовательно, стерический стабилизатор уменьшает агрегацию, агломерацию или даже слияние частиц. Эта методика допускает исключительно высокие дозовые нагрузки наносуспензии (например, вплоть до 400 мг лекарственного средства/мл). Стерические стабилизаторы предпочтительно представляют собой наполнители, которые являются фармацевтически приемлемыми.
Наночастицы лекарственного средства, как правило, имеют среднюю величину размера частиц меньше 1 мкм и d99-величину меньше 5 мкм. Более конкретно, d95-величина составляет 0,9 мкм (d99 составляет X, или d95 составляет X означает, что 99% или 95% частиц по весу (или по другим подходящим методикам измерения, как например, по объему или числу) меньше этого размера X).
В частности, средний размер частиц или наночастиц наносуспензий, подлежащих лиофилизации, или наносуспензии, полученной в результате восстановления лиофилизированной лекарственной наносуспензии, может быть меньше примерно 1000 нм, или меньше примерно 500 нм, или меньше примерно 400 нм, или меньше примерно 300 нм, или меньше примерно 200 нм. Предпочтительно, средний размер частиц составляет примерно 200 нм, или примерно 400 нм, или примерно 800 нм, более предпочтительно, примерно 200 нм.
Возможный подход к получению лекарственной наносуспензии заключается в превращении в порошок субстанции лекарственного средства в мельнице с перемешиваемой средой посредством мокрого измельчения с помощью шариков.
Лекарственные наносуспензии могут улучшать растворимость, скорость растворения, биологическую доступность. Лекарственные наносуспензии также могут применяться как состав с замедленным или отсроченным высвобождением (депо). Такие составы могут применяться для длительного лечения или длительной профилактики, например, при введении парентерально, например, внутримышечно или подкожно. Это означает, что состав может обеспечивать эффективные уровни в плазме крови - уровни в плазме крови, выше минимальной терапевтической концентрации - в течение определенного периода, например, в течение по меньшей мере 1 недели, или по меньшей мере двух недель, или по меньшей мере 1 месяца, или по меньшей мере двух месяцев, или по меньшей мере трех месяцев. Состав также может обеспечивать уровень в плазме крови, который ниже пороговой величины, производящей побочный эффект. Пороговая величина означает уровень в плазме крови в течение значительного периода времени, например, в течение больше 15 минут, в зависимости от конкретного лекарственного средства, выше которой пациенты могут испытывать нежелательные побочные эффекты, или наоборот, означает величину уровня в плазме крови, ниже которой общая переносимость состава, о котором идет речь, остается приемлемой. Пороговой величиной не считаются временные, высокие уровни в плазме крови в течение короткого периода времени, например, в течение меньше 15 минут, в зависимости от конкретного лекарственного средства, которые вызваны, например, неожиданным “взрывным высвобождением” активного ингредиента.
Оба вышеприведенные признаки - уровни в плазме крови выше минимальной терапевтической концентрации, но ниже пороговой величины, производящей побочной эффект - считаются основными требованиями, которым должен удовлетворять современный состав-депо, чтобы быть приемлемым для предусматриваемых пациентов. Ограничение числа введений лекарственного средства и частоты нежелательных побочных эффектов после каждого введения несомненно улучшит соблюдение пациентом терапии. Однако, кроме этих основных требований, можно отметить ряд дополнительных требований, которые будут дополнительно улучшать соблюдение пациентами схемы приема лекарственных средств, при этом два наиболее заметных представляют собой местную переносимость и легкость введения.
Что касается инъецируемых препаратов, хорошая местная переносимость означает минимальное раздражение и воспаление в месте инъекции; легкость введения относится к размеру иглы и промежутку времени, требуемому для введения дозы конкретного лекарственного состава.
Существенным недостатком жидкой лекарственной наносуспензии является ее ограниченная длительная стабильность. Оседание или эффекты Оствальдовского созревания представляют собой общепризнанные проблемы нестабильности.
Поэтому, лиофилизированные лекарственные наносуспензии могут представлять собой привлекательную альтернативу. В этом случае, срок годности состава с лекарственным средством в диапазоне наночастиц может быть увеличен. Предпочтительно, лиофилизированная лекарственная наносуспензия сама по себе обладает приемлемой длительной стабильностью, особенно с точки зрения среднего размера частиц или гранулометрического состава. После хранения и непосредственно после восстановления лиофилизированной лекарственной наносуспензии средний размер частиц, гранулометрический состав, d50, d90, d95 или d99 сохраняется или остается приемлемым.
Эти лиофилизированные лекарственные наносуспензии можно восстанавливать по мере надобности в жидкую наносуспензию, которую затем можно вводить. Введение указанной восстановленной наносуспензии включает пероральное введение или парентеральное введение, такое как, например, внутривенное, внутримышечное или подкожное введение. Введение представляет собой, предпочтительно, парентеральное введение, такое как, например, внутримышечное или подкожное введение. Следует обратить внимание, что восстановленная суспензия остается равномерно диспергированной, или что ее легко диспергировать при встряхивании, что предоставляет возможность для введения однородной суспензии.
Графические материалы
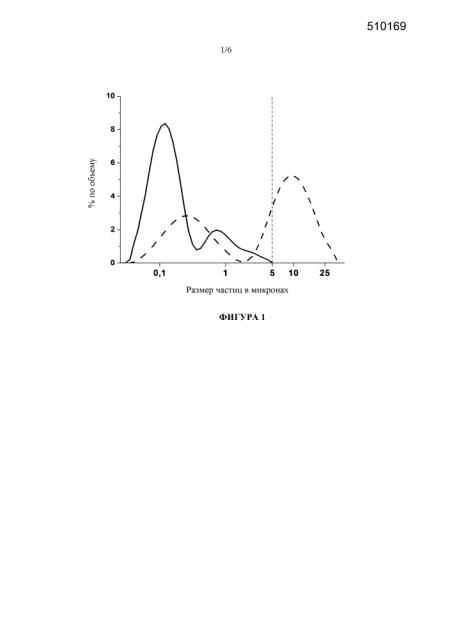
Фигура 1: Сравнение гранулометрических составов исходной лекарственной наносуспензии, стабилизированной с помощью 50 мг/мл Cremophor EL, непосредственно после лиофилизации и на стадии 3 месяцев хранения при условиях окружающей среды (штриховая линия). Граница 5 мкм представляет собой верхний предел размера частиц для парентеральной лекарственной наносуспензии.
Фигура 2: Сравнение гранулометрических составов исходной наносуспензии рилпивирина, стабилизированной с помощью 50 мг/мл полоксамера 338, непосредственно после лиофилизации и на стадии 3 месяцев хранения при условиях окружающей среды (штриховая линия).
Фигура 3: Сравнение гранулометрических составов исходной лекарственной наносуспензии, стабилизированной с помощью 50 мг/мл Cremophor EL, после агрессивных условий способа лиофилизации (сплошная линия, температуру полки при первичной сушке после замораживания сразу повысили до 40°C) и умеренных условий процесса лиофилизации (штриховая линия, температура полки 0°C). Следует обратить внимание, что при обоих режимах измеренные температуры продукта были значительно выше CFT (критической температуры состава, которая обозначается как температура стеклования максимально замороженного концентрированного раствора Tg', как правило, оцениваемой с помощью дифференциальной сканирующей калориметрии (DSC) (Pikal M J. 2002. Freeze drying, in: J. Swarbrick (Ed.), Encyclopedia of Pharmaceutical Technology, vol. 2, Marcel Dekker, New York (2002) 1299-1326).
Фигура 4: Сравнение индексов повторной диспергируемости (RDI) для исходных лекарственных наносуспензий после 3 месяцев хранения при условиях окружающей среды, стабилизированных либо с помощью Cremophor EL (Cr EL), либо с помощью полоксамера 338 (P338), в зависимости от высокого или низкого содержания остаточной влажности (R. M.).
Фигура 5: Сравнение гранулометрических составов лекарственной наносуспензии, стабилизированной с помощью 50 мг/мл Cremophor EL, и с 50 мг/мл трегалозы в качестве лиопротектора, непосредственно после лиофилизации и на стадии 3 месяцев хранения при условиях окружающей среды, в зависимости от высокого или низкого содержания остаточной влажности. Следует обратить внимание, что изначальная стабильность наночастиц не зависела от влагосодержания (сплошная в сравнении с пунктирной линией), но после хранение содержание остаточной влажности ниже 1% (штриховая линия) показало лучшую стабильность частиц по сравнению с влагосодержанием выше 1% (штрих-пунктирная линия).
Фигура 6: Сравнение гранулометрических составов высококонцентрированной лекарственной наносуспензии (200 мг/мл рилпивирина), стабилизированной с помощью 50 мг/мл полоксамера 338, и с 50 мг/мл PVP K15 в качестве лиопротектора показывает, что первоначальный гранулометрический состав после лиофилизации (сплошная линия) полностью сохранился через 3 месяца хранения при 25°C (штриховая линия), а также при 40°C (пунктирная линия).
Описание изобретения
Таким образом, настоящее изобретение относится к лиофилизированной лекарственной наносуспензии, под которой понимают лиофилизированную наносуспензию, содержащую лекарственное средство, или водную наносуспензию, содержащую лекарственное средство, лиофилизированную до твердой композиции.
Подходящие лекарственные средства или активные фармацевтические ингредиенты, которые могут применяться в лиофилизированных наносуспензиях по настоящему изобретению, включают без ограничения:
- анальгезирующие и противовоспалительные лекарственные средства (NSAID, фентанил, индометацин, ибупрофен, кетопрофен, набуметон, парацетамол, пироксикам, трамадол, ингибиторы ЦОГ-2, такие как целекоксиб и рофекоксиб);
- антиаритмические лекарственные средства (прокаинамид, хинидин, верапамил);
- антибактериальные и антипротозойные средства (амоксициллин, ампициллин, бензатин пенициллин, бензилпенициллин, цефаклор, цефадроксил, цефпрозил, цефуроксим аксетил, цефалексин, хлорамфеникол, хлорохин, ципрофлоксацин, кларитромицин, клавулановая кислота, клиндамицин, доксициклин, эритромицин, флуклоксациллин натрия, галофантрин, изониазид, канамицина сульфат, линкомицин, мефлохин, миноциклин, нафциллин натрия, налидиксовая кислота, неомицин, норфлоксацин, офлоксацин, оксациллин, феноксиметилпенициллин калия, пириметамин-сульфадоксим, стрептомицин);
- антикоагулянты (варфарин);
- антидепрессанты (амитриптилин, амоксапин, бутриптилин, кломипрамин, дезипрамин, дотиепин, доксепин, флуоксетин, ребоксетин, аминептин, селегилин, гепирон, имипрамин, карбонат лития, миансерин, милнаципран, нортриптилин, пароксетин, сертралин; 3-[2-[3,4-дигидробензофуро[3,2-c]пиридин-2(1H)-ил]этил]-2-метил-4H-пиридо[1,2-a]пиримидин-4-он);
- антидиабетические лекарственные средства (глибенкламид, метформин);
- противоэпилептические лекарственные средства (карбамазепин, клоназепам, этосуксимид, габапентин, ламотриджин, леветирацетам, фенобарбитал, фенитоин, примидон, тиагабин, топирамат, вальпромид, вигабатрин);
- противогрибковые средства (амфотерицин, клотримазол, эконазол, флуконазол, флуцитозин, гризеофульвин, итраконазол, кетоконазол, миконазола нитрат, нистатин, тербинафин, вориконазол);
- антигистаминные средства (астемизол, циннаризин, ципрогептадин, декарбоэтоксилоратадин, фексофенадин, флунаризин, левокабастин, лоратадин, норастемизол, оксатомид, прометазин, терфенадин);
- гипотензивные лекарственные средства (каптоприл, эналаприл, кетансерин, лизиноприл, миноксидил, празозин, рамиприл, резерпин, теразозин);
- антимускариновые средства (атропина сульфат, гиосцин);
- противоопухолевые средства и антиметаболиты (соединения платины, такие как цисплатин, карбоплатин; таксаны, такие как паклитаксел, доцетаксел; теканы, такие как камптотецин, иринотекан, топотекан; алкалоиды барвинка, такие как винбластин, виндецин, винкристин, винорелбин; производные нуклеозидов и антагонисты фолиевой кислоты, такие как 5-фторурацил, капецитабин, гемцитабин, меркаптопурин, тиогуанин, кладрибин, метотрексат; алкилирующие средства, такие как азотистые иприты, например, циклофосфамид, хлорамбуцил, хлорметин, ифосфамид, мелфалан, или нитрозомочевины, например, кармустин, ломустин, или другие алкилирующие средства, например, бусульфан, дакарбазин, прокарбазин, тиотепа; антибиотики, такие как даунорубицин, доксорубицин, идарубицин, эпирубицин, блеомицин, дактиномицин, митомицин; антитела к HER 2, такие как трастузумаб; производные подофиллотоксина, такие как этопозид, тенипозид; ингибиторы фарнезилтрансферазы; производные антрахинона, такие как митоксантрон; абиратерон и его сложные эфиры, такие как абиратерона ацетат);
- лекарственные средства против мигрени (алнидитан, наратриптан, суматриптан);
- лекарственные средства против болезни Паркинсона (бромокриптина мезилат, леводопа, селегилин);
- антипсихотические, снотворные и седативные средства (алпразолам, буспирон, хлордиазепоксид, хлорпромазин, клозапин, диазепам, флупентиксол, флуфеназин, флуразепам, 9-гидроксирисперидон, лоразепам, мазапертин, оланзапин, оксазепам, пимозид, пипамперон, пирацетам, промазин, рисперидон, селфотел, сероквел, сертиндол, сульпирид, темазепам, тиотиксен, триазолам, трифлуперидол, зипразидон, золпидем);
- противоинсультные средства (лубелузол, лубелузола оксид, рилузол, аптиганел, элипродил, ремацемид);
- противокашлевые препараты (декстрометорфан, леводропропизин);
- противовирусные препараты (ацикловир, ганцикловир, ловирид, тивирапин, зидовудин, ламивудин, зидовудин + ламивудин, диданозин, залцитабин, ставудин, абакавир, лопинавир, ампренавир, невирапин, эфавиренз, делавирдин, индинавир, нелфинавир, ритонавир, саквинавир, адефовир, гидроксимочевина, этравирин, дапивирин, рилпивирин, дарунавир, тенофовир или тенофовира дизопроксил фумарат, эмтрицитабин);
- блокаторы бета-адренорецептора (атенолол, карведилол, метопролол, небиволол, пропанолол);
- сердечные инотропные средства (амринон, дигитоксин, дигоксин, милринон);
- кортикостероиды (беклометазона дипропионат, бетаметазон, будезонид, дексаметазон, гидрокортизон, метилпреднизолон, преднизолон, преднизон, триамцинолон);
- дезинфицирующие средства (хлоргексидин);
- диуретики (ацетазоламид, фрусемид, гидрохлортиазид, изосорбид);
- эфирные масла (анетол, анисовое масло, тмин, кардамон, масло кассии, цинеол, коричное масло, гвоздичное масло, кориандровое масло, дементолизированное масло мяты, укропное масло, эвкалиптовое масло, эвгенол, имбирь, лимонное масло, горчичное масло, неролиевое масло, масло мускатного ореха, апельсиновое масло, масло мяты перечной, шалфей, мята колосковая, терпинеол, тимьян);
- желудочно-кишечные средства (циметидин, цизаприд, клебоприд, дифеноксилат, домперидон, фамотидин, лансопразол, лоперамид, лоперамида оксид, месалазин, метоклопрамид, мозаприд, низатидин, норцизаприд, олсалазин, омепразол, пантопразол, перпразол, прукалоприд, рабепразол, ранитидин, ридогрел, сульфасалазин);
- гемостатические средства (аминокапроновая кислота);
- средства, регулирующие уровень липидов (аторвастатин, ловастатин, правастатин, пробукол, симвастатин);
- местные анестетики (бензокаин, лигнокаин);
- опиоидные анальгетики (бупренорфин, кодеин, декстроморамид, дигидрокодеин, гидрокодон, оксикодон, морфин);
- парасимпатомиметики и лекарственные средства против деменции (AIT-082, эптастигмин, галантамин, метрифонат, миламелин, неостигмин, физостигмин, такрин, донепезил, ривастигмин, сабкомелин, талсаклидин, ксаномелин, мемантин, лазабемид);
- половые гормоны (эстрогены: конъюгированные эстрогены, этинилэстрадиол, местранол, эстрадиол, эстриол, эстрон; прогестогены; хлормадинона ацетат, ципротерона ацетат, 17-деацетил норгестимат, дезогестрел, диеногест, дидрогестерон, этинодиола диацетат, гестоден, 3-кетодезогестрел, левоноргестрел, линестренол, медроксипрогестерона ацетат, мегестрол, норэтиндрон, норэтиндрона ацетат, норэтистерон, норэтистерона ацетат, норэтинодрел, норгестимат, норгестрел, норгестриенон, прогестерон, квингестанола ацетат);
- стимулирующие средства (силденафил);
- вазодилататоры (амлодипин, буфломедил, амилнитрит, дилтиазем, дипиридамол, глицерилтринитрат, изосорбида динитрат, лидофлазин, молсидомин, никардипин, нифедипин, окспентифиллин, пентаэритритола тетранитрат);
в том числе их стереохимически изомерные формы;
их N-оксиды, их фармацевтически приемлемые соли присоединения кислоты или основания, или их сольваты.
Фармацевтически приемлемые соли присоединения кислоты включают формы солей присоединения кислоты, которые легко можно получить путем обработки формы основания активного ингредиента соответствующими органическими и неорганическими кислотами, например, галогенводородными кислотами, к примеру, хлористоводородной, бромистоводородной и т.п.; серной кислотой; азотной кислотой; фосфорной кислотой и т.п.; или органическими кислотами, например, уксусной, пропионовой, гидроксиуксусной, 2-гидроксипропионовой, 2-оксопропионовой, щавелевой, малоновой, янтарной, малеиновой, фумаровой, яблочной, винной, 2-гидрокси-1,2,3-пропантрикарбоновой, метансульфоновой, этансульфоновой, бензолсульфоновой, 4-метилбензолсульфоновой, циклогексансульфаминовой, 2-гидроксибензойной, 4-амино-2-гидроксибензойной кислотами и подобными кислотами. И, наоборот, при обработке щелочью солевую форму можно превратить в форму свободного основания.
Активные ингредиенты, содержащие кислотные протоны, можно превращать в их терапевтически активные формы солей присоединения нетоксичного металла или амина путем обработки соответствующими органическими и неорганическими основаниями. Соответствующие формы солей основания включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например, соли лития, натрия, калия, магния, кальция и т.п., соли с органическими основаниями, например, с первичными, вторичными и третичными алифатическими и ароматическими аминами, такими как метиламин, этиламин, пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин, бензатин, N-метил-D-глюкамин, 2-амино-2-(гидроксиметил)-1,3-пропандиол, гидрабаминовые соли и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. И, наоборот, при обработке кислотой солевую форму можно превращать в форму свободного основания.
Термин “сольваты” включает гидраты и формы присоединения растворителя, которые способны образовывать активные ингредиенты или их фармацевтически приемлемые соли. Примерами таких форм являются, например, гидраты, алкоголяты и т.п.
Формы N-оксидов активных ингредиентов включают такие активные ингредиенты, где один или несколько третичных атомов азота окислены до так называемого N-оксида.
Термин “стехиометрически изомерные формы” обозначает все возможные стереоизомерные формы, которыми могут обладать активные ингредиенты. Более конкретно, стереогенные центры могут иметь R- или S-конфигурацию, а активные ингредиенты, содержащие одну или несколько двойных связей, могут иметь E- и Z-конфигурацию.
В одном варианте осуществления лекарственное средство или активный фармацевтический ингредиент представляет собой противогрибковое средство, такое как, например итраконазол, или противовирусное средство, в частности, средство против ВИЧ, более конкретно ненуклеозидный ингибитор обратной транскриптазы (NNRTI), такой как, например, дапивирин, этравирин или рилпивирин.
Концентрация лекарственного средства в наносуспензии, подлежащей лиофилизации, может изменяться в диапазоне от 1 до 500 мг/мл, или от 1 до 400 мг/мл, или от 50 до 200 мг/мл, или от 50 до 100 мг/мл, или от 10 до 100 мг/мл, или от 10 до 75 мг/мл, или от 10 до 50 мг/мл, или от 20 до 50 мг/мл, или составляет примерно 200 мг/мл или составляет примерно 300 мг/мл.
Высокая концентрация наночастиц улучшает механическую стабильность лиофилизата.
Лиофилизированную лекарственную наносуспензию можно восстанавливать до жидкой лекарственной наносуспензии с такой же концентрацией лекарственного средства, что и в наносуспензии, которую лиофилизировали, или с отличающейся концентрацией лекарственного средства (более или менее концентрированной).
В одном варианте осуществления настоящее изобретение относится к лиофилизированной лекарственной наносуспензии, где лекарственное средство является малорастворимым, очень малорастворимым или практически нерастворимым согласно USP 33, общие указания, 5. Компоненты фармакопейной статьи (USP 33, general notes, 5. Monograph components). В частности, малорастворимое, очень малорастворимое или практически нерастворимое лекарственное средство выбрано из малорастворимых, очень малорастворимых или практически нерастворимых лекарственных средств, перечисленных в списке выше. Предпочтительные лекарственные средства выбирают из итраконазола, этравирина, дапивирина, рилпивирина. Лекарственным средством предпочтительно является активный фармацевтический ингредиент с небольшой химической молекулой (отличающийся от крупной молекулы, такой как, например, пептид, или белок, или последовательность ДНК/РНК).
В одном варианте осуществления настоящее изобретение относится к лиофилизированной наносуспензии, содержащей лекарственное средство, в частности, малорастворимое, очень малорастворимое или практически нерастворимое лекарственное средство, и дополнительно содержащей стерический стабилизатор. В одном варианте осуществления стерический стабилизатор представляет собой твердое вещество при комнатной температуре.
В одном варианте осуществления стерический стабилизатор представляет собой кристаллическое твердое вещество при комнатной температуре, в частности, стерический стабилизатор представляет собой кристаллическое твердое вещество при комнатной температуре и характеризуется температурой плавления, равной или выше 30°C, или температурой плавления, равной или выше 50°C, или температурой плавления, равной или выше 75°C, или температурой плавления, равной или выше 90°C.
В одном варианте осуществления стерический стабилизатор представляет собой аморфное твердое вещество при комнатной температуре, в частности, стерический стабилизатор представляет собой аморфное твердое вещество при комнатной температуре и обладает температурой стеклования (Tg), равной или выше 30°C, или Tg, равной или выше 50°C, или Tg, равной и выше 75°C, или Tg, равной или выше 90°C.
Стерический стабилизатор обеспечивает приемлемую стабильность гранулометрического состава при хранении, в том числе при длительном хранении лиофилизированной лекарственной наносуспензии. Было обнаружено, что скорость замораживания не является решающим фактором для сохранения первоначального гранулометрического состава наночастиц в лиофилизированной лекарственной наносуспензии.
Определение стабильности гранулометрического состава лиофилизированной лекарственной наносуспензии можно выполнить путем расчета индекса повторной диспергируемости (RDI) или путем определения величин d50, или d90, или d99 непосредственно после лиофилизации (T0) и после периода хранения, например, через 1, или 2, или 3 месяца хранения (T1, T2, T3). RDI определяется как D0/D, где D0 представляет собой средневзвешенную по объему среднюю величину размера частиц после лиофилизации в T0, а D представляет собой соответствующую величину после периода хранения, например, через 3 месяца хранения. Следовательно, RDI 100% будет означать, что хранимая лиофилизированная лекарственная наносуспензия может полностью превращаться в частицы исходного размера при T0 после регидратации. Лиофилизированная лекарственная наносуспензия обладает приемлемой стабильностью в отношении размера частиц при хранении, если RDI через 3 месяца при 25°C составляет по меньшей мере 90%, в частности, по меньшей мере 92%, или 94%, или 96%, или 98%. В частности, лиофилизированная лекарственная наносуспензия обладает приемлемой стабильностью в отношении размера частиц при хранении, если RDI через 3 месяца при 40°C составляет по меньшей мере 90%, в частности, по меньшей мере 92%, или 94%, или 96%, или 98%.
В одном варианте осуществления стерический стабилизатор представляет собой твердое, кристаллическое или аморфное вещество при комнатной температуре и является полимером или поверхностно-активным веществом (например, полимерным поверхностно-активным веществом). В предпочтительном варианте осуществления стерический стабилизатор представляет собой полоксамер 338, особенно в лиофилизированных наносуспензиях для составов для парентерального введения. В предпочтительном варианте осуществления стерический стабилизатор представляет собой гидроксипропил метилцеллюлозу, особенно в лиофилизированных наносуспензиях для перорального введения.
Концентрация стерического стабилизатора в наносуспензии, подлежащей лиофилизации, может находиться в диапазоне от 1 до 200 мг/мл, или от 10 до 100 мг/мл, или от 10 до 75 мг/мл, или от 10 до 50 мг/мл, или от 20 до 50 мг/мл или составлять примерно 33,3 мг/мл или примерно 50 мг/мл.
В одном варианте осуществления настоящее изобретение относится к лиофилизированной лекарственной наносуспензии, содержащей стерический стабилизатор, как описано в любом из вышеприведенных вариантов осуществления, и дополнительно содержащей криопротектор или лиопротектор. Криопротектор представляет собой соединение, которое стабилизирует компоненты, подлежащие лиофилизации, во время этапа замораживания. Лиопротектор представляет собой соединение, которое стабилизирует компоненты, подлежащие лиофилизации, во время этапа дегидратации. Многие наполнители могут служить как криопротекторами, так и лиопротекторами.
В одном варианте осуществления криопротектором или лиопротектором является сахарид, в частности, моно- или дисахарид, такой как, например, сахароза, трегалоза, маннит.
В одном варианте осуществления криопротектором или лиопротектором является полимер, такой как, например, поливинилпирролидон, а именно, PVP K12, PVP K15 или PVP K17, при этом предпочтительными являются PVP K15 и PVP K17.
В одном варианте осуществления криопротектором или лиопротектором является смесь сахарида и полимера, например, смесь PVP и трегалозы.
Криопротектор или лиопротектор могут дополнительно повышать стабильность гранулометрического состава при хранении, в том числе при длительном хранении лиофилизированной лекарственной наносуспензии.
Концентрация криопротектора или лиопротектора в наносуспензии, подлежащей лиофилизации, может находиться в диапазоне от 1 до 200 мг/мл, или от 10 до 100 мг/мл, или от 10 до 75 мг/мл, или от 10 до 50 мг/мл, или от 20 до 50 мг/мл или составляет примерно 12,5 мг/мл, или примерно 25 мг/мл, или примерно 50 мг/мл, или примерно 75 мг/мл.
В предпочтительном варианте осуществления концентрация лиопротектора или криопротектора является насколько возможно низкой для предотвращения сморщивания или разрушения лиофилизата, но достаточно высокой для обеспечения стабилизации наночастиц, а концентрация стерического стабилизатора является минимальной концентрацией, которая, как правило, выше минимальной концентрации, необходимой для достижения стабильности первоначальных наночастиц непосредственно после измельчения для получения наносуспензии.
В одном варианте осуществления лиофилизированная лекарственная наносуспензия, как описано в любом из вышеприведенных вариантов осуществления, имеет содержание остаточной влажности, равное или ниже 2% вес/вес, или равное или ниже 1% вес/вес, или равное или ниже 0,5% вес/вес. Такое ограниченное содержание остаточной влажности дополнительно улучшает стабильность гранулометрического состава при хранении, в том числе при длительном хранении лиофилизированной наносуспензии.
В одном варианте осуществления настоящее изобретение относится к лиофилизированной лекарственной наносуспензии, как описано в любом из вышеприведенных вариантов осуществления, для применения в получении лекарственного препарата, в частности, жидкой лекарственной наносуспензии, более конкретно водной лекарственной наносуспензии, для перорального или парентерально введения, в частности, парентерального введения, более конкретно подкожного или внутримышечного введения.
Настоящее изобретение также относится к водной наносуспензии, получаемой путем восстановления лиофилизированной лекарственной наносуспензии, как описано в данном документе выше или ниже, с помощью жидкой или дисперсионной среды, в частности, с помощью водной дисперсионной среды, например, воды или воды для инъекций.
Настоящее изобретение также относится к способу получения жидкой наносуспензии, в частности, водной наносуспензии, отличающемуся восстановлением лиофилизированной лекарственной наносуспензии, как описано в данном документе выше или ниже, с помощью жидкой или дисперсионной среды, в частности, с помощью водной дисперсионной среды.
Лиофилизированная лекарственная наносуспензия по настоящему изобретению может также дополнительно содержать фармацевтически приемлемые ингредиенты. Последние включают любые ингредиенты для применения в инъецируемых составах, или в суспензионных составах, или в пероральных составах. Эти ингредиенты можно выбирать из одного или нескольких из суспендирующего средства, буфера, средства, регулирующего рН, консерванта, изотонирующего средства и подобных ингредиентов. В одном варианте осуществления указанные ингредиенты выбирают из одного или нескольких из суспендирующего средства, буфера, средства, регулирующего рН, и, необязательно, консерванта и изотонирующего средства. Конкретные ингредиенты могут действовать в качестве двух или более из таких средств одновременно, например, ведут себя подобно консерванту и буферу или ведут себя подобно буферу и изотонирующему средству.
Примеры фармацевтически приемлемых ингредиентов дополнительно описаны ниже.
В одном варианте осуществления настоящее изобретение относится к лиофилизированной наносуспензии, как описано в любом из вышеприведенных вариантов осуществления, где лекарственное средство представляет собой лекарственное средство против ВИЧ, в частности, ненуклеозидный ингибитор обратной транскриптазы (NNRTI), такой как, например, дапивирин, этравирин или рилпивирин, в частности, рилпивирин. Указанная наносуспензия может предназначаться для применения в получении лекарственного препарата, в частности, жидкой наносуспензии средства против ВИЧ, более конкретно водной наносуспензии лекарственного средства против ВИЧ для парентерального введения, в частности, подкожного или внутримышечного введения, в частности, для длительной профилактики или длительного лечения ВИЧ-инфекции.
Вследствие фармакокинетических свойств и необходимости поддерживать уровни в плазме крови выше минимального уровня, для применяемых в настоящее время лекарственных средств против ВИЧ требуется частое введение относительно высоких доз. Число и/или объем лекарственных форм, которые необходимо ввести, обычно рассматривают как показатель общего количества применяемых единиц дозирования (так называемый "pill burden"). Высокий "pill burden" нежелателен по многим причинам, таким как частота приема, зачастую сочетающаяся с неудобством, заключающимся в глотании большого количества лекарственных форм, а также необходимостью хранить и транспортировать большое количество или объем пилюль. Высокий "pill burden" повышает вероятность того, что пациенты не будут принимать их полную дозу, тем самым будут не способны соблюдать предписанную схему приема лекарственных средств. Помимо снижения эффективности лечения, это также приводит к появлению вирусной устойчивости. Проблемы, ассоциированные с высоким "pill burden", выражены в терапии против ВИЧ, где пациент должен принимать большое количество различных средств против ВИЧ.
Поэтому, было бы целесообразно обеспечить ВИЧ-ингибирующую терапию, которая снижает "pill burden", поскольку она предполагает введение лекарственных форм с относительно небольшим размером, и, кроме того, не требуется частый прием. Заманчиво было бы обеспечить терапию против ВИЧ, включающую введение лекарственных форм на длительные промежутки времени, такие как одна неделя или дольше, или даже один месяц или дольше.
На сегодняшний день нельзя полностью избавиться от ВИЧ, так что люди, инфицированные ВИЧ, представляют собой постоянную угрозу инфицирования других людей. После первичного инфицирования до проявления первых симптомов СПИДа проходит длительное время. Люди могут годами жить с инфекцией, не испытывая каких-либо ее воздействий, из-за чего не подозревают о риске дальнейшего переноса вируса в других людей. Поэтому профилактика передачи ВИЧ является крайне важной. На сегодняшний день профилактика направлена на то, чтобы избежать передачи половым путем, в частности, с помощью использования презервативов группой риска в отношении инфицирования ВИЧ, на тщательный контроль проб крови на наличие ВИЧ и на то, чтобы избежать контакта с кровью потенциально инфицированных субъектов.
Несмотря на эти меры, всегда существует неизбежный риск заражения отдельных лиц, контактирующих с ВИЧ-инфицированными людьми. В частности, это касается тех, кто оказывает медицинскую помощь инфицированным пациентам или пациентам, подверженным риску заразиться, а именно врачей, медсестер или стоматологов.
В связи с этим существует потребность в дополнительных средствах, обеспечивающих профилактику передачи ВИЧ. Существует особая потребность в эффективных средствах профилактики, которые были бы простыми в применении. Обеспечение таких средств профилактики представляет собой другую цель настоящего изобретения.
Следовательно, один вариант осуществления настоящего изобретения представляет собой лиофилизированную наносуспензию, как описано в любом из вышеприведенных вариантов осуществления, лекарственного средства против ВИЧ с 4-[[4-[[4-(2-цианоэтенил)-2,6-диметилфенил]амино]-2-пиримидинил]амино]бензонитрилом, или его стереоизомерной формой, или его фармацевтически приемлемой солью.
Один вариант осуществления настоящего изобретения представляет собой лиофилизированную наносуспензию, как описано, во всех возможных случаях, в любом из вышеприведенных вариантов осуществления, лекарственного средства против ВИЧ с 4-[[4-[[4-(2-цианоэтенил)-2,6-диметилфенил]амино]-2-пиримидинил]амино]бензонитрилом или его стереоизомерной формой; или его фармацевтически приемлемой солью, при этом указанная лиофилизированная наносуспензия дополнительно содержит стерический стабилизатор, в частности, полоксамер 338, и дополнительно необязательно содержит криопротектор, в частности, поливинилпирролидон, более конкретно PVP K15 или PVP K17. Что касается концентраций