Производные оксимов 4-бензоилпиридина, обладающие противосудорожной активностью, как средства лечения эпилепсии и пароксизмальных состояний
Иллюстрации
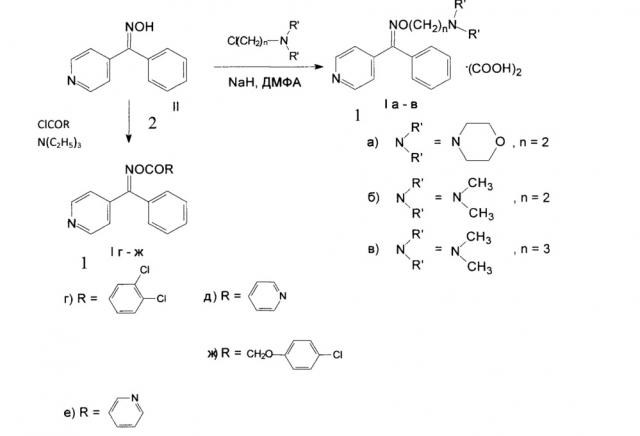
Показать всеИзобретение относится к производным O-R-оксимов 4-бензоилпиридина общей формулы:
где R может быть:
а также:
где R может быть:
X: щавелевая кислота или другие органические или минеральные кислоты, или отсутствует, которые проявляют противосудорожную активность, и к способам их получения. 5 н. и 1 з.п. ф-лы, 12 табл., 10 пр.
Реферат
Область, к которой относится изобретение
Изобретение относится к области медицины, биологии, фармакологии и органической химии, а именно к новым производным O-R-оксимов 4-бензоилпиридина общей формулы:
где
где n=2 или 3; N(R')2-морфолино или диметиламино, X=(СООН)2 или другие органические или минеральные кислоты (1а-в), или отсутствует R=O-(3,4-дихлор)бензоил; O-никотиноил; O-изоникотиноил; O-(4-хлорфеноксиацетил), X отсутствует (1г-ж),
которые могут быть использованы для расширения арсенала препаратов, применяемых в терапии для лечения эпилепсии и пароксизмальной активности, появляющейся при различных патологиях. Изобретение относится также к способам получения новых производных O-R-оксимов 4-бензоилпиридина и к фармацевтическим препаратам, содержащим эти соединения в качестве активных компонентов.
Целью изобретения является создание и выявление новых производных O-R-оксимов 4-бензоилпиридина, обладающих противосудорожной активностью. Цель достигается синтезом заявляемых соединений путем взаимодействия оксима 4-бензоилпиридина с замещенными аминоалкилгалогенидами или хлорангидридами кислот и проведением психофармакологического скрининга заявляемых соединений.
Распространенность эпилепсии в разных странах по данным ВОЗ варьирует в очень широком диапазоне - от 1,5 до 50 случаев на 1000 населения (Сидоренко К.В., Даренская Е.Ю. Распространенность эпилепсии в мире // Успехи современного естествознания. 2014. №6; Hauser W.A. Epidemiology of epilepsy / W.A. Hauser // X Всероссийский съезд неврологов с международным участием: материалы съезда. Нижний Новгород, - 2012. - С. - 313-314), а в Российской Федерации составляет 2,98 на 1000 человек населения (Гехт, В.А. Хаузер, Л.Е. Мильчакова и др. // X Всероссийский съезд неврологов 125 с международным участием: материалы съезда. Нижний Новгород. - 2012. - С. 277).
Для лечения эпилепсии применяется значительное количество противоэпилептических препаратов (ПЭП), таких как леветирацетам, топирамат, карбомазепин, финлепсин, дифенин и другие, однако продолжается их активный поиск и совершенствование, что связано с тем, что современные ПЭП не удовлетворяют в полной мере требованиям клиники. Несмотря на широкий спектр противосудорожных средств около 20-30% больных остаются резистентными к лечению основными противосудорожными препаратами. Кроме того, отмечаются случаи провокации судорожных проявлений на фоне терапии ПЭП, обусловленных многообразием механизмов генерации судорог, что создает трудности подбора противосудорожной терапии. (Р.Дж. Портер, Б.С. Мелдрум. Противоэпилептические средства. / В кн. Б.Г. Катцунг. Базисная и клиническая фармакология: В 2 т. Т. 1. / Пер. с англ. - 2-е изд., перераб. и доп. - М.; СПб.: Изд-во Бином, Изд-во «Диалект», 2007. С. 464-491; Карлов В.А. Эпилепсия у детей и взрослых женщин и мужчин: руководство для врачей / В.А. Карлов. М.: Медицина, 2010. - 717 с.).
Среди производных пиридинов в медицине нашел применение никардипин (метил-2-[метил(фенилметил)амино]этил-1,4-дигидро-2,6-диметил-4-(3-нитрофенил)-3,5-пиридиндикарбоксилат) (Jpn. Kokai Tokkyo Koho JP 62.221.669 [87.221.669]) как антигипотензивный препарат. Зимелидин ((Z)-3-(4-бромофенил)-N,N-диметил-3-(пирадин-3-ил)проп-2-эн-1-амин) обладает антидепрессивной активностью (J. Med. Chem., 1981, 24, №2, 1499-1507). Производные ([(3-пиридинилметилен)амино]окси)алканоатов являются ингибиторами агрегации кровяных тел (US Patent 794999, 1985).
Большинство оригинальных ПЭП производится за пределами России, поэтому не всегда больные имеют к ним доступ, что является одной из причин отсутствия адекватной помощи.
Задачей изобретения является получение и выявление новых соединений среди производных O-R-оксимов 4-бензоилпиридина с противосудорожной активностью, расширяющих арсенал средств, используемых для лечения эпилепсии и других пароксизмальных состояний, обладающих низкой токсичностью.
Технический результат достигается путем создания новых и исследования существующих производных O-R-оксимов 4-бензоилпиридина, обладающих противосудорожной активностью, не сопровождающихся побочными эффектами.
Заявляемые соединения синтезированы по методике, заключающейся во взаимодействии оксима 4-бензоилпиридина с замещенными аминоалкилгалогенидами или хлорангидридами кислот с последующим выделением продуктов в виде оснований или солей (описана в примерах 1,2) и обладают высокой противосудорожной активностью в диапазоне доз 5-100 мг/кг при внутрибрюшинном введении по ряду тестов, представленных в примерах.
Схема синтеза
При реакции оксима (2) с диалкиламиноалкилхлоридами в присутствии гидрида натрия в ДМФА получают основания I а-в в виде масел, выход количественный. Основания растворяют в спирте, добавляют сухую щавелевую кислоту и выделяют оксалаты O-(2-диалкиламиноалкил)оксимов 4-бензоилпиридина (1а-в), а при кипячении 2 с хлорангидридами соответствующих кислот в присутствии триэтиламина в бензоле получаются O-(R-бензоил)оксимы 4-бензоилпиридина (1г-ж).
Экспериментальная часть химического синтеза
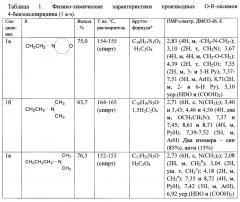
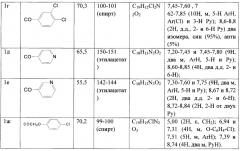
ПМР-спектры сняты на приборе Bruker АС-250, внутренний стандарт ТМС. Данные элементных анализов производных оксимов 4-бензоилпиридина (1а-ж) соответствуют брутто-формулам. Физико-химические свойства представлены в таблице 1.
Пример 1
O-2-морфолиноэтилоксим 4-бензоилпиридина, оксалат (1а).
К 0,90 г (0,022 моль) NaH в 7 мл сухого ДМФА прикапывают раствор 2,24 г (0,011 моль) оксима 4-бензоилпиридина (2) (J. Pharm. Sci., 1965, V. 54, P. 393) в 20 мл ДМФА при охлаждении водой (10-15°C), перемешивают 1 ч, добавляют 2,56 г (0,017 моль) хлорэтилморфолина (основания, полученного из 3,5 г хлоргидрата амина), перемешивают 2 ч при комнатной температуре, добавляют 220 мл воды, экстрагируют 3 раза этилацетатом (по 40 мл), сушат над MgSO4, упаривают, остаток (количественный выход, в виде масла) растворяют в 5 мл спирта, добавляют 0,9 г щавелевой кислоты в 2 мл спирта, полученный осадок отфильтровывают, получая 3 г соединения 1а.
Соединения 1б,в получены аналогично (J. A. van Zorge, US Patent 4297359, 1981). Данные о соединениях 1а-в приведены в табл. 1.
Пример 2
O-(3,4-дихлорбензоил)оксим 4-бензоилпиридина (1г).
Смесь 0,99 г (0,005 моль) оксима 4-бензоилпиридина (2), 1,26 г (0,006 моль) хлорангидрида 3,4-дихлорбензойной кислоты и 0,60 г (0,006 моль) сухого триэтиламина в 10 мл сухого бензола кипятят 2 ч, оставляют на сутки, обрабатывают водой (осадок растворяется), бензольный раствор промывают насыщенным раствором NaHCO3, затем водой, сушат над MgSO4, упаривают, масло затирают под петролейным эфиром. Выход 1,70 г (91,9%), кристаллизуют из спирта. Выход 1,30 г.
Соединения 1д-з получены аналогично. Данные о соединениях 1г-з приведены в таблице 1.
* Соединения 1а-в получены в виде оксалатов, а 1г-ж - в виде оснований.
Фармакологическая часть.
Экспериментальных животных получали из питомника «Столбовая» ГУ НЦБМТ (Московская область). Содержание животных соответствовало правилам лабораторной практики (GLP) и нормативным документам «Санитарные правила по устройству, оборудованию и содержанию вивариев», утвержденным Главным Государственным санитарным врачом 06.04.1973 г. №1045-73 и Приказом МЗ и социального развития РФ от 23 августа 2010 г. №708н «Об утверждении Правил лабораторной практики».
Пример 3
Противосудорожное действие производных диалкиламиноалкиловых эфиров оксимов 4-бензоилпиридина на модели первично-генерализованных судорог, вызванных максимальным электрошоком.
Эксперименты проводили на белых беспородных мышах-самцах, массой 20-26 г. Каждая доза соединения исследовалась на 8-10 животных. Методика максимального электрошока (МЭШ) моделирует первично-генерализованные судороги - так называемые «большие» (Grant mal) судорожные припадки и является базисным тестом при оценке действия веществ с противосудорожной активностью (Воронина Т.А., Неробкова Л.Н. Методические указания по изучению противосудорожной активности фармакологических веществ. «Руководство по проведению доклинических исследований лекарственных средств» Часть. 1. ФГБУ «НЦЭМСП». Москва, Изд-во Гриф и К, 2012, Глава 14, с. 235-250; Loscher et al., The role of technical, biological and pharmacological factors in the laboratory evaluation of anticonvulsant drugs. II. Maximal electroshock seizure models, Epilepsy Res., 1991, v. 8, p. 79-94; Swinyard E.A.- Laboratory evaluation of antiepileptic drugs. Reviewof laboratory methods, Epilepsia, 1969, v. 10, pp. 107-119).
Максимальный электросудорожный припадок (МЭШ) создавали с использованием сертифицированной установки «Rodent Shocker RS», type 221 (Harvard Apparatus, GmbH, Германия). Животные получали через специальные корнеальные электроды электрические стимулы (режим 500/300 V/mA : 144 mA, длительностью 0,3 с.). Регистрировали следующие показатели: тоническую экстензию задних и передних конечностей, а затем, клонические судороги и гибель животных. Противосудорожный эффект заявляемых соединений оценивали по способности предупреждать развитие тонической экстензии и гибель животных Соединения вводили внутрибрюшинно за 40 минут до проведения МЭШ. Для определения ЭД50 (эффективной дозы вещества, оказывающей противосудорожный эффект у 50% животных) использовался метод пробит-анализа (метод Финни) с помощью программного пакета StatplusV5 рассчитывали ЭД16, ЭД50, ЭД84 - дозы, при введении которых противосудорожный эффект наблюдался соответственно у 16%, 50% и 84% животных.
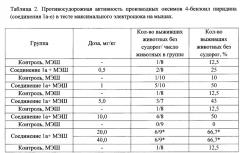
Установлено, что проведение МЭШ вызывало тоническую экстензию и гибель 88-100% мышей. Соединение 1а в диапазоне доз от 0,5 до 10,0 мг/кг уменьшало (на уровне тенденции) число животных с тонической экстензией и увеличивало количество выживших животных по сравнению с контролем. Соединение 1а в дозах от 20,0 до 150,0 мг/кг статистически достоверно уменьшало число животных с тонической экстензией и увеличивало количество выживших животных по сравнению с контролем. Так, в дозе 20 мг/кг устранение судорог и увеличение выживаемости наблюдалось у 67% животных, а в дозах 60,0; 80,0; 100,0 и 150 мг/кг - у 100% мышей (Таблица 2).
Соединение 1б в дозах от 25,0 до 100,0 мг/кг не оказывало выраженного действия на судороги мышей, вызванные МЭШ. Только в дозе 50,0 мг/кг выживаемость мышей, получивших соединение 1б, повысилась до 33,3% относительно 100% гибели животных контрольной группы (Таблица 2).
Соединение 1в в дозах 1,0 и 3,0 мг/кг не оказывало достоверного влияния на судороги и показатель выживаемости в тесте антагонизма с МЭШ, а в дозе 5,0 мг/кг под влиянием соединения 1в наблюдалась тенденция к увеличению показателя выживаемости по сравнению с контролем. Соединение 1в в дозе 20,0 мг/кг достоверно увеличивало показатель выживаемости по отношению к контролю на 62,5%, а в дозе 40,0 мг/кг - на 87.5% (Р≤0,05). При использовании соединения 1в в дозе 40,0 мг/кг судорожная картина характеризуется полным отсутствием стадии тонической экстензии с потерей рефлекса переворачивания у 50% животных (Таблица 2).
Соединение 1г изменяло кривую зависимости выживаемости от дозы и эти изменения носили куполообразный характер. Так, в дозе 5,0 мг/кг соединение 1г способствовало устранению тонической экстензии и выживаемости 25% мышей, а в дозе 20,0 мг/кг - 62,5%, тогда как с повышением дозы до 40,0 мг/кг эффективность соединения 1г снижалась до 50% по показателю выживаемость (Таблица 2). Соединение 1е во всех используемых дозах от 5,0 до 60,0 мг/кг уменьшало число животных с тонической экстензией и увеличивало количество выживших животных по сравнению с контролем. Максимальный противосудорожный эффект соединения 1е регистрировался в наибольшей дозе 60,0 мг/кг и составлял 100% выживаемость животных относительно 12,5% выживаемости контрольной группы (Таблица 2). Соединение 1д в диапазоне доз от 5,0 до 40,0 мг/кг не оказывало противосудорожного эффекта, что регистрировалось по отсутствию влияния на выживаемость мышей с генерализованными судорогами, вызванными МЭШ. (Таблица 2).
Примечание: * - значимость отличий от контрольной группы, при p≤0,05 (точный критерий Фишера).
Методом пробит-анализа установлено, что начальная действующая доза соединения 1а, при которой наблюдается предупреждение судорог и гибели 16% мышей (ЭD16), составляет 2 (0,2÷5,7) мг/кг, доза, при которой наблюдается предупреждение судорог и гибель 50% мышей (ЭD50) - 15 (5,2÷38,8) мг/кг и доза, при которой наблюдается предупреждение судорог и гибель у большинства (84%) мышей (ЭD84), составляет 107 (46,5÷471,0) мг/кг. Соединение 1в полностью предупреждает гибель крыс в тесте антагонизма с МЭШ в дозе 40 мг/кг. ЭD16 соединения 1в составляет 1,4(0,4÷2,7) мг/кг, ЭD50 - 7 (4,0÷42,5) мг/кг и ЭD84 - 37 (17,3÷485,1). Соединение 1 г предупреждает гибель 62,5% животных в дозе 20 мг/кг: ЭD16 составляет - 3,4 (1,7÷4,9) мг/кг, ЭD50 составляет - 13,9 (11,3÷48,9) мг/кг, ЭD84 составляет - 56,3 (34,3-458,1) мг/кг. Начальная действующая доза соединения 1е, при которой наблюдается предупреждение судорог и гибели 16% мышей (ЭD16), составляет 2,5 (0,8÷5,4) мг/кг, ЭD50 - 13,7 (5,8÷19,6) мг/кг и ЭD84 - 51,7 (30,0÷120,0).
Таким образом, производные диалкиламиноэтилового эфира оксимов 4-бензоил пиридина (соединения 1а, 1в, 1г и 1е) обладают выраженным противосудорожным действием в тесте МЭШ на мышах, предупреждая развитие судорог и гибель животных. Противосудорожный эффект соединения 1а развивается в диапазоне доз от 10,0 до 150,0 мг/кг, ЭD50 составляет - 15,0 (5,2÷38,8) мг/кг, а в диапазоне доз от 60,0 до 150,0 мг/кг соединение 1а полностью предотвращает развитие судорог и гибель всех (100%) животных. Противосудорожный эффект соединения 1в развивается в диапазоне доз от 5,0 до 40,0 мг/кг, ЭD50 составляет - 17,0 (4,0÷12,5) мг/кг, а в дозе 40,0 мг/кг соединение 1в полностью предотвращает развитие судорог и гибель всех (100%) животных. Противосудорожный эффект соединения 1 г развивается в диапазоне доз от 5,0 до 40,0 мг/кг, ЭD50 составляет - 13,9 (11,3÷18,9) мг/кг. Противосудорожный эффект соединения 1е развивается в диапазоне доз от 5,0 до 60,0 мг/кг, ЭD50 составляет - 13,7 (5,8÷19,6) мг/кг, а в дозе 60,0 мг/кг соединение 1е полностью предотвращает развитие судорог и гибель всех (100%) животных.
Пример 4
Противосудорожное действие производного морфолиноэтилового эфира оксима 4-бензоилпиридина (1а) на модели первично-генерализованных судорог, вызванных электрошоком малой интенсивности.
Эксперименты проводили на белых беспородных мышах-самцах, массой 20-26 г. Каждая доза соединения исследовалась на 8-10 животных. Животные через корнеальные электроды получали электрические стимулы меньшей интенсивности и продолжительности (режим 250/300 V/mA: 12 mA, длительность 0,2с) в сравнении с максимальным электрошоком. Использование электрошока малой интенсивности позволяет в динамике проследить развитие судорожного припадка. В балльной системе оценивали следующие показатели степени выраженности судорожного припадка: 1 балл - одиночное подергивание тела мыши; 2 балла - клонические судороги; 3 балла - тонико-экстензорные судороги; 4 балла - гибель животного. Подсчитывали суммарное количество баллов.
Исследуемое вещество вводили внутрибрюшинно за 40 минут до начала эксперимента. Установлено, что в контроле количество выживших животных составило 60-70%, а степень выраженности судорожного припадка 3-3,25 балла (Таблица 3). Соединение 1а в дозах 5,0 и 20,0 мг/кг увеличивало выживаемость животных и снижало выраженность судорожного припадка статистически недостоверно (Таблица 3). Вместе с тем, при увеличении дозы до 60,0 мг/кг соединение 1а снижало выраженность судорожных проявлений более чем в 3 раза (до 1 балла) относительно контрольных значений (3,0 балла) и полностью предупреждало гибель животных. Картина судорог при использовании соединения 1а в дозе 60 мг/кг характеризовалась отсутствием стадий клонических судорог и тонической экстензии у 90% животных (Таблица 3).
Таким образом, соединение 1а в дозе 60,0 мг/кг обладает выраженным противосудорожным действием, предупреждая как развитие тонической экстензии, так и клонических судорог, вызванных электрошоком малой интенсивности и защищая 100% животных от гибели.
Пример 5
Противосудорожное действие производных диалкиламиноалкиловых эфиров оксимов 4-бензоилпиридина на модели первично-генерализованных судорог, вызванных коразолом.
Эксперименты проводили на белых беспородных мышах-самцах, массой 20-26 г. Каждая доза соединения исследовалась на 8-10 животных. Тест антагонизма с коразолом (пентилентетразол, Sigma-Aldrich, США) - антагонистом ГАМК-А рецепторов, также, как и тест максимального электрошока, является базисной методикой при оценке действия веществ с противосудорожной активностью (Воронина Т.А., Неробкова Л.Н. Методические указания по изучению противосудорожной активности фармакологических веществ. «Руководство по проведению доклинических исследований лекарственных средств». Часть. 1. ФГБУ «НЦЭМСП». Москва, Изд-во Гриф и К, 2012, Глава 14, с. 235-250; Loscher et al, The role of technical, biological and pharmacological factors in the laboratory evaluation of anticonvulsant drugs. III. Pentylenetetrazol seizure models. Epilepsy Res., 1991, v. 8, p. 171-189). В этой методике судороги вызываются химическим воздействием и моделируют первично-генерализованные судороги при так называемых «малых» (Petit mal) судорожных припадках.
Опытным группам внутрибрюшинно вводили соединение 1а, растворенное в физиологическом растворе в дозах 1,0 и 50,0 мг/кг за 40 минут до коразола. Контрольным животным внутрибрюшинно вводили физиологический раствор в эквивалентном объеме. Для получения судорожного припадка животным подкожно в область шейного отдела спины вводился коразол в дозе 95,0 мг/кг, вызывающей судороги у 97% мышей. Животные наблюдались в течение 30-60 мин после инъекции коразола. Регистрировали: латентный период первого генерализованного приступа с потерей рефлекса переворачивания (ЛП), время гибели и число погибших животных.
Установлено, что у контрольных животных после введения коразола в дозе 95,0 мг/кг судорожные проявления развивались в следующей последовательности.
1. Одно или более миоклонических подергиваний всего тела - 100% мышей. 2. Повторяющиеся клонические судороги передних и/или задних конечностей длительностью более чем 3 секунды без потери рефлекса переворачивания - 100% мышей. 3. Генерализованные клонические судороги передних и задних конечностей с утратой рефлекса переворачивания - 90% мышей. 4. Гибель животных - 80-100% мышей.
Установлено, что соединение 1а в дозах 20,0 и 60,0 мг/кг статистически достоверно увеличивает латентный период первого приступа (ЛП) на 148 и 59 секунд, соответственно, по сравнению с контрольной группой животных, но не предотвращает развитие вызванных коразолом судорог и гибель животных (Таблица 4). Соединение 1в в дозе 40,0 мг/кг статистически достоверно увеличивает латентный период первого приступа (ЛП) на 35 секунд по сравнению с контрольной группой животных, но не предотвращает вызванных коразолом судорог и гибель животных (Таблица 4). Соединение 1б в дозах от 12,5 до 50,0 мг/кг не оказывало воздействия на судорожные проявления, вызванные коразолом, и выживаемость мышей (Таблица 4). Соединение 1г среди изученных доз (5,0-40,0 мг/кг) оказывает противосудорожное действие в дозе 20,0 мг/кг, отодвигая время наступления гибели животных, спровоцированной коразолом, на 986,7 секунд (увеличение более чем в 2 раза) (Таблица 4). Противосудорожный эффект соединения 1д фиксировался во всех исследуемых дозах от 12,5 до 50,0 мг/кг и проявлялся в увеличении всех регистрируемых показателей относительно контрольных значений. В дозах 12,5 и 50,0 мг/кг соединение 1д увеличивало ЛП наступления судорог и общее время жизни животных в 5 и 4,5 раза соответственно дозам, что повысило количество выживших мышей на 44,7 и 33,5%. В три раза увеличивалось общее время жизни животных, получивших соединение 1д в дозе 25,0 мг/кг, но количество выживших оставалось на уровне контроля (Таблица 4).
* - достоверность отличий от группы контроля, при Р≤0.05 (критерий Стьюдента).
Таким образом, соединение 1а в дозах 20,0 и 60,0 мг/кг и соединение 1в в дозе 40,0 мг/кг статистически достоверно увеличивают латентный период возникновения первого судорожного приступа, но не предотвращают развитие вызванных коразолом судорог и гибель животных. Соединения 1г в дозе 20,0 мг/кг и 1д в дозах 12,5; 25,0 и 50,0 мг/кг увеличивают латентный период возникновения первого судорожного приступа и общее время жизни мышей. Вместе с тем, соединение 1д в дозах 12,5 и 50,0 мг/кг защищает от гибели животных, вызванной генерализованным приступом.
Пример 6
Противосудорожное действие производного морфолиноэтилового эфира оксима 4-бензоилпиридина (1а) на парциальные (фокальные) вторично-генерализованные судороги в хроническом эксперименте у крыс с хроническим кобальт-индуцированным эпилептогенным очагом.
Исследования выполнены на самцах аутбредных половозрелых белых крыс массой 220-250 г. Исследование проведено с использованием методики создания хронического эпилептогенного очага, вызванного аппликацией кобальта, которая моделирует парциальные (фокальные) и вторично-генерализованные судороги в хроническом эксперименте. Методика широко используется для изучения механизмов действия противосудорожных веществ в России и за рубежом (Авакян Т.Н., Неробкова Л.Н., Воронина Т. А., Маркина Н.В. Митрофанов А.А. Влияние карбамазепина на структурно-функциональные связи в развитии эпилептической системы // Экспериментальная и клиническая фармакология, 2002, №2, с. 7-10; Bregman, F. Le Saux, S. Trottier 1, P. Chauvel 1, and Y. Maurin. Chronic Cobalt-induced Epilepsy: Noradrenaline Ionophoresis and Adrenoceptor Binding Studies in the Rat Cerebral Cortex. J. Neural Transmission, 1985, v. 63, p.109-118) и рекомендована «Руководством по проведению доклинических исследований лекарственных средств, ФБГУ «НЦЭСМП» Минздравсоцразвития России» (Воронина Т.А., Неробкова Л.Н. Методические указания по изучению противосудорожной активности фармакологических веществ. «Руководство по проведению доклинических исследований лекарственных средств», М., изд ФБГУ «НЦЭСМП» Минздравсоцразвития России, 2012, часть 1, глава 14, с 235-250).
Операции по вживлению долгосрочных электродов в структуры мозга крыс (в двигательную зону коры левого и правого полушарий, дорзальный отдел гиппокампа, латеральные ядра гипоталамуса) осуществляли с помощью стереотаксического прибора по координатам атласа мозга крыс (Bures et al. 1960). Операции по вживлению электродов проводились под хлорал гидратным наркозом (300 мг/кг). Индифферентный электрод, используемый при монополярной записи, помещался в носовой кости черепа. Запись биоэлектрической активности производилась в условиях свободного передвижения животного по экспериментальной камере. Для того чтобы избежать артефактов от движения штырьков, использовались специальные пружинные контакты. Регистрация биопотенциалов мозга осуществлялась на 21-канальном нейрографе «Нейросенсор», работающем на базе IBM-PC 586 с установленными фильтрами на 32 Гц, с постоянной времени (0,03 с) и с записью цифровой компьютерной ЭЭГ для последующей обработки данных.
Эпилептогенный очаг создавался аппликацией порошка металлического кобальта на поверхность двигательной области коры левого полушария мозга крыс. С этой целью в кости черепа просверливалось трепанационное отверстие, в которое вводилась стеклянная канюля с порошком кобальта (диаметр канюли соответствовал диаметру отверстия и не превышал 1 мм). Канюля опускалась на поверхность коры (твердая мозговая оболочка предварительно вскрывалась тонкой инъекционной иглой). Аппликация кобальта на кору головного мозга крысы вызывает гиперактивность нейронов, локализованных в месте введения, что выражается в появлении эпилептиформных пароксизмальных разрядов на ЭЭГ. Формирующийся эпилептогенный очаг является началом развития динамической постоянно усложняющейся структурно-функциональной системы. Функциональная организация этой системы характеризуется наличием детерминантного и зависимого очагов; детерминантный очаг усиливает и синхронизирует активность других очагов, объединяя их в единый комплекс. В развитии эпилептической системы, вызванной аппликацией кобальта на сенсомоторную кору мозга, выделяют несколько стадий. Основными из них являются стадия формирования первичного и вторичного эпилептогенных очагов через 24-48 часов после операции, стадия генерализованной эпилептиформной активности (ЭпА) в различных структурах мозга со стабильным уровнем синхронизированных пароксизмальных разрядов на 5-6 день после аппликации кобальта (вторая стадия развития ЭпА).
У всех крыс эпилептогенный очаг локализовался в сенсомоторной области коры левого полушария по следующим координатам: 1 мм вперед от брегмы и 1 мм в сторону от сагиттального шва. Динамика ЭпА у крыс с кобальтовым эпилептогенным очагом изучалась на протяжении 7-8 суток после аппликации кобальта на сенсомоторную зону коры. Регистрацию ЭЭГ начинали через 48 часов после аппликации кобальта и проводили на 5-6 сутки (стадия генерализации ЭпА).
Соединение 1а вводили однократно (внутрибрюшинно) в дозе 60,0 мг/кг после фоновой записи. После введения вещества регистрация ЭЭГ проводилась в течение 120 минут. Регистрация фоновой ЭЭГ животных через 48 часов после операции (1-я стадия) выявила образование очагов эпилептической активности (ЭпА) во всех исследуемых структурах с наибольшим числом и продолжительностью разрядов в ипсилатеральной коре и гиппокампе. ЭпА характеризовалась единичными острыми высокоамплитудными волнами, пиками, а также синхронно возникающими пароксизмальными разрядами (Таблица 5).
Изучение влияния производного морфолиноэтилового эфира оксима 4-бензоилпиридина (соединение 1а) в дозе 60,0 мг/кг на эпилептиформную активность мозга крыс показало, что на 1-й стадии формирования эпилептической системы (через 48 часов после операции) через 30 минут после введения вещества число разрядов ЭпА (в среднем за минуту) статистически достоверно снижалось в электрокортикограммах ипси- и контрлатеральной коры, гиппокампа и гиппоталамуса. При этом наибольшая выраженность эффекта (по числу разрядов) определялась в ипсилатеральной коре и гипоталамусе, а также наблюдалось укорочение средней длительности разрядов в этих структурах (Таблица 5).
На 2-й стадии развития ЭпА (5-6 день) у контрольных (фон) крыс отмечалось затухание первичного очага, регистрируемое по уменьшению числа разрядов и их длительности в электрограммах ипсилатеральной коры и формирование вторичных очагов, регистрируемых по увеличению числа разрядов и их длительности в электрограммах контралатеральной коры, гиппокампа и гипоталамуса (Таблица 6).
Через 30 минут после введения соединения 1а в дозе 60,0 мг/кг отмечалось значительное и статистически достоверное уменьшение числа разрядов и их длительности во всех исследуемых структурах. Наиболее выраженный эффект выявлен в контрлатеральной коре, где наблюдали уменьшение числа разрядов в 5 раз и их длительности в 7,5 раза (Таблицы 6, 7).
Полученные данные свидетельствуют о том, что на модели кобальт-индуцированной эпилепсии у крыс производное диалкиламиноэтилового эфира оксима 4-бензоилпиридина - соединение 1а оказывает выраженное противосудорожное действие, достоверно уменьшая число судорожных разрядов и их длительность во всех структурах мозга как на первой, так и на второй стадиях формирования эпилептической системы. На первой стадии развития эпилептической системы наиболее заметное уменьшение числа судорожных разрядов и их длительности наблюдается в электрограммах ипсилатеральной коры и гипоталамуса - в 1,6 раз. Во 2-ю стадию развития эпилептической системы эффект соединения 1а был наиболее выражен в контрлатеральной коре и гипоталамусе, что регистрировалось по уменьшению разрядной активности в 5 раз и в 3,1 раз соответственно.
Таким образом, в условиях методики парциальной (фокальной) эпилепсии, моделирующей вторично-генерализованные судороги в хроническом эксперименте у крыс с хроническим кобальт-индуцированным эпилептогенным очагом, производное диалкиламиноэтилового эфира оксима 4-бензоилпиридина - соединение 1а в дозе 60,0 мг/кг оказывает выраженный противосудорожный эффект как на первичные, так и на вторичные эпилептические очаги в различных структурах мозга, статистически достоверно уменьшая как число судорожных разрядов, так и их длительность. На первой стадии развития эпилептической системы наибольший эффект соединения 1а выявляется в ипсилатеральной коре и гипоталамусе, а во вторую стадию генерализации ЭпА - в контрлатеральной коре и гипоталамусе.
Пример 7
Влияние производного морфолиноэтилового эфира оксима 4-бензоилпиридина (1а) на эпилептический статус, вызванный гомоцестеина тиалактоном у кобальт-индуцированных крыс.
Эксперименты проводили на белых беспородных крысах самцах массой 220-260 г. Согласно методике, описанной в Примере 4, создавали кобальт-индуцированный эпилептический очаг. На 7-8 день после аппликации кобальта крысам, со стойкими изменениями биэлектрической активности в структурах мозга, вводили гомоцистеина тиалактон (DL-homocysteinethiolactone, НСТ) в дозе 5,5 ммоль/кг, разводимого в 3,5 мл/кг физиологического раствора непосредственно перед использованием. Провокация эпилептического статуса осуществлялась по методике, описанной ранее (Воронина Т.А., Неробкова Л.Н. Методические указания по изучению противосудорожной активности фармакологических веществ. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. - М., 2005. - С. 277-294; Walton N.Y. et. al., Lamotrigine vs. Phenytoin for treatment of status epilepticus: comparison in an experimental model. EpilepsyRes., 1996, v. 24, pp. 19-28).
Фоновую биоэлектрическую активность мозга крыс регистрировали в течение 15 минут до и в течение 2 часов после введения нейротоксина. Для оценки способности веществ устранять развившийся эпилептический статус соединение 1а в дозе 60,0 мг/кг (внутрибрюшинно) вводили после развития электрографического статуса и эффект соединения регистрировали через 30 минут после его введения. Способность вещества устранять эпилептический статус оценивали по уменьшению проявлений развернутого эпилептического приступа в электрограммах различных структур мозга (ипси- и контрлатеральная кора, гиппокамп и гипоталамус) и по моторно-поведенческим показателям.
Установлено, что нейротоксин вызывал у 70% крыс развитие эпилептического статуса, который характеризовался стойкими и длительными клинико-поведенческими моторными проявлениями: подергиваниями мышц спины и обеих передних лап, запрокидыванием головы.
После введения нейротоксина у крыс наблюдается усиление пароксизмальной активности на ЭЭГ, которая нарастает до появления на ЭЭГ высокоамплитудного продолжительного (от 10 до 15 сек) разряда и появление вторично-генерализованных тонико-клонических судорог (ВГТКС): 4,1 ВГТКС в среднем на крысу. ВГТКС характеризуется ЭЭГ пароксизмальной активностью (у 100% крыс) и моторными проявлениями (у 70% крыс). ВГТКС завершается подергиваниями мышц спины и обеих передних лап, запрокидыванием головы, барабанным боем и гибелью животного. Отдельные фокальные подергивания наблюдались у 80% крыс, сложные моторные комплексные движения - у 60% крыс, барабанный бой у 40% крыс. По окончании приступов у 50% животных наблюдалось боковое положение, заканчивающееся гибелью животных (Таблица 9). Таким образом, клинико-поведенческие моторные проявления эпилептического статуса сопровождались появлением характерных паттернов судорожной активности в электрограммах коры, гиппокампа и гипоталамуса.
Соединение 1а в дозе 60,0 мг/кг полностью устраняло ЭЭГ и поведенческие моторные проявления (подергивание мышц спины и обеих передних лап, запрокидывание головы и вторично-генерализованные тонико-клонические судороги (ВГТКС) (Таблица 8). Изчезновение ВГТКС сопровождалось восстановлением биоэлектрической активности в электрограммах коры, гиппокампа и гипоталамуса.
Соединение 1а в дозе 60,0 мг/кг вызывало уменьшение числа животных с фокальными моторными приступами до 30% (в контроле 80%) и полностью (до 0%) устраняло сложные моторные комплексные движения, барабанный бой и боковое положение, а также защищало от гибели 100% животных (Таблица 9).
Таким образом, производное диалкиламиноэтилового эфира оксима 4-бензоилпиридина - соединение 1а в дозе 60,0 мг/кг полностью у 100% животных устраняет электрографические и поведенческие проявления эпилептического статуса, вызванного нейротоксином гомоцистеина тиолактоном у кобальт-индуцированных крыс.
Пример 8
Противогипоксическое действие производных диалкиламиноалкиловых эфиров оксима 4-бензоилпиридина на модели нормобарической гипоксии с гиперкапнией в гермообъеме («баночной» гипоксии)
В опыте были использованы беспородные мыши - самцы, массой 22-24 г. Исследование противогипоксических свойств осуществляли в условиях нормобарической гипоксии с гиперкапнией - модель «баночной» гипоксии. Эксперименты проводили согласно методическим рекомендациям по исследованию лекарственных средств с ноотропным типом действия (Т.А. Воронина, Р.У. Островская, Т.Л. Гарибова. Руководство по проведению доклинических исследований лекарственных средств. Издание: ФГБУ «НЦЭМСП» Минздравсоцразвития России // Москва 2012. Часть 1. Глава 17. С. - 285).
Животных одинакового веса (разброс не более 2-х г на группу) помещали поодиночке в герметически закрываемые банки объемом 200 см3 и регистрировали время жизни до агонального вздоха.
Соединения 1a и 1в вводили однократно, внутрибрюшинно и регистрацию эффектов осуществляли через 40 минут после введения.
При изучении соединения 1а в дозах 20,0 и 60,0 мг/кг на модели гипоксии с гиперкапнией установлено статистически значимое увеличение продолжительности жизни на 172 и 449 секунд соответственно относительно контрольных значений (Таблица 10).
Соединение 1в в дозе 40,0 мг/кг вызывает увеличение средней продолжительности жизни мышей - на 212 секунд по сравнению с контролем в условиях нормобарической гипоксии с гиперкапнией в гермообъеме (Таблица 10).
Таким образом, производные диалкиламиноэтилового эфира оксима 4-бензоилпиридина (соединения 1а и 1в) оказывают отчетливое противогипоксическое действие на модели гипоксии с гиперкапнией в гермообъеме, что выражается в статистически достоверном увеличении продолжительности жизни животных в условиях гипоксии.
Пример 9
Изучение возможных побочных эффектов (неврологического дефицита) производных диалкиламиноалкиловых эфиров оксимов 4-бензоилпиридина.
Эксперименты проводили на белых аутбредных крысах самцах массой 220-260 г и аутбредных мышах-самцах массой 20-22 г. Исследование проводили согласно «Руководству по проведению доклинических исследований лекарственных средств. Издание: ФГБУ «НЦЭМСП» Минздравсоцразвития России. Москва 2012. Часть 1. Глава 13. С - 224). Изучение способности веществ вызывать неврологический дефицит в тестах нарушения координации движений, в тестах вращающегося стержня и подтягивания на горизонтальной перекладине. Для оценки нарушения координации движений и миорелаксации у животных использовали сертифицированную установку вращающегося стержня (Rota Rod фирма "Ugo Basile", Италия). На горизонтальный стержень диаметром 3 см, вращающийся со скоростью 10 об/мин, помещали мышей. Подсчитывали число падений со стержня. В тесте подтягивания на горизонтальной перекладине мышей подвешивали передними конечностями за проволоку (диаметр 0,4 см), натянутую на высоте 20-30 см от поверхности стола. Неспособность животных подтянуть задние конечности на проволоку регистрировали как проявление неврологического дефицита.
Соединения 1а и 1в вводили однократно, внутрибрюшинно и регистрацию эффектов осуществляли через 40 минут после введения.
Установлено, что соединение 1а в диапазоне доз от 0,5 до 150,0 мг/кг не вызывает повышения возбудимости, тремора, судорожных проявл