Способ анализа полиморфных маркеров в генах метаболизма лекарственных препаратов и генах иммунного ответа при терапии острых лейкозов у детей
Иллюстрации
Показать всеПредложенная группа изобретений относится к области медицины. Предложены способ и набор олигонуклеотидных зондов для определения полиморфных маркеров в генах метаболизма лекарственных препаратов и генах иммунного ответа. Предложенная группа изобретений позволяет определять терминальные мутации в генах, участвующих в метаболизме основных лекарственных препаратов при терапии острых лейкозов у детей, и генах иммунного ответа. 2 н. и 2 з.п. ф-лы, 2 ил., 3 табл., 4 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области генетики, молекулярной биологии и медицины и касается способа определения фармако- и иммуногенетического профилей у детей с острыми лейкозами посредством анализа маркеров в генах метаболизма лекарственных препаратов и генах иммунного ответа с использованием полимеразной цепной реакции (ПЦР) и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом).
Уровень техники
В настоящее время существует ряд методов анализа полиморфных маркеров в генах метаболизма лекарственных препаратов и генах иммунного ответа. Спектр анализируемых маркеров существенно варьирует.
Наиболее распространенным методом определения полиморфизма генов является ПЦР с различными вариациями. Сущность метода заключается в многократном избирательном увеличении определенного участка нуклеиновой кислоты. Существует большое количество методов обнаружения генных мутаций, основанных на ПЦР.
Аллель-специфичная ПЦР с последующим гель-электрофорезом.
При постановке ПЦР на каждую анализируемую мутацию ставится две параллельные ПЦР. В одной ПЦР-смеси содержится аллель-специфичный праймер, который на 3'-конце комплементарен последовательности дикого типа, в другой - праймер, комплементарный мутантной последовательности гена. После проведения ПЦР продукты амплификации визуализируются в агарозном геле и делается вывод о генотипе анализируемого образца. К достоинствам данного метода относится невысокая стоимость расходных материалов и отсутствие необходимости в высокой квалификации персонала. Недостатком данного метода является постановка большого количества параллельных реакций по количеству анализируемых однонуклеотидных замен и разделение их с помощью гель-электрофореза, что существенно снижает ценность метода в клинической диагностике [Orita М., Iwahana Н., Kanazawa Н., Sekya Т. Detection of polymorphism of human DNA by gel electrophoresis as single cell conformation polymorphism. Proc. Natl. Acad. Sci. 1989. 86: 2766-2770].
Аллель-специфичная ПЦР в реальном времени
В данном методе, как и в предыдущем, используются параллельные реакции с аллель-спеифичными праймерами. О наработке ПЦР продукта судят по возрастающему уровню флуоресценции в пробирке, которая регистрируется на каждом цикле ПЦР и выводится на экран. В качестве флуоресцентного красителя наиболее часто используется флуоресцентный краситель SYBRGreen, преимущественно связывающийся с двунитевой ДНК или дополнительные олигонуклеотидные пробы TaqMan, специфично взаимодействующие с мутантной последовательностью. Анализ кривых флуоресценции позволяет отличить специфическую амплификацию от неспецифической и, таким образом, сделать вывод о генотипе анализируемого образца [Giada V Zapparoli, Robert N Jorissen, Chelsee A Hewitt, Michelle McBean, David A Westerman, Alexander Dobrovic Quantitative threefold allele-specific PCR (QuanTAS-PCR) for highly sensitive JAK2 V617F mutant allele detection. BMC Cancer. 2013; 13: 206; Sai Huang, Hua Yang, Li Gao, Li-Ping Dou, Yuan-Yuan Xu, Nan Wang, Li-Li Wang, Li Yu Prognostic significance of detecting MLL-AF9 fusion gene expression in patients with acute myeloid leukemia by real-time fluorescence quantitative PCR./ // Zhongguo Shi Yan Xue Ye Xue Za Zhi. - 2013. - Vol.6. - P. 1435-1440; Dolz S, E, Fuster, Llop M, Cervera J, Such E, De Juan I, Palanca S, Murria R, Bolufer P, Luna I, I, M, M, Sanz MA. Novel real-time polymerase chain reaction assay for simultaneous detection of recurrent fusion genes in acute myeloid leukemia. J Mol Diagn. - 2013. - Vol. 5. - P. 678-686.9]. К недостаткам можно отнести высокую стоимость оборудования и необходимость использовать высококвалифицированный персонал ПЦР с последующим секвенированием по Сенгеру.
В настоящее время этот метод широко применяется в различных диагностических лабораториях. Этот метод является достаточно информативным и позволяет обнаруживать мутации de novo. [Carnt, NAW. Association of single nucleotide polymorphisms of interleukins-lbeta, -6, and-12B with contact lens keratitis susceptibility and severity / M.D. Hau, S. Garthwaite, L.L. Evans, V.E. Radford // Ophthalmology. -2012. - V. 119. - P. 1320-1327.] Однако он обладает и рядом существенных недостатков, так как требует постановки отдельной реакции амплификации на каждый анализируемый локус, причем необходимо использование дорогостоящего оборудования и высокая квалификация персонала.
Аллель-специфичный рестрикционный анализ
Данный метод основан на использовании ПЦР с последующим расщеплением продукта амплификации с помощью высокоселективной рестриктазы, сайт рестрикции которой локализован в месте мутации. Если мутация присутствует в последовательности, происходит расщепление фрагмента рестриктазой. Вывод о наличии мутации в образце делается на основе электрофоретического разделения продуктов рестрикции [ С. The methylenetetrahydrofolate reductase (MTHFR) 677 C>Т polymorphism increases the risk of developing chronic myeloid leukemia-a case-control study / M. Iancu, A.P. Trifa, I. Macarie, D. Dima, M. Dobreanu // Tumour Biol. - 2015. - V. 36. №4. - P. 3101-3107]. К недостаткам данного метода можно отнести его низкую аналитическую чувствительность и невозможность детектировать мутации de novo. Для каждой анализируемой мутации требуется постановка отдельной ПЦР и рестрикции. К достоинствам метода можно отнести то, что для использования данного метода не требуется персонал высокого уровня квалификации.
Различные варианты гибридизации с биочипами
В исследованиях природы рака для анализа свойств опухолевых клеток и классификации опухолей широкое применение нашли микрочипы. Чрезвычайно широко используются экспрессионные микрочипы, позволяющие анализировать изменения профилей генной экспрессии в опухолевых клетках [144. Sears С, Armstrong SA. Microarrays to identify new therapeutic strategies for cancer. Adv Cancer Res 2007. 96: 51-74].
SNP-микрочипы используют в исследованиях по онкологии для определения потери гетерозиготности LOH (lossofheterozigosity) и аллельного дисбаланса, что важно для идентификации генов-супрессоров опухоли.
Гелевые биочипы, которые давно и успешно разрабатываются в Лаборатории биологических микрочипов ИМБ РАН, являются примером диагностических микрочипов низкой плотности. Метод гибридизации с аллель-специфическими олигонуклеотидами включает амплификацию фрагментов ДНК и последующую гибридизацию флуоресцентно меченной ДНК мишени с аллель-специфичными олигонуклеотидами [145. Gel-based microarrays in clinical diagnostics in Russia.Gryadunov D, Dementieva E, Mikhailovich V, Nasedkina T, Rubina A, Savvateeva E, Fesenko E, Chudinov A, Zimenkov D, Kolchinsky A, Zasedatelev A.Expert Rev Mol Diagn. 2011 Nov; 11(8):839-53. doi: 10.1586/erm.11.73].
Анализ патентов выявил тест-системы для анализа полиморфных маркеров в генах метаболизма лекарственных препаратов и генах иммунного ответа.
Метод, описанный в патенте CN 105002275, опубликованном 2015-10-28, позволяет производить одновременный анализ генов MTHFR и MTRR с помощью ПЦР, в патенте CN 104789685, опубликованном 2015-10-28, мутации 16 генов.
В Российском патенте RU 2501020 от 2013-12-10 описан метод анализа MTHFR С677Т и А1298С, MTRR G66A ПЦР синтеза ДНК с последующей рестрикцией.
В патенте CN 101275161, опубликованном 2008-10-01, описан метод идентификации 28 SNP, основанный на ПЦР в реальном времени с использованием специфических праймеров и зондов. В патенте CN 101275160, опубликованном 2008-10-01, описан метод идентификации 48 SNP, а в CN 105256019, опубликованном 2016-01-20, только трех. Выполнение анализа производится в отдельных пробирках на один анализируемый образец, что является трудоемким для клинической диагностики, а также требует дорогостоящего оборудования.
Олигонуклеотидный чип, описанный в патенте IN4226DEN2014 от 2015-05-22, содержит олигонуклеотидные зонды, позволяет определять от 2 до 30 полиморфизмов. Метод обладает высокой чувствительностью, но для проведения анализа и интерпретации результатов требуется дорогостоящее оборудование.
В патенте, US 2005202483, опубликованном 2005-09-15, описан метод, основанный на базовой ПЦР, анализе сиквенса и электрофорезе, которые могут быть применены в комбинации или отдельно. Изобретение обеспечивает метод прогнозирования риска развития побочных реакций у пациентов, получающих 6-меркаптопурин. Однако диагностическая важность подтверждена лишь для гена ITPA.
В патенте CN 102676667, опубликованном 2012-09-19, описан метод пиро-секвенирования полиморфизма rs1142345 гена ТРМТ, который является высокоточным, однако диагностическая важность подтверждена лишь для одного SNP, а трудности подготовки и интерпретации результатов являются существенным недостатком данной методики для применения в клинической практике.
Раскрытие изобретения
Задача настоящего изобретения состоит в создании способа экспресс-диагностики полиморфных маркеров в генах метаболизма лекарственных препаратов и генах иммунного ответа при терапии острых лейкозов у детей.
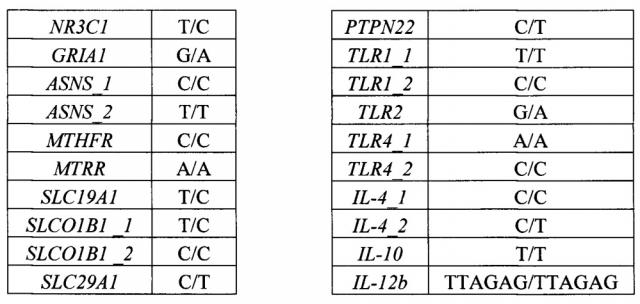
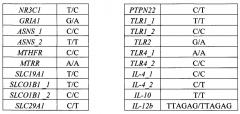
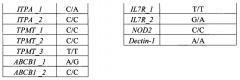
Сущность изобретения заключается в обеспечении способа определения терминальных мутаций в генах, участвующих в метаболизме основных лекарственных препаратов при терапии ОЛ (острых лейкозов), и генах иммунного ответа. Данный способ позволяет выявлять следующие полиморфизмы генов: NR3C1 rs56149945, GRIA1 rs4958351, ASNS rs10486009, rs6971012, MTHFR rs1801133, MTRR rs1801394, SLC19A1 rs1051266, SLCOIBI rs4149056, rs11045879, ITPA rs1127354, rs7270101, TPMT rs1800462, rs1800460, rs1142345, SLC29A1 rs324148, ABCB1 rs1045642, ABCB1 rs2032582, PTPN22 rs2476601, TLR1 rs4833095, rs5743618, TLR2 rs5743708, TLR4 rs4986790, rs4986791, IL-4 rs2243250, rs2070874, IL-10 rs1800896, IL-12b rs17860508, IL7R rs1494558, rs1494555, NOD2 rs2066844, Dectin-1 rs16910526.
Основными признаками данного изобретения являются ПЦР и последующая гибридизация на биочипе, содержащем набор иммобилизованных дифференцирующих олигонуклеотидных зондов.
Первый важный признак изобретения - специфические праймеры для амплификации участков генов, набор которых используется для получения флуоресцентно меченных продуктов в необходимом количестве для гибридизации на биочипе. Последовательности праймеров для проведения ПЦР приведены в табл. 1 и Перечне последовательностей (SEQ ID NO: 1-61).
Второй важный признак изобретения - биочип, содержащий набор иммобилизованных дифференцирующих олигонуклеотидных зондов, последовательности которых приведены в таблице 2 и Перечне последовательностей (SEQ ID NO: 62-124). Дифференцирующие олигонуклеотидные зонды иммобилизуются в ячейках гидрогелевого микрочипа, как описано в патенте RU 2206575 (дата публикации 2003-06-20) в концентрации 2000 мкМ. Схема расположения зондов в ячейках биочипа для анализа полиморфизмов генов NR3C1, GRIA1, ASNS, MTHFR, MTRR, SLC19A1, SLCOIBI, SLC29A1, ITPA, TPMT, ABCB1, PTPN22, TLR1, TLR2, TLR4, IL-4, IL-10, IL-12b, IL7R, NOD2, Dectin-1 приведена на Фиг. 1.
Набор праймеров для ПЦР используется для проведения ПЦР для получения флюоресцентно-меченного продукта в один раунд для гибридизации на биочипе. На этапе ПЦР использовались специфические праймеры со специальной вставкой, комплементарные участкам интересующих генов, за счет чего нарабатывался только продукт, соответствующий гену, а также универсальный праймер для наработки одноцепочечной ДНК с одновременным введением флуоресцентной метки. Далее проводится гибридизация флуоресцентно меченных фрагментов ДНК, полученных после проведения ПЦР, с иммобилизованными в ячейках геля олигонуклеотидными зондами, расположенными на пластиковой подложке. После проведения гибридизации и отмывки биочипа проводится анализ полученной флуоресцентной картины, на основании которого делается отчет о генотипе исследуемого образца. Пример картины гибридизации приведен на Фиг. 2.
Краткое описание чертежей
Фигура 1. Схема расположения зондов в ячейках биочипа для анализа полиморфных маркеров в генах метаболизма лекарственных препаратов и генах иммунного ответа при терапии острых лейкозов у детей, (а) локализация ячеек на биочипе; (б) расшифровка условных обозначений. В угловых позициях нанесены ячейки (М), содержащие флуоресцентный краситель Су5, светящийся перманентно, для ориентировки и контроля интенсивности свечения.
Фигура 2. Гибридизационная картина, полученная с помощью биочипа для анализа полиморфных маркеров в генах метаболизма лекарственных препаратов и генах иммунного ответа при терапии острых лейкозов у детей (у пациента №1).
Осуществление изобретения
Для обеспечения оптимальных условий проведения ПЦР необходимо использовать специфические праймеры, отжиг которых на мишени происходит при одинаковой температуре (для одного этапа), и они не образуют при этой температуре вторичных структур. Для оптимальной наработки необходимого для гибридизации на биочипе количества флюоресцентно-меченого ПЦР-продукта должны быть подобраны такие параметры как концентрации реагентов и температурный режим реакций. В результате проведенной работы подобраны праймеры для проведения ПЦР, которые позволяют осуществлять эффективную наработку фрагмента, соответствующего участка гена.
Олигонуклеотиды для иммобилизации на биочипе подбираются таким образом, чтобы идентифицировать все выбранные для анализа участки последовательности генов.
Олигонуклеотидные зонды должны быть подобраны в соответствии со следующими критериями:
1) Олигонуклеотидный зонд должен обладать высокой специфичностью к анализируемому локусу.
2) Предпочтительно расположение вариабельного нуклеотида в серединной области зонда, так как такая конструкция зонда позволяет добиться лучшей дискриминации между совершенными и несовершенными дуплексами.
3) Олигонуклеотидный зонд не должны образовывать стабильных вторичных структур в условиях, при которых проводится гибридизация, наличие которых может приводить к снижению эффективности гибридизации.
На биочипе для определения полиморфных маркеров в генах метаболизма лекарственных препаратов и генах иммунного ответа при терапии острых лейкозов иммобилизовано 63 высокоспецифичных дифференцирующих олигонуклеотидных зонда (таблица 2 и Перечень последовательностей (SEQ ID NO: 62-124)), структура которых обеспечивает специфичное связывание с полностью комплементарными ДНК-мишенями. Зонды подобраны таким образом, что яркий флюоресцентный сигнал наблюдается только в ячейках, в которых образовался совершенный дуплекс между олигонуклеотидным зондом и флюоресцентно-меченным ПЦР-продуктом.
Приведем последовательность анализа с использованием данного метода. Амплификация ПЦР-продуктов для последующей гибридизации на биочипе проводится посредством «гнездовой» ПЦР в один этап, при этом в качестве матрицы для проведения реакции используют образец ДНК пациентов.
ПЦР может быть проведена с использованием любого вида термостабильной полимеразы (Taq-полимераза, Tth-полимераза, Tf1-полимераза, Pfu-полимераза, Vent-полимераза, DeepVent-полимераза и другие коммерчески доступные ферменты, выделенные из термофилов), работающей в соответствующем буфере. Для построения новой цепи в буфер добавляется смесь дНТФ (дАТФ, дГТФ, дЦТФ, дТТФ). Для проведения ПЦР могут быть использованы готовые коммерчески доступные наборы, например, фирмы Qiagen, содержащие все необходимые компоненты за исключением праймеров.
Реакционная смесь содержит локус-специфичные праймеры с температурой отжига не менее 65°С. Все обратные праймеры имеют короткую универсальную вставку по 5'-концу. Также, в реакционную смесь добавлен универсальный праймер, имеющий последовательность, идентичную универсальной вставке и температуру отжига не более 56°С. В ходе первой стадии происходит классическая симметричная ПЦР при температуре отжига не менее 65°С. При этом универсальный праймер в реакции на участвует. После первой стадии температура отжига понижается до 56°С и наравне с локус-специфичными праймерами в реакцию вступает универсальный. В ходе этой второй стадии происходит амплификация преимущественно ssDNA. Для флуоресцентного мечения ПЦР-продукта используется дУТФ-Су5, который способен включаться в растущую цепь ДНК. В качестве флуоресцентной метки также может быть использован любой флуорохром без ограничения (например, FITC, Texas red, Су-3 и т.д.), а также биотин.
Синтез праймеров и олигонуклеотидных зондов осуществляется с помощью таких химических подходов как фосфодиэфирный метод, гидрофосфорильный метод и т.д. Для синтеза праймеров используются автоматические ДНК/РНК синтезаторы, например, производства фирмы «Applied Biosystems» (США). Для иммобилизации в гидрогелевых ячейках биочипа, к 5'- или 3'-концу олигонуклеотидных зондов добавляется активная группа (например на 3'-конец может быть добавлена свободная аминогруппа с помощью 3'-Amino-Modifier С7 CPG 500, «Glen Research)), США).
Для проведения ПЦР используют праймеры SEQ ID NO: 1-61, приведенные в Перечне последовательностей в таблице 1.
Далее проводится гибридизация флуоресцентно меченных фрагментов ДНК, полученных после проведения ПЦР, с иммобилизованными в ячейках геля олигонуклеотидами, которые представляют собой участки целевых последовательностей генов, продукты которых участвуют в метаболизме лекарственных препаратов, и генов иммунного ответа, и являются комплементарными последовательностям «дикого типа» или последовательностям содержащим мутации.
Гибридизация ПЦР-продукта с олигонуклеотидными зондами на биочипе может быть проведена в любом гибридизационном буфере, например, в SSPE-буфере или гуанидиновом. Перед постановкой гибридизации ПЦР-продукт прогревают при 95°С в течение 5 минут, затем охлаждают на льду в течение 2 минут, после чего наносят гибридизационную смесь на биочип. Гибридизация проводится 12-14 ч при 37°С. Отмывка биочипа после проведения гибридизации может быть проведена в любом известном в данной области техники буфере с добавлением соли (SSC, SSPE и т.п.) или более короткое время в дистиллированной воде [Molecular cloning: a laboratory manual / J.F. Sambrook, D.W. Russell // Cold Spring Harbor Laboratory Press. - 2001].
Анализируемый фрагмент ДНК в условиях (состав реакции и температура), при которых осуществляется гибридизация, образует совершенные дуплексы только с полностью комплементарными ему олигонуклеотидными зондами. Сигнал флюоресценции детектируется только в ячейках, в которых образовался совершенный дуплекс. В случае, если дуплекс несовершенный (присутствует хотя бы одно не спаренное основание), то сигнал флюоресценции отсутствует.
После проведения гибридизации следует стадия отмывки биочипа в буфере (например, SSPE-буфере) или дистиллированной воде. Далее проводится визуализация результатов гибридизации с помощью любой детектирующей системы, способной возбуждать флюоресценцию и распознавать флуоресцентный сигнал (например, портативный анализатор биочипов, снабженный ПЗС-камерой и специальным программным обеспечением, производства ООО «БИОЧИП-ИМБ» (Москва, Россия)).
Изготовление биочипов может осуществляться посредством последовательного нанесения на поверхность подложки из стекла ячеек акриламидного геля, активации ячеек и иммобилизации в ячейках модифицированных олигонуклеотидов [Analysis of SNPs and other genomic variations using gel-based chips /A. Kolchinsky, A. Mirzabekov //Hum Mutat. - 2002. Vol. 19. - P. 343-360. Review]. В качестве подложки кроме стекла может быть использован другой материал, в том числе металл, гибкие мембраны и пластик (Патент RU2309959, опубликован 2007-11-10). Биочипы также могут быть изготовлены любыми другими известными способами [Arrays of immobilized oligonucleotides--contributions to nucleic acids technology / H. Seliger, M. Hinz, E. Happ // Curr Pharm Biotechnol- 2003. - Vol.4. - P. 379-395].
Для изготовления биочипа в настоящем изобретении используется набор олигонуклеотидов SEQ ID NO: 62-124, приведенный в Перечне последовательностей, а также в таблице 2. Расположение конкретных олигонуклеотидных зондов на биочипе может варьироваться в зависимости от удобства интерпретации результатов.
Далее приведены примеры, иллюстрирующие возможности применения способа анализа полиморфных маркеров в генах метаболизма лекарственных препаратов и генах иммунного ответа при терапии острых лейкозов у детей. Варианты и модификации осуществления изобретения, которые могут быть осуществлены, не отходя от общей концепции настоящего изобретения и без привлечения собственной изобретательской деятельности, также будут входить в объем притязаний настоящего изобретения.
Пример 1. Амплификация участков генов метаболизма лекарственных препаратов и генов иммунного ответа с целью получения флуоресцентно меченного ПЦР-продукта в необходимом количестве.
Из крови пациента больного ОЛ выделяли ДНК с помощью набора QIAamp DNA Blood Mini Kit (Qiagen, США).
Наработку участков анализируемых генов проводили методом «ПЦР на приборе Т100 («Bio-Rad», США). ПЦР-смесь общим объемом 25 мкл включала в себя: 2.5 ед. акт.HotTaq-полимеразы («Силекс», Россия), ПЦР-буфер (70 мМ Трис-НСl (рН 8.3), 16.6 мМ (NH4), 2.5 мМ MgCl2, 200 мкМ каждого из дНТФ («Силекс», Россия), 8 мкМ флуоресцентно меченного дУТФ-Су5 для флуоресцентного мечения ПЦР-продукта, по 2 пмоль каждого праймера (SEQ ID NO: 2-61), 50 пмоль универсального праймера-адаптера (SEQ ID NO: 1), 1 мкл ДНК. Амплификацию проводили по следующей схеме: денатурация при 95°С (5 мин); далее 45 циклов: 95°С (30 с), 65°С (20 с), 67°С (20 с), 69°С (20 с), 72°С (10 с); затем 30 циклов: 95°С (20 с), 55°С (30 с), 72°С (20 с).
Пример 2. Олигонуклеотидный биочип для анализа полиморфных маркеров в генах метаболизма лекарственных препаратов и генах иммунного ответа при терапии острых лейкозов.
Олигонуклеотиды для иммобилизации на микрочипе синтезируют на автоматическом синтезаторе 394 DNA/RNA Synthesizer («Applied Biosystems», США) с использованием стандартной фосфоамидитной процедуры. 3'-конец олигонуклеотидов содержит спейсер со свободной аминогруппой, который вводят в состав олигонуклеотида при синтезе путем использования 3'-Amino-Modifier С7 CPG 500 («Glen Research)), США). Присоединение флуоресцентной метки к олигонуклеотидам по свободной аминогруппе осуществляют в соответствии с рекомендациями производителя.
Биочип изготовляют методом сополимеризации олигонуклеотида в акриламидном геле (патент RU 2309959, опубликованный 2007-11-10 и RU 2175972, опубликованный 2001-11-20). Биочип содержит 63 иммобилизованных олигонуклеотидных зонда (SEQ ID NO: 62-124), список которых представлен также в таблице 2. Ячейки наносят согласно схеме на Фиг. 1.
Пример 3. Гибридизация меченного продукта на биочипе
Реакционную смесь, полученную после проведения ПЦР, описанного в Примере 1, используют для гибридизации на биочипе. Гибридизационная смесь общим объемом 40 мкл состояла из 20 × SSPE («Promega», США), формамида и амплификата. Гибридизационную смесь денатурировали при 95°С 5 минут, охлаждали во льду 2 минуты, наносили на биочип и оставляли на 12 часов при 37°С. После проведения гибридизации биочип отмывали в 1 × SSPE в течение 10 минут при комнатной температуре.
Пример 4. Регистрация и интерпретация результатов гибридизации
Регистрацию гибридизационной картины производят с помощью портативного анализатора биочипов, снабженного ПЗС-камерой, производимого ООО «Биочип-ИМБ».
Определим генотип по гибридизационной картине, представленной на Фиг. 2.
Генотип образца:
1. Способ анализа полиморфных маркеров в генах метаболизма лекарственных препаратов и генах иммунного ответа при терапии острых лейкозов у детей, предусматривающий следующие стадии:
(а) - амплификация фрагментов генов метаболизма лекарственных препаратов и генов иммунного ответа с помощью «гнездовой» ПЦР, в которой в качестве матрицы для амплификации используется ДНК, выделенная из крови или другого биоматериала, полученного от пациента; при проведении ПЦР используется набор праймеров с последовательностями, представленными в SEQ ID NO: 1-61; в результате образуются преимущественно одноцепочечные флуоресцентно меченные ПЦР-продукты;
(б) - обеспечение биочипа для идентификации полиморфных маркеров в генах метаболизма лекарственных препаратов и генах иммунного ответа, содержащего набор олигонуклеотидных зондов с последовательностями, представленными в SEQ ID NO: 62-124;
(в) - гибридизация флуоресцентно меченного ПЦР-продукта, полученного на стадии (а), на биочипе, полученном на стадии (б);
(г) - регистрация и интерпретация результатов гибридизации на биочипе, проведенной на стадии (в).
2. Способ по п. 1, в котором регистрацию результатов гибридизации на стадии (г) проводят с помощью устройства, способного регистрировать и записывать сигналы флуоресценции, оснащенного программным обеспечением, позволяющим проводить автоматическую обработку интенсивности сигналов с последующей интерпретацией результатов.
3. Способ по п. 1, в котором для идентификации полиморфных маркеров в генах метаболизма лекарственных препаратов и генах иммунного ответа при терапии острых лейкозов у детей, амплифицированных с помощью набора праймеров, охарактеризованных в п. 1, используется биочип, представляющий собой подложку с набором иммобилизованных на ней олигонуклеотидных зондов с последовательностями, представленными в SEQ ID NO: 62-124.
4. Набор олигонуклеотидных зондов, используемый в способе по п. 1, применяемый для идентификации полиморфных маркеров в генах метаболизма лекарственных препаратов и генах иммунного ответа, причем зонды имеют последовательности, представленные в SEQ ID NO: 62-124.