Средство, проявляющее антитромботический эффект посредством блокирования рецепторов тромбоцитов гп iib-iiia (варианты)
Иллюстрации
Показать всеИзобретение относится к фармацевтической химии, фармакологии и медицине. Предложено применение 3-метил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1H-пурин-2,6(3H,7H)-диона гидрохлорида, или 1,3-диметил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1Н-пурин-2,6(3H,7H)-диона гидрохлорида, или 1-бутил-3-метил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1H-пурин-2,6(3H,7H)-диона гидрохлорида, или 1-бензил-3-метил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1H-пурин-2,6(3H,7H)-диона гидрохлорида в качестве средства, проявляющего антитромботический эффект посредством блокирования рецепторов тромбоцитов ГП IIb-IIIa. Технический результат состоит в получении биологически активного вещества, проявляющего антитромботический эффект посредством блокирования рецепторов тромбоцитов ГП IIb-IIIa. 2 табл.
Реферат
Предлагаемое изобретение относится к фармацевтической химии, фармакологии и медицине, может быть использовано для создания лекарственных препаратов антитромботического действия.
В качестве антиагрегационных средств, блокирующих тромбоцитарные рецепторы ГП IIb-IIIa, известны разрешенные к клиническому применению препараты L-цистеинамид, N6-(аминоиминометил)-N2-(3-меркапто-1-оксопропил)-L-лизилглицил-L-α-аспартил-L-триптофи-L-пропил-,циклический(1-6)-дисульфид («Интегрилин», Glaxo Operations UK Limited, Великобритания), N-(бутилсульфонил)-4-[4-(4-пиперидин)бутокси]-α-фенилаланина моногидрохлорид моногидрат (Тирофибан, «Аграстат», Correvio, Великобритания), F(ab')2 фрагменты мышиных моноклональных антител FRaMon против рецептора фибриногена тромбоцитов - ГП IIb-IIIa («Монафрам®», ЗАО «Фрамон», Россия) [Holmes L.E. A randomized trial assessing the impact of three different glycoprotein IIb/IIIa antagonists on glycoprotein IIb/IIIa platelet receptor inhibition and clinical endpoints in patients with acute coronary syndromes / L.E. Holmes, R. Gupta, S. Rajendran, J. Luu, J.K. French, C.P. Juergens // Cardiovasc. Ther. - 2016, N21. doi: 10.1111/1755-5922.12203].
В качестве прототипа взят «Аграстат»: N-(бутилсульфонил)-4-[4-(4-пиперидин)бутокси]-α-фенилаланина моногидрохлорид моногидрат, как единственный селективный непептидный синтетический блокатор рецепторов тромбоцитов ГП IIb-IIIa, применяемый в медицинской практике [King S. Glycoprotein IIb/IIIa inhibitors: The resurgence of tirofiban / S. King, M. Short, C. Harmon // Vascul. Pharmacol. - 2016. - Vol. 78. - P. 10-16].
Задачей изобретения является расширение арсенала биологически активных веществ, в том числе обладающих антитромботическим эффектом посредством блокирования рецепторов тромбоцитов ГП IIb-IIIa.
Технический результат - получение биологически активного вещества, проявляющего антитромботический эффект посредством блокирования рецепторов тромбоцитов ГП IIb-IIIa.
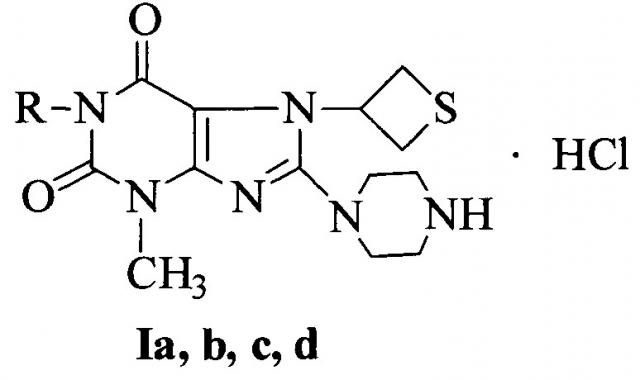
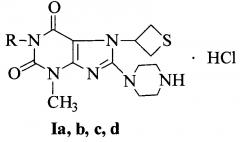
Сущность изобретения: Применение 3-метил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1H-пурин-2,6(3H,7H)-диона гидрохлорида (Ia), или 1,3-диметил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1H-пурин-2,6(3H,7H)-диона гидрохлорида (Ib), или 1-бутил-3-метил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1H-пурин-2,6(3H,7H)-диона гидрохлорида (Ic), или 1-бензил-3-метил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1H-пурин-2,6(3H,7H)-диона гидрохлорида (Id) общей формулы:
где R=Н (Ia), СН3 (Ib), С4Н9-н (Ic), СН2С6Н5 (Id),
в качестве средства, проявляющего антитромботический эффект посредством блокирования рецепторов тромбоцитов ГП IIb-IIIa.
Синтез соединений 3-метил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1H-пурин-2,6(3H,7H)-диона гидрохлорид и 1,3-диметил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1H-пурин-2,6(3H,7H)-диона гидрохлорид осуществляется по методике [Халиуллин Ф.А. Тиираны в синтезе биологически активных производных ксантина и бензимидазола: дис. … д-ра фарм. наук. - Уфа, 1998. - 428 с.], соединения 1-бензил-3-метил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1H-пурин-2,6(3H,7H)-диона гидрохлорид - по методике [Филипенко Ю.В. Синтез и биологическая активность новых N-1-замещенных 7-(тиетанил-3)ксантинов: дис. … канд. фарм. наук. - Уфа, 2006. - 183 с.], соединения 1-бутил-3-метил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1H-пурин-2,6(3H,7H)-диона гидрохлорид - по методике [Шарафутдинов P.M. Синтез и биологические свойства 8-замещенных 1-н-бутил-3-метилксантинов: дис. … канд. фарм. наук. - Уфа, 2012. - 154 с.].
Известно, что соединение 1-бутил-3-метил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1H-пурин-2,6(3H,7H)-диона гидрохлорид проявляет антиагрегационную и дезагрегационную активность в отношении тромбоцитов в условиях in vitro на донорской крови здоровых добровольцев [Шарафутдинов P.M. Синтез и биологические свойства 8-замещенных 1-н-бутил-3-метилксантинов: дис. … канд. фарм. наук. - Уфа, 2012. - 154 с.]. Однако прецедентов по констатации механизма его антитромботического эффекта и использованию данного соединения в качестве средства профилактики или лечения тромбоза, в т.ч. экспериментального, не было.
Оценка связывания с тромбоцитарными рецепторами ГП IIb-IIIa.
Эффект связывания заявленных соединений и аграстата с тромбоцитарными рецепторами ГП IIb-IIIa определяли методом проточной цитометрии на крови здоровых доноров-мужчин в возрасте 18-24 лет. Исследование было одобрено этическим комитетом ФБОУ ВО «Башкирский государственный медицинский университет» Минздрава России (№2 от 17.10.2012). Информированное согласие было получено у всех участников исследования до забора крови. Взятие крови проводили из локтевой вены в стерильных условиях с использованием систем вакуумного забора крови BD Vacutainer® (Dickinson and Company, США). В качестве стабилизатора венозной крови использовали 3,8% раствор цитрата натрия в соотношении 9:1. Для исключения влияния других форменных элементов крови вся исследовательская работа была проведена на образцах обогащенной тромбоцитами плазмы (PRP). Образцы богатой тромбоцитами плазмы получали центрифугированием цитратной крови при 100g в течение 10 минут. В работе использовалась центрифуга ОПН-3.02 (ОАО ТНК «ДАСТАН», Киргизия). Далее определяли эффект связывания с тромбоцитарными рецепторами ГП IIb-IIIa флюоресцентно-меченными антителами против CD61 и CD41a. Для этого вносили по 10 мкл PRP в пластиковые пробирки, разводили в 100 раз фосфатно-солевым буферным раствором (PBS). Образцы инкубировали 5 мин при комнатной температуре. После инкубации с исследуемым веществом и препаратами сравнения образцы PRP инкубировали 20 мин при комнатной температуре с моноклональными антителами CD41a, мечеными РЕ (фикоэритрином) и CD61, мечеными FITC (флюоресцеинизотиоционатом), (Becton Dickinson, США), согласно рекомендациям производителя. Цитофлюориметрический анализ проводили на приборе BD FACSCanto II (Becton Dickinson Immunocytometry Systems, США), используя программное обеспечение «FACSDiva». Параметры настройки прибора были одинаковы для всех измерений. Для каждой пробы собирали не менее 10000 событий. «Тромбоцитарное окно» выделяли по параметрам прямого (FCS) и малоугольного (SSC) светорассеяния в логарифмической шкале координат. Оценивали количество позитивных клеток (%) по CD41a и CD61. Результат представлен в IC50 - концентрации, связывающей 50% тромбоцитарных рецепторов ГП IIb-IIIa по интегринам CD41a и CD61. В качестве препаратов сравнения были выбраны: препарат прототип - N-(бутилсульфонил)-4-[4-(4-пиперидин)бутокси]-α-фенилаланина моногидрохлорид моногидрат («Аграстат», Correvio, Великобритания) и L-цистеинамид, N6-(аминоиминометил)-N2-(3-меркапто-1-оксопропил)-L-лизилглицил-L-α-аспартил-L-триптофи-L-пропил-,циклический(1-6)-дисульфид («Интегрилин», Glaxo Operations UK Limited, Великобритания).
Антитромботический эффект.
Изучение антитромботического эффекта заявленных соединений и аграстата проведено на 120 белых беспородных мышах-самцах половозрелого возраста массой 20-22 г с использованием модели генерализованного коллаген-адреналинового тромбоза по методу DiMinno G. и Silver M.J. [DiMinno G.S. Mouse antithrombotic assay: a simple method for the evaluation of antithrombotic agents in vivo. Potentiation of antithrombotic activity by ethyl alcohol / G.S. DiMinno // J. Pharmacol. Exp. Ther. - 1983. - V. 225. - P. 57-60]. В хвостовую вену мышей вводили смесь растворов коллагена и адреналина (0,5 мг/кг и 0,06 мг/кг соответственно). В качестве критерия эффективности исследуемых соединений отмечали количество выживших животных по сравнению с контрольной группой. За 1 час до моделирования тромбоэмболии внутривенно вводили исследуемые соединения в эквимолярных дозах. В качестве препаратов сравнения были выбраны: препарат прототип - N-(бутилсульфонил)-4-[4-(4-пиперидин)бутокси]-α-фенилаланина моногидрохлорид моногидрат («Аграстат», Correvio, Великобритания) и L-цистеинамид, N6-(аминоиминометил)-N2-(3-меркапто-1-оксопропил)-L-лизилглицил-L-α-аспартил-L-триптофи-L-пропил-,циклический(1-6)-дисульфид («Интегрилин», Glaxo Operations UK Limited, Великобритания). Контрольной группе мышей вводился физиологический раствор в аналогичных объемах.
Обработка результатов.
Результаты исследования обработаны с применением статистического пакета Statistica 10,0 (StatSoft Inc, США). Проверку на нормальность распределения фактических данных выполняли с помощью критерия Шапиро-Уилка. Для описания групп использованы медиана и межквартильный интервал. Дисперсионный анализ проводили с помощью критерия Краскела-Уоллиса. Критический уровень значимости р для статистических критериев принимали равным 0,05. Выживаемость оценивали от времени инъекции в хвостовую вену взвеси коллагена и адреналина до момента гибели или истечения 14 суток наблюдений. Анализ выживаемости проведен при помощи метода Каплана-Мейера. Различия выживаемости между группами оценивались при помощи критерия Вилкоксона. Величину IC50 заявленных соединений и препарата сравнения рассчитывали с помощью нелинейного фиттинга кривых, описывающих процент позитивных по CD41a и CD61 клеток по логарифмическому уравнению с 4 параметрами, используя программное обеспечение GraphPad Prism (GraphPad Software, Inc., США).
На модели генерализованного коллаген-адреналинового тромбоза исследуемые соединения эффективнее аграстата и интегрилина препятствовали развитию тромбоза. Выживаемость в контрольной группе составила 0,0%, в группе интегрилина - 65,0%, аграстата - 75,5%, в группе заявленных соединений выживаемость независимо от соединения превышала 80% (таблица 1).
Применяемые в клинической практике препараты группы блокаторов рецепторов тромбоцитов ГП IIb-IIIa имеют разное сродство с этим рецептором по интегринам CD41a и CD61. Аграстат не обладает эффектом связывания с рецептором ГП IIb-IIIa по интегринам CD41a и CD61. Интегрилин связывается с рецептором только по интегрину CD41a. Все заявленные соединения имеют сродство с тромбоцитарным рецептором ГП IIb-IIIa по интегринам CD41a и CD61 (таблица 2).
Применение 3-метил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1Н-пурин-2,6(3Н,7Н)-диона гидрохлорида, или 1,3-диметил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1Н-пурин-2,6(3Н,7Н)-диона гидрохлорида, или 1-бутил-3-метил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1Н-пурин-2,6(3Н,7Н)-диона гидрохлорида, или 1-бензил-3-метил-8-(пиперазин-1-ил)-7-(тиетан-3-ил)-1Н-пурин-2,6(3Н,7Н)-диона гидрохлорида в качестве средства, проявляющего антитромботический эффект посредством блокирования рецепторов тромбоцитов ГП IIb-IIIa.