Средство для купирования опиоидного абстинентного синдрома
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой новое применение известного гидрохлорида N-2-адамантил-гексаметиленимина (гимантана) в качестве средства для купирования опиоидного абстинентного синдрома. Изобретение обеспечивает снижение проявления соматических признаков опиоидной абстиненции, препятствует развитию механической аллодинии в условиях резкого прекращения приема опиоидов, проявляет отставленную по времени анальгетическую активность. 3 ил., 1 табл., 3 пр.
Реферат
Изобретение относится к медицине, в частности к фармакологии, и касается нового применения известного вещества
гидрохлорида N-2-адамантил-гексаметиленимина (гимантана),
в качестве средства для купирования опиоидного абстинентного синдрома.
Процесс терапии больных наркоманиями на начальном этапе включает купирование абстинентного синдрома, поскольку угроза формирования абстиненции нередко становится основной причиной продолжения потребления психоактивных веществ. Опиоидный абстинентный синдром (F11 «Психические и поведенческие расстройства, вызванные употреблением опиоидов», F11.30 «Абстинентное состояние», согласно МКБ-10) представляет собой комплекс вегетативных, соматических, неврологических и психических нарушений, возникающих у больных наркоманией при полном прекращении приема опиоидов или снижении их дозы на фоне сформированной лекарственной зависимости. Согласно теории аллостаза, отрицательное аффективное состояние, вызванное синдромом отмены, является главной движущей силой в склонности к рецидиву употребления психоактивных веществ (Fox ME, Rodeberg NT, Wightman RM. Neuropsychopharmacology. 2017. 42(3):671-681; Koob GF. Eur J Pharmacol. 2015.753:73-87). Для синдрома отмены препаратов опиоидного ряда характерны такие проявления, как мидриаз, зевота, слезотечение, насморк с чиханием, «гусиная кожа», бессонница, озноб, потливость и слабость, а также дискомфорт в мышцах спины, ног и шеи, боль в межчелюстных суставах и жевательных мышцах в острый период, позже присоединяются тошнота, рвота, боли в области живота, усиление перистальтики кишечника, диарея, к концу первых суток появляются мышечные боли, тонические судороги периферических мышц. Максимальной выраженности абстинентные расстройства при употреблении опиоидов достигают на 2-3 сутки, а их продолжительность зависит от вида наркотика, длительности заболевания, проводимого лечения. Острые абстинентные расстройства при героиновой зависимости в условиях лечения продолжаются 7-10 дней (Kosten TR, PG. N Engl J Med. 2003. 348:1786-1795).
Хроническая интоксикация препаратами опиоидного ряда вызывает нарушение функциональной активности ряда нейромедиаторных систем, следовательно, фармакотерапия, нацеленная на преодоление данного дисбаланса, способна препятствовать развитию основных клинических проявлений абстинентного синдрома. Одними из наиболее эффективных средств купирования синдрома отмены при опиоидной зависимости являются агонист альфа-2-адренорецепторов клонидин, селективный блокатор дофаминовых D2-рецепторов атипичный нейролептик тиапридал и опиоидный анальгетик из группы частичных агонистов опиоидных рецепторов трамадол. Кроме того, в комплексной терапии часто используют нестероидные противовоспалительные средства для купирования болевого синдрома при опийной (героиновой) абстиненции (Н.Н. Иванец, М.А. Винникова. Героиновая зависимость. Клиника и лечение постабстинентного состояния. М.: Медпрактика-М, 2001. - 129 с.).
Роль глутаматной системы и, в частности, ионотропных N-метил-D-аспартатных (NMDA) рецепторов в формировании и проявлении аддиктивных состояний подтверждена многочисленными поведенческими и биохимическими исследованиями (Noda Y., Nabeshima Т. Eur. J. Pharmacol. 2004. 500: 121-128), доказывающими способность антагонистов NMDA-рецепторов подавлять развитие физической зависимости от опиатов. Все неконкурентные NMDA-антагонисты, такие как кетамин, декстрометорфан, МК-801 и мемантин, ослабляют проявление синдрома отмены, включая прыжки, диарею, птоз, скрежетание зубами у морфин-зависимых мышей, крыс и морских свинок при моделировании налоксон-индуцированного синдрома отмены (Tanganelli S. et al. Neurosci.Lett. 1991. 122:270-272; Tokuyama S. et al. Eur.J.Pharmacol. 1996. 295:123-129), так же как и конкурентные антагонисты NMDA-рецепторов LY-274614 и CGP39551 (Rasmussen К. et al., Eur.J.Pharmacol. 1991. 197: 9-16; Gonzalez et al., Eur.J.Pharmacol. 1997. 332: 257-262). Показано, что при субхроническом использовании при одновременном введении с морфином антагонисты NMDA-рецепторов предотвращают развитие опиатной зависимости, заметно ослабляя манифестацию признаков синдрома отмены (Bespalov A. et al., J.Pharmacol.Exp.Ther. 1999. 290: 20-27; Trujillo K.A. Psychopharmacology, 2000. 151:121-141).
Механизм, лежащий в основе подавляющего действия NMDA-антагонистов на опиатную зависимость, до конца не изучен. Опиаты при хроническом использовании вызывают адаптивное увеличение внутриклеточной аккумуляции Са++ и экспрессии Са++/кальмодулин киназы II (CAMKII). CAMKII играет важную роль в фосфорилировании транскрипционного фактора CREB (cAMP response element-binding protein), что приводит к увеличению его активности и повышению экспрессии c-fos мРНК (Sheng et al. Science. 1991. 252:1427-1430), влияющей на разные формы нейрональной пластичности. В работе Hamdy et al. (2004) установлена вовлеченность Са++/кальмодулин-зависимого сигнального пути в ингибирующем влиянии МК-801 на поведенческие признаки синдрома отмены морфина и экспрессию c-fos в области cingulate cortex (Humdy М.М. et al. Behav.Brain Res. 2004. 152: 263-270).
По данным нейрохимических исследований установлено значительное увеличение внеклеточного содержания глутамата в locus coeruleus у крыс с синдромом отмены морфина, спровоцированного неселективной блокадой опиатных рецепторов налоксоном (Tokuyama S. et al. Eur.J.Pharmacol., 1996, 295, 123-129). МК-801 купировал развитие признаков синдрома отмены у животных, но не предотвращал повышение уровня глутамата в locus coeruleus, что позволяет предположить участие постсинаптических NMDA-рецепторов в данной области в проявлении характерных признаков опиоидной абстиненции у зависимых животных (Tokuyama S. et al. Neurochem. Int., 2001, 39, 103-109).
Неконкурентный антагонист NMDA-рецепторов мемантин (3,5-диметил-адамантан-1-амин), используемый в клинической практике для лечения деменции разного генеза, ослаблял выраженность симптомов абстиненции у больных с героиновой зависимостью (Bisaga A. et al., Psychopharmacology. 2001. 157: 1-10), однако, в последующем плацебо-контролируемом исследовании мемантина как средства адьювантной терапии зависимости от опиатов его эффективность не была подтверждена (Bisaga А. et al. Drug Alcohol Depend. 2011. 119(1-2): e23-9.). В комплексной терапии кетамин при внутривенном введении оказывал положительное, но кратковременное действие на проявление синдрома отмены (Jovaisa Т. et al., Medicina (Kaunas). 2006; 42(8): 625-34).
По данным Национального Института по изучению злоупотребления наркотиками (NIDA) в США, серьезные побочные эффекты осложняют использование неконкурентных антагонистов NMDA-рецепторов (Herman ВН, Vocci F, Bridge P. Neuropsychopharmacology. 1995. 13(4): 269-93.). Декстрометорфан, показавший положительные результаты в доклинических и первичных клинических исследованиях в устранении симптомов опиоидного синдрома отмены, при использовании в больших дозах проявлял негативное побочное действие, ассоциированное с его первичным метаболитом декстрорфаном (Akerele Е. et al., Am J Addict. 2008. 17(3): 176-80).
В клинических исследованиях отмечается формирование повышенной чувствительности к раздражению ноцицепторов, обусловленной хроническим применением препаратов опиоидного ряда (Angst M.S., Koppert W., Pahl I. et al. Pain. 2003. 106(1-2):49-57; Weber L., Yeomans D.C., Tzabazis A. Curr Opin Anaesthesiol. 2017 Jun 5. doi: 10.1097/ACO.0000000000000485). Гиперальгезия, развивающаяся при отмене опиоидов, тесно связана с ноцицептивной системой, включающей NMDA-рецепторы (Lee М., Silverman S.M., Hansen. H. et al. Pain Physician. 2011. 14(2): 145-61; Roeckel L.A., Le Coz GM., C, Simonin F. Neuroscience. 2016. 338:160-182).
В связи с ограниченным набором лекарственных средств для фармакотерапии опиоидной зависимости, наличием негативных сопутствующих побочных эффектов у существующих в настоящее время препаратов, задачей, решаемой с помощью изобретения, стало расширение арсенала средств для купирования симптомов опиоидной абстиненции.
Цель, достигаемая техническим решением, - выявление новых свойств у известного лекарственного средства, направленных на ослабление соматических проявлений синдрома отмены опиоидов за счет реализации оригинального мультитаргетингового действия на ключевые фармакологические мишени.
Гимантан (гидрохлорид N-2-адамантил-гексаметиленимина) - оригинальный препарат, созданный на основе структуры адамантана в ФГБНУ «НИИ фармакологии имени В.В. Закусова», обладает выраженной активностью, доказанной на экспериментальных моделях паркинсонизма (Вальдман Е.А. и др. Экспер. и Клин. Фармакол. 1999. 4: 3-6; Капица и др. Психофармакол. и биол. наркология. 2005. 1: 822-827; Капица И.Г. и др. Экспер. и Клин. Фармакол. 2011. 7:9-12) и подтвержденной у больных с начальными стадиями болезни Паркинсона (Катунина Е.В. и др. Жур. неврологии и психиатрии им. С.С. Корсакова. 2008. 108(6): 24-27).
Существование нескольких молекулярных мишеней, включая ионные каналы NMDA-рецепторов (Елшанская М.В. и др., Экспер. Клин. Фармакол. 2001. 64(1): 18-21), дофаминовые рецепторы D1 и D2 (Абаимов Д.А. и др., Экспер. Клин. Фармакол. 2008. 71(1): 18-21), транспортер дофамина DAT (Abaimov D.A. et al., Bull Exp Biol Med. 2008. 145(3):331-3) и MAO-B (Вальдман Е.А. и др., Экспер. Клин. Фармакол. 2003. 66(5):3-5), наличие антидепрессивного эффекта и противовоспалительных свойств (Ivanova Е.А. et al., Advances in Parkinsons Disease. 2016. 5(3): 50-60) в спектре фармакологической активности гимантана при отсутствии способности к формированию толерантности и лекарственной зависимости позволяют рассматривать его в качестве средства для купирования опиоидного абстинентного синдрома. В доступных источниках до настоящего времени отсутствуют указания на применение гимантана по предлагаемому назначению.
Таким образом, получен заявленный технический результат - расширение арсенала средств для купирования опиоидного абстинентного синдрома.
Изобретение иллюстрируется следующими примерами.
Животные. Настоящее исследование выполнено на беспородных белых крысах-самцах с массой тела 230-250 г (n=32) и инбредных мышах-самцах линии С57В1/6 с массой тела 18-22 г (n=30) (ФГБНУ «Научный центр биомедицинских технологий Федерального медико-биологического агентства», филиал «Столбовая»). Животных содержали по 6 (крысы) и 15 (мыши) особей в клетке в условиях вивария ФГБНУ «НИИ фармакологии имени В.В. Закусова» (температура 21-23°C, относительная влажность воздуха 40-60%) при естественной освещенности и свободном доступе к воде и брикетированному корму в течение 10 суток до начала тестирования. Организация и проведение работ осуществлялись в соответствии с приказом Минздрава России №199 от 01 апреля 2016 года «Об утверждении правил надлежащей лабораторной практики». Животные содержались в соответствии с СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» от 29 августа 2014 г. №51. Проведение экспериментов одобрено Комиссией по биомедицинской этике ФГБНУ «НИИ фармакологии имени В.В. Закусова».
Препараты. Морфина гидрохлорид (Минмедбиопром объединение «Чимкентбиофарм», субстанция) растворяли в воде для инъекций и вводили внутрибрюшинно (в/б) из расчета 0.1 мл/100 г массы тела крыс. Животные контрольных групп получали воду для инъекций. Гимантан (гидрохлорид N-2-адамантил-гексаметиленимина, субстанция, синтезированная в ФГБНУ «НИИ фармакологии имени В.В. Закусова») и амантадин (1-аминоадамантана гидрохлорид) в качестве референтного соединения в эффективных дозах 10.0 и 20.0 мг/кг растворяли в воде для инъекций и вводили в/б из расчета 0.1 мл/100 г (крысы) и 0.1 мл/10 г (мыши) массы животного.
Методики. Формирование зависимости от опиатов и оценка соматических проявлений синдрома отмены морфина. У беспородных крыс-самцов вырабатывали зависимость от морфина и оценивали поведение на наличие специфических признаков синдрома отмены (СО) в соответствии со стандартной схемой, описанной ранее (Константинопольский М.А. и соавт., Экспер. клин. фармакол. 1992. 55 (1): 21-24). Для получения животных, зависимых от морфина, препарат вводили животным в возрастающих дозах 10-20 мг/кг, 2 раза в день через 8 ч в течение 5 суток: 1-е сутки всего - 10 и 10 мг/кг, 2-е сутки - 10 и 20 мг/кг, 3-е сутки - 20 и 20 мг/кг, 4-е сутки - 20 и 20 мг/кг, 5-е сутки - 20 мг/кг. Гимантан в дозах 10 и 20 мг/кг, в/б, вводили однократно за 30 минут до морфина на 5-й день эксперимента. Тестирование животных на наличие специфических признаков синдрома отмены (СО) морфина проводили на 5-й день опыта в течение 5 мин в «открытом поле» (освещенная круглая арена диаметром 80 см) через 15 мин после введения антагониста опиатных рецепторов налоксона ("Du Pont De Nemours Int. S.A., Swiss") в дозе 1.0 мг/кг для провокации СО. Контрольным животным ежедневно в течение 5 дней однократно утром вводили воду для инъекций, а на 5-й день опыта перед тестированием - налоксон в дозе 1.0 мг/кг. Для всех групп регистрировали поведенческие реакции животных (двигательную активность (ДА), стойки, груминг, дефекации) и специфические признаки СО морфина (16 показателей). Дискретные признаки абстиненции (диарею - в баллах, отряхивания и скрежет зубами - по числу актов) оценивали количественно и альтернативно, остальные - в альтернативной форме по принципу «да» - «нет». Суммарный индекс (СИ) выраженности СО для каждого животного и средние значения для опытных и контрольных групп рассчитывали на основании альтернативных признаков при максимально возможной величине СИ, равной 16 баллам. Среднее значение выраженности СО в группе «морфин» (активный контроль) принимали за 100%.
Оценку изменений тактильной чувствительности у интактных крыс до введения веществ и у животных с выработанной зависимостью от морфина выполняли, используя стандартный набор из 20 нейлоновых монофиламентов (филаменты фон Фрея - "von Frey filaments set" фирмы Ugo Basile), которые позволяют наносить градуированное по силе тактильное неболевое раздражение на кожу задних конечностей крыс. Экспериментальная установка этой же фирмы для тестирования представляла собой металлическую сетчатую платформу (размер ячеек 5×5 мм), приподнятую на опорах над поверхностью стола на 20 см. На поверхность сетчатой платформы устанавливали 6 индивидуальных прямоугольных пластиковых боксов без дна (9×17 см), в каждый из которых помещалось 1 животное. До тестирования крысы находились в боксах для адаптации и угашения исследовательской активности в течение 8-10 минут. В ходе тестирования отдельный филамент через сетчатую поверхность платформы контактировал с кожей задних лап крысы в течение 1-2 с, отдергивание или смещение лапы считали положительной реакцией. С каждым филаментом выполняли до 6 попыток. В момент контакта кончика филамента с кожей животного допускалось его легкое дугообразное сгибание. Процедуру начинали с высоких значений упругости филаментов и при наличии реакции животных смещались в сторону низких значений. Пороговый уровень тактильного стимула определяли по его наименьшему значению, вызывавшему реакцию у крыс, в соответствии с градуировкой в граммах, указанной на каждом филаменте. В ходе исследования процедуру тестирования проводили дважды: в день, предшествующий первому дню субхронического введения морфина, и через 24 часа после отмены препаратов. Возможность применения данного показателя для оценки СО морфина была показана ранее (Konstantinopolsky М.А. et al. European Neuropsychopharmacology. 2014. 24(S2): S676-S677).
Тест «горячая пластинка» использовали для оценки ноцицептивной реакции на супраспинальном уровне у мышей-самцов линии С57В1/6. С помощью анальгезиметра «Ugo Basile» (Италия) регистрировали латентное время реакции (лизание задней лапы или прыжок). За 1-2 ч до начала опыта отбирали животных на основе базовой реактивности в условиях данной экспериментальной модели, исключая мышей, остававшихся на нагретой до 56.0±0.5°C пластине дольше 15 с. Латентный период в 20 с (максимальное время экспозиции) расценивали как 100% анальгезию. Фиксировали время появления реакции у мышей через 30, 60, 90, 120, 180 и 240 мин после однократного введения изучаемых препаратов. Полученные результаты выражали в виде максимально возможного эффекта (МВЭ) в %. МВЭ = (латентный период реакции после введения препарата минус фоновый латентный период реакции)/(максимальное время экспозиции минус фоновый латентный период реакции) ×100%. Гимантан вводили однократно за 30 мин до тестирования в/б из расчета 0.1 мл/10 г (мыши) массы животного.
Статистическую обработку результатов производили при помощи теста Манна-Уитни, теста множественных сравнений средних рядов для всех групп, однофакторного дисперсионного анализа (ANOVA) с последующим использованием теста Дункана. Проверку нормальности распределения данных осуществляли с помощью критерия Шапиро-Уилкса. Критический уровень значимости α=0.05. Данные представлены в виде средних значений (mean) и средних значений и стандартной ошибки средних значений.
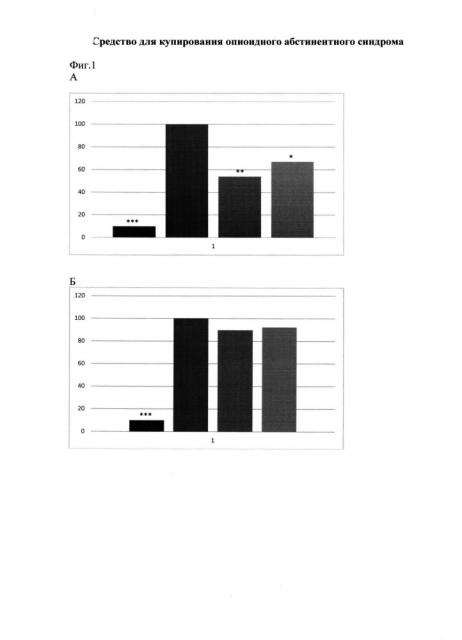
Пример 1. Влияние гимантана при однократном введении на проявление поведенческих признаков «синдрома отмены» морфина у крыс
Полученные результаты показывают, что гимантан оказывает существенное влияние на специфические поведенческие показатели синдрома отмены у крыс, получавших морфин. Суммарный индекс (СИ) СО морфина для группы «М + гимантан 10 мг/кг» в сравнении с группой активного контроля «морфин» снижался на 46%. Эффект гимантана был менее выражен при его введении в дозе 20 мг/кг: снижение СИ СО в этом случае составило 33% (фиг. 1А). Оценивая коррекцию отдельных проявлений СО морфина, следует отметить снижение выраженности или полное устранение таких показателей, как вокализация (р<0,01), скрежет зубами (р<0,05), птоз (р<0,05) (таблица 1).
Примечание: * - р<0.05, **- р<0,01, *** - р<0,001 по сравнению с группой «контроль», # - р<0.05, ## - р<0.01 по сравнению с группой «морфин», согласно однофакторному дисперсионному анализу (ANOVA) и U-тесту Манна-Уитни, число животных в группах по 8.
Не отмечалось значимых изменений двигательной активности в течение 5 мин в ОП, вертикальной активности («стоек»), числа актов груминга и дефекаций у животных, получавших гимантан в сравнении с контрольной группой и группой «морфин».
Амантадин не оказывал значимого влияния на показатели суммарного индекса синдрома отмены морфина. При его введении в дозе 10 мг/кг уровень суммарного индекса синдрома отмены снижался на 10.3% (р>0.05), в дозе 20 мг/кг - на 7.7% (р>0.05) (фиг. 1Б). Единственным показателем СО, у которого отмечены изменения, была диарея (в группе «морфин» - 2.5, в группе «м + амантадин 10 мг/кг» - 0.6, р<0.05).
Пример 2. Влияние гимантана на пороги чувствительности при отмене морфина у крыс со сформированной зависимостью
Снижение плантарных тактильных порогов является важным показателем при оценке выраженности СО морфина у крыс. Гимантан продемонстрировал дозо-зависимый эффект, статистически значимо увеличивая пороги чувствительности только в максимальной изученной дозе 20 мг/кг при однократном введении по сравнению с группой «морфин» (р<0.01) (фиг. 2А). В отличие от гимантана амантадин в дозе 20 мг/кг еще больше вызывал снижение порогов тактильной чувствительности у крыс с налоксон-индуцированным синдромом отмены морфина по сравнению с группой «морфин» (р<0.05) и контрольной группой (р<0.001).
Таким образом, сравнение эффектов гимантана и амантадина на поведенческой модели СО морфина по разнообразным поведенческим и физиологическим показателям демонстрирует преимущества гимантана, способного снижать величину суммарного индекса зависимости, не оказывая влияния на общую двигательную активность и повышать пороги тактильной чувствительности в условиях острой отмены морфина.
Пример 3. Влияние гимантана на ноцицептивную реакцию при термическом раздражении мышей линии C57BI/6
Изучены антиноцицептивные свойства гимантана при моделировании соматической боли на супраспинальном уровне. Средний базовый уровень ноцицептивной реакции для мышей С67В1/6 в тесте «горячая пластинка» составил 6.8±0.3 с. Впервые установлено, что гимантан дозо-зависимо проявлял анальгетическую активность, а именно, начиная со 180-й мин по 240-ю мин наблюдений, препарат в эффективной дозе 20 мг/кг статистически значимо (р<0.01) увеличивал порог болевой реакции у мышей в тесте «горячая пластинка» (фиг. 3). Несмотря на небольшое снижение болевого порога на 90-й мин, гимантан в дозе 10 мг/кг проявлял тенденцию к повышению латентного периода реакции со 180-й по 240-ю мин (р<0.1).
Гимантан продемонстрировал умеренную отставленную по времени анальгетическую активность в дозах, не вызывающих нарушения координации движений (Вальдман Е.А. Автореф. дис. док. мед. наук, Москва (2001)). Подобный эффект в научной литературе описан не был. Несмотря на положительные результаты производных аминоадамантана при купировании хронической нейропатической боли (Medvedev I.O. et al. Neuropharmacology, 2004. 47(2): 175-83), неконкурентные антагонисты NMDA-рецепторов не проявляли самостоятельной активности на модели острой ноцицептивной реакции (Belozertseva I.V. et al., Eur. J. Pharmacol. 2000. 396: 77-83), Redwine K.E., K.A. Trujillo, Pharmacol Biochem Behav. 2003. 76(2): 361-72).
Таким образом, опираясь на полученные данные, можно сделать вывод, что гидрохлорид N-2-адамантил-гексаметиленимина представляет собой средство для купирования опиоидного абстинентного синдрома, так как при однократном введении гимантан дозо-зависимо снижает проявление соматических признаков опиоидной абстиненции, препятствует развитию механической аллодинии в условиях резкого прекращения приема опиоидов и проявляет отставленную по времени анальгетическую активность.
Описание чертежей
Фиг. 1. Сравнительная оценка влияния гимантана и амантадина на суммарный индекс налоксон-индуцированного синдрома отмены у крыс.
А. Влияние гимантана на синдром отмены морфина. По оси абсцисс представлены экспериментальные группы, по оси ординат - значения суммарный индекс синдрома отмены в %. Экспериментальные группы: 1-й столбец - контрольная группа (вода для инъекций), 2-й столбец - морфин, 3-й столбец - морфин + гимантан в дозе 10 мг/кг, 4-й столбец - морфин + гимантан в дозе 20 мг/кг.
* - р<0.05, ** - р<0.01, *** - р<0.001 статистически значимые отличия по сравнению с группой «морфин», ANOVA, U-тест Манна-Уитни; число животных в группе - 8; данные представлены в виде средних значений (mean).
Б. Влияние амантадина на синдром отмены морфина. По оси абсцисс представлены экспериментальные группы, по оси ординат - значение суммарного индекса синдрома отмены в %. Экспериментальные группы: 1-й столбец - контрольная группа (вода для инъекций), 2-й столбец - морфин, 3-й столбец - морфин + амантадин в дозе 10 мг/кг, 4-й столбец - морфин + амантадин в дозе 20 мг/кг.
*** - р<0.001 статистически значимые отличия по сравнению с группой «морфин», ANOVA, U-тест Манна-Уитни; число животных в группе - 8; данные представлены в виде средних значений (mean).
Фиг. 2. Сравнительная оценка влияния гимантана и амантадина на механическую аллодинию, индуцированную отменой морфина у крыс со сформированной зависимостью.
А. Влияние гимантана на пороги тактильной чувствительности у морфин-зависимых крыс. По оси абсцисс представлены экспериментальные группы, по оси ординат - пороги тактильной чувствительности в %. Экспериментальные группы: 1-й столбец - контрольная группа (вода для инъекций), 2-й столбец - морфин, 3-й столбец - морфин + гимантан в дозе 10 мг/кг, 4-й столбец - морфин + гимантан в дозе 20 мг/кг.
* - р<0.05, ** - р<0.01 статистически значимые отличия по сравнению с группой «контроль», # - р<0.05 статистически значимые отличия по сравнению с группой «морфин», ANOVA, U-тест Манна-Уитни; число животных в группе - 8; данные представлены в виде средних значений (mean).
Б. Влияние амантадина на пороги тактильной чувствительности у морфин-зависимых крыс. По оси абсцисс представлены экспериментальные группы, по оси ординат - пороги тактильной чувствительности в %. Экспериментальные группы: 1-й столбец - контрольная группа (вода для инъекций), 2-й столбец - морфин, 3-й столбец - морфин + амантадин в дозе 10 мг/кг, 4-й столбец - морфин + амантадин в дозе 20 мг/кг.
** - р<0.01, *** - р<0.001 статистически значимые отличия по сравнению с группой «контроль», # - р<0.05 статистически значимые отличия по сравнению с группой «морфин», ANOVA, U-тест Манна-Уитни; число животных в группе - 8; данные представлены в виде средних значений (mean).
Фиг. 3. Влияние гимантана на порог болевой реакции при термическом воздействии у мышей C57BL/6.
По оси абсцисс - время после введения препарата (мин), по оси ординат - латентный периода реакции в ответ на термическое раздражение ноцицепторов (с). Экспериментальные группы: линия из точек с точкой «ромб» - группа «контроль», линия прерывистая с точкой «квадрат» - группа «морфин + гимантан в дозе 10 мг/кг», линия сплошная с точкой «треугольник» - группа «морфин + гимантан в дозе 20 мг/кг». Данные представлены в виде средних значение и ошибки среднего (mean±SEM).
* - р<0.05, ** - р<0.01, # - р<0.1 статистически значимо по отношению к группе "контроль", ANOVA, тест Дункана; число животных в группе 9.
Применение гидрохлорида N-2-адамантил-гексаметиленимина в качестве средства для купирования опиоидного абстинентного синдрома.