Способ определения необходимости использования психофармакотерапии у пациентов с расстройствами аутистического спектра на момент их обследования
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к психиатрии, и может быть использовано для оценки необходимости психофармакотерапии пациента с расстройством аутистического спектра (РАС). Способ по изобретению включает клиническое обследование пациентов, определение нозологической принадлежности заболевания по МКБ-10 и DSM-5 и дополнительно нейрофизиологическое обследование путем определения особенностей биоэлектрической активности мозга пациента при электроэнцефалографии, преимущественно в диапазоне бета- и тета-ритмов, и иммунологическое исследование пациентов путем определения в сыворотке периферической крови ферментативной активности лейкоцитарной эластазы (ЛЭ), функциональной активности α1-протеиназного ингибитора (α1-ПИ) и уровня аутоантител (aАТ) к нейроспецифическим антигенам - S-100b и основному белку миелина (ОБМ). Психофармакотерапию пациенту назначают по результатам клинического обследования при достоверном превышении показателей дополнительных исследований над аналогичными показателями у здоровых детей соответствующего возраста. Использование изобретения позволяет оценить активность текущего патологического процесса в мозге больных с РАС на момент осмотра и определить необходимость медикаментозной терапии на конкретном этапе течения болезни. 2 табл., 2 пр.
Реферат
Изобретение относится к области медицины, в частности к психиатрии, и может быть использовано для качественной и количественной клинико-биологической оценки необходимости введения психофармакотерапии на момент осмотра пациента с расстройством аутистического спектра (РАС).
Расстройства аутистического спектра в детском возрасте являются одной из актуальнейших проблем современной психиатрии в связи с их высокой распространенностью (62:10000 детского населения), трудностями диагностики, а также недостаточной изученностью патогенетических механизмов развития этих состояний.
Аутизм, как негативный симптом болезни, наблюдается в той или иной степени при разных нозологиях, в том числе и болезнях объединенных в группу РАС. Аутизм способствует остановке психического развития пациента, нарушению социализации, коммуникации, сопровождается стереотипным поведением.
Расстройства аутистического спектра (РАС) представляют собой нозологически гетерогенную группу заболеваний, в которую входят: непсихотический эволютивно-конституциональный аутизм при синдроме Аспергера (F84.5), детский эволютивно-процессуальный аутизм Каннера (F84.0), инфантильный психоз (F84.02), атипичный детский психоз (F84.11) и другие типы расстройств.
Для диагностики аутистического расстройства, на основании критериев Международной классификации болезней 10-го пересмотра первоначально используют скрининг, дифференциальную диагностику аутизма, которую проводит врач-психиатр (МКБ-10, F84.0-F84.8), клиническое (психопатологическое) исследование, физикальное исследование (соматическое и неврологическое).
В качестве основного инструментария при клиническом исследовании во всем мире используется количественная шкала оценки выраженности детского аутизма («Childhood Autism Rating Scale» - CARS) [Schopler E. et al., 1988]. CARS - Рейтинговая шкала детского аутизма, стандартизированный инструмент, основанный на непосредственном наблюдении за поведением ребенка
Следующий этап - диагностика развития: экспериментально-психологическое (патопсихологическое) исследование, которое дает информацию об индивидуально-психологических свойствах и психическом состоянии больного с РАС. Она необходима для уточнения диагноза и подбора психотерапевтической тактики. При этом используют шкалы измерения интеллекта Векслера (оригинальный вариант WISC-IV, и его отечественные модификации для детей от 5 лет до 15 лет 11 месяцев и для дошкольников от 4 до 6,5 лет).
Нейропсихологическое диагностическое исследование направлено на выявление отклонений высших психических функций с анализом сформированности т.н. регуляторных функций (программирования, регуляции и контроля). Это позволяет провести оценку когнитивной деятельности ребенка и разработать индивидуальную программу коррекции.
В числе параклинических методов используют электроэнцефалографию (ЭЭГ).
[«Расстройства аутистического спектра: диагностика, лечение, наблюдение». Клинические рекомендации (протокол лечения) 2015].
Известен также способ диагностики аутизма посредством определения наличия высоких концентраций определенных пептидов в пробе крови и/или плазмы крови, и/или сыворотки. Способ предусматривает выявление определенных, имеющих аминокислотные последовательности SKITHRIHWESASLL, SSKITHRIHWESASLL и SSKITHRIHWESASLLR, с молекулярной массой соответственно 1779±1 Да, 1865±1 Да и 2022±1 Да. Превышение концентраций данных пептидов в 10 и более раз по сравнению с нормой является маркером для диагностики аутизма. (RU №2340900, 2004)
При этом авторы указывают на то, что проведено мало биохимических исследований, касающихся аутизма и имеется очень мало результатов, поскольку отсутствуют доступные модели на животных, и имеется практическая проблема сбора материала от пациентов.
Описанные источники не содержат информации о необходимости (или об отсутствии необходимости) использования психофармакотерапии у пациентов с расстройствами аутистического спектра на момент их обследования.
На основании результатов многочисленных исследований, проведенных в последние годы в ФГНБУ НЦПЗ была выявлена вовлеченность врожденного (воспалительные реакции) и приобретенного (аутоантитела к нейроантигенам) иммунитета в патогенез эндогенных психических заболеваний. При исследовании клинико-биологических корреляций из широкого спектра воспалительных медиаторов был выделен ряд показателей, тесно взаимосвязанных с клиническими особенностями психического состояния пациента и степенью активности патологического процесса [Каледа В.Г., Клюшник Т.П., Сармаиова З.В., Отман И.П., Дупин A.M. Корреляция клинических и иммунологических показателей при первом приступе юношеского эндогенного психоза // Журнал неврологии и психиатрии им. С.С. Корсакова. - 2009. - Т. 109(1). - С. 16-19; Клюшник Т.П., Сиряченко Т.М., Сармаиова З.В., Отман И.Н., Дупин A.M. Иммунологические реакции при различных формах психической патологии // Журнал неврологии и психиатрии им. С.С. Корсакова. - 2009. - Т. 109(4). - С. 55-58; Щербакова И.В. Особенности врожденного и приобретенного иммунитета при высоком риске возникновения шизофрении и в процессе ее развития: Дис. … доктора мед. наук. - М., 2006].
В частности, была показана высокая энзиматическая активность лейкоцитарной эластазы - протеолитического фермента, принимающего участие в развертывании воспалительных реакций, что имеет место при обострении эндогенных психических заболеваний, но в ремиссии активность этого фермента снижается. Повышение энзиматической активности ЛЭ в острой стадии заболевания в большинстве случаев сопровождается также повышением функциональной активности α1-ПИ, синтезирующегося печенью белка острой фазы воспаления, который связывается с ЛЭ и снижает ее деструктивный потенциал, что в свою очередь способствует ограничению и разрешению воспалительного процесса. Низкая активность этого ингибитора может приводить к неконтролируемому протеолизу тканевых белков и развитию вторичных метаболических повреждений, что является неблагоприятным фактором в ходе дальнейшего развития заболевания [Клюшник Т.П., Сиряченко Т.М., Брусов О.С., Сарманова З.В., Отман И.Н., Дупин A.M. Поиск предикторов эффективности антипсихотической терапии шизофрении по иммунологическим показателям сыворотки крови // Журнал неврологии и психиатрии им. С.С. Корсакова. - 2008. - Т. 108(1). - С. 31-35].
Были также получены данные, свидетельствующие о том, что активация приобретенного иммунитета (появление в крови аутоантител к белкам нервной ткани) сопровождает наиболее тяжелые патологические процессы в головном мозге, преимущественно характерные для прогредиентных форм психических заболеваний [Каледа В.Г., Клюшник Т.П., Сармаиова З.В., Отман И.П., Дупин A.M. Корреляция клинических и иммунологических показателей при первом приступе юношеского эндогенного психоза // Журнал неврологии и психиатрии им. С.С. Корсакова. - 2009. - Т. 109(1). - С. 16-19; Клюшник Т.П., Сиряченко Т.М., Брусов О.С., Сарманова З.В., Отман И.Н., Дупин A.M. Поиск предикторов эффективности антипсихотической терапии шизофрении по иммунологическим показателям сыворотки крови // Журнал неврологии и психиатрии им. С.С. Корсакова. - 2008. - Т. 108(1). - С. 31-35; Щербакова И.В., Каледа В.Г., Бархатова А.Н., Клюшник Т.П. Маркеры эндотелиальной дисфункции при приступообразно-прогредиентной шизофрении // Журнал неврологии и психиатрии им. С.С. Корсакова. - 2005. - Т. 105(3). - С. 43-46].
Также было показано, что изменения значений вышеперечисленных показателей врожденного иммунитета могут не только возникать синхронно с изменениями клинических проявлений психического состояния больных, но и порой опережать их по времени возникновения. В последнем случае изменения показателей врожденного иммунитета будут предшествовать по времени клиническим изменениям психического состояния [Клюшник Т.П., Зозуля С.А., Андросова Л.В., Сарманова З.В., Отман И.Н., Дупин A.M., Пантелеева Т.П., Олейчик И.В. и др. Иммунологический мониторинг эндогенных приступообразных психозов // Журнал неврологии и психиатрии им. С.С. Корсакова. - 2014. - Т. 2. - С. 31-35], то есть определение иммунологических показателей в динамике может быть использовано для объективного прогноза дальнейшего развития заболевания и степени выздоровления больного при его клиническом обследовании.
Выявленные закономерности послужили основой для создания новой медицинской технологии «Нейро-иммуно-тест», объективно дополняющей клиническое обследование пациента в динамике. Технология заключается в комплексном определении клинических параметров и показателей врожденного и приобретенного иммунитета в сыворотке крови пациента в течение эндогенного психического заболевания.
Характер изменения этих показателей по сравнению с контрольными значениями позволяет определить активность течения патологического процесса в мозге пациента, оценить степень его остроты и тяжести. Анализ изменения показателей врожденного и приобретенного иммунитета в динамике позволяет вероятностно предсказывать закономерный ход дальнейшего развития заболевания.
Известен способ прогнозирования психомоторного развития детей с перинатальным поражением центральной нервной системы, (патент РФ №2475747, 2011 г); способ лабораторного выявления последствий перинатальных поражений центральной нервной системы и определения степени их тяжести у детей, (патент РФ №2425371, 2010 г); способ определения характера патофизиологических нарушений психомоторного развития детей первого года жизни, патент РФ №2231074, 2003 г); способ выявления групп риска развития нервно-психических заболеваний, патент РФ №2218569, 2002 г), в которых частично описано определение ряда иммунологических показателей, однако ни один из них не описывает, не подразумевает и не предвосхищает предложенный способ определения необходимости использования психофармакотерапии у пациентов с расстройствами аутистического спектра на момент их обследования.
В связи с вопросом об использовании фармакотерапии, важно оценить, какой группы препараты наиболее подходят для лечения пациентов с РАС (с доказательных патогенетических позиций).
Распространенным заблуждением при лечении расстройств аутистического спектра является назначение исключительно нейрометаболической терапии детям и подросткам, нуждающимися в проведении специфического лечения, т.к. монотерапия только ноотропными препаратами не оказывает должного эффекта на психотическую составляющую, недостаточна для преодоления когнитивного дефицита, способна вызвать и парадоксальные эффекты. Комбинированная терапия препаратами с психотропной активностью (нейролептики) в сочетании с ноотропами, нейропептидами, корректорами нарушений мозгового кровообращения при лечении больных с расстройствами аутистического спектра эффективна более чем в 80% случаев. С осторожностью следует относиться к назначению препаратов с психостимулирующей активностью.
Основными методами оценки выраженности аутизма во всем мире являются психометрические шкалы, которые не предусматривают точность диагностики конкретных форм РАС и не могут свидетельствовать о степени активности течения процесса. Следовательно, данные психометрического обследования не способствуют решению вопроса о необходимости введения психофармакотерапии на момент осмотра пациента врачом психиатром.
Так, аутизм в тяжелой форме, определяемый в 37-60 баллов по рейтинговой шкале аутизма у детей - CARS, прослеживается на разных стадиях течения болезни практически при всех гетерогенных формах РАС (детском аутизме, атипичном аутизме, синдромальном аутизме). Опора только на психометрическую количественную шкалу CARS не эффективна, так как «тяжелый» аутизм в ней представлен слишком широким разбросом баллов в отличие от легкого/умеренного (30-36 баллов), что не способствует верификации состояния больного.
Для оценки тяжести РАС используются также клинические маркеры болезни. Однако единого перечня симптомов и синдромов РАС в мире не существует.«Глоссарий психических расстройств детского возраста» (Ковалев В.В., Когловская Г.В., 1967), «Основные симптомы и синдромы детской шизофрении» (Башина В.М., 1989).
Описанные способы не нашли широкого применения при РАС из-за того, что они не содержат подробный перечень симптомов для РАС, не предполагают количественного метода оценки, не могут быть использованы в качестве формализованной схемы истории болезни. Кроме того, за прошедшее время были получены новые данные о нозологически разных формах гетерогенной группы РАС, проведена их дифференциация с детской шизофренией и другими заболеваниями, которые в данных глоссариях не учитываются, что влияет непосредственно на точность оценки психического состояния на момент осмотра ребенка.
В МКБ-10 (Международная классификация болезней 10 пересмотра), ДСМ-5 (Диагностическое и статистическое руководство по психическим расстройствам 5 пересмотра), наряду с основными проявлениями аутизма в форме нарушения вербальной и невербальной коммуникации, социализации, стереотипного поведения, выделены «неспецифические» продуктивные симптомы (возбуждение, фобии, нарушения пищевого поведения и др.). Опора на присущие РАС «неспецифические» кататонические симптомы в качественном и количественном выражении осуществляется по шкале оценки кататонических расстройств - BFCRS (кататония менее 25 баллов определяется как легкая; 25-35 баллов - умеренная и более 35 баллов - тяжелая). Шкала BFCRS позволяет качественно оценить характер кататонических расстройств с помощью условного разделения опросника на 3 субшкалы: BFCRS_1 - «гиперкинетическая кататония», BFCRS_2 - «гипокинетическая кататония», BFCRS_3 - «симптомы малой кататонии», а также оценка соматовегетативных нарушений - BFCRS_4.
Данные баллы по указанным психометрическим шкалам дают возможность оценить тяжесть психического состояния ребенка на момент осмотра, но не свидетельствуют об активности текущего процесса и необходимости назначения психофармакотерапии на конкретный момент осмотра пациента.
Таким образом, трудности диагностики, недостаточная изученность патогенетических механизмов развития болезни и патогенетических подходов к терапии диктуют необходимость поиска биологических маркеров, сопряженных с характеристиками заболевания и объективно отражающих особенности клинического состояния пациентов.
Необходимо отметить, что в современной дифференциальной диагностике патологии, после постановки диагноза доминирующим остается подход, направленный на лечение «болезни», как комплекса симптомов без учета особенностей физиологии пациента, его психосоциального контекста.
И, тем не менее, в настоящее время все более широкое распространение получает метод персонализированной медицины - оказание комплексной медицинской помощи, осуществляемое в соответствии с характеристиками конкретного пациента, в том числе и с учетом его биологических особенностей.
Таким образом, проблемой, решаемой в данном изобретении, является оценка степени активности текущего патологического процесса в мозге больных с РАС на момент осмотра психиатра и обоснование необходимости введения персонализированной психофармакотерапии.
Технический результат изобретения состоит в том, что при проведении комплексной клинико-биологической оценки психического состояния больного РАС учитываются не только нарушения в ведущих сферах психической деятельности, но и активность течения патологического процесса по клиническим и биологическим параметрам. Это позволяет наряду с клиническими, использовать биологические маркеры - нейрофизиологические и нейроиммунологические, которые с доказательных патогенетических позиций могут служить для мультидисциплинарного подтверждения диагноза, тяжести и активности текущего процесса, а главное - необходимости введения медикаментозной терапии на конкретном этапе течения болезни.
Для решения указанной проблемы предложен способ определения необходимости использования психофармакотерапии у пациентов с расстройствами аутистического спектра на момент их обследования, включающий клиническое обследование пациентов, определение нозологической принадлежности заболевания по МКБ-10 и DSM-5 и назначение соответствующей психофармакотерапии, при этом, дополнительно осуществляют нейрофизиологическое обследование путем определения спектральной мощности биоэлектрической активности мозга пациента при электроэнцефалографии, преимущественно бета- и тета- ритмов, и иммунологическое исследование пациентов путем определения в сыворотке периферической крови ферментативной активности лейкоцитарной эластазы (ЛЭ), функциональной активности α1-протеиназного ингибитора (α1-ПИ) и уровня аутоантител (аАТ) к нейроспецифическим антигенам - S-100b и основному белку миелина (ОБМ), а психофармакотерапию пациенту назначают по результатам клинического обследования при достоверном превышении значений исследуемых биологических показателей по сравнению с аналогичными показателями здоровых детей соответствующего возраста.
Заявленный способ клинико-биологической оценки степени активности текущего патологического процесса у больных РАС и определения необходимости использования психофармакотерапии у пациентов с расстройствами аутистического спектра на момент их обследования был апробирован в ФГБНУ «Научный центр психического здоровья» в течение 5 лет при обследовании 250 пациентов с детским и атипичным аутизмом.
Многочисленными исследованиями была показана вовлеченность иммунных (как воспалительных, так и аутоиммунных) реакций в патогенез расстройств аутистического спектра (см. например, Клюшник Т.П., Сергиенко Н.С., Даниловская Е.В., Горюнова А.В., Маслова О.И. Аутоантитела к фактору роста нервов при нарушениях психического развития детей раннего возраста. Журн. неврологии и психиатрии 1999; 99(6): 44-46). В крови пациентов выявлены различные маркеры воспаления: повышенный уровень провоспалительных цитокинов (Ashwood Р, Krakowiak Р, Hertz-Picciotto I, Hansen R, Pessah IN, Van de Water J. Associations of impaired behaviors with elevated plasma chemokines in autism spectrum disorders. J Neuroimmunol. 2011; 232(1-2): 196-199. doi: 10.1016/j.jneuroim.2010.10.025), белков острой фазы воспаления (Brown AS, Sourander A, S, McKeague IW, Sundvall J, Surcel HM. Elevated maternal Creactive protein and autism in a national birth cohort. Mol Psychiatry. 2014; 19(2):259-264. doi: 10.1038/mp.2012.197); изменение активности протеолитических ферментов, ответственных за сосудистую проницаемость (Клюшник Т.П., Андросова Л.В., Симашкова Н.В., Зозуля С.А., Отман И.Н., Коваль-Зайцев А.А. Состояние врожденного и приобретенного иммунитета у детей с психотическими формами расстройств аутистического спектра. Ж. Неврологии и психиатрии им. С.С. Корсакова. 2011; 111 (8): 41-45.), а также повышенный уровень аутоантител к нейроантигенам (Шмакова О.А., Андросова Л.В., Шмакова А.А., Отман И.Н., Клюшник Т.П. Клинико-иммунологические корреляции у детей и подростков с хроническими психическими расстройствами вне обострения. Психиатрия. 2015; 65 (1): 17-23.)
Были выявлены корреляционные связи между стадией заболевания (обострение или ремиссия), выраженностью аутистических расстройств по шкале CARS, выраженностью кататонических расстройств по шкале BFCRS, оценкой тяжести состояния по шкале CGI-S и комплексной оценкой состояния иммунной системы (r=0,49; r=0,48; r=0,42; r=0,60, р<0,05, соответственно).
К настоящему времени также были получены многочисленные данные, подтверждающие существование ЭЭГ-нарушений, связанных с РАС. Заметное повышение интереса к нейрофизиологическим аспектам изучения аутизма у детей возникло в связи с разработкой новых концепций патогенеза аутистических расстройств. Так, согласно одной из гипотез, в основе аутистических расстройств может лежать дисфункция системы зеркальных нейронов, отвечающей за подражание, формирование социальных и коммуникативных навыков. Значительное место отводится ЭЭГ-исследованиям также в концепции о ведущей роли в патогенезе аутизма бессудорожной эпилептической энцефалопатии.
Проведенные в ФГБНУ «Научный центр психического здоровья» исследования показали связь параметров ЭЭГ с особенностями структуры клинических состояний при разных формах аутистических расстройств.
Были обследованы 195 детей с разными формами РАС - эволютивными, психотическими, с аутистической симтоматикой при генетических заболеваниях. Выявлено, что на разных стадиях болезни (обострение, ремиссия) при разных видах РАС имеет место своя картина нарушения соотношения ритмов ЭЭГ. Так, наибольшие изменения отмечены при тяжелой форме РАС - атипичном детском психозе (АДП) в клинической стадии регресса, когда в ЭЭГ 70% пациентов наблюдалось доминирование ритмической тета-активности и достоверное снижение мощности альфа-ритма. При более легкой форме РАС - инфантильном психозе с кататоническими расстройствами у 78% детей во время приступа сохранялся организованный характер ЭЭГ с регулярным альфа-ритмом, а в период ремиссии присутствовал выраженный мю-ритм, мощность которого достоверно превышала возрастные нормативы. При эволютивной форме РАС - высоко функциональном синдроме Аспергера уже в младшем возрасте (3-4 года) наблюдалось достоверное усиление спектральной мощности высокочастотных компонентов альфа-ритма (у 40% детей в виде его доминирования). При эволютивно-процессуальном синдроме Каннера, наоборот, выявлялась задержка в формировании альфа-ритма, что отчетливо прослеживалось в младшем возрасте.
Динамические наблюдения изменений биопотенциалов мозга на разных стадиях болезни, анализ параметров ЭЭГ с учетом клинического состояния пациентов позволили выявить корреляции отдельных параметров ЭЭГ с особенностями структуры клинических проявлений, что позволяет использовать их наряду с другими исследованиями в качестве нейрофизиологических маркеров.
Таким образом, в ФГНБУ НЦПЗ впервые для оценки активности патологического процесса были использованы наряду с клиническими биологические маркеры - нейрофизиологические и нейроиммунологические, которые с доказательных патогенетических позиций могут служить для мультидисциплинарного подтверждения диагноза, тяжести и активности текущего процесса, а главное - необходимости введения медикаментозной терапии на конкретном этапе течения болезни.
Назначение психофармакотерапии является персонолизированным, соотносится со степенью активности течения заболевания на момент осмотра пациента, подтвержденной с клинико-биологических позиций, что является доказательным и понятным для общества в целом. Немедикаментозная коррекция сочетается с медикаментозной в активном периоде течения болезни, актуальна на протяжении болезни при всех формах РАС, и является ядерной при эволютивных формах РАС.
Способ осуществляют следующим образом:
При клиническом обследовании пациентов с РАС используют шкалу количественной оценки выраженности детского аутизма (Childhood Autism Rating Scale - CARS) 23 Schopler E, Reichler RJ, DeVellis RF, Daly K. Toward objective classification of childhood autism: Chilhood Autism Rating Scale (CARS). J Autism Dev Disord. 1980; 10(1): 91-103). Оценка по шкале CARS основывается на анализе 15 аспектов поведения, каждый оценивается от 1 до 4 баллов; возможные итоговые суммарные оценки могут варьировать от 15 до 60 баллов. Итоговая оценка в диапазоне от 15 до 29 баллов соответствует отсутствию клинической картины аутизма, 30-36 баллов - легкому/умеренно выраженному аутизму, 37-60 баллов - тяжелому аутизму.
По шкале кататонии BFCRS (Bush-Francis Catatonia Rating Scale) 11 Bush G, Fink M, Petrides G, Dowling F, Francis A. Catatonia. I. Rating scale and standardized examination. Acta Psychiatr Scand. 1996; 93(2): 129-136) оценивают выраженность кататонических расстройств, что позволяет оценить их динамику по мере течения приступа. Кататония менее 25 баллов определяется как легкая; 25-35 баллов - умеренная; и свыше 35 баллов, как тяжелая.
Тяжесть клинической симптоматики оценивают по шкале общего клинического впечатления (Clinical global impression scale - CGI-S) 24 Spearing MK, Post RM, Leverich GS, Brandt D, Nolen W. Modification of the Clinical Global Impressions (CGI) Scale for use in bipolar illness (BP): the CGI-BP. Psychiatry Res. 1997; 73(3): 159-171). По шкале CGI-S баллы 1 и 2 соответствуют легким, баллы 3 и 4 - умеренным, баллы 5-6 - тяжелым; балл 7 - крайне тяжелым расстройствам.
Нейрофизиологическое исследование включает регистрацию электроэнцефалограмм (ЭЭГ) от 16 областей (затылочных, теменных, центральных, лобных и трех височных обоих полушарий, а также двух сагиттальных - центральных и теменных). Электроды располагались по стандартной международной системе 10-20%. Использовали монополярную схему регистрации с референтными объединенными ушными электродами. Запись ЭЭГ и дальнейший статистический анализ осуществляли с помощью компьютерной системы NeuroKM (Россия). Анализировались очищенные от артефактов участки записи у пациентов, находящихся в состоянии бодрствования с закрытыми глазами. Обработка данных включала спектральный анализ и ЭЭГ-картирование в диапазоне от 0.5 до 30 Гц с использованием метода быстрого преобразования Фурье. Проводилось сравнение спектров мощности ЭЭГ каждою ребенка с нормативной базой данных своего возраста (Z-критерий).
Иммунологические показатели определяют в сыворотке периферической крови, забор которой осуществляли из пальца в сухую пробирку типа Эппендорф. Форменные элементы после свертывания крови осаждали центрифугированием при 750 g в течение 15 минут при 22°С, затем отбирали сыворотку, которая использовалась для анализа либо сразу после получения, либо хранилась при +2 - +8°С не более суток или в замороженном состоянии при температуре от -18 до -24°С в течение месяца до проведения анализа.
Энзиматический метод определения активности ЛЭ.
Эластазную активность сыворотки крови, обусловленную на 90% присутствием в сыворотке комплекса эластазы нейтрофилов (ЛЭ) с α1-ПИ, определяли ферментативным методом, предложенным Доценко В.Л Активность ЛЭ измеряли по скорости расщепления эластазой специфического хромогенного субстрата N-терт-бутоксикарбонил-L-аланин-паранитрофенилового эфира (BOC-Ala-ONp) (ICN Biomedical Inc.) в условиях, подобранных для полного высвобождения фермента из комплекса ЛЭ-α1-ПИ, при 25°С. Регистрировали изменение оптической плотности с помощью компьютерной программы SWIFT 1000 Reaction Kinetics (Version 2.03, Biochrom Ltd) на спектрофотометре Ultrospec 1100 (Amercham) в течение 3 мин при длине волны 347 нм, соответствующей максимуму поглощения продукта реакции. Активность эластазы выражали в нмоль/мин × мл. Чувствительность метода 40 нмоль/мин × мл, коэффициент вариации результатов определения активности ЛЭ в одном и том же образце (10 повторений) не превышает 8%.
Метод определения активности α1-ПИ.
Измерение активности α1-ПИ в сыворотке крови проводили с помощью спектрофотометрического метода. Метод основан на взаимодействии этого ингибитора с трипсином при использовании в качестве субстрата N-α-бензоил-L-аргининэтиловый эфир гидрохлорид (BAEE) (ICN Biomedical Inc): α1-ПИ образует с трипсином комплекс, не гидролизующий ВАЕЕ. Активность α1-ПИ в сыворотке определяли по степени торможения ВАЕЕ-эстеразной активности трипсина определенным количеством исследуемой сыворотки. Регистрировали изменение оптической плотности с помощью компьютерной программы SWIFT 1000 Reaction Kinetics (Version 2.03, Biochrom Ltd) на спектрофотометре Ultrospec 1100 (Amercham) в течение 3 мин при длине волны 253 нм. Активность α1-ПИ выражали в ингибиторных единицах на мл (ИЕ/мл). Чувствительность метода 5 ИЕ/мл, коэффициент вариации результатов определения функциональной активности α1-ПИ в одном и том же образце не превышает 5%.
Определение уровня аAT к S100b и ОБМ.
Определение уровня aАТ к S100b и ОБМ в сыворотке крови проводили методом стандартного твердофазного иммуноферментного анализа (ИФА).
Для активации иммунологического планшета (Costar, США) использовали белок S100b или ОБМ (Sigma, США). Для идентификации связавшихся aАТ использовали конъюгат кроличьих антител, меченных пероксидазой хрена к IgG и IgM человека (ИМТЕК, Россия). Измерение оптической плотности проводили через 2-3 мин после остановки реакции при длине волны 492 нм на спектрофотометре Multiskan RC (Labsystems, Финляндия). Уровень aАТ оценивали в единицах оптической плотности (ОП), прямо пропорциональной интенсивности окраски.
На основе определения обозначенных выше воспалительных и аутоиммунных маркеров проводилась также комплексная оценка состояния иммунной системы пациентов, учитывающая корпоративное взаимодействие врожденного и приобретенного иммунитета в ходе иммунной активации (Kanner L. Autistic disturbances of affective contact. Nervous Child, 1943, 2, p. 217-250). Условно было выделено 3 уровня состояния иммунной системы: 1-й уровень - «нормальный». Активность/уровень определяемых иммунных показателей в диапазоне значений контрольной группы. 2-й уровень - «активация врожденного иммунитета» (повышение активности ЛЭ и α1-ПИ выше 75 перцентиля контрольной группы), 3-й уровень - «активация врожденного и приобретенного иммунитета» (повышение активности ЛЭ и α1-ПИ, а также уровня аутоантител выше 75 перцентиля контрольной группы).
Если при клиническом обследовании нозологически верифицирован диагноз РАС, наблюдаются «умеренные и тяжелые» аутистические расстройства по шкале CARS, «неспецифические» кататонические симптомы по шкале BFCRS в качественном и количественном выражении отсутствуют или определяются как «умеренные», дополнительные нейрофизиологические показатели (спектральные характеристики альфа-, бета-ритмов ЭЭГ достоверно не отклоняются от нормы, тета-ритм не выражен), иммунологические показатели (врожденного и приобретенного иммунитета) не превышают нормативные, то больные не нуждаются в назначении психотропной терапии. Абилитация ограничивается немедикаментозной коррекцией.
Если при клиническом обследовании нозологически верифицирован диагноз РАС, наблюдаются аутистические расстройства «тяжелой» степени выраженности по шкале CARS и «неспецифические» «тяжелые» кататонические симптомы по шкале BFCRS и при этом в ЭЭГ значимо усилена выраженность тета- и/или бета-ритмов, а при иммунологическом обследовании наблюдается повышение активности ЛЭ и α1-ПИ, уровня AT выше 75 перцентиля контрольной группы, то больные нуждаются в назначении психотропной терапии. Длительность этой терапии определяется динамикой клинических и биологических показателей.
В каждом случае при назначении медикаментозной терапии требуется проведение детальной диагностики. Выбор препарата проводится с учетом психопатологической структуры расстройства, наличия или отсутствия сопутствующих психологических, неврологических и соматических нарушений.
При разных видах РАС медикаментозная терапия кардинально отличается. Кроме того, медикаментозная терапия незаменима при действии внешних и внутренних неблагоприятных факторов (изменения в окружающей среде, микросоциальном окружении, критические периоды развития). Медикаментозная коррекция обязательно сочетается с развивающим обучением. Существует корреляция между возрастом начала лечебно-коррекционных воздействий и клинико-социальным прогнозом для больных с РАС. Для предотвращения формирования тяжелых личностных и олигофреноподобных дефектов, необходимы ранние и адекватные профилактические мероприятия (скрининг, нозологическая верификация, клиническая типология, абилитация).
Лечение проводится с учетом психопатологической структуры обострения болезни, которая определяет выбор психотропных средств, а также с учетом особенностей терапевтической или спонтанной трансформации синдрома в процессе лечения, с чем может быть связана замена или присоединение других методов лечения. Выбор конкретного препарата осуществляют с учетом спектра психотропной активности антипсихотика и характера возникающих побочных эффектов, а также противопоказаний к применению и возможных лекарственных взаимодействий. Режим дозирования, средние и максимально допустимые суточные дозы и возможный путь введения конкретного нейролептика определяется характером и выраженностью имеющейся психопатологической симптоматики, соматическим состоянием и возрастом больного. Следует избегать полипрогмазии. Эффективность проводимой терапии оценивается на основании положительной динамики клинических проявлений. Основными показателями являются быстрота развития и стойкость эффекта, а также безопасность терапии.
В случае развития инфантильного психоза, атипичного детского психоза с преобладанием неспецифических аутистических проявлений (фобии, тревога, психомоторное возбуждение, агрессивность) следует прибегать к назначению нейролептиков с седативным компонентом действия (хлорпромазин, левомепромазин, хлорпротиксен, алимемазин, галоперидол, перициазин и др.), в том числе парентерально (убедительность доказательств В).
Дезингибирующие антипсихотики (сульпирид) назначают с учетом растормаживающего, активирующего действия (убедительность доказательств В).
Для улучшения когнитивных функций рекомендуется использовать как типичные (трифлюоперазин, перфеназин - убедительность доказательств В), так и атипичные нейролептики (рисперидон, клозапин, палиперидон) - убедительность доказательств В.
Для улучшения когнитивных функций при у больных с РАС используются ноотропы (гопотеновая кислота, кортексин, церебролизин и др.) - убедительность доказательств В.
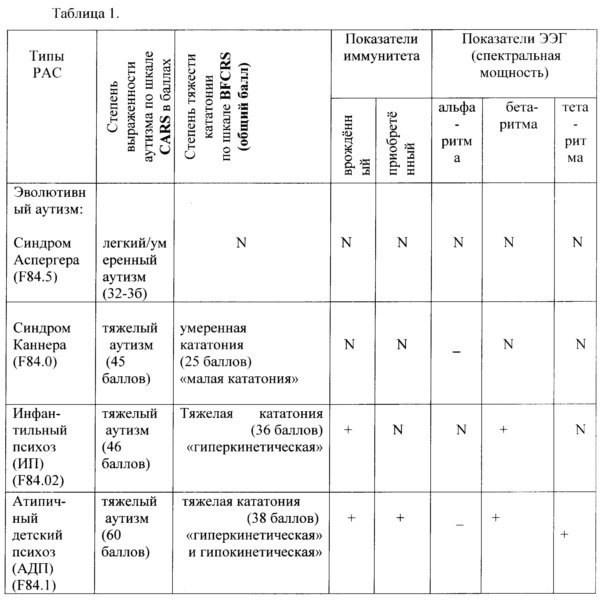
Клинико-биологические показатели у детей с разными типами РАС, использующиеся для назначения (или исключения) психофармакотерапии приведены в таблице 1.
Обозначения: N - показатели не превышают значения, полученные для здоровых детей соответствующего возраста; «плюс» - показатели достоверно выше возрастных нормативов; «минус» - показатели ниже возрастных границ.
Примечание. Для оценки степени отклонения биологических показателей от нормы использовались экспертные системы на основании анализа аналогичных показателей у здоровых детей соответствующего возраста.
Как следует из таблицы 1, при 4-х типах РАС наблюдаются разные варианты корреляции клинических и биологических показателей. При эволютивно-конституциональном аутизме - синдроме Аспергера (F84.5), и клинические и биологические маркеры не превышают нормативные показатели, что свидетельствует об отсутствии активного течения болезни, и не требует назначения психофармакотерапии. Выраженность аутизма в рамках «легкого/умеренного». Больные СА нуждаются в проведении психосоциальной коррекции.
При других типах РАС (синдроме Каннера, детском и атипичном аутизме) на момент обследования психометрические показатели количественной выраженности аутизма попадают в широкие границы бальной оценки «тяжелого аутизма» по шкале CARS (37-60 баллов). Неспецифическая продуктивная кататоническая симптоматика выраженная, по шкале BFCRS (от 25 до 38 баллов). Казалось бы, но клиническим показателям все больные нуждаются в назначении психофармакотерапии.
Но при непсихотическом эволютивно-процессуальном синдроме Каннера (F84.0), дополнительные биологические показатели не превышают нормативные, что свидетельствует об отсутствии активности патологического процесса в мозге. Т.о. больные СК не нуждаются в назначении психофармакотерапии нейролептиками, снимающими остроту состояния. Для улучшения когнитивных функций (маркер - отставание формирования альфа-ритма в ЭЭГ) вводятся ноотропы. Мультидисциплинарная немедикаментозная коррекция и социальное сопровождение необходимы им на протяжении жизни.
Больные психотическими формами РАС: детским аутизмом, переносящие инфантильный психоз, и атипичным аутизмом, переносящие атипичный детский психоз, имеют такие же выраженные клинические маркеры в форме «тяжелого аутизма» и «тяжелой кататонии». Но, в отличие от предыдущего случая, при этих формах РАС «активны» биологические маркеры - повышены показатели иммунитета и избирательно выходят за рамки нормативных значений отдельные компоненты ЭЭГ.
Больные ИП с клинико-биологических позиций нуждаются в назначении комбинированной психофармакотерапии (нейролептиками и ноотропами) в активном периоде течения болезни. Продолжительность терапии соотносится с длительностью активного периода, рамки которого определяются по дополнительным биологическим показателям. По минование активного периода болезни, приоритет в лечении больного остается за немедикаментозной коррекцией.
При АДП «тяжелый» аутизм, «тяжелая» кататония сохраняются, останавливают психическое развитие больного. Дополнительным маркером активности процесса, наря