Гетероциклические соединения и их применение
Иллюстрации
Показать всеИзобретение относится к гетероциклическим пиримидиновым соединениям формулы
, а также к фармацевтическим композициям на их основе. Технический результат: получены новые соединения, которые модулируют мутант-селективную киназную активность рецепторов эпидермального фактора роста (EGFR) и которые применимы в способах лечения заболеваний, связанных с киназной активностью EGFR. 6 н. и 40 з.п. ф-лы, 1 ил., 6 табл., 61 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США №61/409080, поданной 1 ноября 2010 г., №61/411829, поданной 9 ноября 2010 г., №61/412330, поданной 10 ноября 2010 г., и №61/534323, поданной 13 сентября 2011 г., содержание каждой из которых полностью включено в настоящее описание посредством ссылок.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее изобретение относится к соединениям, подходящим для применения в качестве мутант-селективных ингибиторов киназ рецепторов эпидермального фактора роста (EGFR). В настоящем изобретении также предложены фармацевтически приемлемые композиции, содержащие соединения согласно настоящему изобретению, и способы применения указанных композиций для лечения различных заболеваний.
УРОВЕНЬ ТЕХНИКИ
[0003] Тирозиновые протеинкиназы представляют собой класс ферментов, которые катализируют перенос фосфатной группы от АТФ или ГТФ на остаток тирозина, находящийся в белковом субстрате. Действие рецепторных тирозинкиназ состоит в передаче сигналов извне внутрь клетки путем активации вторичных эффекторов переноса посредством фосфорилирования. Указанные сигналы способствуют протеканию различных клеточных процессов, включая пролиферацию, утилизацию углеводов, синтез белков, ангиогенез, рост клеток и выживаемость клеток.
[0004] Существует серьезный прецедент вовлеченности EGFR в развитие рака у человека, поскольку более 60% всех солидных опухолей сверхэкспрессируют по меньшей мере один из указанных белков или их лигандов. Сверхэкспрессия EGFR часто наблюдается в опухолях молочной железы, легких, головы и шеи, мочевого пузыря.
[0005] Активирующие мутации в тирозинкиназном домене EGFR были обнаружены у пациентов с немелкоклеточным раком легкого (Lin N.U., Winer E.Р., Breast Cancer Res 6: 204-210, 2004). Обратимо действующие ингибиторы Тарцева (эрлотиниб) и Иресса (гефитиниб) в настоящее время представляют собой терапию первой линии для пациентов, страдающих немелкоклеточным раком легкого с активирующими мутациями. Наиболее распространенными активирующими мутациями являются L858R и deIE746-A750.
[0006] Кроме того, для большинства пациентов, которые переносили рецидив, приобретенная лекарственная устойчивость, такая как устойчивость, вызванная мутацией остатка гена-привратника Т790М, была обнаружена по меньшей мере у половины таких клинически устойчивых пациентов. Более того, Т790М может также исходно существовать, и может иметь место независимая онкогенная роль мутации Т790М. Например, существуют пациенты с мутацией L858R/T790M, которые никогда не получали лечение гефитинибом. Кроме того, генеративные мутации Т790М EGFR связаны с некоторыми видами наследственного рака легких.
[0007] Современные лекарственные средства, находящиеся на стадии разработки, включая ковалентные ингибиторы второго поколения, такие как BIBW2992, HKI-272 и PF-0299804, эффективны против мутации устойчивости Т790М, однако проявляют дозолимитирующие токсические свойства вследствие одновременного ингибирования WT EGFR. Таким образом, сохраняется необходимость в поиске мутант-селективных ингибиторов киназ EGFR, подходящих для применения в качестве терапевтических агентов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0008] В настоящем изобретении обнаружено, что соединения согласно настоящему изобретению и их фармацевтически приемлемые композиции эффективны в качестве мутант-селективных ингибиторов киназ EGFR. Такие соединения представляют собой соединения, имеющие общую формулу I:
,
или их фармацевтически приемлемую соль, где каждый из n, m, W, G, R1, R2 и R5 определен и описан в настоящей заявке.
[0009] Соединения согласно настоящему изобретению и их фармацевтически приемлемые композиции являются подходящими для лечения раковых заболеваний, связанных с одной или более мутациями EGFR. Такие заболевания, расстройства или состояния включают заболевания, расстройства или состояния, описанные в настоящей заявке.
[0010] Соединения, предложенные в настоящем изобретении, также являются подходящими для изучения киназ в биологических и патологических процессах, изучения путей внутриклеточной сигнальной трансдукции, опосредуемых такими киназами, и сравнительной оценки новых ингибиторов киназ.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг. 1 представлен МС-анализ, подтверждающий ковалентное модифицирование T790M/L858R EGFR соединением I-4.
ПОДРОБНОЕ ОПИСАНИЕ НЕКОТОРЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
1. Общее описание соединений согласно настоящему изобретению
[0011] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы I:
или его фармацевтически приемлемая соль, где:
n составляет 0, 1 или 2;
m составляет 0, 1 или 2, причем m и n одновременно не равны 0;
W представляет собой -О- или -NH-;
R1 представляет собой -OR;
каждый R независимо представляет собой C1-4 алкил или C1-4 фторалкил;
R2 представляет собой -CF3, Cl или Br;
G представляет собой -O-, -NR3-, -S(O)2- или -CH(OR4)-;
R3 представляет собой -C(O)-R, -C(O)OR, -C(O)NHR, -SO2-R, -SO2NH2, -C(O)-C1-4 алкилен-ОН или -SO2-С1-4 алкилен-ОН;
R4 представляет собой водород, C1-4 алкил или C1-4 фторалкил и
R5 представляет собой водород или -C(O)OR.
[0012] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы I:
или его фармацевтически приемлемая соль, где:
n составляет 0, 1 или 2;
m составляет 0, 1 или 2, причем m и n одновременно не равны 0;
W представляет собой -О- или -NH-;
R1 представляет собой -OR;
каждый R независимо представляет собой C1-4 алкил или C1-4 фторалкил;
R2 представляет собой -CF3, Cl или Br;
G представляет собой -O-, -NR3- или -CH(OR4)-;
R3 представляет собой -C(O)-R, -C(O)OR, -C(O)NHR, -SO2-R, -SO2NH2, -C(O)-C1-4 алкилен-ОН или -SO2-С1-4 алкилен-ОН и
R4 представляет собой водород, C1-4 алкил или C1-4 фторалкил.
[0013] В настоящей заявке термин «C1-4 алкилен» означает двухвалентный насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий 1-4 атомов углерода.
[0014] В некоторых вариантах реализации настоящего изобретения n составляет 0, а G представляет собой -CH(OR4)-.
[0015] В некоторых вариантах реализации настоящего изобретения m составляет 0, а G представляет собой -CH(OR4)-.
[0016] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы I или I-a, где W представляет собой -NH-.
[0017] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы I или I-a, где W представляет собой -NH-, а R2 представляет собой -CF3.
[0018] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы I или I-a, где W представляет собой -O-, а R2 представляет собой -Cl.
[0019] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы I-a, где G представляет собой -O-, с получением таким образом соединения формулы II:
или его фармацевтически приемлемой соли, где W и R2 определены выше для формулы I и I-a.
[0020] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы II, где W представляет собой -NH-.
[0021] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы II, где W представляет собой -NH-, а R2 представляет собой -CF3.
[0022] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы I, I-a или II, для которых выполняются по меньшей мере одно или оба следующих условия:
(a) W представляет собой -О- или -NH- и
(b) R2 представляет собой -CF3 или Cl.
[0023] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы I, I-a или II, для которых выполняются по меньшей мере одно или оба следующих условия:
(a) W представляет собой -О- и
(b) R2 представляет собой -CF3 или Cl.
[0024] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы I, I-a или II, для которых выполняются по меньшей мере одно или оба следующих условия:
(a) W представляет собой -NH- и
(b) R2 представляет собой -CF3 или Cl.
[0025] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы I, где G представляет собой -NR3-, с получением таким образом соединения формулы III:
или его фармацевтически приемлемой соли, где W, R2 и R3 определены выше для формулы I.
[0026] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы I-a, где G представляет собой -NR3-, с получением таким образом соединения формулы III-a:
или его фармацевтически приемлемой соли, где W, R2 и R3 определены выше для формулы I.
[0027] Как определено выше, группа R3 формулы III или III-a представляет собой -C(O)-C1-4 алкил, -SO2-C1-4 алкил, -C(O)-C1-4 алкилен-ОН или -SO2-C1-4 алкилен-ОН. Специалисту в данной области будет понятно, что заместитель R3 у атома азота пиперазина превращает азот в «неосновный». Следует иметь в виду, что фрагмент, содержащий такой «неосновный» азот, «не склонен» действовать в качестве акцептора протонов, например, по сравнению с соответствующим вторичным амином или его алкилзамещенным производным.
[0028] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы III или III-a, где W представляет собой -NH-.
[0029] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы III или III-a, где W представляет собой -NH-, a R2 представляет собой -CF3.
[0030] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы III или III-a, где W представляет собой -O-, а R2 представляет собой -Cl.
[0031] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы III или III-а, для которых выполняются по меньшей мере одно, по меньшей мере два или все три следующих условия:
(a) W представляет собой -О- или -NH-;
(b) R2 представляет собой -CF3 или Cl и
(c) R3 представляет собой -С(O)СН3 или -SO2CH3.
[0032] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы III или III-а, для которых выполняются по меньшей мере одно, по меньшей мере два или все три следующих условия:
(a) W представляет собой -NH-;
(b) R2 представляет собой -CF3 или Cl и
(c) R3 представляет собой -С(O)СН3.
[0033] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы III или III-а, для которых выполняются по меньшей мере одно, по меньшей мере два или все три следующих условия:
(a) W представляет собой -NH-;
(b) R2 представляет собой -CF3 или Cl и
(c) R3 представляет собой -SO2CH3.
[0034] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы III или III-a, для которых выполняются по меньшей мере одно, по меньшей мере два или все три следующих условия:
(a) W представляет собой -O-;
(b) R2 представляет собой -CF3 или Cl и
(c) R3 представляет собой -С(O)СН3.
[0035] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы III или III-a, для которых выполняются по меньшей мере одно, по меньшей мере два или все три следующих условия:
(a) W представляет собой -O-;
(b) R2 представляет собой Cl и
(c) R3 представляет собой -С(O)СН3.
[0036] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы III или III-a, для которых выполняются по меньшей мере одно, по меньшей мере два или все три следующих условия:
(a) W представляет собой -O-;
(b) R2 представляет собой -CF3 или Cl и
(c) R3 представляет собой -SO2CH3.
[0037] В некоторых вариантах реализации настоящего изобретения предложено соединение формулы III или III-a, для которых выполняются по меньшей мере одно, по меньшей мере два или все три следующих условия:
(a) W представляет собой -O-;
(b) R2 представляет собой Cl и
(c) R3 представляет собой -SO2CH3.
[0038] Иллюстративные соединения формулы I приведены ниже в Таблице 1.
| Таблица 1. | ||
| Иллюстративные соединения | ||
[0039] В некоторых вариантах реализации настоящего изобретения предложено соединение, приведенное выше в Таблице 1, или его фармацевтически приемлемая соль.
[0040] В некоторых вариантах реализации настоящего изобретения предложенное соединение не является соединением структуры
.
[0041] В настоящей заявке термин «фармацевтически приемлемая соль» относится к таким солям, которые по результатам тщательной медицинской оценки подходят для применения в контакте с тканями человека и низших животных без чрезмерной токсичности, раздражения, аллергической реакции и т.п. и соответствуют разумному соотношению польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области. Например, S.М. Berge с соавт. подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 1977, 66, 1-19, включенном в настоящее описание посредством ссылки. Фармацевтически приемлемые соли соединений согласно настоящему изобретению включают соли, полученные из подходящих неорганических и органических кислот и оснований. Примерами фармацевтически приемлемых нетоксичных солей присоединения кислоты солей являются соли, содержащие аминогруппу, полученные с применением неорганических кислот, таких как соляная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или органических кислот, таких как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или другими способами, применяемыми в данной области, такими как ионный обмен. Другие фармацевтически приемлемые соли включают такие соли, как адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидройодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерат и т.п.
[0042] Соли, полученные из подходящих оснований, включают соли щелочных металлов, щелочноземельных металлов, аммония и N+(C1-4алкил)4 соли. Типичные соли щелочных или щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния и т.п. Также фармацевтически приемлемые соли при необходимости включают соли, содержащие нетоксичные катионы аммония, четвертичного аммония и амина, полученные с применением противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
2. Описание иллюстративных вариантов реализации настоящего изобретения
[0043] Как подробно описано в настоящей заявке ниже, предложенные соединения представляют собой селективные ингибиторы по меньшей мере одной мутации EGFR. Неожиданно было обнаружено, что предложенные соединения представляют собой селективные ингибиторы по меньшей мере одной мутации EGFR по сравнению с EGFR дикого типа («WT»). В некоторых вариантах реализации настоящего изобретения по меньшей мере одна мутация EGFR представляет собой Т790М. В некоторых вариантах реализации настоящего изобретения по меньшей мере одна мутация EGFR представляет собой делеционную мутацию. В некоторых вариантах реализации настоящего изобретения по меньшей мере одна мутация EGFR представляет собой активирующую мутацию. В некоторых вариантах реализации настоящего изобретения предложенное соединение селективно ингибирует по меньшей мере одну мутацию устойчивости и по меньшей мере одну активирующую мутацию по сравнению с WT EGFR. В некоторых вариантах реализации настоящего изобретения предложенное соединение селективно ингибирует по меньшей мере одну делеционную мутацию и/или по меньшей мере одну точечную мутацию и по существу не ингибирует WT EGFR.
[0044] Мутация EGFR может быть выбрана из Т790М (мутация устойчивости или онкогенная), L858R (активирующая), deIE746-A750 (активирующая), G719S (активирующая) или их комбинации.
[0045] В настоящей заявке термин «селективно ингибирует», применяемый по сравнению с ингибированием WT EGFR, означает, что предложенное соединение ингибирует по меньшей мере одну мутацию EGFR (то есть по меньшей мере одну делеционную мутацию, по меньшей мере одну активирующую мутацию, по меньшей мере одну мутацию устойчивости или комбинацию по меньшей мере одной делеционной мутации и по меньшей мере одной точечной мутации) в ходе по меньшей мере одного анализа, описанного в настоящей заявке (например, биохимического или клеточного). В некоторых вариантах реализации настоящего изобретения термин «селективно ингибирует», применяемый по сравнению с ингибированием WT EGFR, означает, что предложенное соединение является в по меньшей мере 50 раз, по меньшей мере 45 раз, по меньшей мере 40 раз, по меньшей мере 35 раз, по меньшей мере 30 раз, по меньшей мере 25 раз или по меньшей мере 20 раз более сильным ингибитором по меньшей мере одной мутации EGFR, определенной и описанной в настоящей заявке, по сравнению с WT EGFR.
[0046] В настоящей заявке термин «по существу не ингибирует WT EGFR» означает, что селективный ингибитор по меньшей мере одной мутации EGFR, определенной и описанной выше в настоящей заявке, ингибирует EGFR при верхнем пределе обнаружения в по меньшей мере одном анализе, описанном в настоящей заявке (например, биохимическом или клеточном, подробно описанных в Примерах 56-58). В некоторых вариантах реализации настоящего изобретения термин «по существу не ингибирует WT EGFR» означает, что предложенное соединение ингибирует WT EGFR с IC50, составляющей по меньшей мере 10 мкМ, по меньшей мере 9 мкМ, по меньшей мере 8 мкМ, по меньшей мере 7 мкМ, по меньшей мере 6 мкМ, по меньшей мере 5 мкМ, по меньшей мере 3 мкМ, по меньшей мере 2 мкМ или по меньшей мере 1 мкМ.
[0047] В некоторых вариантах реализации настоящего изобретения предложенное соединение селективно ингибирует (а) по меньшей мере одну активирующую мутацию и (b) T790M и (с) по существу не ингибирует WT. В некоторых вариантах реализации настоящего изобретения по меньшей мере одна активирующая мутация представляет собой делеционную мутацию. В некоторых вариантах реализации настоящего изобретения по меньшей мере одна активирующая мутация представляет собой точечную мутацию. В некоторых вариантах реализации настоящего изобретения активирующая мутация представляет собой deIE746-A750. В некоторых вариантах реализации настоящего изобретения активирующая мутация представляет собой L858R. В некоторых вариантах реализации настоящего изобретения активирующая мутация представляет собой G719S.
[0048] В некоторых вариантах реализации настоящего изобретения по меньшей мере одна мутация EGFR представляет собой L858R и/или Т790М.
[0049] Не желая ограничиваться какой-либо конкретной теорией, полагают, что введение предложенного соединения пациенту, имеющему по меньшей мере одну активирующую мутацию, может предупредить образование мутации устойчивости Т790М. Таким образом, в некоторых вариантах реализации настоящего изобретения предложен способ ингибирования активирующей мутации у пациента, включающий введение пациенту предложенного соединения или его композиции, описанной в настоящей заявке.
[0050] Специалисту в данной области будет понятно, что некоторые пациенты имеют мутацию Т790М онкогенного типа, то есть мутация Т790М существует до введения пациенту любого ингибитора EGFR и, следовательно, является онкогенной. Таким образом, в некоторых вариантах реализации настоящего изобретения предложен способ ингибирования онкогенной Т790М у пациента, включающий введение пациенту предложенного соединения или его композиции, описанной в настоящей заявке.
[0051] Тарцева (эрлотиниб) и Иресса (гефитиниб) представляют собой лекарственные средства терапии первой линии для пациентов с активирующими мутациями, однако проявляют токсические свойства, ограничивающие дозу, вследствие одновременного ингибирования WT EGFR. Кроме того, лекарственные средства, в настоящее время находящиеся на стадии разработки, включая ковалентные ингибиторы второго поколения, такие как BIBW2992, HKI-272 и PF-0299804, эффективны против мутации устойчивости Т790М, однако проявляют токсические свойства, ограничивающие дозу, вследствие одновременного ингибирования WT EGFR.
[0052] Неожиданно было обнаружено, что предложенные соединения селективно ингибируют каждую из активирующих и делеционных мутаций EGFR. Более того, предложенные соединения по существу не ингибируют WT EGFR и не обладают обусловленными ингибированием WT EGFR токсическими свойствами, ограничивающими дозу.
[0053] Предложенные соединения с указанными свойствами составляют контаст с другими известными ингибиторами EGFR (например, BIBW2992 и HKI-272), которые являются лишь до некоторой степени эффективными против мутантов, но при этом сохраняют активность против WT EGFR, и, следовательно, их применение ограничено токсическими свойствами, обусловленными ингибированием WT EGFR. В Таблице 2 ниже приведены значения GI50 для Тарцева, BIBW2992 и HKI-272 по сравнению с предложенными соединениями I-2 и I-4 (где номера соединений соответствуют номерам соединений в Таблице 1 выше). Данные, представленные в Таблице 2, представляют собой значения GI50, полученные в результате анализа клеточной пролиферации, подробно описанного в Примере 58, где клетки А431 экспрессируют WT EGFR, HCC827 экспрессируют EGFR, обладающий делеционной мутацией deIE746-A750, а клетки Н1975 экспрессируют EGFR, обладающий двойной мутацией L858R/T790M.
| Таблица 2. | |||||
| Сравнительные значения GI50 (нМ) | |||||
| Линия клеток | Тарцева | BIBW2992 | HKI-272 | I-2 | I-4 |
| А431 | 298 | 20 | 4 | >1000 | 500-1000 |
| HCC827 | 12 | <5 | 78 | 10-100 | 10-100 |
| Н1975 | >5000 | 196 | 13 | 10-100 | 10-100 |
[0054] В некоторых вариантах реализации настоящего изобретения предложенное соединение является в по меньшей мере 50 раз, по меньшей мере 45 раз, по меньшей мере 40 раз, по меньшей мере 35 раз, по меньшей мере 30 раз, по меньшей мере 25 раз или по меньшей мере 20 раз более сильным ингибитором по меньшей мере одной мутации EGFR по сравнению с WT EGFR, что установлено путем биохимического анализа, подробно описанного в Примере 56 ниже. В некоторых вариантах реализации настоящего изобретения предложенное соединение является в по меньшей мере 20, по меньшей мере 15 или по меньшей мере 10 раз более сильным ингибитором по меньшей мере одной мутации EGFR по сравнению с WT EGFR, что установлено путем клеточного анализа, подробно описанного в Примере 58 ниже.
[0055] В некоторых вариантах реализации настоящего изобретения предложенное соединение является по меньшей мере в 50 раз, по меньшей мере в 45 раз, по меньшей мере в 40 раз, по меньшей мере в 35 раз, по меньшей мере в 30 раз, по меньшей мере в 25 раз или по меньшей мере в 20 раз более сильным ингибитором по меньшей мере одной делеционной мутации EGFR по сравнению с WT EGFR по данным биохимического анализа, подробно описанного в Примере 56 ниже. В некоторых вариантах реализации настоящего изобретения предложенное соединение является по меньшей мере в 20, по меньшей мере в 15 или по меньшей мере в 10 раз более сильным ингибитором по меньшей мере одной делеционной мутации EGFR по сравнению с WT EGFR по данным клеточного анализа, подробно описанного в Примере 58 ниже.
[0056] В некоторых вариантах реализации настоящего изобретения предложенное соединение является по меньшей мере в 50 раз, по меньшей мере в 45 раз, по меньшей мере в 40 раз, по меньшей мере в 35 раз, по меньшей мере в 30 раз, по меньшей мере в 25 раз или по меньшей мере в 20 раз более сильным ингибитором L858R и/или Т790М мутации EGFR по сравнению с WT EGFR по данным биохимического анализа, подробно описанного в Примере 56 ниже. В некоторых вариантах реализации настоящего изобретения предложенное соединение является по меньшей мере в 20, по меньшей мере в 15 или по меньшей мере в 10 раз более сильным ингибитором L858R и/или Т790М мутации EGFR по сравнению с WT EGFR поданным клеточного анализа, подробно описанного в Примере 58 ниже.
[0057] В некоторых вариантах реализации настоящего изобретения предложенное соединение является по меньшей мере в 20, по меньшей мере в 15 или по меньшей мере в 10 раз более сильным ингибитором двойного мутанта в клетках Н1975 по сравнению с WT EGFR по данным анализа передачи сигналов, подробно описанного в Примере 57.
[0058] В некоторых вариантах реализации настоящего изобретения предложенное соединение ингибирует по меньшей мере одну мутацию EGFR селективно по сравнению с WT EGFR и по сравнению с другими протеинкиназами (например, ErbB2, ErbB4, ТЕС-киназой и/или JAK3). Следует иметь в виду, что акриламидный фрагмент, представленный в формуле I, представляет собой реакционноспособную группу, образующую ковалентную связь с ключевым остатком цистеина в связывающем домене по меньшей мере одной мутации EGFR селективно по сравнению с WT EGFR и другими протеинкиназами. Протеинкиназы, содержащие остаток цистеина в связывающем домене, известны специалисту в данной области. Такие Протеинкиназы, содержащие остаток цистеина в связывающем домене, включают Протеинкиназы семейства ТЕС (включая ТЕС, ВТК, ITK, BMX, JAK3 и RLK). В некоторых вариантах реализации настоящего изобретения остаток цистеина сохраняется у протеинкиназ всего подсемейства, таких как ErbB1 (обычно называемого EGFR), ErbB2 и ErbB4.
[0059] Не желая ограничиваться какой-либо конкретной теорией, полагают, что предложенные соединения необратимо ингибируют (то есть ковалентно модифицируют) по меньшей мере одну мутацию EGFR селективно по сравнению с WT EGFR и другими протеинкиназами. В некоторых вариантах реализации настоящего изобретения предложенное соединение необратимо ингибирует по меньшей мере одну мутацию EGFR селективно по сравнению с по меньшей мере одной протеинкиназой, выбранной из ErbB1, ErbB2, ErbB4, ТЕС, ВТК, ITK, BMX, JAK3 или RLK.
[0060] Тем не менее, в некоторых вариантах реализации настоящего изобретения предложенные соединения незначительно ингибируют, обратимо или необратимо, другие Протеинкиназы. В некоторых вариантах реализации настоящего изобретения предложенное соединение является селективным в случае ингибирования по меньшей мере одного мутанта EGFR по сравнению с протеинкиназами, не являющимися мишенями, таким образом избегая воздействия и не приобретая токсических свойств, обусловленных их ингибированием.
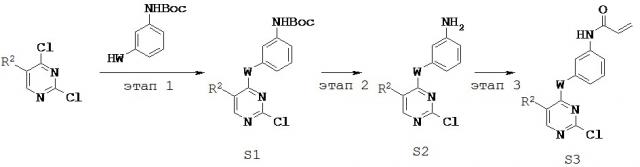
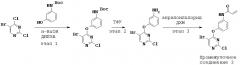
3. Синтез и промежуточные соединения
[0061] В некоторых вариантах реализации настоящего изобретения предложенное соединение синтезируют с применением одного или более следующих этапов и промежуточных соединений:
,
где R2 и W определены и описаны в разделах и подразделах настоящей заявки.
[0062] На этапе 1 обеспечивают проведение реакции R2-замещенного 2,4-дихлорпиримидина, например, с Вос-защищенным 3-аминофенолом с получением промежуточного соединения S1. В некоторых вариантах реализации настоящего изобретения этап 1 проводят в щелочных условиях. В некоторых вариантах реализации настоящего изобретения этап 1 проводят в присутствии третичного амина. В некоторых вариантах реализации настоящего изобретения этап 1 проводят в присутствии основания Хунига. В некоторых вариантах реализации настоящего изобретения этап 1 проводят в протонном растворителе. В некоторых вариантах реализации настоящего изобретения этап 1 проводят в спиртовом растворителе. В некоторых вариантах реализации настоящего изобретения этап 1 проводят в н-бутаноле.
[0063] На этапе 2 с промежуточного соединения S1 снимают защитную группу с получением промежуточного соединения S2. В некоторых вариантах реализации настоящего изобретения с промежуточного соединения S1 снимают защитную группу с применением кислоты. В некоторых вариантах реализации настоящего изобретения с промежуточного соединения S1 снимают защитную группу в присутствии трифторуксусной кислоты.
[0064] На этапе 3 промежуточное соединение S2 ацилируют с применением акрилоильной группы с получением промежуточного соединения S3. В некоторых вариантах реализации настоящего изобретения ацилирующий агент представляет собой акрилоилхлорид. В некоторых вариантах реализации настоящего изобретения этап 3 осуществляют в галогенированном растворителе. В некоторых вариантах реализации настоящего изобретения этап 3 проводят в дихлорметане.
[0065] Промежуточное соединение S3 может быть подвергнут реакции с различными анилинами с получением соединений, описанных в настоящей заявке.
4. Применение, состав и введение
Фармацевтически приемлемые композиции
[0066] Согласно другому варианту реализации в настоящем изобретении предложена композиция, содержащая соединение согласно настоящему изобретению или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, адъювант или наполнитель. Количество соединения в композиции согласно настоящему изобретению представляет собой такое количество, которое является эффективным для поддающегося измерению ингибирования протеинкиназы, в частности для ингибирования по меньшей мере одного мутанта EGFR селективно по сравнению с WT EGFR, в биологическом образце или в организме пациента. В некоторых вариантах реализации настоящего изобретения по меньшей мере один мутант EGFR представляет собой мутант с мутацией Т790М. В некоторых вариантах реализации настоящего изобретения по меньшей мере один мутант EGFR представляет собой мутант с делеционной мутацией EGFR. В некоторых варианта