Модифицированные дендритные клетки и их применение в лечении злокачественных опухолей
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к модифицированным in vitro дендритным клеткам, и может быть использовано в медицине. Полученные определенным способом дендритные клетки используют в составе фармацевтической композиции или набора для регулируемой экспрессии полипептида, обладающего функцией интерлейкина-12 (IL-12) в присуствии активирующего лиганда. Изобретение позволяет эффективно ингибировать рост опухоли у млекопитающих. 6 н. и 30 з.п. ф-лы, 18 ил., 5 пр.
Реферат
Область изобретения
[0001] Настоящее изобретение относится к области генной терапии при лечении злокачественных опухолей. Согласно одному варианту реализации, настоящее изобретение относится к модификации дендритных клеток для обеспечения регулируемой экспрессии интерлейкина-12, и применению указанных клеток в терапии. Согласно другому варианту реализации, настоящее изобретение относится к модификации дендритных клеток для обеспечения регулируемой экспрессии интерлейкина-12 (IL-12) и/или интерферона-альфа (IFN-alpha), и применению указанных клеток в терапии.
Уровень техники
[0002] Описание различных патентов, патентных заявок и публикаций полностью включено в данное описание посредством ссылок. Тем не менее, упоминание любой ссылки в настоящей заявке не следует рассматривать как признание того, что указанная публикация доступна в качестве предшествующего уровня техники по отношению к настоящему изобретению.
[0003] Интерлейкин-12 принадлежит к семейству цитокинов 1-го типа, участвующих во множестве биологических процессов, включающих в себя (но не ограниченных) защитные иммунные реакции и подавление процессов образования опухолей (Abdi et al, 2006; Adorini, 1999; Adorini, 2001; Adorini et al, 2002; Adorini et al, 1996; Akhtar et al, 2004; Akiyama et al, 2000; Al-Mohanna et al, 2002; Aliberti et al, 1996; Allavena et al, 1994; Alii and Khar, 2004; Alzona et al, 1996; Amemiya et al, 2006; Araujo et al, 2001; Arulanandam et al, 1999; Athie et al, 2000; Athie-Morales et al, 2004; Bertagnolli et al, 1992; Bhardwaj et al, 1996; Biedermann et al, 2006; Brunda and Gately, 1994; Buchanan et al, 1995; Romani et al, 1997; Rothe et al, 1996; Satoskar et al, 2000; Schopf et al, 1999; Thomas et al, 2000; Tsung et al, 1997; Wolf et al, 1994; Yuminamochi et al, 2007). Увеличивающееся количество публикаций по данной тематике указывает на то, что воздействие на интерлейкин-12 может являться весьма многообещающим средством контроля заболеваний человека (например, рака).
[0004] Несмотря на то, что интерлейкин-12 рассматривают в качестве потенциального терапевтического агента для лечения рака, благодаря его способности поддерживать активность противоопухолевых NK-клеток 1-го типа, CD4+ Т-клеток и CD8+ Т-клеток (Trinchiery 2003), имеющиеся данные о токсичности рекомбинантного интерлейкина-12 человека (rhlL-12) по отношению к пациентам (Atkins et al, 1997), а также ограниченность источников получения рекомбинантного интерлейкина-12 человека по системе контроля качества GMP для клинического применения препятствуют успешному развитию способов терапии, основанных на использовании интерлейкина-12. Таким образом, разумно предположить, что способы генной терапии могут предоставить возможности более безопасного и надежного лечения. Действительно, первая фаза клинических испытаний внутри- или околоопухолевого введения рекомбинантной вирусной (Sangro et al, 2004; Triozzi et al, 2005) или плазмидной кДНК интерлейкина-12 (Heinzerling et al, 2005) или аутологичных фибробластов с модифицированным геном интерлейкина-12 (Kang et al, 2001) была показана и безопасность и хорошая переносимость.
[0005] Тем не менее, объективные клинические результаты у пациентов с меланомой или различными видами карциномы, которых подвергали указанной генной терапии, были редкими, многовариантными, временными и, в большинстве своем, локализированными в месте применения (Kang et al, 2001; Sangro et al, 2004; Triozzi et al, 2005; Heinzerling et al, 2005). В случаях, когда излечивание заболевания было частичным или полным, наблюдали повышенные количества противопоухолевых эффекторых лимфоцитов (Heinzerling et al, 2005; Sangro et al, 2004) и циркулирующих опухолеспецифических CD8+ Т-клеток (Heinzerling et al, 2005), что вполне согласуется с примированием перекрестно-реагирующим антигеном Т-клеток у таких пациентов.
[0006] Кроме того, имеется несколько дополнительных оснований для беспокойства, например: непредвиденная токсичность, связанная с генной терапией дендритных клеток (DC) интерлейкином-12, и возможные зависимые от интерлейкина-12 изменения в миграции терапевтических дендритных клетках, вырабатывающих интерлейкин-12 (DC.IL-12) после внутриопухолевого введения. Есть также опасения, касающиеся времени синтеза интерлейкина-12 в трансдуцированных дендритных клетках, что наиболее важно для эффективного лечения (Murphy et al, 2005).
[0007] Поскольку примирование перекрестно-реагирующим антигеном специфических Т-клеток наиболее эффективно осуществляется дендритными клетками, которые служат естественным, но регулируемым источником интерлейкина-12 (Berard et al, 2000), недавние отчеты о превосходной пре-клинической эффективности генной терапии с применением DC.IL-12, вызвали огромный интерес (Satoh et al, 2002; Tatsumi et al, 2003; Yamanaka et al, 2002). Так, оказалось, что внутриопухолевое введение дендритных клеток, модифицированных для выработки интерлейкин-12р70 (путем их инфицирования рекомбинантным аденовирусом), вызывает значительное повышение интенсивности примирования перекрестно реагирующим антигеном спектра высокоактивных опухолеспецифических CD8+ T-клеток, вместе с отторжением опухолей у исследуемых мышей (Tatsumi et al, 2003). Ввиду применения рекомбинантного аденовируса, кодирующего интерлейкин-12 мыши под контролем CMV-промотора (rAd.cIL12, Tatsumi et al, 2003), экспрессия интерлейкина-12 модифицированными дендритными клетками была постоянной, вследствие этого, нельзя было определить относительное иммунологическое действие этого цитокина, поначалу в месте повреждения опухоли, а затем и внутри инфильтрованных опухолью (дренирующих опухоль) лимфатических узлах. Таким образом, существует необходимость в дендритных клетках, модифицированных для регулируемой экспрессии интерлекийна-12. Настоящее изобретение обеспечивает многообещающий терапевтический результат при использовании таких клетке.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0008] Настоящее изобретение обеспечивает рекомбинантный вектор, который кодирует белок, обладающий функцией интерлейкина-12 под контролем регулируемого промотора. Согласно одному из вариантов реализации настоящего изобретения, указанный вектор представляет собой аденовирусный вектор, кодирующий интерлейкин-12р70 и под контролем регулируемого промотора, который активируется при условии присоединения к нему растворимого низкомолекулярного лиганда, такого, как диацилгидразин, например: RG-115819, RG-115830 или RG-115932. Такой вектор позволяет контролировать экспрессию интерлейкина-12 дендритными клетками (rAD.RheoIL12).
[0009] Согласно одному из вариантов реализации, настоящее изобретение обеспечивает вектор для регулируемой экспрессии белка, обладающего функций интерлейкина-12, который содержит полинуклеотид, кодирующий переключатель гена, содержащий по меньшей мере одну последовательность транскрипционного фактора, причем указанная, по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, функционально связанный с промотором, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12, при этом, указанный полинуклеотид связан с промотором, который активируется вышеуказанным лиганд-зависимым транскрипционным фактором. Согласно другому варианту реализации, настоящее изобретение обеспечивает вектор для регулируемой экспрессии белка, обладающего функций интерлейкина-12 и/или интерферона-альфа, который содержит: (1) полинуклеотид, который кодирует переключатель гена, при этом, указанный переключатель содержит по меньшей мере одну последовательность транскрипционного фактора, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, функционально связанный с промотором, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12 и/или полинуклеотид, кодирующий белок, который обладает функцией интерферона-альфа, при этом, указанный полинуклеотид связан с промотором, который активируется вышеуказанным лиганд-зависимым транскрипционным фактором.
[0010] Например, настоящее изобретение обеспечивает вектор для регулируемой экспрессии белка, обладающего функцией интерлейкина-12, который содержит полинуклеотид, который кодирует переключатель гена, причем указанный полинуклеотид содержит: (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12, при этом, указанный полинуклеотид связан с промотором, который активируется вышеуказанным лиганд-зависимым транскрипционным фактором. Также, настоящее изобретение обеспечивает вектор для регулируемой экспрессии белка, обладающего функцией интерлейкина-12 и/или белка, обладающего функцией интерферона-альфа, и содержащий полинуклеотид, кодирующий переключатель гена, причем указанный полинуклеотид содержит: (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12 и/или полинуклеотид, кодирующий белок, который обладает функцией интерферона-альфа, при этом, указанный полинуклеотид связан с промотором, который активируется вышеуказанным лиганд-зависимым транскрипционным фактором.
[ООП] Кроме того, настоящее изобретение обеспечивает способ получения популяции дендритных клеток, регулируемо экспрессирующих белок, обладающий функцией интерлейкина-12, посредством модификации указанных дендритных клеток рекомбинантным вектором, обеспечивающим регулируемую экспрессию белка, обладающего функцией интерлейкина-12, например: rAd.RheoIL12. Согласно другому варианту реализации, настоящее изобретение обеспечивает способ получения популяции дендритных клеток, регулируемо экспрессирующих белок, обладающий функцией интерлейкина-12 и/или белок, обладающий функцией интерферона-альфа, путем модификации дендритных клеток рекомбинантным вектором, обеспечивающим регулируемую экспрессию белка, обладающего функцией интерлейкина-12 и/или интерферона-альфа.
[0012] Согласно одному из вариантов реализации, настоящее изобретение обеспечивает способ получения популяции дендритных клеток, регулируемо экспрессирующих белок, обладающий функцией интерлейкина-12, включающий в себя модификацию по меньшей мере части дендритных клеток путем введения в них вектора, содержащего: (1) полинуклеотид, кодирующий переключатель гена, который содержит по меньшей мере одну последовательность транскрипционного фактора, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, функционально связанный с промотором, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12, при этом, указанный полинуклеотид связан с промотором, который активируется вышеуказанным лиганд-зависимым транскрипционным фактором. Согласно другому варианту реализации, настоящее изобретение обеспечивает способ получения популяции дендритных клеток, регулируемо экспрессирующих белок, обладающий функцией интерлейкина-12 и/или белок, обладающий функцией интерферона-альфа, включающий в себя модификацию по меньшей мере части дендритных клеток путем введения в них вектора, содержащего: (1) полинуклеотид, кодирующий переключатель гена, который содержит по меньшей мере одну последовательность транскрипционного фактора, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, функционально связанный с промотором, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12 и/или полинуклеотид, кодирующий белок, который обладает функцией интерферона-альфа, при этом, указанный полинуклеотид связан с промотором, который активируется вышеуказанным лиганд-зависимым транскрипционным фактором.
[0013] Например, настоящее изобретение обеспечивает способ получения популяции дендритных клеток, управляемо экспрессирующих белок, обладающий функцией интерлейкина-12, включающий в себя модификацию по меньшей мере части дендритных клеток путем введения в них вектора, содержащего полинуклеотид, который кодирует переключатель гена, причем данный полинуклеотид содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12, при этом, данный полинуклеотид связан с промотором, который активируется вышеуказанным лиганд-зависимым транскрипционным фактором. Настоящее изобретение также обеспечивает способ получения популяции дендритных клеток, управляемо экспрессирующих белок, обладающий функцией интерлейкина-12 и/или белок, обладающий функцией интерферона-альфа, включающий в себя модификацию по меньшей мере части дендритных клеток путем введения в них вектора, содержащего полинуклеотид, который кодирует переключатель гена, причем данный полинуклеотид содержит: (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12 и/или полинуклеотид, кодирующий белок, который обладает функцией интерферона-альфа белок, при этом, указанный полинуклеотид связан с промотором, который активируется вышеуказанным лиганд-зависимым транскрипционным фактором.
[0014] Также, настоящее изобретение обеспечивает популяцию дендритных клеток, модифицированных для регулируемой экспрессии белка, обладающего функцией интерлейкина-12, с применением рекомбинантного вектора, обеспечивающего регулируемую экспрессию белка, который обладает функцией интерлейкина-12, например, вектора rAd.RheoIL12. Было показано, что дендритные клетки, инфицированные rAd.RheoIL12, вырабатывают повышенные количества интерлейкина-12 только после обработки активирующим лигандом. Другой вариант реализации относится к популяции дендритных клеток, модифицированных для регулируемой экспрессии белка, обладающего функцией интерлейкина-12 и/или белка, обладающего функцией интерферона-альфа, с применением рекомбинантного вектора, обеспечивающего регулируемую экспрессию белка, который обладает функцией интерлейкина-12 и/или белка, который обладает функцией интерферона-альфа. Подходящие лиганды включают в себя, но не ограничиваются следующими: RG-115830, RG-115932, RG-115819, RSL1 и другими диацилгидразинами.
[0015] Согласно одному из вариантов реализации, настоящее изобретение обеспечивает модифицированные in vitro дендритные клетки, содержащие вектор, включающий в себя полинуклеотид, кодирующий переключатель гена, который содержит: (1) по меньшей мере одну последовательность транскрипционного фактора, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, функционально связанный с промотором, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12, связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором. Согласно другому варианту реализации, настоящее изобретение обеспечивает модифицированные in vitro дендритные клетки, содержащие вектор, включающий в себя полинуклеотид, кодирующий переключатель гена, который содержит: (1) по меньшей мере одну последовательность транскрипционного фактора, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, функционально связанный с промотором, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12, и/или полинуклеотид, кодирующий белок, который обладает функцией интерферона-альфа, связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором.
[0016] Например, настоящее изобретение обеспечивает модифицированные in vitro дендритные клетки, содержащие вектор, включающий в себя полинуклеотид, кодирующий переключатель гена, содержащий: (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий белок, обладающий функцией интерлейкина-12, связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным in vitro фактором. Настоящее изобретение обеспечивает модифицированные дендритные клетки, содержащие вектор, включающий в себя полинуклеотид, кодирующий переключатель гена, причем полинуклеотид содержит: (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12, и/или полинуклеотид, кодирующий белок, который обладает функцией интерферона-альфа, связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором.
[0017] Также, настоящее изобретение обеспечивает фармацевтическую композицию, содержащую популяцию дендритных клеток, модифицированных для регулируемой экспрессии, белка, который обладает функцией интерлейкина-12, с помощью рекомбинантного вектора, регулируемо экспрессирующего обладающий функцией интерлейкина-12 белок, например: вектора rAd.RheoIL12. Согласно другому варианту реализации, настоящее изобретение обеспечивает фармацевтическую композицию, содержащую популяцию дендритных клеток, модифицированных для управляемой экспрессии белка, обладающего функцией интерлейкина-12 и/или белка, обладающего функцией интерферона-альфа с помощью рекомбинантного вектора, регулируемо экспрессирующего обладающий функцией интерлейкина-12 белок и/или обладающий функцией интерферона-альфа белок.
[0018] Также, настоящее изобретение обеспечивает способ лечения злокачественных опухолей, таких как меланомы или глиомы. Лечение геном интерлейкина-12 показало противоопухолевую активность в исследованиях на модельных животных, при применении рекомбинантного кДНК-вектора (Faure et al, 1998; Sangro et al, 2005), и, еще в большее степени, при применении в форме генетически модифицированных дендритных клеток (Satoh et al, 2002; Svane et al, 1999; Tatsumi et al, 2003; Yamanaka et al, 2002). К настоящему моменту, тем не менее, процедуры первой фазы клинических испытаний на людях терапии геном интерлейкина-12, включающие в себя применения плазмидных или вирусных векторов, не обеспечили стойкого объективного клинического эффекта в контролировании злокачественных опухолей (Heinzerling et al, 2005; Kang et al, 2001; Sangro et al, 2004; Triozzi et al, 2005). Лечение геном интерлейкина-12, основанное на дендритных клетках (с или без интерферона-альфа) и описанное в данном материале, показало многообещающую терапевтическую перспективу.
[0019] Согласно одному из вариантов реализации, настоящее изобретение обеспечивает способ лечения опухоли у млекопитающего, включающий:
(a) внутриопухолевое введение в микроокружение опухоли популяции модифицированных in vitro дендритных клеток, содержащих вектор, включающий полинуклеотид, кодирующий переключатель гена и содержащий (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий обладающий функцией интерлейкина-12 белок, и связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором, и
(b) введение указанному млекопитающему эффективного количество лиганда, активирующего указанный лиганд-зависимый транскрипционный фактор; что приводит к стимулированию экспрессии обладающего функцией интерлейкина-12 белка и излечиванию указанной опухоли.
[0020] Например, настоящее изобретение обеспечивает способ лечения опухоли у млекопитающего, включающий в себя следующие стадии:
(a) модификацию in vitro дендритных клеток для регулируемой экспрессии белка, обладающего функцией интерлейкина-12;
(b) внутриопухолевое введение в микроокружение опухоли, указанных, модифицированных in vitro дендритных клеток; и
(c) введение указанному млекопитающему терапевтически эффективной дозы активирующего лиганда;
что приводит к стимулированию экспрессию белка, обладающего функцией интерлейкина-12, и излечиванию вышеуказанной опухоли.
[0021] Согласно следующим вариантам реализации, настоящее изобретение обеспечивает способ лечения опухоли у млекопитающего, включающий: (а) внутриопухолевое введение в микроокружение опухоли модифицированных in vitro дендритных клеток, причем указанные дендритные клетки содержат вектор, включающий полинуклеотид, кодирующий переключатель гена и содержащий (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12 и/или белок, который обладает функцией интерферона-альфа, связанный с промотором, который активируется вышеуказанным лиганд-зависимым фактором транскрипции, и (b) введение указанному млекопитающему терапевтически эффективной дозы активирующего лиганда; что приводит к стимулированию экспрессии белка, обладающего функцией интерлейкина-12, и/или белка, обладающего функцией интерферона-альфа, и излечиванию вышеуказанной опухоли.
[0022] Например, настоящее изобретение обеспечивает способ лечения опухоли у млекопитающего, включающий следующие стадии:
(a) модификация in vitro дендритных клеток для регулируемой экспрессии белка, обладающего функцией интерлейкина-12 и/или белка, обладающего функцией интерферона-альфа;
(b) внутриопухолевое введение в микроокружение опухоли, указанных, модифицированных in vitro дендритных клеток; и
(c) введение указанному млекопитающему терапевтически эффективной дозы активирующего лиганда;
что приводит к стимулированию экспрессию белка, обладающего функцией интерлейкина-12 и/или белка, обладающего функцией интерферона-альфа, и излечиванию вышеуказанной опухоли.
[0023] Также настоящее изобретение обеспечивает способ определения степени эффективности терапии модифицированными дендритными клетками посредством: определения контрольного уровня, который получают в результате измерения уровня экспрессии или активности интерферона-гамма у пациента до начала терапии;
введения дендритных клеток, модифицированных для регулируемой экспрессии белка, обладающего функцией интерлейкина-12, и последующего введения эффективного количества активирующего лиганда; и затем
определения тестового уровня, который получают в результате, измерения уровня экспрессии интерферона-гамма;
сравнения указанного контрольного уровня с указанным тестовым для определения, является ли терапевтический режим эффективным.
[0024] Согласно одному из вариантов реализации, настоящее изобретение обеспечивает способ определения эффективности терапевтического режима пациента, основанного на терапии модифицированными in vitro дендритными клетками,, включающий:
(a) измерения экспрессии и/или активности интерферона-гамма в первом биологическом образце, полученном от нуждающегося в этом пациента перед введением модифицированных in vitro дендритных клеток с получением контрольного уровня;
(b) введение нуждающемуся в этом пациенту дендритных клеток, модифицированных in vitro для регулируемой экспрессии белка, обладающего функцией интерлейкина-12;
(c) введение пациенту терапевтически эффективной дозы активирующего лиганда;
(d) измерение экспрессии и/или активности интерферона-гамма во втором биологическом образце, полученном от нуждающегося в этом пациента, после введения модифицированных in vitro дендритных клеток и активирующего лиганда с получением тестового уровня;
(e) сравнение указанного контрольного и указанного тестового уровня экспрессии или активности интерферона-гамма, причем повышенный тестовый уровень экспрессии и/или активности, по сравнению с контрольным уровнем говорит об эффективности терапии для данного пациента.
[0025] Согласно другому варианту реализации, настоящее изобретение обеспечивает способ стимуляции регулируемой экспрессии белка, обладающего функцией интерлейкина-12 в дендритных клетках, включающий: (1) введение нуждающемуся в этом млекопитающему эффективного количества популяции модифицированных in vitro дендритных клеток согласно настоящему изобретению; и (2) введение указанному млекопитающему эффективного количества активирующего лиганда для активации лиганд-зависимого транскрипционного фактора.
[0026] Для исследования клинической эффективности, были продолжены исследования проведенные на модели саркомы CMS4 на мышах BALB/c, и оказалось, что внутриопухолевое введение изогенных дендритных клеток, взятых из костного мозга и предварительно инфицированных Ad.cIL12 (конститутивная экспрессия), привело к эффективному отторжению опухоли. (Tatsumi et al., 2003). Отторжение произошло в связи с системной CD8+ T-клеточно опосредованной иммунной реакцией против опухолей CMS4 (Tatsumi et al, 2003).
ПОДРОБНОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
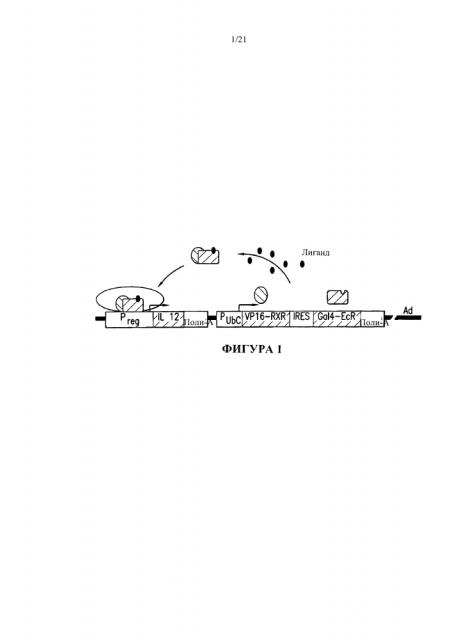
[0027] На Фигуре 1 изображена структура вектора rAd.RheoIL12, из которого удалили области Е1 и Е3 и заменили область Е1 компонентами RheoSwitch® Therapeutic System (RTS)-IL-12. Мотив, обозначенный как ʺIL12ʺ, показывает кодирующие последовательности IL-12p40 и JL-12p35, разделенные участком внутренней посадки рибосомы (IRES).
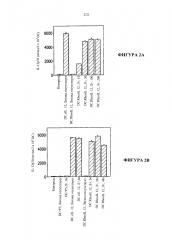
[0028] На Фигуре 2A-2C показано, что модифицированные дендритные клетки регулируемо вырабатывают белок интерлейкин-12 в присутствии RG-115830.
[0029] На Фигуре 3A: показано, что модифицированные дендритные клетки, введенные в микроокружение меланомы, вызывают регресс опухоли у мышей C57B 1/6 на 7-й день после появления у них подкожных опухолей В16, при внутрибрюшинном введении RG-115830, в течение 24 часов после введения дендритных клеток. Фигура 3B-3C: регресс опухоли произошел при постоянном введении RG-115830 в течение суток 1-5, но не произошел при введении RG-115830 только в течение суток 1-2 или 1-3 после введения дендритных клеток.
[0030] На Фигуре 4 показано, что модифицированные дендритные клетки лучше выживают в опухоли и в инфильтрованных опухолью лимфатических узлах (ЛУ) после внутрибрюшинного введения активирующего лиганда, в случае, если введение было произведено в течение 24 часов после инъекции дендритных клеток, при этом выживаемость значительно ниже или равна нулю при введении лиганда в течение 48 и 72 часов после инъекции клеток, соответственно.
[0031] На Фигуре 5A показано, что модифицированные дендритные клетки вызывают сильную периферическую активацию анти-B16 CD8+ T-клеток после внутрибрюшинного введения активирующего лиганда, в случае, если введение было произведено в течение 24 часов после инъекции указанных дендритных клеток. Фигура 5B показывает, что мыши, перед тем получавшие лечение от меланомы, обладают специфической защитой от опухолевых клеток B16, но не от опухолевых клеток MC38 карциномы прямой кишки, когда не зараженные опухолью животные были инфицированы соответствующими клетками B16 меланомы или клетками MC38 карциномы толстой кишки на 45-й день после первичного заражения B16.
[0032] Фигура 6 показывает терапевтические преимущества, обусловленные введением лиганда внутрибрюшинно или орально.
[0033] На Фигуре 7 изображены графики Каплана-Майера, иллюстрирующие динамику выживаемости мышей при глиоме мышей (GL261) в результате внутриопухолевой инъекции дендритных клеток, модифицированных полинуклеотидами, кодирующими интерлейкин-12 и/или интерферон-альфа под контролем RTS. Аббревиатуры на данном рисунке расшифровываются следующим образом: Ad-IFNa - аденовирусный вектор, регулируемо вырабатывающий интерферон-альфа; Ad-RTS-IFHa - аденовирусный вектор, кодирующий интерферон-альфа под контролем RTS; Ad-RTS-IFHa no ligand - аденовирусный вектор, содержащий RTS и интерферон-альфа при отсутствии активирующего лиганда; Ad-rFNa/IL-12 относится к дендритным клеткам, модифицированным аденовирусным вектором, кодирующим интерферон-альфа и интерлейкин-12; и Ad-RTS- EFNa/IL-12 относится к дендритным клеткам, модифицированным двумя аденовирусными векторами, кодирующими интерферон-альфа и интерлейкин-12 под контролем RTS.
[0034] На Фигуре 8 изображена карта аденовирусного вектора Ad-RTS-hTL-12.
[0035] На Фигуре 9 показана выработка интерлейкина-12 дендритными клетками человека, модифицированными аденовирусным вектором Ad-RTS-IL-12 мыши, при разных значениях MOI и разной продолжительности адсорбции вирусов. Трансдукция дендритных клеток человека аденовирусом при разных значениях MOI и разной продолжительности адсорбции вирусов выявила эффективную трансдукцию клеток при 3-часовой адсорбции вирусов и значении MOI, равном 500. Активирующее вещество (ʺADʺ или ʺактивирующий лигандʺ) индуцировало экспрессию интерлейкина-12 указанными дендритными клетками человека.
[0036] На Фигуре 10 показан результат сравнительного анализа эффекта различных, содержащих ген интерлейкина-12 аденовирусных векторов. Вариант SPl-RheoIL-12 оказался наиболее эффективным среди всех вариантов, содержащих Rheoswitch. Spl-RheoIL-12 отличается от oldRheoIL-12 тем, что последовательность AdEasy-1 в нем заменена на последовательность RAPAd (ViraQuest). Аналогичным образом, TTR-RheoIL-12 отличается от oldRheoIL-12 тем, что он содержит минимальный промотор TTR, по направлению транскрипции от сайтов связывания Gal4, который заменяет синтетический минимальный промотор и сайты связывания SpI, а основа последовательности вектора является последовательностью RAPAd (ViraQuest). Как показано на Фигуре 10, Spl-RheoIL-12 оказался аналогичным oldRheoIL-12 и более эффективным, чем TTR-RheolL-12 в отношении уменьшения размера опухоли меланомы B16.
[0037] На Фигуре 11 показано отсутствие формирования опухоли меланомы B16 после повторной инициации опухоли у мышей, перед этим получивших лечение дендритными клетками, содержащими рекомбинантный аденовирусный Rheoswitch-индуцируемый интерлейкин-12. Это говорит о том, что опухолевый рост меланомы B16 блокируется в течение приблизительно 25 суток, когда мышей, обладающих иммуннитетом к B16 подвергали повторной инокуляции через 45 дней после первичного заражения клетками B16. Дендритные клетки мыши были получены из костного мозга мышей B6 путем 7-дневного культивирования в полной среде (RPMI-1640, 10% FBS), содержащей rmIL-4 и rmGM-CSF. Затем CD11c-положительные дендритные клетки выделяли с помощью специфичных частиц MACS согласно протоколу производителя (Miltenyi Biotech) и инфицировали при значении MOI, равном 100, с использованием rAd.IL-12 vs. SP1 vs. TTR), в течение 24 часов до инъекции дендритных клеток 10E6 подкожно (s.c.) в образовавшиеся на 9-й день опухоли меланомы B16 (5 мышей в каждой группе, опухоль на правом боку). Затем часть мышей подвергли ежедневным внутрибрюшинным (i.p.) инъекциям активирующего лиганда RG-115830 (30 мг/кг в 50 мкл диметилсульфоксида, DMSO) в дни 0-4 после введения дендритных клеток. Размер опухоли контролировали каждые 3-4 дня и измеряли в мм2, как произведение ортогональных диаметров. Для оценки специфичности защиты, связанной с терапией, всех животных, у которых отсутствовала опухоль, подвергли повторным инъекциям клеток меланомы 10E5 B16 в левый бок и клеток карциномы толстой кишки MC38 в правый бок на 45-е сутки после первичного инфицирования клетками опухоли B16. Опухоли MC38 были выявлены, в то время как опухоли B16 не образовались.
[0038] Фигура 12 показывает результат сравнительного анализа между количеством дендритных клеток, введенных в опухоль B16 (10E5, 10E6, 103E7), продолжительностью введения лиганда (6 дней или 13 дней) и последующим регрессом опухоли у модельных мышей, зараженных меланомой B16. Лиганды, при введении ежедневно в течение 13 дней в комбинации с дендритными клетками 10E7, оказались наиболее эффективным средством, вызывающим регресс опухолей в течение 25 дней.
[0039] На Фигуре 13 показано, что описанная в данной заявке терапия не была причиной нежелательной потери веса вследствие изнуренного состояния. Изнуренное состояние и потеря веса часто связаны с высокими уровнями интерферона-гамма и фактора некроза опухолей-альфа (TNF-alpha), синтез которых положительно регулируется интерлейкином-12.
[0040] На Фигуре 14 показано, что в результате повторной инициации опухоли у мышей перед этим получивших лечение дендритными клетками, содержащими рекомбинантный аденовирусный RheoSwitch-индуцируемый интерлейкин-12 и активизирующий лиганд RG-115932, опухоли меланомы B16 не формируются. Меланомы B16 развивались в течение 7 дней после подкожных инъекций пяти изогенным мышам B6 в правый бок. На седьмой день, внутриопухолево, в дозах 105, 106 или 107 ввели дендритные клетки DC.SP1-IL-12 (взятые из костного мозга дендритные клетки, инфицированные при значении MOI, равном 100, с применением оптимального переключателя SP1). RG-115932 вводили внутрибрюшинно в день введения дендритных клеток (и затем ежедневно в течение 6 или 13 дней). Каждая группа состояла из 5 животных, рост опухолей контролировали каждые 3-4 дня и протоколировали в виде среднего размера (кв. мм как произведение ортогональных измерений). Во время измерения размеров также оценивали индивидуальные массы животных (Фигура 13). Все животные, избавившиеся от болезни благодаря любому способу лечения, были повторно инокулированы на 50-й день (следующая за первичной прививка опухоли B16) 105 клетками меланомы B16 в противоположный бок (левый бок) относительно первичной опухоли и 105 клетками карциномы толстой кишки MC38 в правый бок. Рост опухолей контролировали каждые 3-4 дня и сравнивали с ростом, наблюдаемым у животных, ранее не получивших лечение (см. Фигура 12). Таким образом, Фигура 14 демонстрирует, что рост опухолей меланомы B16 был блокирован в течение около 24 дней, при повторном введении клеток меланомы B16 иммунным к B16 мышам. Фигура 14 также показывает, что мыши не привитые B16 не были защищены от образования опухолей также, как и MC38-иммунные мыши и мыши, не привитые MC38. MC38 - это вид карциномы толстой кишки, известный специалистам в данной области. Вышеописанное демонстрирует специфичность иммунизации, обусловленной введением в первичную опухоль B16 дендритных клеток, содержащих рекомбинантный аденовирусный Rheoswitch-индуцируемый интерлейкин-12.
[0041] Фигура 15 показывает экспрессию интерлейкина-12 в дендритных клетках мышей, модифицированных Ad-RTS-IL-12, зависимую от дозы активирующего вещества.
[0042] Фигура 16 показывает реакцию Включения/Выключения экспрессии интерлейкина-12 в присутствие или отсутствие RG-115932 в клетках НТ1080, модифицированных Ad-RTS-IL-12 мыши.
[0043] Фигура 17 показывает, что реакция CD8+ Т-клеток на иммунизацию путем внутриопухолевой инъекции аденовирусных модифицированных дендритных клеток в присутствие или отсутствие активирующего вещества (AD) соответствует противоопухолевой реакции.
[0044] Фигура 18 иллюстрирует активацию синтеза интерлейкина-12 человека во взятых от трех добровольцев дендритных клетках человека, модифицированных аденовирусным вектором, кодирующим интерлейкин-12 под контролем RTS.
ДЕТАЛЬНОЕ ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0045] SEQ ID NO: 1 - полная нуклеотидная последовательность гена p35 интерлейкина-12 мыши дикого типа.
[0046] SEQ ID NO: 2 - полная нуклеотидная последовательность гена p40 интерлейкина-12 мыши дикого типа.
[0047] SEQ ID NO: 3 - полная нуклеотидная последовательность гена p35 интерлейкина-12 человека дикого типа.
[0048] SEQ ID NO: 4 - полная нуклеотидная последовательность гена p40 интерлейкина-12 человека дикого типа.
[0049] SEQ ID NO: 5 - полная полипептидная последовательность белка p35 интерлейкина-12 мыши дикого типа.
[0050] SEQ ID NO: 6 - полная аминокислотная последовательность белка p40 интерлейкина-12 мыши дикого типа.
[0051] SEQ ID NO: 7 - полная аминокислотная последовательность белка p35 интерлейкина-12 человека дикого типа.
[0052