Способ идентификации штаммов вида vibrio parahaemolyticus методом пцр в режиме реального времени
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и генетической инженерии. Изобретение может быть использовано при экспресс-диагностике представителей вида V. parahaemolyticus.
Амплификацию исследуемой ДНК проводят с помощью сконструированных праймеров: vppC For CGG-CAA-GCG-TGG-TTT-GTG-AC, vppC Rev CGT-TGA-TGC-AAC-TTG-CAC-CTT-G, в присутствии специфичногозонда: vppC ProbaA (-ROX-CG-TTC-ACA-ACC-ACC-AAC-AGC-AAC-GAC-TTG-BHQ2-). Зонд содержит в своем составе флуоресцентную метку ROX и гаситель флуоресценции BHQ2. Учет результатов идентификации происходит автоматически на мониторе компьютера в виде кривых и в численных значениях, отражающих уровень флуоресцентного свечения определенной длины волны. Если возникает флуоресцентный сигнал с длинной волны 605 нм, характерный для флуорофора ROX, то делают заключение о наличии в пробе ДНК штаммов вида V. parahaemolyticus. ПЦР проводят в объеме 25 мкл. Реакционная смесь содержит: ТаgДНК-полимераза - 0,5 мкл, 10×dNTP - 0,5 мкл, 5×буфер - 5 мкл, праймер For - 2 мкл, праймер Rev - 2 мкл, зонд - 1,5 мкл, исследуемая ДНК - 5 мкл, деионизированная вода - 8,5 мкл. ПНР реакции проходит с соблюдением следующих этапов: 1 этап - 95,0°С - 15 мин, 2 этап - 94,0°С - 30 сек, 55,0°С - 30 сек, 72,0°С - 30 сек., при этом повтор 2 этапа 35 циклов, 3 этап - 10,0°С – хранение, 4 этап - 55°С - 30 сек учет результатов. 2 з.п. ф-лы, 2 пр., 2 ил.
Реферат
Предлагаемое изобретение относится к области биотехнологии и генетической инженерии и может быть использовано при экспресс-диагностике представителей вида V. parahaemolyticus.
В последние годы все большее внимание уделяется случаям пищевых инфекций среди людей, вызываемых галофильными вибрионами. Наиболее частым этиологическим агентом диарейных заболеваний, вызванных этими микроорганизмами, являются штаммы V. parahaemolyticus.
Средой обитания представителей вида V. parahaemolyticus является морская вода, а основным фактором передачи человеку служат инфицированные ими гидробионты. Опасность заражения V. parahaemolyticus существует везде, где население использует в питании продукты моря и контактирует с морской водой. Поэтому для практического здравоохранения важно быстро и достоверно определить возбудителя в исследуемом материале.
В настоящее время существует большое количество микробиологических методов детекции, основанных на культивировании, выделении чистых культур и серотипирования этих вибрионов. Сложность идентификации и дифференциации парагемолитических от других близкородственных видов вибрионов традиционными методами обусловлена их большим фенотипическим сходством, вариабельностью признаков и как следствие относительной диагностической ценностью отдельных таксономических тестов.
В связи с этим весьма перспективен метод ПЦР с видоспецифичными праймерами, позволяющий определить в геноме бактерий участки молекулы ДНК, специфичные для каждого вида микроорганизма (1, 2, 3).
Данный метод обладает рядом преимуществ по сравнению с традиционным бактериологическим и серологическим методами, так как сочетает в себе быстроту и простоту исполнения, а также потенциально высокую специфичность и чувствительность при выявлении патогенных микроорганизмов.
Однако недостатком данного метода является необходимость учета результатов реакции с помощью электрофореза, что требует дополнительного времени наличия сложного оборудования (печи для плавления агарозы, камеры для электрофореза, источника тока, трансиллюминатора, регистрирующей аппаратуры) и расходных материалов (агарозы, буферов).
Кроме того, для учета результатов реакции амплификации нуклеиновых кислот методом электрофореза необходима отдельная рабочая зона, оснащенная необходимым оборудованием. Эти обстоятельства усложняют использование метода ПЦР с учетом результатов с помощью электрофореза в геле.
В последние годы широкое распространение во многих странах получил способ идентификации микроорганизмов с помощью полимеразной цепной реакции с детекцией продуктов амплификации в режиме реального времени (4). Основными преимуществами, которого является объединение этапов амплификации и детекции, что помимо упрощения процедуры анализа, снижает риск перекрестной контаминации, возможность проведения количественного анализа, имеет высокую специфичность и чувствительность.
За прототип выбран способ идентификации штаммов вида V. parahaemolyticus методом мультиплексной ПНР с использованием праймеров, специфичных для вида V.parahaemolyticus(5), где использовали для идентификации V.parahaemolyticus нуклеотидную последовательность генов металлопротеазы (коллагеназы) - vppC.
Однако, помимо сложностей связанных с электрофоретическим методом учета результатов, недостатком данного способа является невозможность их использования на территории РФ, так как в соответствии с письмом Роспотребнадзора №04-18010/15, на основании ч. 1 ст. 38 Ф3 от 21.11.2011 №323 и ФЗ №532 от 31.12.2014 наборы реагентов для выявления ДНК возбудителей инфекционных заболеваний подлежат государственной регистрации в установленном порядке. В Российской Федерации отсутствуют зарегистрированные олигонуклеотидные праймеры, зонды для видовой идентификации вида V. parahaemolyticus.
Технической задачей предлагаемого изобретения является разработка нового, в режиме реального времени, эффективного, достоверного способа идентификации вида V. parahaemolyticus на основе метода ПЦР.
Поставленная задача достигается тем, что способ идентификации штаммов вида V. parahaemolyticus методом ПЦР в режиме реального времени, включает выделение хромосомной ДНК из исследуемого материала, постановку ПЦР со специфическими праймерами и зондами, с последующим учетом полученных результатов, причем амплификацию исследуемой ДНК проводят с помощью сконструированных праймеров:
vppC For CGG-CAA-GCG-TGG-TTT-GTG-AC,
vppC Rev CGT-TGA-TGC-AAC-TTG-CAC-CTT-G,
в присутствии специфичного зонда:
vppC ProbaA (-ROX-CG-TTC-ACA-ACC-ACC-AAC-AGC-AAC-GAC-TTG- BHQ2- ),
при этом зонд содержит в своем составе флуоресцентную метку ROX и гаситель флуоресценции BHQ2, учет результатов идентификации происходит автоматически на мониторе компьютера в виде кривых и в численных значениях, отражающих уровень флуоресцентного свечения определенной длины волны, если возникает флуоресцентный сигнал с длинной волны 605 нм, характерный для флуорофора ROX, то делают заключение о наличии в пробе ДНК штаммов вида V. parahaemolyticus.
При этом ПЦР проводят в объеме 25 мкл и реакционная смесь содержит: ТаgДНК-полимераза - 0,5 мкл, 10×dNTP - 0,5 мкл, 5×буфер - 5 мкл, праймер For - 2 мкл, праймер Rev - 2 мкл, зонд - 1,5 мкл, исследуемая ДНК - 5 мкл, деионизированная вода - 8,5 мкл.
Кроме того ПЦР реакции проходит с соблюдением следующих этапов:
1 этап - 95,0°С - 15 мин,
2 этап - 94,0°С - 30 сек,
55,0°С - 30 сек,
72,0°С - 30 сек,
при этом повтор 2 этапа 35 циклов,
3 этап - 10,0°С – хранение,
4 этап - 55°С - 30 сек учет результатов.
Обоснование выбора праймеров и зондов
С помощью программного обеспечения PrimerM (ФКУЗ Ростовский-на-Дону противочумный институт Роспотребнадзора) и BLASTNCBI был проанализирован участок гена металлопротеазы (коллагеназы) вида V. parahaemolyticus в результате чего определен специфический фрагмент гена, который был использован в качестве мишени для конструирования специфического зонда, комплементарного соответствующей последовательности ДНК. Для амплификации в ПЦР фрагмента ДНК, содержащего мишень для зонда и в соответствии с нуклеотидной последовательностью зонда были сконструированы и синтезированы специфичные для вида V. parahaemolyticus праймеры.
Зонд позволяет проводить детекцию специфических продуктов ПЦР, гибридизуясь на них и впоследствии разрушаясь под воздействием TagДНК-полимеразы во время различных этапов амплификации, что приводит к началу флуоресцентного свечения флуорофора. Используется специфический зонд vppCProbaA (-CG-TTC-ACA-ACC-ACC-AAC-AGC-AAC-GAC-TTG-3), содержащий в своем составе флуоресцентную метку ROX, гаситель флуоресценции BHQ2, позволяет идентифицировать представителей вида V. parahaemolyticus.
Способ осуществляется следующим образом.
Для постановки ПЦР суточные агаровые культуры суспендируют в дистиллированной воде до 1×109 микробных клеток в 1 мл и обеззараживают прогреванием при 99°С в течение 15 минут. Затем клетки осаждают центрифугированием при 10 тыс. об./мин. в течение 5 минут и используют прозрачные супернатанты в качестве ДНК-матриц.
Следующий этап заключается в составлении реакционной смеси для ПЦР. Реакцию проводят в 25 мкл смеси следующего состава (на 1 пробу):
ДНК-полимераза - 0,5 мкл
10×dNTP-0,5 мкл
5×буфер - 5 мкл
Праймер vpp For(CGG-CAA-GCG-TGG-TTT-GTG-AC) - 2 мкл
Праймер vppC Rev(CGT-TGA-TGC-AAC-TTG-CAC-CTT-G) - 2 мкл
Зонд vppC ProbaA (-ROX-CG-TTC-ACA-ACC-ACC-AAC-AGC-AAC-GAC-TTG- BHQ2-)-1,5 мкл
Исследуемая ДНК - 5 мкл
Деионизированная вода - 8,5 мкл
После приготовления реакционной смеси осуществляют постановку реакции амплификации в автоматическом детектирующем амплификаторе ДТ322 (ДНК-технология, Россия) или ДТ-Lite (ДНК-технология, Россия), в которых заданы следующие этапы амплификации (программа амплификации VppC55):
1 этап - 95,0°С - 15 мин,
2 этап - 94,0°С - 30 сек,
55,0°С - 30 сек,
72,0°С - 30 сек,
при этом повтор 2 этапа 35 циклов,
3 этап - 10,0°С – хранение,
4 этап - 55°С - 30 сек - учет результатов.
Учет результатов амплификации происходит автоматически в ходе проведения ПЦР с помощью детектирующего амплификатора. При наличии в исследуемой пробе ДНК гена металлопротеазы (коллагеназы) вида V. parahaemolyticusc с помощью используемой пары специфических праймеров гибридизируется зонд, так как является комплементарным ему (фрагменту), а последующее разрушение зонда Taq-полимеразой приводит к началу флуоресцентного свечения флуорофора ROX с длиной волны 605 нм, которое регистрируется прибором.
Учет детекции флуоресцентного свечения по соответствующей длине волны в амплификаторе отражается на мониторе компьютера, связанного с прибором, в виде графиков, на которых представлены кривые и численные значения, отражающие уровни флуоресцентного свечения определенной длинны волны, соответствующие каждой пробе взятой для исследования.
Преимущества предлагаемого изобретения:
- Высокая специфичность реакции за счет использования высокоспецифичного флуоресцентного зонда и праймеров.
- Использование режима учета ПЦР в реальном времени.
- Высокая специфичность и достоверность результата.
- Сокращение трудозатрат исследования в отличие от использования традиционных микробиологических методов.
Пример 1
Идентификация клинических штаммов V. parahaemolyticus способом ПЦР в реальном времени. Штаммы V. parahaemolyticus №13580, 17161, 16754, 16762, 17078, 16920 с точно установленной видовой принадлежностью взяты из коллекции ФКУЗ Ростовского-на-Дону противочумного института Роспотребнадзора. В качестве отрицательного контроля был взят штамм V. alginolyticus 16594.
Суточные агаровые культуры суспендировали в дистиллированной воде до 1×109 микробных клеток в 1 мл и обеззараживали прогреванием при 99°С в течении 15 минут. Затем клетки осаждали центрифугированием при 10 тыс. об./мин. в течении 5 минут. Затем проводили постановку Real-TimeПЦР с выделенной ДНК в амплификаторе ДТ-Lite (ДНК-технология, Россия) с использованием предложенных нами праймеров и зонда. ПЦР проводили с использованием программы амплификации VppC55 по вышеизложенной технологии.
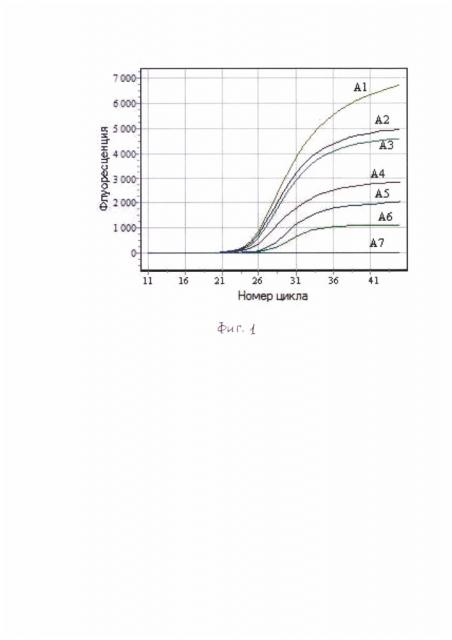
Результаты ПЦР учитывают в реальном времени. Наличие флуоресцентного сигнала с длинной волны 605 нм, характерной для флуорофора ROX (фигура 1),
где А1-А6 - клинические штаммы V. parahaemolyticus №13580, 17161, 16754, 16762, 17078, 16920;
А7 - отрицательный контроль штамм V. alginolyticus №16594.
График показывает, что кривые штаммов АгАб имеют флуоресцентный сигнал с длиной волны 605 нм, что подтверждает их принадлежность к виду V. parahaemolyticus
Пример 2
Идентификация штаммов V. parahaemolyticus, выделенных из морской воды методом Real-Time PCR. Штаммы V. Parahaemolyticus №18758, 19132 с точно установленной видовой принадлежностью были взяты из коллекции ФКУЗ Ростовский-на-Дону противочумный институт Роспотребнадзора. В качестве отрицательного контроля был взят штамм V. alginolyticus №16672.
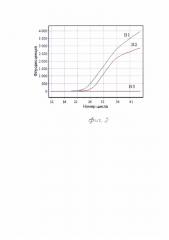
Исследование проводили как в примере 1. Программа и условия проведения амплификации сходные. Детектирующее флуоресцентное свечение молекулы флуорофора ROX (длинна волны 605 нм), связанной с зондом свидетельствует о принадлежности исследуемых штаммов к виду
V.parahaemolyticus (фигура 2), где кривые штаммов В1-В2 - V.parahaemolyticus №18758, 19132; ВЗ - отрицательный контроль штамм V. alginolyticus№l6672.
Использование предлагаемого изобретения позволяет за счет набора реагентов, который включает два сконструированных праймера и специфичный зонд проводить идентификацию представителей вида V. parahaemolyticus методом полимеразной-цепной реакции в режиме реального времени (Real-Time PCR). Это позволит достоверно, быстро и эффективно проводить детекцию и дифференцировать от близкородственных видов штаммы V. Parahaemolyticus.
Кроме того, простое в исполнении тестирование, невысокая себестоимость, высокая чувствительность и специфичность данных праймеров и зонда даст возможность применять их в практике бактериологических лабораторий центров гигиены и эпидемиологии, лечебно-профилактических, противочумных и других учреждений.
Источники информации
1. Khamesipour F., Noshadi Е., Moradi М., Raissy М., 2014 Detection of Vibrio spp. in shrimp from aquaculture sites in Iran using polymerase chain reaction (PCR)//J. AACL Bioflux. - 2014. - Vol. 7, №1. - P. 1-7.
2. Chakraborty R., Sinha S., Mukhopadhyay A.K., Asakura M., Yamasaki S., Bhattacharya S.K. et al. Species-specific identification of Vibrio fluvialis by PCR targeted to the conserved transcriptional activation and variable membrane tether regions of the toxR gene // J. Med. Microbiol. - 2006. - Vol. 55. - P. 805-808.
3. Reham A.A., Amani M.S. Specific Detection of Pathogenic Vibrio species in Shellfish by Using Multiplex Polymerase Chain Reaction // J. Global Veterinaria. - 2012. - Vol. 8, №5. - P. 525-531.
4. Panicker G., Bej A.K. Real-time PCR detection of Vibrio vulnificus in oysters: comparison of oligonucleotide primers and probes targeting vvhA// J. Appl. Environ. Microbiol. - 2005. - Vol.71, №10. - P. 5702-5709.
5. Di Pinto A., Ciccarese G., Tantillo G. A collagenase-targeted bultiplex PCR assay for identification of Vibrio alginolyticus, Vibrio cholerae, and Vibrio parahaemolyticus // J. of Food Protection. - 2005. - Vol.68, №1. - P. 150-153.
1. Способ идентификации штаммов вида V. parahaemolyticus методом ПЦР в режиме реального времени, включающий выделение хромосомной ДНК из исследуемого материала, постановку ПЦР со специфическими праймерами и зондами, с последующим учетом полученных результатов, отличающийся тем, что амплификацию исследуемой ДНК проводят с помощью сконструированных праймеров:
vppC For CGG-CAA-GCG-TGG-TTT-GTG-AC,
vppC Rev CGT-TGA-TGC-AAC-TTG-CAC-CTT-G,
в присутствии специфичного зонда:
vppC ProbaA (5'-ROX-CG-TTC-ACA-ACC-ACC-AAC-AGC-AAC-GAC-TTG-BHQ2-3'),
при этом зонд содержит в своем составе флуоресцентную метку ROX и гаситель флуоресценции BHQ2, учет результатов идентификации происходит автоматически на мониторе компьютера в виде кривых и в численных значениях, отражающих уровень флуоресцентного свечения определенной длины волны, если возникает флуоресцентный сигнал с длинной волны 605 нм, характерный для флуорофора ROX, то делают заключение о наличии в пробе ДНК штаммов вида V. parahaemolyticus.
2. Способ по п. 1, отличающийся тем, что ПЦР проводят в объеме 25 мкл и реакционная смесь содержит: ТаgДНК-полимераза - 0,5 мкл, 10×dNTP - 0,5 мкл, 5×буфер - 5 мкл, праймер For - 2 мкл, праймер Rev - 2 мкл, зонд - 1,5 мкл, исследуемая ДНК - 5 мкл, деионизированная вода - 8,5 мкл.
3. Способ по п. 1, отличающийся тем, что ПЦР реакции проходит с соблюдением следующих этапов:
1 этап - 95,0°C - 15 мин,
2 этап - 94,0°C - 30 сек,
55,0°C - 30 сек,
72,0°C - 30 сек,
при этом повтор 2 этапа 35 циклов,
3 этап - 10,0°C – хранение,
4 этап - 55°C - 30 сек учет результатов.