Использование биогенеза микрорнк в экзосомах для диагностики и лечения
Иллюстрации
Показать всеПредставлен способ выявления ракового биомаркера у субъекта in vitro. Охарактеризованный способ включает получение от субъекта биологического образца; измерение уровня RISC-белка во фракции экзосом образца и/или активности процессинга первичной микроРНК или активности процессинга предшественника микроРНК во фракции экзосом образца и эталонного образца; идентификацию того, что субъект обладает раковым биомаркером, на основании (i) выявления RISC-белка во фракции экзосом образца, полученного от субъекта, или (ii) выявления активности процессинга микроРНК во фракции экзосом образца, которая отсутствует в эталонном образце. Изобретение может быть использовано при диагностике рака. 20 з.п. ф-лы, 6 табл., 2 пр., 112 ил.
Реферат
[001] В данной заявке заявлено преимущественный приоритет согласно предварительной заявке на патент 61/791301, поданной 15 марта 2013 г., содержание которой в полном объеме включено в настоящий документ посредством ссылки.
[002] Данное изобретение выполнено при государственной поддержке по грантам №№ ЕВ 003472, ЕВ 006462, СА 135444, СА 125550, СА 155370, СА 151925, DK 081576 и DK 055001, предоставленным Национальными институтами здравоохранения, и грантам №№ EFRI-1240410, СВЕТ-0922876 и СВЕТ-1144025, предоставленным Национальным научным фондом. В данном изобретении государство имеет определенные права.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
1. Область техники
[003] Данное изобретение в целом относится к области молекулярной биологии, онкологии и медицины. Конкретнее, оно относится к способам выявления раковых заболеваний по уникальному содержанию их экзосом и способам улучшенного лечения на основе ингибирующих РНК.
2. Описание предшествующего уровня техники
[004] Все клетки осуществляют связь с окружающей их средой посредством множества разных механизмов, включающих факторы роста, цитокины, гормоны, хемокины, мембраносвязанные белки и липиды. Экзосомы способны опосредовать такие коммуникации и обеспечивать их на больших расстояниях (Mathivanan et al., 2010; Kahlert and Kalluri, 2013). Коммуникация посредством экзосом вероятно может преодолевать ограничения, связанные со стабильностью и диффузией факторов роста цитокинов/хемокинов/гормонов (Mathivanan et al., 2010). Экзосомы представляют собой нановезикулы размером 30-140 нм, которые содержат белки, мРНК и микроРНК (miRNA), защищенные липидным бислоем (Cocucci et al., 2009; Simons и Raposo, 2009; Simpson et al., 2008; Thery et al., 2002). В нескольких последних исследованиях продемонстрировано, что экзосомы секретируются многими типами клеток, включая раковые клетки, стволовые клетки, иммунные клетки и нейроны (Simpson et al., 2008; Thery, 2001). Отмечено, что раковые клетки секретируют больше экзосом, чем нормальные клетки (Taylor и Gercel-Taylor, 2011). Более того, содержание экзосом увеличено в системе кровообращения пациентов с раковыми заболеваниями по сравнению со здоровыми субъектами (Logozzi et al., 2009; Taylor и Gercel-Taylor, 2008); однако, функциональная роль экзосом остается неизвестной. Последние данные дают основание предположить, что экзосомы могут играть важную роль в развитии рака и метастаз (Luga et al., 2012; Peinado et al., 2012; Yang et al., 2011).
[005] Предположение, что экзосомы опосредуют перенос РНК и микроРНК между клетками дополнительно увеличивает сложность коммуникаций клетки с клеткой в организме. RNAi представляет собой природный биологический процесс внутри живых клеток, который принимает участие в контроле экспрессии и активности генов. Изначально исключительно думали, что микроРНК для внеклеточных взаимодействий должны содержаться внутри экзосом (Valadi et al., 2007). После этого несколько сообщений подтвердили присутствие микроРНК в апоптотических тельцах (Zernecke et al., 2009), липопротеинах высокой и низкой плотности (Vickers et al., 2011) (HDL/LDL), больших внеклеточных везикулах, названных микровезикулами и ассоциированных с AGO2 (Arroyo et al., 2011; Li et al., 2012; Turchinovich et al., 2011). Однако, в последнем сообщении высказано предположение, что большинство микроРНК, обнаруженных в сыворотке и слюне человека, главным образом, сконцентрировано внутри экзосом (Gallo et al., 2012). Присутствие микроРНК в экзосомах предполагает возможность регулирования экспрессии генов клеток в удаленных местах (Guescini et al., 2010; Valadi et al., 2007; Mittelbrunn et al., 2011; van Balkom et al., 2013). Посредством регуляции ими трансляции мРНК, микроРНК координируют экспрессию целых наборов генов и придают форму транскриптому организма (Bartel, 2009).
[006] микроРНК накапливаются в экзосомах, полученных из многих типов разных клеток (Valadi et al., 2007). Они представляют собой малые некодирующие РНК длиной 18-24 нуклеотидов (нт), которые посттранскрипционно контролируют экспрессию генов. Они синтезируются посредством последовательных действий эндонуклеаз Drosha и Dicer и внедряются в RISC (РНК-индуцируемый комплекс сайленсинга) для нацеливания на мРНК (Bartel, 2009; Maniataki и Mourelatos, 2005). У мышей с нокаутом гена Dicer, нарушение биосинтеза микроРНК приводит к летальному исходу из-за дефектной пролиферации и дифференциации эмбриональных стволовых клеток (Bernstein et al., 2003; Fukagawa et al., 2004).
[007] МикроРНК действуют посредством последовательность-специфического взаимодействия и спаривания микроРНК-ассоциированного RISC (состоящего из белков Dicer, TRBP и AGO2) с мРНК-мишенями (Bartel, 2009). Это воздействие ингибирует трансляцию и/или вызывает дестабилизацию мРНК (Filipowicz, 2005). Степень комплементарности микроРНК и их мРНК-мишеней обуславливает процесс сайленсинга мРНК или посредством дестабилизации/деградации мРНК или ингибированием трансляции (Ambros, 2004; Bartel, 2009). Если имеется полная комплементарность между последовательностью микроРНК и мРНК, комплекс RISC воздействует, расщепляя связанную мРНК, что обеспечивает ее деградацию (Ambros, 2004; Bartel, 2009). Если нет абсолютной комплементарности, как в большинстве случаев микроРНК в животных клетках, то предотвращается трансляция, чем достигается сайленсинг генов (Ambros, 2004; Bartel, 2009).
[008] Для того, чтобы микроРНК была функциональной и обеспечивала эффективный микроРНК-опосредованный сайленсинг генов, она должна образовывать комплекс с RLC-белками (RISC-нагруженный комплекс) Dicer, TRBP и AGO2. Для механизма RLC для процессирования предшественников микроРНК (пре-микроРНК) требуются Dicer и TRBP, после чего они выходят из ядра через экспортин-5 для образования микроРНК и ассоциации с AGO2. AGO2, связанный со зрелыми микроРНК, составляет минимальный комплекс RISC и в дальнейшем может диссоциировать от Dicer и TRBP (Chendrimada et al., 2005; Gregory et al., 2005; Haase et al., 2005; MacRae et al., 2008; Maniataki и Mourelatos, 2005; Melo et al., 2009). Одноцепочечные микроРНК сами по себе внедряются в RISC очень слабо и, поэтому, не могут эффективно направляться на свои мРНК-мишени для посттранскрипционной регуляции (Tang, 2005; Thomson et al., 2013).
[009] Синтетические миРНК (двухцепочечные) вызывают распад мРНК благодаря совершенному спариванию оснований с их мРНК-мишенями (Ambros, 2004; Bartel, 2009). Такие миРНК непосредственно внедряются в RISC-белки Dicer, TRBP и AGO2 благодаря их двухцепочечной природы (Tang, 2005). Одноцепочечные микроРНК не могут внедриться в RISC и, поэтому, не могут направляться на свои мРНК-мишени для ингибирования трансляции и деградации (Tang, 2005; Thomson et al., 2005).
[0010] В некоторых сообщениях предполагают, что микроРНК, содержащиеся в экзосомах могут влиять на экспрессию генов в клетках-мишенях (Ismail et al., 2013; Kogure et al., 2011; Kosaka et al., 2013; Narayanan et al., 2013; Pegtel et al., 2010; Valadi et al., 2007; Zhang et al., 2010), но остается вопрос: насколько эффективными являются эти микроРНК для сайленсинга мРНК, могут ли они внедряться в RISC как пре-микроРНК для полноценного распознавания мРНК и эффективной блокировки трансляции. В то время как зрелые микроРНК (одноцепочечные) не могут ассоциировать с RISC клеток-мишеней, пре-микроРНК экзосом до некоторой степени могут индуцировать сайленсинг генов присоединением RISC-белков клеток-мишеней. Однако при этом, такой процесс является очень неэффективным и медленным из-за потенциально насыщенного состояния белков, вовлеченных в механизм биогенеза микроРНК клеток-мишеней. В последнем сообщении показано наличие Drosha и Dicer в экзосомах из супернатантов культур клеток, полученных из инфицированных ВИЧ-1 клеток и сыворотки пациентов с ВИЧ (Narayanan et al., 2013). В дополнение к этому, в другом исследовании показано совместное фракционное выделение Dicer, TRBP и AGO2 в поздних эндосомах/МВТ (мультивезикулярных тельцах) (Shen et al., 2013).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0011] Экзосомы, секретированные раковыми клетками, являются уникально похожими на нераковые экзосомы, раковые экзосомы содержат уникальные репертуары микроРНК, а также активные RISC-комплексы, процессирующие РНК. Такие инкапсулированные комплексы РНК-RISC также могли бы применяться для биогенеза микроРНК независимого от клеток и высокоэффективного сайленсинга мРНК в клетках-мишенях.
[0012] В одном варианте реализации изобретения данное описание представляет способ выявления ракового биомаркера у субъекта включающий: (а) получение от субъекта биологического образца; (b) измерение уровней чего-либо из: (i) одной или нескольких микроРНК, выбранных из микроРНК, представленных в табл. 5, во фракции экзосом образца; (ii) предшественника микроРНК; (iii) RISC-белка во фракции экзосом образца; или (iv) активности процессинга микроРНК {например, первичной микроРНК и/или активности процессинга предшественника-микроРНК) во фракции экзосом образца и (с) идентификацию субъекта, обладающего или не обладающего раковым биомаркером, на основании измеренного уровня указанной(ых) микроРНК, предшественника микроРНК, RISC-белка или активности процессинга микроРНК. В некоторых аспектах изобретения способ включает измерение уровня по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10 указанных микроРНК. В дополнительных аспектах изобретения способ включает измерение уровня белка AGO2, TRBP или DICER.
[0013] В некоторых аспектах изобретения биологический образец преимущественно свободен от клеток. К примеру, образец может содержать менее 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 клетки (клеток). В одном аспекте изобретения биологический образец не содержит клеток. В некоторых аспектах изобретения биологический образец может быть образцом лимфы, слюны, мочи или крови (например, плазмы). В дополнительном аспекте изобретения способ может дополнительно включать очистку фракции экзосом образца и/или увеличение продукции фракции экзосом образца.
[0014] В некоторых аспектах изобретения раковое заболевание представляет собой рак молочной железы, рак легких, рак головы и шеи, рак простаты, рак пищевода, рак трахеи, рак головного мозга, рак печени, рак мочевого пузыря, рак желудка, рак поджелудочной железы, рак яичников, рак матки, рак шейки матки, рак яичек, рак толстого кишечника, рак прямой кишки или рак кожи. В некоторых аспектах изобретения раковым заболеванием является рак молочной железы. В одном аспекте изобретения субъекта предварительно лечили от ракового заболевания или у него предварительно хирургическим путем удалили опухоль.
[0015] В некоторых аспектах изобретения идентификация субъекта, обладающего или не обладающего раковым биомаркером, дополнительно включает определение корреляции измеренного(ых) уровня(ей) микроРНК, уровня предшественника микроРНК, уровня RISC или активности процессинга микроРНК с риском развития ракового заболевания. В дополнительном аспекте изобретения идентификация субъекта, обладающего или не обладающего раковым биомаркером, дополнительно включает анализ измеренного(ых) уровня(ей) микроРНК, уровня предшественника микроРНК, уровня RISC или активности процессинга микроРНК с использованием алгоритма. В некоторых случаях анализ может быть выполнен на компьютере.
[0016] В некоторых аспектах изобретения способ по вариантам реализации изобретения дополнительно включает измерение уровня чего-либо из: (i) одной или нескольких микроРНК, выбранных из микроРНК, представленных в табл. 5, во фракции экзосом образца и эталонного образца; (ii) предшественника микроРНК; (iii) RISC-белка во фракции экзосом образца и эталонного образца; или (iv) активности процессинга микроРНК во фракции экзосом образца и эталонного образца; и (с) идентификацию субъекта, обладающего или не обладающего раковым биомаркером, при сравнении уровня(ей) микроРНК, предшественника микроРНК, активности процессинга RISC или микроРНК в образце, полученном от субъекта, с уровнем(ями) микроРНК, предшественника микроРНК, активности процессинга RISC микроРНК в эталонном образце.
[0017] В некоторых аспектах изобретения измерение уровней RISC-белка включает проведение вестерн-блоттинга, ИФА или анализа связывания на матрице с множеством антител. В других аспектах изобретения измерение уровней микроРНК включает измерение уровней процессированных микроРНК. В некоторых случаях измерение уровней микроРНК включает проведение ПЦР-РВ, нозерн-блоттинга или гибридизацию на матрице.
[0018] В некоторых аспектах изобретения способ дополнительно включает предоставление информации того обладает ли субъект раковым биомаркером или нет. Предоставление информации может включать подготовку письменного, устного или электронного отчета. К примеру, отчет может быть предоставлен пациенту, врачу, медицинскому учреждению или страховой компании.
[0019] В дополнительном варианте реализации изобретения данное описание представляет способ лечения субъекта, включающий выбор субъекта, идентифицированного как обладающего раковым биомаркером, в соответствии с вариантами реализации, и назначение субъекту противораковой терапии. К примеру, способ может включать: (а) определение уровня: (i) одной или нескольких микроРНК, выбранных из микроРНК, представленных в табл. 5; (ii) предшественника микроРНК; (iii) RISC-белка или (iv) активности процессинга микроРНК во фракции экзосом образца, полученного от субъекта; (b) выбор субъекта, обладающего раковым биомаркером, на основании уровня указанной(ых) микроРНК, предшественника микроРНК, RISC-белка или активности процессинга микроРНК и (с) лечение выбранного субъекта с помощью противораковой терапии. В некоторых аспектах изобретения противораковая терапия представляет собой химиотерапию, радиационную терапию, гормональную терапию, таргетную терапию, иммунотерапию или хирургическое лечение.
[0020] В дополнительном варианте реализации изобретения данное описание представляет способ выбора субъекта с помощью диагностической процедуры, включающей: (а) определение уровня чего-либо из: (i) одной или нескольких микроРНК, выбранных из микроРНК, представленных в табл. 5; (ii) уровня предшественника микроРНК; (iii) RISC-белка или (iv) активности процессинга микроРНК, во фракции экзосом образца, полученного от субъекта; (b) выбор субъекта, обладающего раковым биомаркером, на основании уровня указанной(ых) микроРНК, RISC-белка или активности процессинга микроРНК и (с) выполнение для субъекта диагностической процедуры. В одном аспекте изобретения диагностическая процедура включает диагностическую визуализацию. Визуализация может быть визуализацией с использованием биопсии, рентгеновской, КТ-, МРТ- или ПЭТ-визуализацией.
[0021] В еще одном дополнительном варианте реализации изобретения данное описание представляет материальный машиночитаемый носитель, содержащий машиночитаемый код, который при выполнении компьютером, обуславливает выполнение компьютером операций, включающий: (а) получение информации, соответствующей уровню чего-либо из: (i) одной или нескольких микроРНК, выбранных из микроРНК, представленных в табл. 5; (ii) предшественника микроРНК; (iii) RISC-белка или (iv) активности процессинга микроРНК, во фракции экзосом образца, полученного от субъекта, и (b) определение относительного уровня одной или нескольких из указанных микроРНК, предшественника микроРНК, RISC-белков или активности процессинга микроРНК по сравнению с эталонным уровнем, причем измененный уровень сравнивался с эталонным уровнем, указывавшим, что субъект обладает раковым биомаркером.
[0022] В некоторых аспектах изобретения функционирование материального машиночитаемого носителя, дополнительно включает получение информации, соответствующей эталонному уровню: (i) одной или нескольких микроРНК, выбранных из микроРНК, представленных в табл. 5; (ii) предшественника микроРНК; (iii) RISC-белка или (iv) активности процессинга микроРНК, во фракции экзосом субъекта, не имеющего ракового заболевания.
[0023] В некоторых аспектах изобретения физический машиночитаемый носитель дополнительно содержит машиночитаемый код, который при выполнении компьютером, обуславливает выполнение компьютером одной или нескольких дополнительных операций, включающих: отправку информации, соответствующей относительному уровню микроРНК, предшественника микроРНК, RISC-белка или активности процессинга микроРНК, на материальное устройство хранения данных.
[0024] В дополнительном аспекте изобретения эталонный уровень хранится на указанном материальном машиночитаемом носителе. В одном аспекте изобретения получение информации включает получение из материального устройства хранения данных информации, соответствующей уровню микроРНК, уровню предшественника микроРНК, RISC-белка или активности процессинга микроРНК в образце, полученном от субъекта. В некоторых аспектах изобретения получение информации дополнительно включает получение информации соответствующей уровню в образце, полученном от субъекта, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 указанных микроРНК.
[0025] В некоторых аспектах изобретения машиночитаемый код, при выполнении компьютером, обуславливает выполнение компьютером операций дополнительно включающих (с) расчет диагностической оценки образца, причем диагностическая оценка представляет собой величину вероятности того, что образец получен от субъекта, имеющего раковое заболевание.
[0026] В дополнительном варианте реализации изобретения данное описание представляет способ выявления ракового биомаркера у субъекта, включающий: (а) получение от субъекта биологического образца; (b) измерение в образце уровня одной или нескольких микроРНК, выбранных из микроРНК, представленных в табл. 5, или ее предшественника микроРНК, и (с) идентификацию субъекта, обладающего или не обладающего раковым биомаркером, на основании измеренного уровня указанной(ых) микроРНК. В одном аспекте изобретения биологический образец преимущественно свободен от клеток. В некоторых аспектах изобретения биологический образец может быть образцом лимфы, слюны, мочи или плазмы. В одном аспекте изобретения способ может дополнительно включать очистку фракции экзосом из жидкости организма.
[0027] В еще одном дополнительном варианте реализации изобретения данное описание представляет способ доставки активной ингибирующей РНК, включающий приведение в контакт клетки с ингибирующей РНК, которая доставляется в ассоциации с комплексом RISC-белка. В одном аспекте изобретения комплекс RISC-белка содержит TRBP, DICER и AGO2. В некоторых аспектах изобретения ингибирующая РНК представляет собой миРНК или мшРНК. В одном аспекте изобретения ингибирующая РНК представляет собой микроРНК человека.
[0028] В некоторых аспектах изобретения ингибирующая РНК и комплекс RISC-белка заключены в липосому, наночастицу или микрокапсулу, содержащие липидный бислой. В одном аспекте изобретения микрокапсула представляет собой экзосому.
[0029] В некоторых аспектах изобретения способ дополнительно включает трансфецирование клетки ингибирующей РНК и комплексом RISC-белка. В другом аспекте изобретения способ дополнительно включает введение субъекту ингибирующей РНК и комплекса RISC-белка.
[0030] В еще одном дополнительном варианте реализации изобретения данное описание представляет композицию, содержащую рекомбинантную или синтетическую ингибирующую РНК в ассоциации с комплексом RISC-белка, причем указанный комплекс заключен в липосому, наночастицу или микрокапсулу. В одном аспекте изобретения комплекс RISC-белка содержит TRBP, DICER и AGO2. В некоторых аспектах изобретения ингибирующая РНК представляет собой миРНК или мшРНК. В некоторых аспектах изобретения ингибирующая РНК представляет собой микроРНК человека. В некоторых аспектах изобретения комплекс заключен в синтетическую липосому, наночастицу или микрокапсулу. В одном аспекте изобретения микрокапсула представляет собой экзосому.
[0031] Некоторые аспекты изобретения варианты реализации изобретения, как подробно описано выше, касаются измерения уровня одной или нескольких микроРНК (или предшественника микроРНК) во фракции экзосом образца, выбранных из представленных в табл. 5. К примеру, способ может включать измерение уровня одной или нескольких микроРНК, выбранных из группы, состоящей из: mmu-miR-709, hsa-miR-1308, mmu-miR-615-3р, hsa-miR-1260b, mmu-miR-1937a, mmu-mir-321-A, hsa-miR-615-3p, hsa-miR-1979, mmu-miR-1937b, hsa-mir-373, mmu-miR-1937c, hsa-miR-1273d-P, mmu-miR-720, mmu-miR-1274a, hsa-mir-565-A, mmu-miR-1931, hsa-miR-1246, hsa-mir-594-P, hsa-mir-321-A, mmu-miR-2145-1-P, hsa-mir-639-P, hsa-miR-720, hsa-miR-1280, mmu-miR-3473, hsa-miR-1260, hsa-miR-1281, mmu-miR-1224-P, mmu-miR-690, hsa-miR-375-P, hsa-miR-4301, mmu-miR-700, mmu-miR-125b-5p, mmu-miR-1191-P, hsa-miR-1274a, hsa-miR-3197, mmu-miR-1935, hsa-miR-1975-P, hsa-miR-4324, hsa-miR-886-3р, hsa-miR-1274b, mmu-miR-1957, hsa-miR-933, hsa-mir-675, hsa-miR-595, mmu-miR-2137, hsa-mir-572-P, mmu-miR-1195, hsa-miR-4294-P, mmu-mir-1899-P, mmu-miR-689-P, hsa-miR-199b-3p, hsa-miR-3117-P, mmu-mir-321-P, mmu-miR-1961-P, hsa-mir-10а, mmu-miR-669d-P, mmu-miR-1937b-2-P, hsa-miR-3125-P, mmu-miR-1934-P, hsa-miR-574-3р, hsa-miR-718, mmu-miR-1198, mmu-miR-2182-P, hsa-miR-1273, mmu-miR-2133-P, hsa-miR-92b*, hsa-miR-1290, hsa-miR-448, mmu-miR-689, mmu-miR-449a, mmu-miR-1937b-4-P, hsa-miR-4286, mmu-miR-1947, mmu-miR-342-3р, hsa-miR-1303-P, mmu-miR-2132, hsa-miR-4321-P, hsa-miR-4256-P, hsa-miR-4311, mmu-miR-130a, mmu-miR-1939, hsa-miR-1268-P, mmu-miR-31, mmu-miR-99b, mmu-miR-2141, hsa-miR-1202-P, mmu-miR-466b-3p, mmu-miR-2133, hsa-miR-1268, hsa-miR-466, mmu-miR-494, hsa-miR-1289, hsa-miR-320b, hsa-miR-4254, hsa-mir-7-3-Р, hsa-miR-923, hsa-miR-764, mmu-miR-291a-3p, mmu-miR-883b-3p, hsa-mir-594-A, mmu-miR-1948-P, hsa-miR-206, hsa-mir-565-P, mmu-miR-467e*, hsa-miR-1826, mmu-miR-467a*, mmu-miR-1983, hsa-miR-324-5p, mmu-let-7c, mmu-miR-1965, hsa-mir-632-P, hsa-miR-181a*MM2GT/AC, hsa-miR-1265, hsa-miR-323b-5p, hsa-mir-1914, hsa-mir-1910, hsa-miR-21, hsa-miR-431*, hsa-miR-3135-P, mmu-miR-187-P, mmu-miR-126-3p, mmu-miR-669a-P, hsa-miR-367, mmu-mir-320-P, hsa-miR-181a*MM1G/C, mmu-miR-484-P, mmu-miR-467c-P, hsa-miR-3154, mmu-miR-466d-3p, hsa-miR-3162-P, mmu-miR-201, mmu-miR-1946a, hsa-miR-937, hsa-miR-3147, hsa-mir-596-P, hsa-miR-3148, hsa-miR-1304, hsa-miR-222MM2GG/AC, mmu-miR-125a-5p, hsa-miR-1272-P, hsa-miR-638, hsa-mir-320, hsa-miR-545*, hsa-mir-1908-P, hsa-let-7d-v2-P, mmu-mir-30d-P, hsa-miR-4297, mmu-miR-182, hsa-miR-3166-P, hsa-miR-494, mmu-miR-669o-P, hsa-miR-566, mmu-miR-1188, mmu-miR-2134-AP, hsa-miR-4259-P, mmu-miR-152, mmu-miR-2134, hsa-miR-3193-AP, hsa-miR-125b, hsa-miR-3124-P, hsa-miR-10b, hsa-miR-455-5p, mmu-miR-144, hsa-miR-130a, hsa-miR-1285, hsa-miR-516b*, hsa-miR-27a, hsa-miR-138-1*, mmu-miR-471, hsa-miR-4298-P, hsa-miR-301b, hsa-mir-147-P, hsa-miR-362-5p, mmu-mir-471-P, mmu-miR-466a-3p, hsa-miR-561, hsa-miR-486-5p, mmu-miR-2861, hsa-miR-587, mmu-miR-375, hsa-mir-329-2-P, mmu-miR-2861-P, hsa-miR-144*, hsa-miR-1255a-P, hsa-mir-519a-2-P, hsa-miR-34c-5p, mmu-miR-466e-3p, mmu-miR-743b-5p, mmu-mir-350-P, mmu-miR-181d, hsa-miR-376a*, hsa-miR-1308-P, mmu-miR-467g, mmu-miR-1946a-P, hsa-miR-147-P, hsa-miR-923-P, mmu-miR-465c-5p, hsa-miR-891a, hsa-miR-28-5p, hsa-miR-4292, mmu-miR-677-P, hsa-miR-4257, hsa-miR-4326, hsa-miR-17*MM2GG/AA, hsa-miR-939-P, mmu-miR-2182, hsa-miR-220c-P, hsa-miR-3132-P, hsa-miR-532-5p, mmu-miR-1947-P, mmu-miR-29a, hsa-miR-3162, hsa-miR-375MM1C/G, hsa-miR-768-3р, mmu-miR-182-P, mmu-miR-205-P, hsa-miR-505, hsa-miR-3146-P, mmu-miR-721, mmu-miR-376c, hsa-miR-1179-P, mmu-miR-1970, hsa-miR-3133-P, hsa-miR-200c, hsa-miR-220a, mmu-miR-100, hsa-miR-1255b, hsa-miR-222MM1G/A, hsa-miR-885-3р, hsa-miR-517b, hsa-miR-200a, hsa-miR-3141, mmu-miR-669h-3p, hsa-miR-1301, hsa-miR-877, hsa-mir-941-2, hsa-mir-487b-P, hsa-miR-4302, hsa-miR-99b, hsa-miR-1253, hsa-let-7a*, hsa-miR-34aMM2CT/TC, hsa-miR-3181-P, hsa-miR-3200, hsa-miR-3129-P, hsa-miR-93*, hsa-miR-548q-P, mmu-miR-466g, mmu-miR-155, hsa-miR-2278-P, hsa-miR-3065-5p, hsa-miR-633, hsa-miR-4265, mmu-miR-2135-P, hsa-miR-190, mmu-miR-669f, hsa-miR-1323, hsa-miR-588, mmu-miR-183*, hsa-mir-941-4, hsa-mir-1913, hsa-miR-2116*, hsa-miR-1178, mmu-miR-196a, mmu-miR-574-3р, hsa-miR-346, mmu-miR-1199, mmu-miR-681, hsa-miR-4292-P, hsa-miR-522, hsa-mir-611-P, hsa-miR-3171, hsa-miR-635, hsa-miR-1197-P, hsa-miR-604, mmu-let-7a*, hsa-miR-335, mmu-miR-466c-3p, mmu-miR-466i, hsa-miR-1297, mmu-miR-338-5p, hsa-mir-526a-2-P, hsa-miR-181aMM2GC/AG, hsa-miR-18, hsa-miR-924-P, mmu-miR-190-P, hsa-miR-345, mmu-miR-711, hsa-miR-3116-2-P, hsa-miR-99a, mmu-miR-26a, hsa-miR- 1248-P, mmu-miR-721-P, mmu-miR-801-P, hsa-miR-1826-P, hsa-miR-1236, hsa-miR-339-5p, mmu-miR-804, mmu-miR-467d*, mmu-miR-1191, hsa-miR-148a, hsa-miR-141, mmu-miR-1937a-P, mmu-miR-696 and hsa-miR-302a (т.е. перечисленных в табл. 5).
[0032] Как используется в данном документе формулировка с единственным числом может означать один или несколько объектов. Как используется в пункте(ах) формулы изобретения, использование слова «включающий, содержащий» со словами в единственном числе может означать один или более одного объекта.
[0033] Использование слова «или» в пунктах формулы изобретения применяется для обозначения «и/или», если только это явно не указано в отношении альтернативных вариантов или альтернативные варианты не являются взаимоисключающими, тем не менее, данное описание подтверждает определение, которое относится только к альтернативным вариантам, и подразумевает «и/или». Как используется в данном документе слово «другой» может означать по меньшей мере второй или несколько.
[0034] Во всем объеме этой заявки слово «около» применяется для указания того, что значение включает собственную вариацию погрешности устройства, способа, примененного для определения величины, или вариацию, которая существует среди исследуемых субъектов.
[0035] Другие объекты, особенности и преимущества по данному изобретению станут очевидными из следующего подробного описания. Однако, следует понимать, что подробное описание и специальные примеры, при указании предпочтительных вариантов реализации изобретения, даются таким образом, чтобы служить только иллюстрацией, поскольку различные изменения и модификации в пределах существа и объема изобретения станут очевидными специалистам в данной области техники из этого подробного описания.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0036] Следующие графические материалы составляют часть данного описания и включены для дополнительной демонстрации некоторых аспектов по данному изобретению. Файл патента или заявки содержит по меньшей мере один графический материал, выполненный в цвете. Копии этого патента или публикации патентной заявки с цветным(и) графическим(и) материалом(ами) будут предоставлены администрацией после запроса и оплаты требуемого сбора. Изобретение может быть лучше понято при рассмотрении одного или нескольких из этих графических материалов в комбинации с подробным описанием специальных вариантов реализации изобретения, представленных в данном документе.
[0037] Фиг. 1A-F. Определение характеристик экзосом. - Онкосомы по сравнению с нормосомами накапливают онкогенные микроРНК. (А) Микрофотография онкосом, полученная с помощью просвечивающей электронной микроскопии (верхнее левое фото, нижнее левое фото и увеличенная вставка; пунктирная линия очерчивает увеличенную область). Нижние правые изображения получены с помощью иммунометок с частицами золота с использованием анти-CD9 антитела и просвечивающей электронной микроскопии. Частицы золота видны в виде черных точек. На графике представлен средний размер препаратов экзосом, полученный при анализе 112 изображений ПЭМ. (В) Изображение экзосом из раковых клеток молочной железы, полученное с помощью атомно-силовой микроскопии. Средний график представляет дисперсию частиц на покровном стекле с диапазоном размеров экзосом. Правый график представляет средний размер препаратов экзосом, полученный при анализе 26 изображений АСМ. (С) Иммуноблот с использованием анти-Dicer антитела на экзосомах, собранных из: линий клеток нетуморогенных мышей (NMuMG) и человека (MCF10A) (левый блот, первое изображение); линий раковых клеток мыши, 67NR и 4Т1 (средний блот, первое изображение); линий раковых клеток человека MCF7 и MDA-MB231 (правый блот, первое изображение). Использованные контроли были: экзосомами, обработанными Тритоном X и далее протеиназой K (Тритон + ПК), для индуцирования лизиса экзосом и последующей деградации экзосомальных белков; экзосомами, обработанными протеиназой K (ПК) для деградации внеэкзосомальных белков; супернатантом после ультрацентрифугирования для сбора экзосом (супернатант). TSG101- (второй ряд) и CD9-иммуноблоты (третий ряд) использовали для подтверждения наличия экзосом. (D) Результаты анализа проточной цитометрии, с использованием антител против маркеров экзосом TSG101, CD9, флотиллина-1 и CD63, полученных из клеток MDA-MB231 экзосом, связанных с гранулами размером 0,4 мкм. (Е) Определение размеров экзосом с помощью спектроскопии рассеяния света (СРС). Калибровка системы проведена с использованием сигналов суспензий стеклянных микросфер в фосфатно-солевом буферном растворе (ФСБ) с номинальными диаметрами 24 нм и 100 нм и полистирольных микросфер с номинальными диаметрами 119 нм, 175 нм, 356 нм и 457 нм. Экспериментальные спектры и результаты подбора показаны на левом графике для стеклянных микросфер с номинальным диаметром 100 нм и полистирольных микросфер с номинальным диаметром 356 нм. На правом графике представлены результаты измерения размеров суспензии раковых экзосом в ФСБ. Вставка показывает тот же график с масштабом вплоть до 10 мкм для исключения потенциальной контаминации препаратов полученных авторами экзосом с клетками и клеточным дебрисом. (F) Распределение размеров экзосом, полученное с использованием оборудования NanoSight. На левом графике представлено распределение размеров частиц в растворе, отображающее средний размер 105 нм, а также не отображающее пиков больших размеров. На правом графике представлено распределение по размеру и концентрации частиц в растворе, полученном с помощью NanoSight. Данные, приведенные на этой фигуре и представленные в виде ± с.о., являются результатом трех независимых экспериментов, каждый проведен в трех повторах.
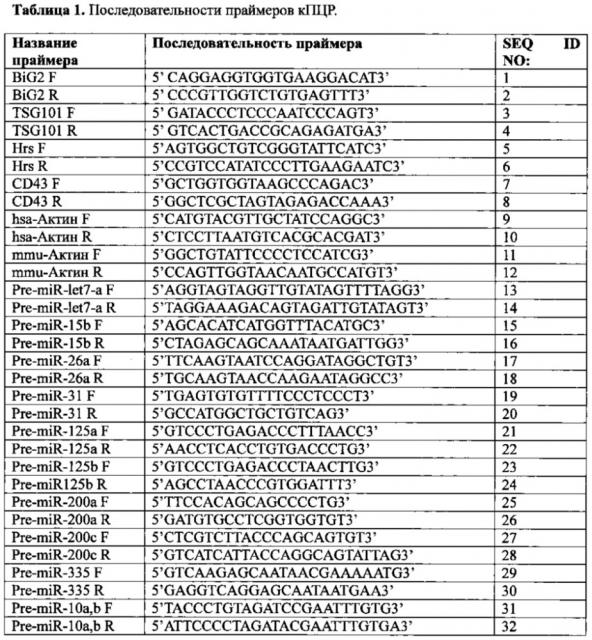
[0038] Фиг. 2A-F. Онкосомы накапливали микроРНК. (А) График корреляции экспрессированных микроРНК в экзосомах MDA-MB231 и экзосомах MCF10A. (В) Графики корреляции среди микроРНК в клетках и соответствующими экзосомами с использованием 6 из дифференциально экспрессировавшихся микроРНК между нормосомами и онкосомами (miR-10a, miR-10b, miR-21, miR-27a, miR-155 и miR-373) после 72 ч бесклеточного культивирования. (С) Нормосомы и онкосомы ресуспендировали в среде DMEM и поддерживали в бесклеточной культуре в течение 24 и 72 ч. После 24 и 72 ч выделяли экзосомы и 15 микроРНК (см. табл. 4) определяли количественно методом кПЦР. Кратность изменения каждой микроРНК в экзосомах после 72 ч бесклеточного культивирования определяли количественно относительно такой же микроРНК в экзосомах после 24 ч бесклеточного культивирования. На графических диаграммах представлены средняя кратность изменения опухолесупрессорных (TS) и онкогенных (ONC) микроРНК в экзосомах, собранных после 72 ч по сравнению с экзосомами, собранными после 24 ч. (D) Нозерн-блоты для miR-10b и miR-21, полученных из нормосом после 24 и 72 ч бесклеточного культивирования, и онкосом без культивирования и с 24 ч, 72 ч и 96 ч бесклеточного культивирования. В качестве контроля нагрузки использовали tRNAMet. Количественное определение проводили с использованием программного обеспечения Image J. (Е) Диаграммы корреляции среди 15 количественно определенных микроРНК в клетках MCF10A, MDA-MB231 и 4Т1 и соответствующим им экзосомам после 72 ч бесклеточного культивирования. Онкосомы проявляли низкие значение корреляции со своими клетками происхождения (средний и правый график) по сравнении с нормосомами (левый график). (F) На графике, полученном с помощью биоанализатора, представленном в единицах флуоресценции (ЕФ) за секунду (с), представлены изображения гелей для определения содержания РНК экзосом в нормосомах и онкосомах.
[0039] Фиг. 3А-Е. Экзосомы содержат пре-микроРНК. (А) Пятнадцать пре-микроРНК, соответствующих зрелым исследованным микроРНК, определяли количественно с использованием кПЦР в экзосомах MCF10A и MDA-MB231. Для каждой пре-микроРНК для отражения ее содержания на график нанесли обратное значение ΔCt и значения представили в виде ± с.о. (В) Онкосомы и нормосомы ресуспендировали в среде DMEM и поддерживали в условиях бесклеточной культуры в течение 24 и 72 ч. После 24 и 72 ч еще раз извлекали экзосомы и 15 пре-микроРНК определяли количественно методом кПЦР. На графиках, представленных в виде ± с.о., показана кратность изменения каждой пре-микроРНК в экзосомах MCF10A и MDA-МВ231 после 72 ч бесклеточного культивирования относительно 24 ч бесклеточного культивирования. (С) Нозерн-блоты для premiR-10b и pre-miR-21, полученных с использованием нормосом MCF10A после 24 и 72 ч бесклеточного культивирования, и онкосом MDA-MB231 с 0 ч, 24 ч, 72 ч и 96 ч бесклеточного культивирования. В качестве контроля нагрузки использовали tRNAMet. Количественное определение проводили с использованием программного обеспечения Image J. (D) Верхние графики: После 24 ч и 72 ч в условиях бесклеточного культивирования определили количество онкогенных пре-микроРНК (левый график) и онкогенных микроРНК (правый график) из онкосом (MDA-MB231) Для каждой пре-микроРНК (левый график) и микроРНК (правый график) на график нанесли обратное значение ΔCt в разные временные точки для отражения их относительного содержания и по данным был отмечен экспоненциальный тренд. Приведенные данные, представленные в виде СО, являются результатом трех повторных анализов биологических образцов. Нижние графики: В условиях бесклеточного культивирования через 6 ч, 12 ч, 24 ч, 36 ч, 48 ч, 72 ч и 96 ч определили количество пре-микроРНК (левый график) и зрелых микроРНК (правый график) из онкосом (MDA-MB231). Для каждой пре-микроРНК (левый график) и микроРНК (правый график) на график нанесли обратное значение ΔCt в разные временные точки и по данным был отмечен экспоненциальный тренд. Данные, приведенные на этой фигуре и представленные в виде ± с.о., являются результатом трех независимых экспериментов, каждый проведен в трех повторах. (В) Онкосомы и нормосомы ресуспендировали в среде DMEM и поддерживали в условиях бесклеточной культуры в течение 0 ч, 24 ч, 72 ч и 96 ч. Экзосомы извлекали в разные временные точки и методом кПЦР определяли количественно пре-микроРНК. Для каждой пре-микроРНК на график нанесли обратное значение ΔCt в разные временные точки для отражения их относительного содержания.
[0040] Фиг. 4A-N. Онкосомы содержат RLC-белки. (А) Иммуноблот с использованием анти-Dicer антитела на экзосомах, собранных из: линий клеток нетуморогенных мышей (NMuMG) и человека (MCF10A); линий раковых клеток мыши, 67NR и 4Т1 и линий раковых клеток человека MCF7 и MDA-MB231. Использованные контроли были: экзосомами, обработанными Тритоном X и с последующей обработкой протеиназой K (Тритон + ПК), для индуцирования лизиса экзосом и последующей деградации экзосомальных белков, и экзосомами, обработанными протеиназой K (ПК) для деградации внеэкзосомальных белков. TSG101- (второй ряд) и CD9-иммуноблоты (третий ряд) использовали для подтверждения наличия экзосом. (В) Микрофотографии, полученные методом просвечивающей электронной микроскопии, иммунометок с частицами золота с использованием анти-Dicer антитела в онкосомах (MDA-MB231). Правое верхнее изображение увеличено цифровом способом из нового независимого изображения этого выделения. Отрицательный контроль относится к IgG. Частицы золота видны в виде черных точек и указаны черными стрелками на нижнем изображении. На графике приведено количественное определение по двум верхним изображениям слева. (С) Иммуноблот с использованием анти-flag антитела (верхнее изображение) в экзосомах MCF10A и MDA-MB231, собранных из клеток, трансфецированных пустым вектором (pCMV-Tag4B; первая и третья дорожки, соответственно) и вектор Flag-Dicer (вторая и четвертая дорожки). Для подтверждения наличия экзосом, а также для контроля нагрузки (нижнее изображение), использовали иммуноблот CD9. (D) Иммуноблот для Dicer в экзосомах, собранных из клеток MCF10A и MDA-MB231, обработанных кальциевым ионофором А23187 (верхнее изображение). В качестве контроля использовали экзосомы, извлеченные из необработанных клеток. Для того, чтобы показать увеличившуюся секрецию экзосом в качестве контроля использовали иммуноблот CD9 (нижнее изображение). (Е) Иммуноблот касательно Dicer в экзосомах, извлеченных из исходных клеток MCF10A и MDA-MB231 и клеток, трансфецированных плазмидами shScramble и shDicer (верхний блот). Для того, чтобы показать наличие экзосом, а также для контроля нагрузки (нижнее изображение), использовали иммуноблот CD9. Количественное определение при иммуноблоттинге проводили с использованием программного обеспечения Image J. (F) Микрофотографии, полученные методом просвечивающей электронной микроскопии, иммунометок с частицами золота с использованием анти-Dicer антитела в онкосомах, полученных из клеток MDAMB231shDicer. Частицы золота видны в виде черных точек. На правом графике изображено количественное определение золотых частиц на изображениях ЭМ. (G) Иммуноблот с использованием анти-AGO2 антитела в экзосомах, собранных из онкосом (MCF7 и MDA-MB231) и нормосом (MCF10A). Использованные контроля были: экзосомами, обработанными Тритоном X и далее протеиназой K (Тритон + ПК), для индуцирования лизиса экзосом и последующей деградации экзосомальных белков; экзосомами, обработанными протеиназой K (ПК) для деградации внеэкзосомальных белков; и супернатантом после ультрацентрифугирования для сбора экзосом (супернатант). TSG101- (второй ряд) и CD9-иммуноблоты (третий ряд) использовали для подтверждения наличия экзосом. (Н) Иммуноблот с использованием анти-TRBP антитела в экзосомах, собранных из онкосом (MCF7 и MDA-MB231) и нормосом (MCF10A). Использованные контроли были: экзосомами, обработанными Тритоном X и далее протеиназой K (Тритон + ПК), для индуцирования лизиса экзосом и последующей деградации экзосомальных белков; экзосомами, обработанными протеиназой K (ПК) для деградации внеэкзосомальных белков; и супернатантом после ультрацентрифугирования для сбора экзосом (супернатант). В качестве маркеров экзосом использовали TSG101- (второй ряд) и CD9-иммуноблоты (третий ряд). (I) Иммуноблот с использованием анти-GFP антитела в клетках MCF10A и MDA-MB231, трансфецированных плазмидой GFP-AGO2 (верхнее изображение). В качестве контроля нагрузки использовали бета-актин (нижнее изображение). (J) Иммуноблот с использованием анти-GFP антитела в экзосомах, извлеченных из клеток MCF10A и MDA-MB231, трансфецированных плазмидой GFP-AGO2 (верхнее изображение). В качестве маркеров экзосом и контролей нагрузки использовали TSG101 (среднее изображение) и CD9 (нижнее изображение). (K) Экспрессия мРНК AGO2 в клетках MCF10A и MDA-MB231, трансфецированных siAGO2. В качестве относительных контролей для