Вакцина mycoplasma hyopneumoniae
Иллюстрации
Показать всеИзобретения касаются иммуногенной композиции, способа иммунизации, набора для осуществления такой иммунизации и способа получения иммуногенной композиции. Композиция содержит эффективное количество растворимой части цельноклеточного препарата Mycoplasma hyopneumoniae (M.hyo); где растворимая часть цельноклеточного препарата M.hyo содержит M.hyo-специфические растворимые протеиновые антигены и является отделенной от нерастворимого клеточного материала, в сущности, является свободной как от (i) lg G, так и от (ii) иммунокомплексов, состоящих из антигена, присоединенного к иммуноглобулину. Изобретения могут быть использованы для индуцирования иммунного ответа у субъекта против заболевания, вызванного M.hyo. 4 н. и 9 з.п. ф-лы, 10 ил., 14 табл., 13 пр.
Реферат
Отрасль изобретения
Данное изобретение касается Mycoplasma hyopneumoniae (М. hyopneumoniae или M.hyo). Более конкретно, изобретение касается растворимой части цельноклеточного лекарственного препарата M.hyo, и ее применения в вакцине для защиты свиней от энзоотической пневмонии.
Предпосылки создания изобретения
Энзоотическая пневмония у свиней, которую также называют микоплазменная пневмония, вызывается M.hyo. Заболевание является хроническим не смертельным заболеванием, которое поражает свиней в любом возрасте. Инфицированные свиньи проявляют только незначительные симптомы кашля и лихорадки, однако заболевание имеет значительное экономическое влияние в результате снижения эффективности питания и уменьшения прироста массы тела. Энзоотическая пневмония передается от свинье к свинье через носовые ходы организмами, которые переносятся воздухом, выделяющимся из легких пораженных свиней. За первичным инфицированием M.hyo может следовать вторичное инфицирование другими видами микоплазм (Mycoplasma hyorhinis и Mycoplasma flocculare), а также другими бактериальными патогенами.
M.hyo является маленьким прокариотическим микроорганизмом, способным к свободному существованию, хотя его часто находят в ассоциации с эукариотическими клетками, в силу того, что он имеет абсолютные требования для экзогенного стерина и жирных кислот. Эти требования, как правило, вызывают необходимость роста в среде, которая содержит сыворотку. M.hyo связывается с клеточной мембраной, а не клеточной стенкой.
Физическая ассоциация микоплазм с поверхностью клетки хозяина является основой развития и присутствия энзоотической пневмонии. M.hyo поражает дыхательные пути свиней, колонизируя трахею, бронхи и бронхиолы. Микоплазма продуцирует статический фактор ресничек, который вызывает повреждение реснитчатого эпителия дыхательных путей и остановку дыхания. Со временем, реснички дегенерируют, что делает свиней склонным к инфицированию вторичным патогеном. Характерные поражения от пурпурных к серым участкам уплотнений наблюдаются у инфицированных животных. Исследование забитых животных обнаружило поражение в 30-80% свиней. Результаты из 37 стад в 13 штатах указали на то, что 99% стад имели свиней с пневмоническими поражениями, типичными для энзоотической пневмонии. Поэтому существует значительная потребность в эффективных превентивных и лечебных средствах.
Антибиотики, такие как тиамулин, триметоприм, тетрациклины и линкомицин имеют некоторые преимущества, однако являются дорогими и нуждаются в пролонгированном применении. Кроме этого, антибиотики не устраняют распространение или повторное инфицирование M.hyo. Предотвращение путем поддерживания стад свободных от патогена иногда является возможным, однако часто случается повторное появление M.hyo. В результате серьезных экономических последствий пневмонии свиней, разрабатываются вакцины против M.hyo. Вакцины, которые включают композиции организмов микоплазм, выращенных в среде, которая содержит сыворотку, были представлены на рынке, однако растет обеспокоенность относительно обратных эффектов, вызванных компонентами сыворотки (такими как иммунокомплексы или неиммуногенные специфические протеины), которые присутствуют в материале для иммунизации. Другие попытки обеспечить вакцины М. hyo были успешными, однако заболевание остается широко распространенным.
M.hyo и цирковирус свиней типа 2 (PCV2) является двумя наиболее распространенными патогенами, с которыми сталкиваются в индустрии свиноводства. Свинья, инфицированная PCV2, проявляет синдром, который обычно называют полисистемным синдромом истощения после отбирания (PMWS). PMWS клинически характеризуется истощением, бледностью кожи, хилостью, дыхательной недостаточностью, диареей и желтухой. Кроме PMWS, PCV2 связана с несколькими другими инфекциями, включая ложное бешенство, репродуктивный и респираторный синдром свиней (PRRS), болезнь Гласера, стрептококковый менингит, сальмонеллез, коли-бактериоз после отбирания, диетический гепатоз и гнойная бронхопневмония. M.hyo связана с энзоотической пневмонией и считается одним из главных кофакторов в развитии заболевания, которое сопровождает цирковирус свиней (PCVAD).
Репродуктивный и респираторный синдром свиней (PRRS) вызывается артеривирусом, имеющим чрезвычайную афинность к макрофагам, особенно, которые находятся в легких (альвеолярные макрофаги). Эти макрофаги глотают и удаляют бактерии и вирусы, которые попали в организм, однако не в случае вируса PRRS (PRRSV). В случае вируса PRRS, он размножается внутри макрофага, образовывая еще большее количество вируса, и убивает макрофаги. Когда PRRSV попадает в стадо, он присутствует и остается активным бесконечно. До 40% макрофагов уничтожаются, что позволяет бактериям и другим вирусам пролиферировать и вредить. Типичным примером этого является заметное ухудшение симптомов энзоотической пневмонии у более взрослых/старых свиней, при инфицировании вирусом PRRS. Больше чем половина PRRS-негативних свиней возраста отбирания заражаются перед попаданием на рынок.
Поэтому потребностью является улучшенная вакцина против микоплазм у свиней. Желательно, вакцина M.hyo является совместимой с другими свиными антигенами, такими как антигены PCV2 и вируса PRRS, независимо от того, или их вводят параллельно как отдельные вакцины, или объединяют в готовую к применению вакцину. Желательно, обеспечить готовую к применению комбинированную вакцину PCV2/M.hyo в одном флаконе с одной дозой.
Резюме изобретения
Данное изобретение касается иммуногенной композиции, которая включает растворимую часть цельноклеточного препарата Mycoplasma hyopneumoniae (M.hyo), где растворимая часть композиции М. hyo в сущности является свободной как от (i) Ig G, так и (ii) иммунокомплексов, состоящих из антигена, присоединенного к иммуноглобулину. В одном аспекте, растворимую часть цельноклеточного препарата M.hyo обрабатывали протеином-А или протеином-G перед добавлением к иммуногенной композиции.
В одном варианте воплощения, растворимая часть препарата M.hyo включает, по меньшей мере, один антиген протеина M.hyo. В другом варианте воплощения, растворимая часть препарата M.hyo включает два или больше антигена протеина M.hyo.
В других вариантах воплощения, иммуногенная композиция данного изобретения также включает, по меньшей мере, один дополнительный антиген. В одном варианте воплощения, по меньшей мере, один дополнительный антиген защищает от микроорганизма, который может вызывать заболевание у свиней.
В одном варианте воплощения, микроорганизм включает бактерии, вирусы или простейших. В другом варианте воплощения, микроорганизм выбирают из, однако не ограничиваются следующими: цирковирус свиней тип 2 (PCV2), вирус репродуктивного и респираторного синдрома свиней (PRRSV), парвовирус свиней (PPV), Haemophilus parasuis, Pasteurella multocida, Streptococcum suis, Staphylococcus hyicus, Actinobacilllus pleuropneumoniae, Bordetella bronchiseptica, Salmonella choleraesuis, Salmonella enteritidis, Erysipelothrix rhusiopathiae, Mycoplama hyorhinis, Mycoplasma hyosynoviae, лептоспиры, Lawsonia intracellulars, вирус свиного гриппа (SIV), антиген Escherichia coli, Brachyspira hyodysenteriae, респираторный коронавирус свиней, вирус эпизоотической диареи свиней (PED), ротавирус, вирус гепатита (TTV), цитомегаловирус свиней, энтеровирусы свиней, вирус энцефаломиокардита, патоген, который вызывает болезнь Ауески, классическая свиная лихорадка (CSF) и патоген, который вызывает трансмиссивный гастроэнтерит свиней, или их комбинации.
В некоторых вариантах воплощения, по меньшей мере, один дополнительный антиген представлен антигеном цирковируса свиней тип 2 (PCV2), антигеном вируса PRRS или их комбинацией. В одном варианте воплощения, композиция данного изобретения вызывает защитный иммунный ответ у свиньи против как M.hyo, так и PCV2. В другом варианте воплощения, композиция данного изобретения вызывает защитный иммунный ответ у свиньи против M.hyo, PCV2 и вируса PRRS.
В одном варианте воплощения, антиген PCV2 находится в форме гибридного цирковируса тип-1-тип 2, где гибридный вирус, включает инактивированный рекомбинантный цирковирус свиней типа 1, экспрессирующий ORF2 протеин цирковируса свиней типа 2. В другом варианте воплощения, антиген PCV2 находится в форме рекомбинантного протеина ORF2. В другом варианте воплощения, рекомбинантный протеин ORF2 экспрессируется бакуловирусним вектором.
В некоторых вариантах воплощения, композиция данного изобретения также включает адъювант. В одном варианте воплощения, адъювант выбирают из, однако не ограничиваются следующими: адъювант масло в воде, полимерный и водный адъювант, адъювант вода в масле, адъювант гидроксид алюминия, адъювант витамин Е и их комбинации. В другом варианте воплощения, композиция данного изобретения также включает фармацевтически приемлемый носитель.
В определенных вариантах воплощения, композиция данного изобретения вызывает защитный иммунный ответ против M.hyo при введении однократной дозы. В других вариантах воплощения, композиция данного изобретения вызывает защитный иммунный ответ против M.hyo, и как минимум одного другого микроорганизма, который может вызвать заболевание у свиньи, при введении однократной дозы. В других вариантах воплощения, композиция данного изобретения вызывает защитный иммунный ответ против M.hyo и как минимум одного другого микроорганизма, который может вызвать заболевание у свиньи, при введении двух доз.
Данное изобретение также касается способа иммунизации свиньи против M.hyo. Этот способ включает введение свинье иммуногенной композиции, которая содержит растворимую часть цельноклеточного препарата Mycoplasma hyopneumoniae (M.hyo), где растворимая часть препарата М. hyo в сущности является свободной как от (i) Ig G, так и (ii) иммунокомплексов, состоящих из антигена, присоединенного к иммуноглобулину. В одном варианте воплощения, растворимая часть цельноклеточного препарата M.hyo введенной композиции включает как минимум один антиген протеина М. hyo.
В одном варианте воплощения способа данного изобретения, поливалентную композицию вводят внутримышечно, интрадермально, трансдермально или подкожно. В другом варианте воплощения способа данного изобретения, композицию вводят с однократным введением. В другом варианте воплощения способа данного изобретения, композицию вводят с двукратным введением.
В другом варианте воплощения способа данного изобретения, композицию вводят вместе с как минимум одним дополнительным антигеном, который защищает против микроорганизма, который может вызвать заболевание у свиньи, например, такого как описанные выше. Такие другие антигены могут вводиться параллельно с композицией M.hyo (то есть, в виде отдельных вакцин), или объединяться в готовую к использованию вакцину
В следующем варианте воплощения, композицию вводят свиньям, которые имеют материнские антитела против M.hyo. В следующем варианте воплощения, композицию вводят свиньям, которые имеют материнские антитела против M.hyo и как минимум одного другого микроорганизма, который может вызвать заболевание у свиньи.
В одном варианте воплощения, композицию вводят свиньям возрастом 3 недели или старшим.
Данное изобретение также касается набора. Набор включает флакон, который содержит иммуногенную композицию. Иммуногенная композиция включает растворимую часть цельноклеточного препарата Mycoplasma hyopneumoniae (M.hyo), где растворимая часть препарата M.hyo в сущности является свободной как от (i) Ig G, так и (ii) иммунокомплексов антиген/иммуноглобулин. В одном варианте воплощения, набор так же включает инструкцию с информацией относительно введения свинье иммуногенной композиции.
Данное изобретение также касается способа получения иммуногенной композиции данного изобретения. Этот способ включает i) культивирование M.hyo в пригодной среде в течение периода в диапазоне 18-144 часа; ii) потом инактивацию культуры М. hyo; iii) сбор жидкости инактивированной культуры, где жидкость инактивированной культуры содержит цельноклеточный препарат M.hyo, включающий как растворимую жидкую фракцию, так и нерастворимый клеточный материал; iv) отделение растворимой жидкой фракции от нерастворимого клеточного материала; v) существенное удаление как Ig G, так и иммунокомплексов антиген/иммуноглобулин из отделенной растворимой жидкой фракции.
Короткое описание чертежей
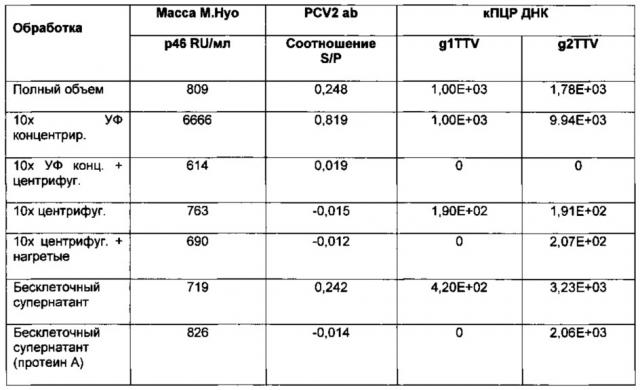
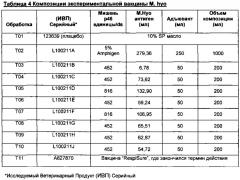
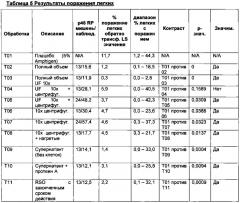
Фигура 1 является диаграммой, которая показывает эффективность моновалентных вакцин M.hyo, полученных из антигенов M.hyo из разных обработок (Т02-Т10 описаны в Примере 3) против плацебо (Т01). Результаты представлены как % LS значений поражений легких.
Фигура 2 является диаграммой, которая показывает результаты эффективности антигена PCV2 (ELISA PCV2 антигена) вакцин M.hyo в комбинации с убитым гибридным вирусом PCV тип1-тип2. Гибридный вирус включали в композиции в начальной концентрации 1,6≤RP. Состояние каждого образца выражали как относительную эффективность (RP).
Фигура 3 является диаграммой, которая показывает результаты виремии PCV2 (количественная ПЦР PCV2), наблюдаемые на композициях вакцин PCV/M.hyo, которые используют разные платформы адъювантов.
Фигура 4 является диаграммой, которая показывает серологические результаты ELISA антитела PCV2 (S/P), наблюдаемые на композициях вакцин PCV/M.hyo, которые используют разные платформы адъювантов, на 1-й, 20-й и 42-й дни стимуляции.
Фигура 5 является диаграммой, которая показывает фекальные выделения PCV2, полученные в группах обработки Т02-Т04, описанные в Примере 7, против плацебо (Т01). Результаты выражены как PCV2 ДНК копии/мл.
Фигура 6 является диаграммой, которая показывает назальные выделения PCV2, полученные в группах обработки Т02-Т04, описанных в Примере 7, против плацебо (Т01). Результаты выражены как PCV2 ДНК копии/мл.
Фигуры 7 (А и В) представлены графиками, показывающими результаты теста на интерферон-гамма (IFN-γ), который измеряет PCV2-специфический клеточно-опосредованный (КОИ) иммунный ответ. Результаты после-вакцинации/перед-заражением представлены на Фигуре 7А, и результаты после-вакцинации/после-заражения представлены на Фигуре 7В. Стимулирование 5×106 клеток считалось значительным.
Фигура 8 показывает эффективность M.hyo экспериментальных композиций вакцины PCV2/M.hyo в SP-масло. Показатели легких для композиций M.hyo с обработками Т02-Т08 против плацебо (Т01) изображены графически на Фигуре 8А. Таблица на Фигуре 8В показывает контраст обработок Т02-Т08 по сравнению с плацебо.
Фигура 9 является блок-схемой, которая показывает один вариант воплощения процесса производства, использованного для получения PCV2-совместимого M.hyo антигена, обработанного Протеином-А.
Короткое описание последовательностей
SEQ ID NO: 1 является одним вариантом воплощения нуклеотидной последовательности, которая кодирует р46 штамма Р-5722 M.hyo;
SEQ ID NO: 2 является одним вариантом воплощения аминокислотной последовательности, которая соответствует р46 штамма Р-5722 M.hyo; SEQ ID NO: 3 является одним вариантом воплощения нуклеотидной последовательности, которая кодирует р97 штамма Р-5722 M.hyo;
SEQ ID NO: 4 является одним вариантом воплощения аминокислотной последовательности, которая соответствует р97 штамма Р-5722 M.hyo; SEQ ID NO: 5 является одним вариантом воплощения геномной последовательности, которая кодирует гибридный вирус PCV1-2;
SEQ ID NO: 6 является одним вариантом воплощения нуклеотидной последовательности, которая соответствует ORF2 цирковируса свиней;
SEQ ID NO. 7 является одним вариантом воплощения аминокислотной последовательности, которая соответствует полипептиду ORF2 цирковируса свиней; SEQ ID NO: 8 является одним вариантом воплощения геномной последовательности, которая кодирует гибридный вирус PCV1-2;
SEQ ID NO: 9 является одним вариантом воплощения нуклеотидной последовательности, которая соответствует ORF2 цирковируса свиней;
SEQ ID NO: 10 является одним вариантом воплощения аминокислотной последовательности, которая соответствует полипептиду ORF2 цирковируса свиней;
SEQ ID NO: 11 является одним вариантом воплощения аминокислотной последовательности, которая соответствует полипептиду ORF2 цирковируса свиней;
SEQ ID NO: 12 является одним вариантом воплощения нуклеотидной последовательности, которая кодирует аминокислотную последовательность SEQ ID NO: 11;
SEQ ID NO: 13 является одним вариантом воплощения аминокислотной последовательности, которая соответствует полипептиду ORF2 цирковируса свиней;
SEQ ID NO: 14 является одним вариантом воплощения нуклеотидной последовательности, которая кодирует аминокислотную последовательность SEQ ID NO: 13;
SEQ ID NO: 15 является одним вариантом воплощения аминокислотной последовательности, которая соответствует полипептиду ORF2 цирковируса свиней;
SEQ ID NO: 16 является одним вариантом воплощения геномной последовательности невирулентной формы изолята североамериканского вируса PRRS, обозначенного как Р129; и
SEQ ID NO: 17 является одним вариантом воплощения нуклеотидной последовательности, которая соответствует ORF2 - ORF5 изолята вируса PRRS, обозначенного как ISU-55.
SEQ ID NO: 18 является одним вариантом воплощения нуклеотидной последовательности, которая соответствует ORF6 и ORF7 изолята вируса PRRS, обозначенного как ISU-55.
Детальное описание изобретения
Данное изобретение касается иммуногенной композиции, которая содержит растворимую часть цельноклеточного препарата Mycoplasma hyopneumoniae (М. hyo), где растворимая часть препарата М. hyo в сущности является свободной как от (i) Ig G, так и (ii) иммунокомплексов, состоящих из антигена, присоединенного к иммуноглобулину. Заявители неожиданно обнаружили, что нерастворимая фракция цельноклеточного препарата M.hyo является неиммуногенной. Напротив, растворимый препарат M.hyo, свободный от Ig G, является иммуногенным и может быть эффективно комбинирован с антигенами другого патогена, такими как PCV2, без аналитической или иммунологической интерференции между антигенами. Это делает растворимый препарат M.hyo эффективной платформой для поливалентных вакцин этого изобретения, включая готовые к использованию препараты в одном флаконе. Заявители также неожиданно обнаружили, что удаление иммуноглобулина и нерастворимых остатков клеток из препарата M.hyo улучшает безопасность иммуногенной композиции.
В описании и формуле использование единичной формы включает также и множественную форму, пока контекст четко не указывает на обратное. Например, термин "антиген протеина" включает множественное число антигенов протеина, включая их смеси.
Как использовано в данном документе, термин "содержит" значит, что композиции и способы включают перечисленные элементы, однако не исключает другие элементы.
Как определено в данном документе, растворимая часть цельноклеточного препарата M.hyo касается растворимой жидкой фракции цельноклеточного препарата M.hyo после отделения нерастворимого материала и существенного удаления Ig G и антиген-связанных иммунокомплексов. Растворимая часть M.hyo может альтернативно означать фракцию супернатанта, культуральный супернатант и т.д. Она включает растворимые протеины, экспрессированные M.hyo (антиген протеина M.hyo), отделенные от или изолированные от нерастворимых протеинов, целые бактерии и другой нерастворимый клеточный материал M.hyo, с использованием обычных способов, таких как центрифугирование, фильтрация или осаждение. Кроме содержания М.hyo-специфических растворимых протеинов, растворимая часть цельноклеточного препарата M.hyo также включает гетерологические протеины, такие как те, которые содержатся в культуральной среде, использованной для ферментации M.hyo.
Термин "антиген" касается соединения, композиции или иммуногенного субстрата, который может стимулировать выработку антител или Т-клеточного ответа, или обоих у животного, включая композиции, которые вводят инъекцией или абсорбируются животными. Иммунный ответ может генерироваться в ответ на всю молекулу или ее часть (например, эпитоп или гаптен).
Как определено в данном документе, "иммуногенная или иммунологическая композиция", касается композиции, которая содержит, по меньшей мере, один антиген, который вызывает иммунологический ответ клеточного и/или антитело-опосредованного происхождения на композицию или вакцину у хозяина.
Термин "иммунный ответ" как использовано в данном документе, касается ответа, вызванного у животного. Иммунный ответ может касаться клеточного иммунитета (КОИ); гуморального иммунитета или может включать оба. Данное изобретение также включает ответ, ограниченный частью иммунной системы. Обычно, "иммунологический ответ" включает, однако не ограничивается одним или несколькими следующими эффектами: выработка или активация антител, В-клеток, хелперов Т-клеток, супрессоров Т-клеток и/или цитотоксических Т-клеток, и/или yd Т-клеток, направленных специфически на антиген или антигены, включенные в композицию или вакцину. Желательно, хозяин будет проявлять терапевтический или защитный иммунологический ответ, так что в результате будет улучшена резистентность к новой инфекции и/или уменьшена клиническая тяжесть болезни. Такая защита будет продемонстрирована уменьшением или отсутствием симптомов, которые в норме имеются у инфицированного хозяина, быстрым временем возобновления и/или снижением вирусного титра у инфицированного хозяина.
Как использовано в данном документе, термин "иммуногенность" означает способность вызывать иммунный ответ у животного хозяина против антигена или антигенов. Этот иммунный ответ формирует основу защитного иммунитета, вызванного вакциной против специфического инфекционного организма.
"Адъювант" как использовано в данном документе, означает композицию, которая состоит из одного или больше соединений, которые усиливают иммунный ответ на антиген(ы). Механизм действия адъюванта полностью не известен. Считается, что некоторые адъюванты усиливают иммунный ответ путем медленного высвобождения антигена, в то время как другие адъюванты является сильно иммуногенными сами по себе и действуют синергично.
Как использовано в данном документе, термин "поливалентная" означает вакцину, которая содержит больше чем один антиген одного вида (то есть, разные изоляты Mycoplasma hyopneumoniae), разных видов (то есть, изоляты как Pasteurella hemolytica, так и Pasteurella multocida), или вакцину, которая содержит антигены разного рода (например, вакцина, которая содержит антигены Pasteurella multocida, Salmonella, Escherichia coli, Haemophilus somnus и Clostridium).
Термин "свинья" или "поросенок" как использовано в данном документе, означает животное свиного происхождения, в то время как "свиноматка" касается свиньи женского рода репродуктивного возраста. "Молодая свинья" касается не супороносной свиньи женского рода.
Как использовано в данном документе, термин "вирулентный" означает изолят, который сохраняет способность к инфицированию животного хозяина.
"Инактивированная вакцина" означает композицию вакцины, которая содержит инфекционный организм или патоген, который больше не способен к репликации или росту. Патоген может быть бактериального, вирусного, протозойного или грибкового происхождения. Инактивация может осуществляться различными способами, включая замораживание-оттаивание, химическую обработку (например, обработку тимерозалом или формалином), обработку ультразвуком, облучение, нагревание или любой другой способ, который способен предотвратить репликацию или рост организма, при этом поддерживая его иммуногенность.
Термин "вариант" как использовано в данном документе, касается полипептида или последовательности нуклеиновой кислоты, которая кодирует полипептид, который имеет одну или больше консервативных аминокислотных вариаций или других второстепенных модификаций, так что соответствующий полипептид имеет в сущности эквивалентную функцию по сравнению с диким типом полипептида.
"Консервативная вариация" означает замену аминокислотного остатка другим биологически подобным остатком, или замену нуклеотида в последовательности нуклеиновой кислоты, так что аминокислотный остаток, который кодируется, не изменяется, или является другим биологически подобным остатком. Примеры консервативных вариаций включают замещение одного гидрофобного остатка, такого как изолейцин, валин, лейцин или метионин, на другой гидрофобный остаток, или замещение одного полярного остатка, например, замещение аргинина на лизин, глутаминовой кислоты на аспарагиновую кислоту, или глутамина на аспарагин, и т.д. Термин "консервативная вариация" также включает применение замещенной аминокислоты вместо незамещенной исходной аминокислоты, при условии, что антитела, вызванные против замещенного полипептида, также иммунореагируют с незамещенным полипептидом.
Как использовано в данном документе, термины "фармацевтически приемлемый носитель" и "фармацевтически приемлемый наполнитель" является взаимозаменяемыми и касаются жидкого наполнителя, который содержит антигены вакцины, которые можно вводить хозяину без побочных эффектов. Пригодные известные в отрасли фармацевтически приемлемые носители включают, однако не ограничиваются следующими: стерильная вода, солевой раствор, глюкоза, декстроза или забуференные растворы. Носители могут включать вспомогательные агенты, включая, однако не ограничиваясь следующими: разбавители, стабилизаторы (то есть, сахара и аминокислоты), консерванты, смачиватели, эмульгаторы, pH буферные агенты, добавки, которые улучшают вязкость, красители и т.д.
Как использовано в данном документе, термин "композиция вакцины" включает по меньшей мере, один антиген или иммуноген в фармацетивчно приемлемом наполнителе, пригодном для вызывания иммунного ответа у хозяина. Композиции вакцины могут быть введены в дозировках и с помощью способов хорошо известных специалистам в отрасли медицины или ветеринарии, принимая во внимание такие факторы как возраст, пол, масса, вид и состояние животного реципиента, и путь введения. Путь введения может быть чрезкожный, введение в слизистую (например, оральное, назальное, анальное, влагалищное) или парентеральное (интрадермальное, трансдермальное, внутримышечное, подкожное, внутривенное или интраперитонеальное). Композиции вакцины могут быть введены отдельно, или вместе или последовательно с другими обработками или терапиями. Формы введения могут включать суспензии, сиропы или эликсиры, и препараты для парентерального, подкожного, интрадермального, внутримышечного или внутривенного введения (например, инъективное введение), такие как стерильные суспензии или эмульсии. Композиции вакцины могут быть введены как спрей или подмешаны к еде и/или воде, или доставлены в смеси с пригодным носителем, растворителем или эксципиентом, таким как стерильная вода, солевой физраствор, глюкоза, и т.д. Композиции могут содержать вспомогательные вещества, такие как смачиватели или эмульгаторы, pH буферные агенты, адъюванты, гелеобразователи или добавки, которые улучшают вязкость, консерванты, ароматизаторы, красители, и т.д., в зависимости от пути введения и желаемого препарата. Стандартные фармацевтические пособия, такие как "Remington's Pharmaceutical Sciences", 1990 могут приниматься во внимание при приготовлении пригодных препаратов, избегая ненужных экспериментов.
"Североамериканский вирус PRRS" означает любой вирус PRRS с генетическими характеристиками, связанными с изолятом североамериканского вируса PRRS, таким как, однако не ограничиваясь вирусом PRRS, впервые изолированным в США в начале 1990-х (смотреть, например, Collins, J. Е., et al., 1992, J. Vet. Diagn. Invest. 4:117-126); изолятом североамериканского вируса PRRS MN-1b (Kwang, J. et al., 1994, J. Vet. Diagn. Invest. 6:293-296); штаммом вируса PRRS Quebec LAF-exp91 (Mardassi, H. et al., 1995, Arch. Virol. 140:1405-1418); и изолятом североамериканского вируса PRRS VR 2385 (Meng, X.-J et al., 1994, J. Gen. Virol. 75:1795-1801). Дополнительные примеры штаммов североамериканского вируса PRRS описаны в данном документе. Генетические характеристики касаются геномного сходства нуклеотидной последовательности и сходства аминокислотной последовательности штаммов североамериканского вируса PRRS. Штаммы китайского вируса PRRS обычно имеют приблизительно 80-93% сходства нуклеотидной последовательности с североамериканскими штаммами.
"Европейский вирус PRRS" касается любого штамма вируса PRRS с генетическими характеристиками, связанными с вирусом PRRS впервые изолированным в Европе приблизительно в 1991 (смотреть, например, Wensvoort, G., et al., 1991, Vet. Q. 13:121-130). "Европейский вирус PRRS" также иногда в отрасли называют "вирусом Lelystad". Примеры штаммов Европейского вируса PRRS описаны в данном документе.
Генетически модифицированный вирус является "аттенуированным", если он является менее вирулентным, чем его немодифицированный родительский штамм. Штамм является "менее вирулентным", если он показывает статистически значимое уменьшение одного или больше параметров, которые определяют тяжесть болезни. Такие параметры могут включать уровень виремии, лихорадку, тяжесть респираторного расстройства, тяжесть репродуктивных симптомов или количество или тяжесть поражений легких, и т.д.
"Инфекционный клон" являются изолированным или клонированным геномом агента заболевания (например, вируса), который может быть специфически и преднамеренно модифицирован в лаборатории, и потом использован для возобновления живого генетически модифицированного организма. Живой генетически модифицированный вирус, полученный из инфекционного клона, может быть применен в живой вирусной вакцине. Альтернативно, вакцины с инактивированным вирусом могут быть получены путем обработки живого вируса, полученного из инфекционного клона, инактивирующими агентами, такими как формалин или гидрофобные растворители, кислоты, и т.д., облучением ультрафиолетом или Х-лучами, нагреванием, и т.д.
Все имеющиеся на данное время вакцины M.hyo и комбинированные вакцины M.hyo получены из убитых цельноклеточных препаратов микоплазм (бактерины). Напротив, данное изобретение применяет растворимую часть цельноклеточного препарата Mycoplasma hyopneumoniae (M.hyo) для комбинирования с антигенами PCV2 и PRRS, где растворимая часть препарата M.hyo в сущности является свободной как от (i) Ig G, так и (ii) иммунокомплексов, состоящих из антигена, присоединенного к иммуноглобулину.
M.hyo имеет абсолютные требования к экзогенному стерину и жирным кислотам. Эти требования обычно являются необходимыми для роста M.hyo в среде, которая содержит сыворотку, такую как свиная сыворотка. Отделение нерастворимого материала от растворимой части цельноклеточного препарата M.hyo (например, центрифугированием, фильтрацией или осаждением) не удаляет свиной Ig G или иммунные комплексы. В одном варианте воплощения данного изобретения, растворимая часть M.hyo обрабатывается протеином-А или протеином-G для значительного удаления Ig G и иммунных комплексов, которые содержатся в культуральном супернатанте. В этом варианте воплощения, понятно, что обработка протеином А осуществляется после ферментации M.hyo. Она в данном документе альтернативно называется даунстрим обработка протеином А. В другом варианте воплощения, может быть применена апстрим обработка ростовой среды протеином А (то есть, перед ферментацией M.hyo). Протеин А связывается из Fc частью Ig G. Протеин G связывается преимущественно из Fc частью Ig G, однако также может связываться и с Fab участком. В отрасли известны способы очистки/удаления общего Ig G из неочищенной смеси протеинов, такой как культуральный супернатант ткани, сыворотка и свободная жидкость брюшной полости.
В некоторых вариантах воплощения, растворимая часть препарата M.hyo включает по меньшей мере, один антиген протеина M.hyo. В других вариантах воплощения, растворимая часть препарата M.hyo включает два или больше антигена протеина M.hyo.
В одном варианте воплощения, фракция супернатанта M.hyo включает один или больше следующих специфических антигенных протеинов M.hyo: протеины M.hyo приблизительно молекулярной массы 46 кД (р46), 64 кД (р64) и 97 кД (р97). В другом варианте воплощения, фракция супернатанта включает по меньшей мере р46, р64 и р97 антигенные протеины M.hyo. Протеин M.hyo приблизительно 64 кД (р64) альтернативно называется в данном документе р65 поверхностный антиген M.hyo, описанный Kim et al. [Infect. Immun. 58(8):2637-2643 (1990)], а также в патенте США №5,788,962.
Futo et al. описали клонирование и характеристику поверхностного протеина M.hyo с массой 46 кД, который может быть применен в композициях данного изобретения [J. Bact 177: 1915-1917 (1995)]. В одном варианте воплощения, M.hyo культуральный супернатант включает р46, чьи соответствующие нуклеотидные и аминокислотные последовательности штамма Р-5722 показаны в SEQ ID NO: 1 и 2, соответственно. Также считается, что варианты таких последовательностей р46 могут быть применены в композициях данного изобретения, как описано ниже.
Zhang et al. описали и охарактеризовали адгезин протеин р97 из M.hyo [Infect. Immun. 63: 1013-1019, 1995]. Кроме этого, King et al. описали протеин массой 124 кД, который называется Mhp1 из штамма Р-5722 M.hyo, и представленные данные предусматривают, что Mhp1 и р97 является одинаковыми протеинами [Vaccine 15:25-35 (1997)]. Такие протеины р97 могут быть применены в композициях этого изобретения. В одном варианте воплощения, культуральный супернатант M.hyo включает р97, чьи соответствующие нуклеотидные и аминокислотные последовательности штамма Р-5722 показаны в SEQ ID NO: 3 и 4, соответственно. Также считается, что варианты таких последовательностей могут быть применены в композициях данного изобретения, как описано ниже.
M.hyo культуральный супернатант также может включать специфические антигенные протеины M.hyo такие как, однако не ограничиваясь, протеинами с молекулярной массой приблизительно 41 кД (р41), 42 кД (р42), 89 кД (р89) и 65 кД (р65). Смотреть, Okada et al., 2000, J. Vet. Med. В 47:527-533 и Kim et al., 1990, Infect. Immun. 58(8):2637-2643. Кроме этого, M.hyo культуральный супернатант может содержать специфические антигенные протеины M.hyo с молекулярной массой приблизительно 102 кД (р102) и 216 кД (р216). Смотреть патенты США №6,162,435 и 7,419,806 Minnion et al.
Любой штамм M.hyo может быть использован в качестве исходного материала для получения растворимой части препарата композиций M.hyo данного изобретения. Приемлемые штаммы M.hyo могут быть получены из коммерческих или академических источников, включая депозитарии, такие как Культуральная Коллекция Американского Типа (АТСС) (Manassas, Va.) и Культуральная Коллекция NRRL (Agricultural Research Service, U.S. Department of Agriculture, Peoria, III.). Только АТСС приводит шесть следующих штаммов M.hyo для продажи: M.hyo АТСС 25095, M.hyo АТСС 25617, M.hyo АТСС 25934, M.hyo АТСС 27714, M.hyo АТСС 27715 и M.hyo АТСС 25934D. Желаемый штамм M.hyo для применения в вариантах воплощения этого изобретения идентифицировано как штамм Р-5722-3, АТСС #55052, депонированный 30.05.1990, в соответствии с правилами доступности патентного ведомства США. Учитывая широкую распространенность болезни, штаммы также могут быть получены путем возобновления M.hyo из секретов легких или тканей свиней, инфицированных известными штаммами, которые вызывают атипическую пневмонию у свиней.
Специалист в отрасли понимает, что варианты последовательностей M.hyo могут быть применены в композициях данного изобретения. Такие варианты могут отличаться где-то на 10-20% идентичности последовательности и все еще сохранять антигенные характеристики, которые делают их пригодными для иммуногенных композиций. Желательно, варианты M.hyo имеют по меньшей мере 80%, желательно по меньшей мере 85%, более желательно по меньшей мере 90%, еще более желательно по меньшей мере 95% идентичности последовательности с непроцессированной геномной последовательностью штамма дикого типа M.hyo. Антигенные характеристики иммунологической композиции могут быть, например, оценены в экспериментах заражения, как показано в Примерах. Более того, антигенная характеристика модифицированного антигена M.hyo еще сохраняется, когда модифицированный антиген предоставляет по меньшей мере 70%, желательно 80%, более желательно 90% защитного иммунитета, по сравнению с протеином дикого типа M.hyo.
В одном варианте воплощения, растворимый р46 антиген M.hyo является включенным в композициях изобретения в конечной концентрации от приблизительно 1,5 мкг/мл до приблизительно 10 мкг/мл, желательно от приблизительно 2 мкг/мл до приблизительно 6 мкг/мл. Указано, что р46 является протеином, использованным для теста на активность M.hyo (смотреть секцию Примеры ниже). В другом варианте воплощения, антиген M.hyo может быть включенным в композициях в конечной концентрации от приблизительно 5,5% до приблизительно 35% супернатанта обработанной протеином-А культуры M.hyo.
Растворимый препарат M.hyo данного изобретения является как безопасным, так и эффективным против M.hyo, и является пригодным для одноразового введения. Кроме этого, заявители неожи