Способы и материалы для лечения болезни помпе
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Представлен способ получения молекулярного комплекса, обладающего активностью GAA (кислой альфа-глюкозидазы), включающий контактирование полипептида с активностью GAA с протеазой из гриба вида Aspergillus oryzae, при этом указанная протеаза расщепляет указанный полипептид в одном или более сайтах между аминокислотой 50 и аминокислотой 74 последовательности указанного полипептида. Представлена выделенная грибковая клетка, включающая нуклеиновую кислоту, кодирующую аминокислотную последовательность указанного полипептида GAA, и нуклеиновую кислоту, кодирующую указанную щелочную протеазу, при этом указанная грибковая клетка продуцирует указанный молекулярный комплекс, обладающий GAA активностью и включающий по меньшей мере два полипептида. Группа изобретений позволяет получать более зрелые формы полипептида GAA, которые обладают увеличенной специфической активностью и улучшенной способностью к снижению уровня гликогена (в сердце, скелетной мышце) по сравнению с предшественником GAA и коммерческой GAA человека. 2 н. и 18 з.п. ф-лы, 14 ил., 5 табл., 14 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет по предварительной патентной заявке США 61/611485, поданной 15 марта 2012 года. Описание предыдущей заявки рассматривается в качестве части описания данной заявки (и включено в нее в качестве ссылки).
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к выделенным молекулярным комплексам, обладающим активностью кислой альфа-глюкозидазы и, более подробно, к молекулярным комплексам, включающим, по меньшей мере, два полипептида, полученных протеолизом из прекурсорной молекулы, при этом молекулярный комплекс включает, по меньшей мере, одну модификацию, которая приводит к увеличению способности молекулярного комплекса транспортироваться внутрь клетки млекопитающего.
УРОВЕНЬ ТЕХНИКИ
Болезнь Помпе (также называемая болезнью накопления гликогена II типа или дефицита кислой мальтазы) представляет собой аутосомное рецессивное заболевание, которое приводит к накоплению гликогена в лизосоме вследствие дефицита альфа-глюкозидазы (GAA). Накопление гликогена вызывает прогрессирующее ослабление мышц (миопатию) по всему телу и воздействует на различные ткани тела, включая сердце, скелетные мышцы, печень и нервную систему.
Болезнь Помпе широко подразделяется по времени развития на инфантильную и взрослую форму. При инфантильной форме в рамках раннего детства (4-8 месяцев) дети обычно обладают слабостью и адинамией, не способны держать голову и демонстрировать иную моторную активность, характерную для их возраста, такую как переворачивание. Без лечения дети, страдающие болезнью Помпе, обычно умирают до возраста 12 месяцев вследствие сердечной недостаточности и респираторной слабости. См. United Pompe Foundation. Поздним формам (включая подростковые и взрослые формы) присуще позднее возникновение и более медленное прогрессирование, чем детским формам. Для лечения болезни Помпе применяют рекомбинантную GAA человека (Myozyme® или Lumizyme®). Однако стоимость Myozyme® или Lumizyme® является очень высокой и превышает $300000 в год. Таким образом, существует потребность в усовершенствованных лекарствах для лечения болезни Помпе.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте данное изобретение относится к выделенному молекулярному комплексу, обладающему активностью кислой альфа-глюкозидазы (GAA) и включающему, по меньшей мере, два полипептида (например, по меньшей мере, три или, по меньшей мере, четыре полипептида), при этом каждый полипептид обладает, по меньшей мере, 85% (например, по меньшей мере, 90%, 95%, 99% или 100%) идентичностью последовательности относительно сегмента аминокислотной последовательности, указанной в SEQ ID NO:1, при этом каждый сегмент получен протеолизом аминокислотной последовательности, указанной в SEQ ID NO:1, в одном или нескольких сайтах между аминокислотой 50 и аминокислотой 74 (например, между аминокислотой 56 и аминокислотой 68 или между аминокислотой 60 и аминокислотой 65). Молекулярный комплекс включает, по меньшей мере, одну модификацию, которая приводит к увеличению способности молекулярного комплекса транспортироваться внутрь клетки млекопитающего. Протеолиз аминокислотной последовательности, указанной в SEQ ID ΝΟ:1, также может включать расщепление в одном или нескольких сайтах между аминокислотой 719 и аминокислотой 746 или расщепление в одном или нескольких сайтах между аминокислотой 137 и аминокислотой 151 аминокислотной последовательности, указанной в SEQ ID NO:1. Протеолиз также может включать расщепление в одном или нескольких сайтах между аминокислотой 719 и аминокислотой 746 аминокислотной последовательности, указанной в SEQ ID NO:1, и расщепление в одном или нескольких сайтах между аминокислотой 137 и аминокислотой 151 аминокислотной последовательности, указанной в SEQ ID NO:1.
В любых описанных здесь молекулярных комплексах, по меньшей мере, один полипептид может включать один или несколько фосфорилированных N-гликанов, при этом модификация может включать декэпирование и деманнозилирование, по меньшей мере, одного фосфорилированного N-гликана. По меньшей мере, 40% (например, по меньшей мере, 60%, 80%, 90%, 95% или 99%) N-гликанов на, по меньшей мере, одном полипептиде могут быть декэпированными и деманнозилированными.
В любом описанном здесь молекулярном комплексе в одном из, по меньшей мере, двух полипептидов сегмент включает аминокислоты от 22 до 57 SEQ ID NO:1, при этом в одном из, по меньшей мере, двух полипептидов сегмент включает аминокислоты от 66 до 896 SEQ ID NO:1.
В любом описанном здесь молекулярном комплексе, содержащем, по меньшей мере, три полипептида, в одном из, по меньшей мере, трех полипептидов сегмент включает аминокислоты от 22 до 57 SEQ ID NO:1, при этом в одном из, по меньшей мере, трех полипептидов сегмент включает аминокислоты от 66 до 726 SEQ ID NO:1, при этом в одном из, по меньшей мере, трех полипептидов сегмент включает аминокислоты от 736 до 896 SEQ ID NO:1.
В любом описанном здесь молекулярном комплексе, содержащем, по меньшей мере, четыре полипептида, в одном из, по меньшей мере, четырех полипептидов сегмент включает аминокислоты от 22 до 57 SEQ ID NO:1, при этом в одном из, по меньшей мере, четырех полипептидов сегмент включает аминокислоты от 66 до 143 SEQ ID ΝΟ:1, при этом в одном из, по меньшей мере, четырех полипептидов сегмент включает аминокислоты от 158 до 726 SEQ ID NO:1, при этом в одном из, по меньшей мере, четырех полипептидов сегмент включает аминокислоты от 736 до 896 SEQ ID NO:1.
В любом описанном здесь аминокислотном комплексе, по меньшей мере, одна модификация может включать любой из указанных ниже, слитый, по меньшей мере, с одним полипептидом в молекулярном комплексе: лиганд для внеклеточного рецептора, таргетирующий домен, который связывает внеклеточный домен рецептора на поверхности клетки-мишени, плазминогенный рецептор урокиназного типа или распознающий домен инсулинподобного фактора роста II человека. Данное изобретение также относится к композициям, которые включают любой из описанных здесь молекулярных комплексов, при этом молекулярный комплекс является лиофилизированным. Композиция может быть упакована во флакон для одноразового применения.
Данное изобретение также относится к фармацевтической композиции, которая включает любой из описанных здесь молекулярных комплексов и фармацевтически приемлемый носитель. Композиция может быть составлена для внутривенного или подкожного введения. Композиция может быть составлена для внутривенной инфузии.
В другом аспекте изобретение относится к способу лечения болезни Помпе. Способ включает введение любой из описанных здесь композиций пациенту с диагностированной болезнью Помпе. Пациенту может быть диагностирована инфантильная форма болезни Помпе или взрослая форма болезни Помпе.
Данное изобретение также относится к способу получения молекулярного комплекса. Способ включает контактирование полипептида с, по меньшей мере, 85% идентичностью последовательности относительно аминокислотной последовательности, указанной в SEQ ID NO:1, с протеазой с, по меньшей мере, 85% (например, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 99% или 100%) идентичностью последовательности относительно аминокислотной последовательности, указанной в SEQ ID NO:8, при этом протеаза расщепляет полипептид в одном или нескольких сайтах между аминокислотой 50 и аминокислотой 74 (например, между аминокислотой 56 и аминокислотой 68 или между аминокислотой 60 и аминокислотой 65). Этап контактирования может быть осуществлен in vitro.
Данное изобретение также относится к способу получения молекулярного комплекса, который включает декэпированные и деманнозилированные фосфорилированные N-гликаны. Способ включает контактирование молекулярного комплекса с маннозидазой, способной (i) гидролизовать маннозо-1-фосфо-6-маннозный остаток с образованием маннозо-6-фосфата и (ii) гидролизовать терминальные связи с альфа-1,2-маннозой, альфа-1,3-маннозой и/или альфа-1,6-маннозой, при этом молекулярный комплекс обладает GAA активностью и включает, по меньшей мере, два полипептида, при этом каждый полипептид обладает, по меньшей мере, 85% идентичностью последовательности относительно сегмента аминокислотной последовательности, указанной в SEQ ID NO:1, при этом каждый сегмент получен протеолизом аминокислотной последовательности, указанной в SEQ ID NO:1, в одном или нескольких сайтах между аминокислотой 50 и аминокислотой 74 (например, между аминокислотой 56 и аминокислотой 68 или между аминокислотой 60 и аминокислотой 65), при этом перед контактированием, по меньшей мере, один полипептид включает фосфорилированные N-гликаны, содержащие один или несколько маннозо-1-фосфо-6-маннозных остатков. Маннозидаза может представлять собой гликозил-гидролазу семейства 38 (например, Canavalia ensiformis mannosidase или Yarrowia lipolytica mannosidase). Контактирование может осуществляться в рекомбинантной грибковой клетке, экспрессирующей маннозидазу.
Данное изобретение также относится к способу получения молекулярного комплекса, который включает декэпированные и деманнозилированные фосфорилированные N-гликаны. Способ включает контактирование молекулярного комплекса с маннозидазой, способной гидролизовать терминальные связи с альфа-1,2-маннозой, альфа-1,3-маннозой и/или альфа-1,6-маннозой, при этом молекулярный комплекс обладает GAA активностью и включает, по меньшей мере, два полипептида, при этом каждый полипептид обладает, по меньшей мере, 85% идентичностью последовательности относительно аминокислотного сегмента, указанного в SEQ ID NO:1, при этом каждый сегмент получен протеолизом аминокислотной последовательности, указанной в SEQ ID NO:1, в одном или нескольких сайтах между аминокислотой 50 и аминокислотой 74 (например, между аминокислотой 56 и аминокислотой 68 или между аминокислотой 60 и аминокислотой 65), при этом перед контактированием, по меньшей мере, один полипептид включает фосфорилированные N-гликаны, включающие декэпированные маннозо-6-фосфатные остатки. Маннозидаза может представлять собой гликозил-гидролазу семейства 47 (например, маннозидазу Aspergillus satoi), гликозил-гидролазу семейства 92 (например, маннозидазу Cellulosimicrobium cellulans) или гликозил-гидролазу семейства 38 (например, маннозидазу Canavalia ensiformis). Контактирование может осуществляться в рекомбинантной грибковой клетке, экспрессирующей маннозидазу.
Данное изобретение также относится к способу получения молекулярного комплекса, который включает декэпированные и деманнозилированные фосфорилированные N-гликаны. Способ включает контактирование молекулярного комплекса с маннозидазой, способной гидролизовать маннозо-1-фосфо-6-маннозный остаток с образованием маннозо-6-фосфата, при этом молекулярный комплекс обладает GAA активностью и включает, по меньшей мере, два полипептида, при этом каждый полипептид обладает, по меньшей мере, 85% идентичностью последовательности относительно аминокислотного сегмента, указанного в SEQ ID NO:1, при этом каждый сегмент получен протеолизом аминокислотной последовательности, указанной в SEQ ID NO:1, в одном или нескольких сайтах между аминокислотой 50 и аминокислотой 74 (например, между аминокислотой 56 и аминокислотой 68 или между аминокислотой 60 и аминокислотой 65), при этом перед контактированием, по меньшей мере, один полипептид включает один или несколько маннозо-1-фосфо-6-маннозных остатков. Маннозидаза может представлять собой гликозил-гидролазу семейства 38 (например, маннозидазу Canavalia ensiformis или маннозидазу Yarrowia lipolytica).
В другом аспекте данное изобретение относится к способу получения молекулярного комплекса, который включает декэпированные и деманнозилированные фосфорилированные N-гликаны. Способ включает а) контактирование молекулярного комплекса с маннозидазой, способной гидролизовать маннозо-1-фосфо-6-маннозный остаток с образованием маннозо-6-фосфата для декэпирования маннозо-6-фосфатных остатков в, по меньшей мере, одном полипептиде молекулярного комплекса, при этом молекулярный комплекс обладает GAA активностью и включает, по меньшей мере, два полипептида, при этом каждый полипептид обладает, по меньшей мере, 85% идентичностью последовательности относительно аминокислотного сегмента, указанного в SEQ ID NO:1, при этом каждый сегмент получен протеолизом аминокислотной последовательности, указанной в SEQ ID NO:1, в одном или нескольких сайтах между аминокислотой 50 и аминокислотой 74 (например, между аминокислотой 56 и аминокислотой 68 или между аминокислотой 60 и аминокислотой 65); и b) контактирование молекулярного комплекса с маннозидазой, способной гидролизовать терминальные связи с альфа-1,2-маннозой, альфа-1,3-маннозой и/или альфа-1,6-маннозой. Этап (а) и этап (b) могут быть катализированы двумя различными ферментами или одним ферментом. Связанные с контактированием этапы могут быть осуществлены совместно или по отдельности и в любом порядке. Контактирование может осуществляться в рекомбинантной грибковой клетке-хозяине, при этом грибковая клетка-хозяин экспрессирует маннозидазу, способную катализировать этап (а), и маннозидазу, способную катализировать этап (b). Контактирование может осуществляться в рекомбинантной грибковой клетке-хозяине, при этом грибковая клетка-хозяин экспрессирует маннозидазу, способную катализировать этапы (а) и (b).
Любой из описанных здесь молекулярных комплексов, который включает, по меньшей мере, один декэпированный и деманнозилированный N-гликан, может применяться для контактирования клетки млекопитающего, при этом после контактирования молекулярный комплекс транспортируется внутрь клетки млекопитающего с увеличенной эффективностью. Клетка млекопитающего может представлять собой клетку человека.
Данное изобретение также относится к способу транспортирования молекулярного комплекса с GAA активностью внутрь клетки. Способ включает контактирование клетки млекопитающего с молекулярным комплексом, при этом молекулярный комплекс включает, по меньшей мере, два полипептида, при этом каждый полипептид обладает, по меньшей мере, 85% идентичностью последовательности относительно аминокислотного сегмента, указанного в SEQ ID NO:1, при этом каждый сегмент получен протеолизом аминокислотной последовательности, указанной в SEQ ID NO:1, в одном или нескольких сайтах между аминокислотой 50 и аминокислотой 74 (например, между аминокислотой 56 и аминокислотой 68 или между аминокислотой 60 и аминокислотой 65); при этом фосфорилированные N-гликаны в, по меньшей мере, одном полипептиде декэпированы и деманнозилированы как указано далее в описании способов. Клетка млекопитающего может быть in vitro или может находиться в субъекте, представляющем собой млекопитающее. Клетка млекопитающего может представлять собой клетку человека.
В другом аспекте, данное изобретение относится к способу транспортирования молекулярного комплекса с GAA активностью внутрь клетки. Способ включает контактирование клетки млекопитающего с молекулярным комплексом, который включает, по меньшей мере, два полипептида, при этом каждый полипептид обладает, по меньшей мере, 85% идентичностью последовательности относительно аминокислотного сегмента, указанного в SEQ ID NO:1, при этом каждый сегмент получен протеолизом аминокислотной последовательности, указанной в SEQ ID NO:1, в одном или нескольких сайтах между аминокислотой 50 и аминокислотой 74 (например, между аминокислотой 56 и аминокислотой 68 или между аминокислотой 60 и аминокислотой 65), при этом молекулярный комплекс включает, по меньшей мере, одну модификацию, которая приводит к увеличению способности молекулярного комплекса транспортироваться внутрь клетки млекопитающего. Клетка млекопитающего может быть in vitro или находится в субъекте, представляющем собой млекопитающее. Клетка млекопитающего может представлять собой клетку человека. Модификация может включать любой из указанных ниже, слитый, по меньшей мере, с одним полипептидом в молекулярном комплексе: лиганд для внеклеточного рецептора, таргетирующий домен, который связывает внеклеточный домен рецептора на поверхности клетки-мишени, плазминогенный рецептор урокиназного типа или распознающий домен инсулин подобного фактора роста II человека.
В другом аспекте данное изобретение относится к выделенной грибковой клетке, которая включает экзогенную нуклеиновую кислоту, кодирующую щелочную протеазу, обладающую, по меньшей мере, 85% идентичностью последовательности относительно аминокислотной последовательности, указанной в SEQ ID NO:8.
Данное изобретение также относится к выделенной грибковой клетке, включающей нуклеиновую кислоту, кодирующую GAA аминокислотную последовательность, указанную в SEQ ID NO:1, и нуклеиновую кислоту, кодирующую щелочную протеазу, обладающую, по меньшей мере, 85% идентичностью последовательности относительно аминокислотной последовательности, указанной в SEQ ID NO:8. Грибковая клетка продуцирует молекулярный комплекс, обладающий GAA активностью и включающий, по меньшей мере, два полипептида, при этом каждый полипептид обладает, по меньшей мере, 85% идентичностью последовательности относительно сегмента аминокислотной последовательности, указанной в SEQ ID NO:1, при этом каждый сегмент получен протеолизом аминокислотной последовательности, указанной в SEQ ID NO:1, в одном или нескольких сайтах между аминокислотой 50 и аминокислотой 74 (например, между аминокислотой 56 и аминокислотой 68 или между аминокислотой 60 и аминокислотой 65) щелочной протеазой. В некоторых вариантах осуществления грибковая клетка также включает нуклеиновую кислоту, кодирующую маннозидазу, при этом маннозидаза способна гидролизовать маннозо-1-фосфо-маннозный остаток с образованием маннозо-6-фосфата. В некоторых вариантах осуществления грибковая клетка также включает нуклеиновую кислоту, кодирующую маннозидазу, при этом маннозидаза способна гидролизовать терминальную связь с альфа-1,2-маннозой, альфа-1,3-маннозой и/или альфа-1,6-маннозой. В некоторых вариантах осуществления грибковая клетка также может включать нуклеиновую кислоту, кодирующую маннозидазу, при этом маннозидаза способна (i) гидролизовать маннозо-1-фосфо-6-маннозный остаток с образованием маннозо-6-фосфата и (ii) гидролизовать терминальную связь с альфа-1,2-маннозой, альфа-1,3-маннозой и/или альфа-1,6-маннозой. Любая из подобных грибковых клеток также может включать нуклеиновую кислоту, кодирующую полипептид, способный промотировать маннозил-фосфорилирование и/или быть генетически модифицированным для устранения ОСН1 активности.
Если не указано иное, все используемые здесь технические и научные термины обладают тем же значением, которое обычно понимается средним специалистом в данной области, к которой принадлежит данное изобретение. Несмотря на то, что способы и материалы, аналогичные или эквивалентные тем, которые указаны здесь, могут применяться при применении на практике или тестировании настоящего изобретения, примерные способы и материалы описаны ниже. Все публикации, патентные заявки, патенты, каталожные номера Genbank® и другие приведенные здесь ссылки приведены для ссылки в их полноте. В случае конфликта настоящее изобретение, включая определения, обладает приоритетом. Материалы, способы и примеры приведены для иллюстрирования и не должны рассматриваться в качестве ограничивающих.
Другие признаки и преимущества изобретения будут очевидны исходя из нижеследующего подробного описания и пунктов формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет собой изображение аминокислотной последовательности (SEQ ID NO:1) кислой альфа-глкжозидазы (GAA) человека после расщепления сигнальной последовательности.
Фиг. 2А представляет собой изображение нуклеотидной последовательности открытой рамки считывания (ORF) OsbA-Cellulosimicrobium cellulans маннозидазы 5 (CcMan5) (SEQ ID NO:2).
Фиг. 2В представляет собой изображение аминокислотной последовательности полипептида СсМап5 с выделенной сигнальной последовательностью (SEQ ID NO:3).
Фиг. 2С представляет собой изображение аминокислотной последовательности полипептида CcMan5 без сигнальной последовательности (SEQ ID NO:4). Предполагаемая молекулярная масса полипептида CcMan5 без сигнальной последовательности составляет 173 кДа.
Фиг. 3А и 3В представляют собой серию электрофореграмм, изображающих анализ N-гликанов rhGAA, подвергаемой действию CcMan5 и JbMan. Анализ осуществляли с помощью углеводного электрофореза с применением секвенирования ДНК и флюорофора (DSA-FACE). Ось Y соответствует относительному количеству единиц флюоресценции в качестве показателя количества каждой структуры N-гликанов. Ось X соответствует относительной капиллярной мобильности каждой структуры N-гликанов. На Фиг. 3А и Фиг. 3В изображение А представляет собой сравнительный образец, содержащий N-гликаны, высвобожденные из RNaseB с помощью PNGaseF. На Фиг. 3А изображения В и С содержат анализ N-гликанов из huGAA (76 кДа вариант) до и после обработки, соответственно, CcMan5 и JbMan.
На Фиг. 3В изображения В, С и D содержат анализ N-гликанов из 76 кДа формы huGAA, 95 кДа формы и 110 кДа формы, соответственно.
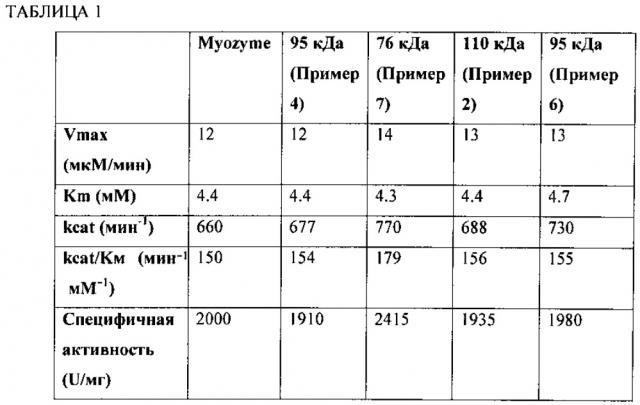
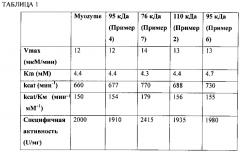
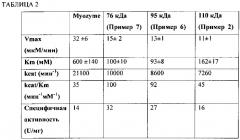
Фиг. 4 представляет собой линейный график количества глюкозы, образующейся в минуту с применением Myozyme (⋅), 76 кДа GAA (▲), 95 кДа GAA (▼) и 110 кДа GAA (♦) с применением гликогена печени кролика в качестве субстрата.
Фиг. 5А содержит два изображения уровней гликогена (мкг/мг белка) в сердце отдельной мыши. Фиг. 5В содержит два изображения уровней гликогена (мкг/мг белка) отдельной мыши в скелетной мышце. Красные точки означают самок, черные точки - самцов. Линии означают медиану в каждой группе.
Фиг. 6 содержит изображение аминокислотной последовательности маннозидазы AMS1 Yarrowia lipolytica (SEQ ID NO:5).
Фиг. 7 содержит изображение аминокислотной последовательности маннозидазы Aspergillus satoi (SEQ ID NO:6).
Фиг. 8 содержит изображение аминокислотной последовательности маннозидазы 4 Cellulosimicrobium cellulans (CcMan4, SEQ ID NO:7) с выделенной сигнальной последовательностью. Предполагаемая молекулярная масса полипептида CcMan4 без сигнальной последовательности составляет 184 кДа.
Фиг. 9 содержит изображение аминокислотной последовательности щелочной протеазы Aspergillus oryzae, включающей сигнальный пептид (21 аминокислоты), про-пептид (100 аминокислот) и зрелый белок (282 аминокислоты) (SEQ ID NO:9).
Фиг. 10 содержит изображение нуклеотидной последовательности слитого конструкта, содержащего кодон-оптимизированную последовательность Y. lipolytica, кодирующую щелочную протеазу A. oryzae (SEQ ID NO:10). Применяющиеся для клонирования сайты рестрикции подчеркнуты. Нуклеотидная последовательность, кодирующая линкер, выделена, при этом нуклеотидная последовательности, кодирующая метку His (10 His остатков) указана курсивом.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В целом данное изобретение относится к выделенным молекулярным комплексам, обладающим активностью кислой альфа-глюкозидазы (GAA) и, по меньшей мере, одной модификацией, которая приводит к увеличению способности транспортироваться внутрь клетки млекопитающего. GAA синтезируется в виде прекурсора массой 110 кДа, содержащего N-связанные гликаны. Прекурсор подвергается протеолитической обработке для удаления сигнальной последовательности и затем подвергается протеолитической обработке с образованием крупных образцов массой 95 кДа, 76 кДа и 70 кДа. Однако, по меньшей мере, некоторые пептиды, которые высвобождаются из прекурсора, остаются связанными с крупными образцами. См., например, Moreland et al., J. Biol. Chem., 280:6780-6791 (2005). Таким образом, описанные здесь обладающие GAA активностью молекулярные комплексы включают, по меньшей мере, два полипептида (по меньшей мере, два, три или четыре полипептида), которые получены с помощью протеолитического расщепления прекурсорной молекулы в одном или нескольких сайтах. По меньшей мере, два полипептида в молекулярном комплексе являются полученными в результате протеолитического расщепления в одном или нескольких сайтах в прекурсоре. Например, протеолиз аминокислотной последовательности, указанной в SEQ ID NO:1, может осуществляться между аминокислотой 50 и аминокислотой 74, например между аминокислотой 56 и аминокислотой 68 или между аминокислотой 60 и аминокислотой 65 для продуцирования, по меньшей мере, двух полипептидов. Молекулярный комплекс, содержащий два полипептида, обозначен здесь как форма массой 95 кДа.
В некоторых вариантах осуществления, по меньшей мере, три полипептида в молекулярном комплексе являются полученными в результате протеолитического расщепления в двух или нескольких сайтах в прекурсоре.
Например, протеолиз аминокислотной последовательности, указанной в SEQ ID NO:1, может включать, помимо расщепления между аминокислотой 50 и аминокислотой 74 (например, между аминокислотой 50 и аминокислотой 74 или между аминокислотой 60 и аминокислотой 65), расщепления в одном или нескольких сайтах между аминокислотой 719 и аминокислотой 746 или расщепление в одном или нескольких сайтах между аминокислотой 137 и аминокислотой 151 аминокислотной последовательности, указанной в SEQ ID NO:1. Молекулярный комплекс, содержащий три полипептида, обозначен здесь как форма массой 76 кДа.
В некоторых вариантах осуществления, по меньшей мере, четыре полипептида в молекулярном комплексе являются полученными в результате протеолитического расщепления в трех или нескольких сайтах в прекурсоре. Например, протеолиз аминокислотной последовательности, указанной SEQ ID NO:1, может включать, помимо расщепления между аминокислотой 50 и аминокислотой 74 (например, между аминокислотой 56 и аминокислотой 68 или между аминокислотой 60 и аминокислотой 65), расщепление в одном или нескольких сайтах между аминокислотой 719 и аминокислотой 746 аминокислотной последовательности, указанной в SEQ ID NO:1, и расщепление в одном или нескольких сайтах между аминокислотой 137 и аминокислотой 151 аминокислотной последовательности, указанной в SEQ ID NO:1. Молекулярный комплекс, содержащий четыре полипептида, обозначен здесь как форма массой 70 кДа.
Будет являться очевидным, что расщепление может осуществляться в одном или нескольких сайтах в одной молекуле и что сайты расщепления могут являться различными в разных молекулах.
Коммерчески доступная протеазная смесь, содержащая протеазы Aspergillus oryzae (например, от Sigma или NovozymesCorp) может применяться для расщепления аминокислотной последовательности, указанной в SEQ ID NO:1, между аминокислотами 50 и 74, например между аминокислотами 56 и 68 или между аминокислотами 60 и 65. Альтернативно, может применяться щелочная протеаза, обладающая, по меньшей мере, 85% (например, по меньшей мере, 95%, 97%, 98%, 99% или 100%) идентичностью последовательности относительно щелочной протеазы Aspergillus oryzae (SEQ ID NO:8). Например, как описано здесь, GAA полипептид, обладающий аминокислотной последовательностью, указанной в SEQ ID NO:1, может контактировать с протеазой, обладающей 85% идентичностью последовательности относительно аминокислотной последовательности, указанной в SEQ ID NO:8 или SEQ ID NO:9. SEQ ID NO:8 представляет собой аминокислотную последовательность зрелой щелочной протеазы Aspergillus oryzae. SEQ ID NO:9 представляет собой аимнокислотную последовательность протеазы Aspergillus oryzae, включающей сигнальный пептид, про-пептид и зрелый белок. Контактирование может осуществляться in vitro с применением протеазы, которая была выделена из Aspergillus oryzae или была получена с помощью рекомбинантных способов. Альтернативно, хозяин, представляющий собой грибок, может быть модифицирован таким образом, что GAA полипептид и щелочная протеаза секретируются в культуральную среду, в которой щелочная протеаза может расщеплять аминокислотную последовательность, указанную в SEQ ID NO:1, между аминокислотой 50 и аминокислотой 74 (например, между аминокислотами 56 и 68 или между аминокислотой 60 и аминокислотой 65).
Описанные здесь выделенные молекулярные комплексы обладают, по меньшей мере, одной модификацией, которая приводит к увеличению способности транспортироваться внутрь клетки млекопитающего. Неограничивающие примеры модификаций, которые увеличивают способность комплекса транспортироваться внутрь клетки млекопитающего, включают декэпирование и деманнозилирование фосфорилированных N-гликанов или пептидных меток, которые обеспечивают транспорт. Способы и материалы описаны здесь для получения молекулярных комплексов, содержащих метки или декэпированные или деманнозилированные N-гликаны.
Выделенные описанные здесь молекулярные комплексы особенно применимы для лечения пациентов с болезнью Помпе, включая пациента с диагностированной инфантильной и взрослой формой болезни Помпе. Болезнь Помпе приводит к накоплению гликогена в лизосоме вследствие дефицита GAA. Накопление гликогена вызывает прогрессирующее ослабление мышц (миопатию) по всему телу и воздействует на различные ткани тела, включая сердце, скелетные мышцы, печень и нервную систему. Каждый полипептид в молекулярном комплексе обладает, по меньшей мере, 85% идентичностью последовательности (например, по меньшей мере, 90%, 95%, 97%, 98%, 99% или 100%о) относительно сегмента аминокислотной последовательности, указанной в SEQ ID NO:1, при этом каждый сегмент получен протеолизом аминокислотной последовательности, указанной в SEQ ID NO:1, в одном или нескольких сайтах между аминокислотой 50 и аминокислотой 74 (например, между аминокислотой 56 и аминокислотой 68 или между аминокислотой 60 и аминокислотой 65). Степень идентичности в процентах между определенной аминокислотной последовательностью и аминокислотной последовательностью, указанной в SEQ ID NO:1, может быть определена следующим образом. Сначала аминокислотные последовательности выравнивают с помощью программы BLAST 2 Sequences (Bl2seq) из выделенной версии BLASTZ, содержащей BLASTP версии 2.0.14. Данная выделенная версия BLASTZ может быть загружена с вебсайта Fish & Richardson (например, www.fr.com/blast/) или вебсайта Национального центра биотехнологической информации правительства США (National Center for Biotechnology Information) (www.ncbi.nlm.nih.gov). Инструкции, объясняющие использование программы Bl2seq, могут быть найдены в файле readme, сопровождающем BLASTZ. Bl2seq осуществляет сравнение между двумя аминокислотными последовательностями с применением алгоритма BLASTP. Для сравнения двух аминокислотных последовательностей опции Bl2seq установлены следующим образом: -i соответствует файлу, содержащему первую аминокислотную последовательность для сравнения (например, C:\seq1.txt); -j соответствует файлу, содержащему вторую аминокислотную последовательность для сравнения (например, C:\seq2.txt); -р соответствует blastp; -о соответствует любому желаемому имени файла (наппример, C:\output.txt); а все другие опции оставлены по умолчанию. Например, следующая команда может применяться для генерации выходного файла, содержащего сравнение между двумя аминокислотными последовательностями: C:\Bl2seq -i c:\seq1.txt -j c:\seq2.txt -p blastp -о c:\output.txt. Если две сравниваемые последовательности обладают гомологией, то полученный выходной файл будет включать данные участки гомологии в виде выравненных последовательностей. Если две сравниваемые последовательности не обладают гомологией, то полученный выходной файл не будет включать выравненные последовательности. Аналогичные процедуры могут применяться для последовательностей нуклеиновых кислот за исключением применения blastn.
После проведения выравнивания количество совпадений определяется путем подсчета количества позиций, в которых идентичные аминокислоты присутствуют в обеих последовательностях. Идентичность в процентах определяется путем деления количества совпадений на длину полноразмерной полипептидной аминокислотной последовательности с последующим умножением полученного результата на 100.
Следует отметить, что значение идентичности в процентах округляется до ближайшей одной десятой. Например, 78,11, 78,12, 78,13 и 78,14 округляются до 78,1, в то время как 78,15, 78,16, 78,17, 78,18, и 78,19 округляются до 78,2. Следует также отметить, что значение длины всегда будет представлять собой целое число.
Является очевидным, что ряд нуклеиновых кислот может кодировать полипептид с определенной аминокислотной последовательностью. Дегенерация генетического кода хорошо известна в данный области, то есть в отношении многих аминокислот существует более чем один триплет, который служит в качестве кодона для аминокислоты. Например, кодоны в кодирующей последовательности какого-либо GAA полипептида могут быть модифицированы таким образом, что достигается оптимальная экспрессия в определенном виде (например, бактериях или грибах) с применением подходящих таблиц смещения кодонов для данного вида.
В одном варианте осуществления молекулярный комплекс может включать, по меньшей мере, два полипептида, при этом один полипептид включает аминокислоты от 22 до 57 SEQ ID NO:1, а другой полипептид включает аминокислоты от 66 до 896 SEQ ID NO:1.
В одном варианте осуществления молекулярный комплекс может включать, по меньшей мере, три полипептида, при этом один полипептид включает аминокислоты от 22 до 57 SEQ ID NO:1, один полипептид включает аминокислоты от 66 до 726 SEQ ID NO:1 и один полипептид включает аминокислоты от 736 до 896 SEQ ID NO:1.
В одном варианте осуществления молекулярный комплекс может включать, по меньшей мере, четыре полипептида, при этом один полипептид включает аминокислоты от 22 до 57 SEQ ID NO:1, один полипептид включает аминокислоты от 66 до 143 SEQ ID NO:1, один полипептид включает аминокислоты от 158 до 726 SEQ ID NO:1 и один полипептид включает аминокислоты от 736 до 896 SEQ ID NO:1.
Биологически активные варианты GAA могут содержать добавления, делеции или замещения относительно последовательностей, указанных в SEQ ID NO:1. GAA белки с замещениями в целом будут обладать не более чем 10 (например, не более чем одним, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью или десятью) консервативными аминокислотными замещениями. Консервативное замещение представляет собой замещение одной аминокислоты на другую с теми же характеристиками. Консервативные замещения включают замещения в рамках следующих групп: валин, аланин и глицин; лейцин, валин и изолейцин; аспарагиновая кислота и глутаминовая кислота; аспарагин и глутамин; серии, цистеин и треонин; лизин и аргинин; и фенилаланин и тирозин. Неполярные гидрофобные аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин. Полярные нейтральные аминокислоты включают глицин, серии, треонин, цистеин, тирозин, аспарагин и глутамин. Положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин. Отрицательно заряженные (кислые) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту. Любое замещение одного члена вышеупомянутых полярной, основной или кислой групп другим членом той же группы может рассматриваться в качестве консервативного замещения. С другой стороны, неконсервативное замещение представляет собой замещение одной аминокислоты на другую с иными характеристиками.
В некоторых вариантах осуществления GAA полипептид может представлять собой слитый белок с гетерологичной аминокислотной последовательностью, такой как последовательность, применяемая для очистки рекомбинантного белка (например, FLAG, полигистидин (например, гексагистидин), гемаглютенин (НА), гемаглютенин-S-трансфераза (GST) или связывающий мальтозу белок (МВР)).
В некоторых вариантах осуществления гетерологичная аминокислотная последовательность применяется для увеличения эффективности транспорта молекулярного комплекса в клетку млекопитающего. Например, по меньшей мере, один из полипептидов в комплексе может быть слит с лигандом для внеклеточного рецептора, таргетирующим доменом, который связывает внеклеточный домен рецептора на поверхности клетки-мишени, плазминогенным рецептором урокиназного типа или доменами инсулин подобного фактора роста II человека, который связывается с маннозо-6-фосфатным рецептором (например, аминокислоты 1-67 или 1-87; по меньшей мере, аминокислоты 48-55; по меньшей мере, аминокислоты 8-28 и 41-61; или, по меньшей мере, аминокислоты 8-87 инсулинподобного фактора роста человека; вариант последовательности инсулинподобного фактора роста II человека (например, R68A) или усеченной формы инсулинподобного фактора роста человека (например, усеченного на С-конце в положении 62)). Гетерологичная аминокислотная последовательность может быть слитой на N-конце или С-конце полипептида. В одном варианте осуществления пептидная метка слита с N- или С-концом полипептида с помощью спейсера (например, 5-30 аминокислотами или 10-25 аминокислотами). См., например, патент США 7785856. Гетерологичные аминокислотные последовательности также могут представлять собой белки, к