Средство для лечения и профилактики неалкогольной жировой болезни печени
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, в частности к средству для лечения и профилактики неалкогольной жировой болезни печени. Средство лечения и профилактики неалкогольной жировой болезни печени на основе водного извлечения листьев подорожника наибольшего (Plantago maxima Juss. et Jacq). Вышеописанное средство эффективно для лечения и профилактики неалкогольной жировой болезни печени. 2 з.п. ф-лы, 2 ил.
Реферат
Изобретение относится к медицине, в частности к гепатологии, и касается профилактики и лечения неалкогольной жировой болезни печени.
Неалкогольная жировая болезнь печени (НЖБП) характеризуется развитием макровезикулярного стеатоза более чем в 5% гепатоцитов у лиц, не злоупотребляющих алкоголем. НАЖБП может приводить к развитию цирроза, гепатоцелюллярной карциномы и повышению смертности от дисфункции печени. Частота развития данной патологии неуклонно увеличивается, достигая 35% в некоторых развитых странах и являясь самой частой причиной хронического заболевания печени (Loomba, R., & Sanyal, А.J. (2013). The global NAFLD epidemic. Nature Reviews Gastroenterology and Hepatology, 10(11), 686-690).
В связи с наличием множественных механизмов, приводящих к развитию НАЖБП, лечение и профилактика данного состояния крайне проблематичны. Более того, не существует общепринятых схем лечения НАЖБП. В настоящее время в качестве препаратов для лечения используются тиазолидиндионы, метформин, статины. Также оценивается эффективность препаратов против ожирения, селективных блокаторов рецепторов к канабиноидам, агонистов и . В то же время эффективность данных средств не доказана (Mishra, Р., & Younossi, Z.М. (2007). Current treatment strategies for non-alcoholic fatty liver disease (NAFLD). Current drug discovery technologies, 4(2), 133-140). Сомнительной также представляется возможность применения данных препаратов для профилактики данной патологии.
В частности, заявлено средство лечения и профилактики НАЖБП, представляющее собой композицию, включающую гидроксихлорохин, бигуаниды и статины. Экспериментальное обоснование эффективности средства проводилось на лабораторных животных, получающих 10% раствор фруктозы в течение 2 недель (Pareek, Anil. "Pharmaceutical compositions for the treatment/prophylaxis of non-alcoholic fatty liver disease." U.S. Patent Application No. 13/501, 342). Учитывая тот факт, что применение лишь растворов фруктозы с концентрацией более 30%, а также высокожировых диет с содержанием жиров 30-75% или же в сочетании с углеводным компонентом позволяет эффективно смоделировать НАЖБП с соответствующим метаболическим профилем (Kanuri, G., & Bergheim, I. (2013). In vitro and in vivo models of non-alcoholic fatty liver disease (NAFLD). International journal of molecular sciences, 14(6), 11963-11980), сомнительно, что предложенное средство может быть эффективным для профилактики тяжелой НАЖБП. Наличие побочного действия у статинов и бигуанидов, входящих в состав предлагаемого средства, также существенно ограничивает его применение с целью профилактики НАЖБП.
В качестве альтернативного подхода к лечению и профилактике НАЖБП используются фитотерапевтические препараты и композиции, наиболее исследованным из которых является силимарин - липофильный экстракт из Silybum marianum, и его основное действующее вещество силибин (Milosevic, N., Milanovic, М., Abenavoli, L., & Milic, N. (2014). Phytotherapy and NAFLD-from Goals and Challenges to Clinical Practice. Reviews on recent clinical trials, 9(3), 195-203). В частности, введение силибина сопровождалось уменьшением степени стеатоза, что было продемонстрировано экспериментально с использованием модели НАЖБП на db/db мышах, содержащихся на метионин-холин дефицитной диете (Salamone, Federico. "Method for the treatment of heart related disorders in nafld patients." U.S. Patent Application No. 13/721, 568). Однако стоит отметить, что использование метионин-холин дефицитной диеты не позволяет добиться успешного моделирования НАЖБП ввиду отсутствия развития инсулинорезистентности (Rinella, М.Е., & Green, R.М. (2004). The methionine-choline deficient dietary model of steatohepatitis does not exhibit insulin resistance. Journal of hepatology, 40(1), 47-51). В то же время, несмотря на значительное уменьшение количества пораженных гепатоцитов, при приеме силибина явления стеатогепатита оставались достаточно выраженными, особенно в центролобулярных участках.
Наиболее близким по технической сущности к предлагаемому средству является использование экстракта травы вербейника сухого (Lysimachiae Foenum-Graeci), эффективность которого показана в экспериментах на мышах, содержащихся на высокожировом рационе с содержанием жиров 60% от общего калоража в течение 6 недель, и выражалась в снижении степени стеатоза, в виде уменьшения размера жировых включений на фоне приема предлагаемого средства (Композиция, содержащая экстракт травы вербейника сенного, для профилактики и лечения заболеваний обмена веществ. Заявка 2010126032 на патент на изобретение в РФ, http://www.findpatent.ru/patent/248/2481851.html). В то же время распространение сырья, необходимого для получения данного средства (Lysimachia Foenum-Graecum), ограничено Китаем (Seidemann J. World Spice Plants: Economic Usage, Botany, Taxonomy. Springer, Berlin-Heidelberg, 2005), а именно отдельными провинциями Гуанси и Юньнань (Li, X.R., Xin, В., Wang, G.L., Dai, Z., & Lin, R.C. (2010). Two new triterpenes from Lysimachia foenum-graecum. Journal of Asian natural products research, 12(3), 204-208), что существенно ограничивает его доступность.
Таким образом, наличие выраженных побочных эффектов у существующих препаратов для лечения НАЖБП, невозможность их использования в качестве профилактических средств, а также ограничения по использованию фитопрепаратов ввиду их недостаточной эффективности или сложности производства, диктуют необходимость поиска новых средств для лечения и профилактики НАЖБП.
Заявляемое средство решает задачу расширения арсенала средств для профилактики и лечения НАЖБП.
Отличительным признаком настоящего изобретения является использование водного извлечения из листьев Plantago maxima Juss. et Jacq в качестве средства для лечения и профилактики НАЖБП. Подорожник наибольший (Plantago maxima Juss. et Jacq) является гемикриптофитом и в степной зоне произрастает на солонцеватых, пойменных остепненных лугах, по берегам рек и озер. Ареал распространения данного вида включает в себя Западную Сибирь, Европейскую часть России, а также районы Болгарии, Румынии и Венгрии (Tzonev, R., & Karakiev, Т. (2007). Plantago maxima (Plantaginaceae): a relict species new for the Bulgarian flora. Phytol. Balcan, 13(3), 347-350), что отражает большую сырьевую базу для получения указанного средства.
Сбор растительного сырья для изготовления предлагаемого средства производился в соответствии с анатомо-морфологическими характеристиками вида (Plantago maxima Juss. et Jacq) в различных местах обитания лесостепного и степного Предуралья с резко-континентальным климатом.
Объектом наблюдения являлись крысы-самки линии Wistar в возрасте 2 мес. Животные были равномерно разделены на 4 группы по 8 в каждой. До начала эксперимента животные находились на карантине в условиях вивария в течение 2 недель. Содержание животных осуществлялось в условиях искусственной вентиляции и 12-часового светового дня. Животные всех групп имели доступ к питью и пище ad libitum.
Стандартный рацион с общей энергетической ценностью 270 ккал/100 г содержал 20% белка, 70% углеводов и 10% жиров.
В качестве модели НАЖБП выбрано алиментарное воздействие с избыточным поступлением жиров и углеводов, в частности высокожировой высокоуглеводный рацион, основанный на добавлении к стандартному рациону свиного сала с итоговым содержанием жиров - 60%, белков - 10%, углеводов - 20%. С целью увеличения поступления углеводов в организм питьевая вода замещалась на 10% раствор сахарозы на весь период исследования. Сочетание избытка жиров и углеводов в рационе животных приводит к интенсивному прогрессированию НАЖБП с развитием более поздних стадий заболевания по сравнению с использованием лишь высокожирового или же высокоуглеводного рациона (Kanuri, G., & Bergheim, I. (2013). In vitro and in vivo models of non-alcoholic fatty liver disease (NAFLD). International journal of molecular sciences, 14(6), 11963-11980).
Предлагаемое средство - извлечение из подорожника наибольшего (Plantago maxima Juss. et Jacq), собранного в период цветения, готовилось согласно статье Государственной Фармакопеи X №349. Для этого сырье (лист) подорожника наибольшего непосредственно перед взвешиванием измельчали до 3-5 мм. Навеску заливали экстрагентом (вода бутилированная с общей минерализацией <250 мг/л) при соотношении сырье:экстрагент 1:10 и учете коэффициента водопоглощения. Экстракция производилась путем настаивания на кипящей водяной бане при температуре 85-90°C в течение 30 минут с периодическим помешиванием. После охлаждения экстракта до комнатной температуры производилась фильтрация с помощью бумажного фильтра с целью избавления от механических включений. После экстракции шрот дополнительно отжимался с целью повышения выхода предлагаемого средства. Полученный экстракт дополнительно подвергался фильтрации. Предлагаемое средство предоставлялось животным вместо бутилированной питьевой воды ad libitum.
Животные I группы содержались на стандартном рационе и получали чистую бутилированную питьевую воду и являлись контрольными.
Животные II группы содержались на высокожировом высокоуглеводном рационе с целью моделирования НАЖБП.
Крысы III группы являлись положительным контролем и получали предлагаемое средство на фоне стандартного рациона.
Животные IV группы содержались на высокожировом высокоуглеводном рационе на фоне приема предлагаемого средства. Углеводный компонент формировался путем добавления требуемого количества сахарозы в полученное водное извлечение. Предлагаемое средство применялось в течение всего эксперимента наряду с алиментарным воздействием. Длительность эксперимента составила 6 недель.
По окончании эксперимента у животных производился забор печени. Правые фрагменты срединной доли печени (De Godoy, J.L., Malafosse, R., Fabre, M., Mitchell, C., Mehtali, M., Houssin, D., & Soubrane, O. (2000). A preclinical model of hepatocyte gene transfer: the in vivo, in situ perfused rat liver. Gene therapy, 7(21), 1816-1823) забирались у всех животных в пластиковые кассеты и фиксировались в 10% нейтральном формалине с последующей заливкой в парафиновые блоки и изготовлением срезов толщиной 5 мкм. Срезы окрашивались гематоксилином Майера и эозином. Полученные микропрепараты использовались для визуальной оценки и микрофотографирования посредством микроскопа ЛОМО Микмед-6 (Россия) при искусственном освещении. Морфометрия структур (ядра, жировые включения) осуществлялась с помощью программного пакета ImageJ. Статистическая обработка полученных данных производилась с использованием программного пакета Statistica 10.0 (Statsoft, Tulsa, OK, US). Анализ характера распределения данных производился с использованием теста Шапиро-Уилка. Поскольку распределение являлось отличным от нормального, для описательной статистики использовались медианы и соответствующие значения 25 и 75 перцентилей. Сравнение погрупповых данных осуществлялось посредством использования непараметрического U-критерия Манна-Уитни; различия считались достоверными при p<0,05.
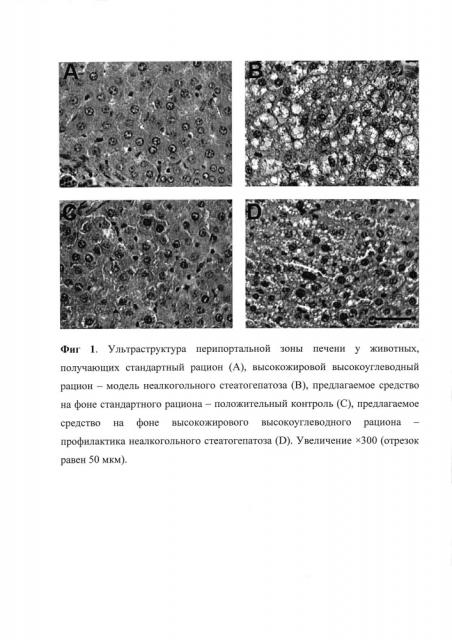
У интактных животных отмечается нормальная ультраструктура печени как в перипортальных (Фиг. 1А), так и в центролобулярных (Фиг. 2А) зонах. Как центролобулярные, так и периферические клетки имеют разные по размерам ядра и разную степень их плоидности. Двуядерные гепатоциты преобладают среди центролобулярных клеток. Средние значения размера ядер гепатоцитов в центролобулярных и перипортальных зонах составляют 84 (72-98) и 88 (73-100) мкм2 соответственно. Различимых при использовании указанного увеличения включений в цитоплазме гепатоцитов не наблюдается.
Содержание животных на высокожировом высокоуглеводном рационе сопровождается появлением крупнокапельного жирового стеатоза преимущественно в перипортальных зонах долек печени (Фиг. 1B). В этих зонах в результате выраженной жировой дистрофии обнаруживается некроз отдельных групп гепатоцитов. Увеличение размера гепатоцитов у животных данной группы, очевидно, указывает на присоединение гидропической дистрофии. Среди центролобулярных гепатоцитов данных животных наблюдаются явления как мелкокапельного, так и крупнокапельного стеатоза, однако количество погибших некрозом гепатоцитов меньше, чем в перипортальной зоне (Фиг. 2B). Описываемые гистологические изменения относительно контрольной группы отмечались у 100% экспериментальных животных. При этом площадь жировых включений в гепатоцитах в перипортальной и центролобулярной зонах составляет 101 (58-198) и 88 (54-143) мкм2 соответственно. Размер ядер существенно уменьшается относительно контрольных значений на 25% (p<0,001) в центролобулярных, составляя 63 (54-76) мкм2, а также на 30% (p<0,001) в перипортальных зонах, составляя 62 (53-75) мкм2.
Применение средства на фоне стандартной диеты не приводит к изменениям структуры печени. Структура печени как в перипортальной (Фиг. 1С), так и в центролобулярной (Фиг. 2С) зонах идентична таковой в группе интактных животных. Размер ядер гепатоцитов у данных животных сопоставим с контрольными значениями в центролобулярной (78 (62-88) мкм2) и перипортальной зонах (82 (67-94) мкм2). Различимых жировых включений в цитоплазме гепатоцитов не отмечается.
Применение предлагаемого средства на фоне высокожирового высокоуглеводного рациона сопровождается меньшей степенью кумуляции липидов, что гистологически проявляется мелкокапельной дистрофией в перипортальных (Фиг. 1D) и центролобулярных зонах (Фиг. 2D). Так, медиана площади жировых включений в перипортальной зоне в характеризуется в 2 раза меньшими значениями по сравнению с группой животных на высокожировом высокоуглеводном рационе, составляя 46 (23-103) мкм2 (p<0,001). Также отмечается уменьшение площади жировых капель в центролобулярной зоне на 23% (p<0,001) относительно соответствующих значений в группе животных на высокожировом высокоуглеводном рационе, не принимающих предлагаемое средство, составляя 68(44-111) мкм2. Также отмечается увеличение количества двуядерных клеток. При этом размер ядер центральных и периферических гепатоцитов превышает соответствующие значения в группе животных с алиментарной нагрузкой, не принимающих предлагаемое средство, на 6% (p=0,006) и 18% (p<0,001), составляя 67 (56-77) мкм2 и 73 (62-84) мкм2 соответственно. Гистологически описываемое улучшение относительно модельной группы животных с крупнокапельным жировым стеатозом на фоне приема предлагаемого средства отмечалось у 90% животных.
Таким образом, употребление предлагаемого средства предотвращало развитие выраженного диета-индуцированного стеатоза и сопровождалось уменьшением количества и площади поперечного сечения жировых включений в центролобулярной и перипортальной зонах, а также ассоциировалось с увеличением площади ядер гепатоцитов центролобулярной и перипортальной зон.
Средство по настоящему изобретению может быть использовано в исходном виде или же введено в композицию, включающую в себя фармацевтически приемлемый носитель после предварительной концентрации или высушивания. Под термином "фармацевтически приемлемый носитель" понимается носитель, не вызывающий каких-либо неблагоприятных эффектов у пациентов на фоне его введения.
Средство по настоящему изобретению может быть включено в состав различных фармацевтических композиций. Фармацевтическая композиция заявляемого средства может быть составлена в виде множества форм, включая жидкую, гелеобразную, капсулированную или таблетированную в случае выпаривания и концентрации. Фармацевтическая композиция заявляемого средства разработана для введения перорально.
Таким образом, приведенные выше данные свидетельствуют о возможности использования водного извлечения листьев подорожника наибольшего (Plantago maxima Juss. et Jacq), в том числе в составе композиций, для лечения и профилактики неалкогольной жировой болезни печени.
1. Средство лечения и профилактики неалкогольной жировой болезни печени на основе водного извлечения листьев подорожника наибольшего (Plantago maxima Juss. et Jacq).
2. Средство по п. 1, отличающееся тем, что содержит фармацевтически приемлемый носитель.
3. Средство по п. 1, отличающееся тем, что выполнено в форме раствора для перорального применения, сиропа, геля, инкапсулированной или таблетированной формы.